基于PI3K/AKT/mTOR 信号通路对电针干预慢性结肠炎大鼠的腧穴特异性及机制研究
唐坤鹏,吕嘉琪,文 坛,张春青,马梦娜,任华山,闫丽萍
(山西中医药大学,山西 晋中 030619)
炎症性肠病(inflammatory bowel disease,IBD)作为一种肠道慢性非特异性炎症性疾病[1]。其病程较长,病势缠绵难愈,常表现为急性发作期与慢性缓解期交替进行。近年来,在我国的发病率呈现逐年增长趋势,且多见于青少年[2]。目前,普遍认为其发病与肠道炎症、稳态平衡破坏、免疫反应失调和上皮屏障受损等因素密切相关[3,4]。研究发现,磷脂酰肌醇3 激酶(phosphatidylinositol3 kinase ,PI3K)/蛋白激酶B(protein kinase B,Akt)/雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路可通过对于炎症介质及炎性细胞的调控,介导由免疫异常所致的炎症反应,在缓解结肠炎症中起到重要作用。
大量研究证实,电针可通过多环节、多靶点对IBD 临床症状及肠道炎症进行有效的控制,且具有低副作用、低复发、长期疗效好等优势,已经逐渐成为补充或替代药物治疗的重要辅助手段[5]。天枢、大肠俞、足三里、上巨虚4 穴是针灸治疗IBD 使用频率较高的特定穴,对于IBD 皆具有良好的的治疗作用[6]。本课题组前期实验研究发现[7,8],电针以上4穴对于急/慢结肠炎大鼠血清IL-6 及髓过氧化物酶(MPO)含量的调节具有相对差异,但对其具体作用机制尚未阐明。因此,本实验基于对PI3K/Akt/mTOR 信号通路中相关蛋白含量及炎性因子的检测,进一步探讨电针刺激此4 组特定穴对肠道慢性炎症的效应差异及作用机制。
1 材料与方法
1.1 实验动物与分组
清洁级6 周龄SD 大鼠60 只,雌性各半,体重(200±20)g,购自北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2016-0006],分笼饲养于山西中医药大学科研实验中心清洁级动物房,温度为(24±2)℃,相对湿度为50%~60%,光照周期模拟昼夜循环12/12 h。自由摄食饮水,适应性喂养一周后将SD 大鼠随机分为正常组、模型组、天枢组、大肠俞组、足三里组、上巨虚组,每组10 只大鼠。本实验方案经山西中医药大学伦理委员会同意并批准(伦理编号:2018DW181)。
1.2 主要试剂与仪器
Sigma 完全弗氏佐剂(CFA,F5881),超敏ECL发光液(北京索莱宝科技有限公司,货号MA0186-1),trizol(美国 Ambion 公司,190906);反转录试剂盒(日本TaKaRa 公司,RR047A),BCA 蛋白浓度测定试剂盒、PCR 试剂盒(上海Beyotime 公司,P0012S,D7281S);PMSF 蛋白酶抑制剂,SDS-PAGE 蛋白上样缓冲液5×(武汉Bosterbio,批号分别为AR1179,AR1112),大鼠IL-17,IL-23,IL-10ELISA 试剂盒(武汉BOSTER 工程有限公司,批号分别为EK0431,EK0866,EK0417),PI3K 抗体,磷酸化(p)-PI3K,Akt 抗体;p-Akt 抗体,mTOR抗体,p-mTOR 抗体(美国Cell Signaling Technology 公司,批号分别为 4292S,4228S,4691S,4060S,2983S,5536S);羊抗兔IgG-HRP,β-action 鼠抗(北京博奥生物技术有限公司),彩色PAGE 快速凝胶试剂盒(爱必信生物科技有限公司,货号abs9367,abs9365)。
华佗牌SDZ-Ⅱ型电子针疗仪,一次性无菌针灸针(北京中研太和),高速冷冻离心机(曦玛离心机有限公司),酶标仪(美国BioTek,型号ELX808),T100TMThermal Cycler 型实时荧光定量PCR 仪,Tanon5200 化学发光成像仪(美国Bio Tek 公司),DYY-6C 型电泳仪(北京六一)。
1.3 模型制备
采用免疫复合致敏法[9]制备慢性结肠炎大鼠模型,取家兔结肠黏膜加入适量0.9%氯化钠溶液制成匀浆液,经离心后取上清液存放于-80℃冰箱中。造模时,将抗原上清液体与CFA 同等比例混合制备为抗原乳化液并分别在大鼠足跖(第3 天)、足趾(第10 天)、背部皮下(第17 天)、腹股沟(第24 天)、腹腔内(第31 天)注射抗原乳化液8 mg,至大鼠血清中抗兔结肠抗体达到一定效价时,将模型组与各腧穴治疗组大鼠禁食不禁水24 h 后采用2%戊巴比妥钠(3 mL/kg)行腹腔麻醉,用软导管将2%福尔马林液灌肠并留置60 min,用生理盐水冲洗后用抗原液不加CFA 再次灌肠并留置2 h,随后用生理盐水再次冲洗,完成造模。每组随机抽取1 只大鼠进行结肠标本病理学检查,以验证造模是否成功[10]。正常组皆用生理盐水替代造模试剂并按上述方法平行操作。
1.4 干预方法
穴位定位参照《实验针灸学》[11],电针双侧“天枢(ST25)”、“大肠俞(BL25)”、“足三里(ST36)”、“上巨虚(ST37)”腧穴,各腧穴治疗组均使用规格为0.18×25 mm 毫针直刺5 mm,同侧穴位连接同对电极,频率为2 Hz/50 Hz,强度2 mA,以大鼠肌肉或针柄微颤为宜,20 min/次,每日1 次,于造模成功后开始治疗,干预10 d。空白组、模型组只给与同等时间以相同方式进行固定。
1.5 取材及指标检测
所有大鼠经2%戊巴比妥钠(3 mL/kg)行腹腔深度麻醉后,充分暴露腹腔进行腹主动脉采血,经离心后置于-20℃冰箱留存以备ELISA 检测;经颈椎脱臼法处死大鼠后截取结肠组织,经生理盐水冲洗干净后,一部分放入组织固定液常温下保存以待病理组织学观察,一部分经液氮速冻后即置于-80℃冰箱保存,以备PCR 及Western blot 检测。
1.5.1 HE 染色观察大鼠结肠黏膜损伤及组织病理形态 结肠组织依次经4%组织固定液固定、脱水、透明、石蜡浸润包埋后,切制成厚度为4 μm 的石蜡切片,再经60 ℃温箱烘烤,脱蜡,染色,漂洗,脱水后经中性树脂封片。40 倍光镜下观察结肠组织形态结构变化。
1.5.2 ELISA 法检测大鼠血清中IL-23、IL-17、IL-10 水平 将离心后的大鼠血液上清经解冻后,严格按照ELISA 试剂盒说明书的步骤对慢性结肠炎大鼠血清中相关炎性因子进行含量检测。实验完毕后将酶标仪调至450 nm 波长,测量各孔吸光度值,做出标准曲线,计算各样品浓度。
1.5.3 Real-time PCR 检测结肠组织中PI3K、Akt、mTOR mRNA 表达 使用TRIzol 试剂提取结肠总RNA,将RNA 反转成cDNA,随后进行PCR 扩增。反应程序:95 ℃30 s,95 ℃5 s,60 ℃34 s,72 ℃30 s,共40 个循环,反应结束后采集溶解曲线统计Ct 值。各引物由通用生物技术有限公司设计合成,引物序列列于表1 中。

表1 引物序列Tab 1 Primer sequences
1.5.4 Western blot 检测结肠组织中PI3K/p-PI3k、p-Akt/Akt、p-mTOR/mTOR 蛋白表达 将预先冻存的结肠组织剪取100 mg 于液氮中研磨,依据重量按比例依次加入RIPA 裂解液、蛋白酶抑制剂、磷酸酶抑制剂置于冰中低温均浆,待蛋白充分裂解后离心提取蛋白上清液,使用BCA 法对样本进行蛋白定量,确定上样量后煮沸蛋白使其变性冷却后置于-20 ℃保存备用。依据所测蛋白量的大小进行配胶、上样,继而在电泳液、电解液中电泳与转膜,经洗膜、封闭、再次洗膜后,加入一抗PI3K,p-PI3k,p-Akt,Akt,p-mTOR,mTOR 及β-actin(1∶1 000,1∶500,1∶2 000,1∶1 000,1∶1 000,1∶1 000,1∶1 000)于4 ℃孵育过夜。次日在二抗溶液(1∶5 000)中室温孵育2 h,洗膜后在条带上滴入ECL 发光液显色曝光,运用ImageJ 软件进行分析,按目的蛋白灰度值/内参蛋白灰度值计算相对数值。
1.6 统计学处理
实验数据使用 SPSS26.0 统计软件分析,以均数±标准差(±s)表示。所有数据均进行正态性检验和方差齐性检验。组间比较采用单因素方差分析继以 LSD-t 法进行两两比较。P<0.05 差异具有统计学意义。
2 结果
2.1 大鼠造模后一般状况
造模前各组大鼠各项体征均正常并无明显差异且毛色光洁亮丽,反应敏捷,精神状态良好。在造模过程中大鼠体重下降较为缓和,逐渐出现懒动毛竖,粪便稀溏等症状,嗜睡及扎堆现象比较严重,造模结束后各造模组大鼠出现肛周污秽及部分大鼠出现肉眼血便及黑便等现象。经电针干预后各腧穴组与模型组相比各项症状均有所改善,如黑便及血便减少或消失,饮食及体重增加显著等。
2.2 各组大鼠结肠组织病理形态学比较
组织学切片显示,空白组大鼠结肠结构完整,无任何炎症、坏死或组织损伤迹象;模型组大鼠结肠黏膜在造模成功后大量的炎性细胞浸润至黏膜下层、肌层,黏膜各层界限不清晰,肠腺坏死、萎缩;经电针治疗后各腧穴治疗组结肠黏膜损伤较模型组各项炎性反应均减轻,黏膜上皮损伤有所修复,其中上巨虚组较其余腧穴治疗组结肠黏膜炎症损伤更为减轻。见图1。
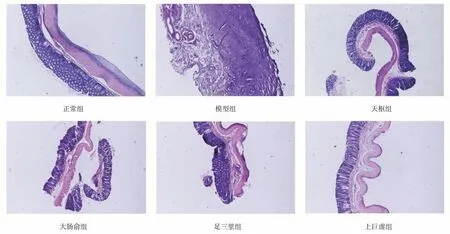
图1 各组大鼠结肠组织镜下观察(HE,×40)Fig 1 Colon tissue observation under microscope in each group of rats (HE,× 40)
2.3 各组大鼠血清中IL-23、IL-17 及IL-10 水平的比较
与正常组相比,模型组大鼠血清IL-23,IL-17 水平均明显升高,IL-10 水平明显降低(P<0.01);与模型组相比,天枢、大肠俞、足三里、上巨虚组大鼠血清IL-23,IL-17 水平均明显降低,IL-10 水平明显升高(P<0.01);其中,上巨虚组与天枢、大肠俞、足三里组相比,大鼠血清中IL-23,IL-17 水平显著降低(P<0.05),IL-10 水平显著升高(P<0.01);天枢组、大肠俞组、足三里之间相比较,大鼠血清中IL-23,IL-17,IL-10 上升或下降水平差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠血清中IL-23,IL-17 及IL-10 水平比较(pg/mL,±s,n=9)Tab 2 Comparison of IL-23,IL-17,and IL-10 levels in serum of rats in each group(pg/mL,±s,n=9)

表2 各组大鼠血清中IL-23,IL-17 及IL-10 水平比较(pg/mL,±s,n=9)Tab 2 Comparison of IL-23,IL-17,and IL-10 levels in serum of rats in each group(pg/mL,±s,n=9)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01;与上巨虚组比较,△P<0.05,△△P<0.01。
IL-10 99.34±2.57 65.38±2.83**77.72±7.43##△△79.43±3.23##△△78.80±3.76##△△89.88±3.13##69.78<0.000 1组别正常组模型组天枢组大肠俞组足三里组上巨虚组FP IL-23 34.14±4.16 102.40±8.88**69.48±6.14##△70.61±15.31##△71.01±9.70##△55.68±8.82##49.85<0.000 1 IL-17 10.50±0.63 39.57±1.22**17.48±1.69##△24.42±1.45##△23.04±1.46##△17.17±0.85##60.776<0.000 1
2.4 各组大鼠结肠组织中PI3K、Akt、mTOR mRNA 表达的比较
与正常组相比,模型组结肠组织中PI3K、Akt、mTOR mRNA 表达明显升高(P<0.01);与模型组比较,各腧穴电针干预组结肠组织中PI3K、Akt、mTOR mRNA 表达显著降低(P<0.05,P<0.01);其中,上巨虚组与天枢、大肠俞、足三里组相比,结肠组织中PI3K、Akt、mTOR mRNA 表达明显下降(P<0.05,P<0.01);天枢组、大肠俞组、足三里组间相比差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠结肠组织PI3K,Akt,mTOR mRNA 相对表达量比较(±s,n=9)Tab 3 Comparison of relative expression levels of PI3K,Akt,mTOR mRNA in colon tissue of rats in each group(±s,n=9)

表3 各组大鼠结肠组织PI3K,Akt,mTOR mRNA 相对表达量比较(±s,n=9)Tab 3 Comparison of relative expression levels of PI3K,Akt,mTOR mRNA in colon tissue of rats in each group(±s,n=9)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与上巨虚组比较,△P<0.05,△△P<0.01。
mTOR mRNA 0.86±0.33 2.49±0.14**1.58±0.26##△1.67±0.10##△1.64±0.18##△1.00±0.14##23.73<0.000 1组别正常组模型组天枢组大肠俞组足三里组上巨虚组FP PI3K mRNA 1.02±0.26 5.41±0.53**3.39±0.51##△3.94±0.36#△△4.10±0.67#△△2.13±0.12##36.14<0.000 1 Akt mRNA 1.01±0.17 2.54±0.04**1.55±0.10##△1.69±0.18##△△1.71±0.07##△△1.07±0.32##31.21<0.000 1
2.5 各组大鼠结肠组织中p-PI3k/PI3K、p-Akt/Akt、p-mTOR/mTOR 蛋白相对表达量的比较
与正常组相比,模型组结肠组织中p-PI3k、p-Akt、p-mTOR 蛋白相对表达量明显升高(P<0.01);与模型组相比,各腧穴电针干预组大鼠结肠组织中p-PI3k、p-Akt、p-mTOR 蛋白相对表达量显著降低(P<0.01);其中,上巨虚组与天枢、大肠俞、足三里组相比,结肠组织中p-PI3k、p-Akt、p-mTOR蛋白相对表达量明显下降(P<0.05,P<0.01);天枢组、大肠俞组、足三里组间相比差异无统计学意义(P>0.05)。见图2,表4。

图2 各组大鼠结肠组织中p-PI3k,PI3K,p-Akt,Akt,p-mTOR,mTOR 蛋白表达Fig 2 Expression of p-PI3k,PI3K,p-Akt,Akt,p-mTOR,mTOR proteins in colon tissue of rats in each group
表4 各组大鼠结肠组织中p-PI3k/PI3K,p-Akt/Akt,p-mTOR/mTOR 蛋白相对表达量的比较(±s,n=9)Tab 4 Comparison of relative expression levels of p-PI3k/PI3K,p-Akt/Akt,and p-mTOR/mTOR proteins in colon tissues of rats in each group(±s,n=9)
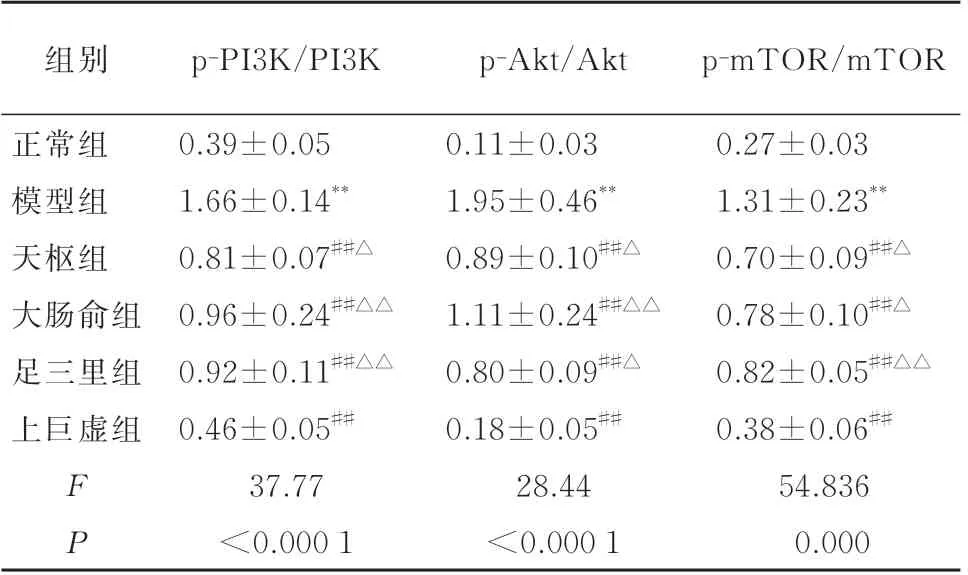
表4 各组大鼠结肠组织中p-PI3k/PI3K,p-Akt/Akt,p-mTOR/mTOR 蛋白相对表达量的比较(±s,n=9)Tab 4 Comparison of relative expression levels of p-PI3k/PI3K,p-Akt/Akt,and p-mTOR/mTOR proteins in colon tissues of rats in each group(±s,n=9)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01;与上巨虚组比较,△P<0.05,△△P<0.01。
组别正常组模型组天枢组大肠俞组足三里组上巨虚组FP p-PI3K/PI3K 0.39±0.05 1.66±0.14**0.81±0.07##△0.96±0.24##△△0.92±0.11##△△0.46±0.05##37.77<0.000 1 p-Akt/Akt 0.11±0.03 1.95±0.46**0.89±0.10##△1.11±0.24##△△0.80±0.09##△0.18±0.05##28.44<0.000 1 p-mTOR/mTOR 0.27±0.03 1.31±0.23**0.70±0.09##△0.78±0.10##△0.82±0.05##△△0.38±0.06##54.836 0.000
3 讨论
中医古籍文献中并无炎症性肠病的专属病名,依据其相关症状表现归属中医“肠澼”、“泄泻”、“痢疾”、“便血”等病范畴[12]。中医学认为本病属于内外合因,本虚标实之证[13]。本因素体脾胃虚弱,运化功能失调,复感湿热之邪侵犯肠腑,气血壅滞,脂膜血络受损合而发病[14]。其病位在大肠,但与脾胃密切相关,病变日久累及肝肾。故而在治疗上多以补脾健胃,通调肠腑,疏通气血为主。本实验所选天枢穴作为大肠募穴,处于腹部最为接近大肠,与处于背部督脉的大肠俞均是大肠经气汇聚之处,具有疏通阳明气血,激发大肠经气之效;足三里、上巨虚穴处于下肢皆属于足阳明胃经,分别为胃经合穴及大肠经下合穴,具有调补脾胃,通腑降气之效。对于腹泻、腹胀、痢下赤白脓血等胃肠疾病皆有改善作用。本实验研究结果显示,造模后大鼠体重下降,粪便稀溏并夹杂脓血便,肛周普遍出现污秽,懒动喜于扎堆;病理切片见出血、溃疡及大量炎性细胞浸润,腺体消失,黏膜消失,提示模型制备成功。各腧穴组经电针干预后一般状态皆有所改善;病理切片显示炎性细胞减少,黏膜各层均有不同程度的修复,其中上巨虚组较其余腧穴组炎症减轻更为显著,腺体排列整齐接近正常组。
现代医学研究发现,IBD 的发病受到多种因素相互影响,在多种细胞及其分泌的细胞因子的参与下,经多种炎症信号通路的介入导致肠道黏膜免疫屏障功能受损,以结肠黏膜炎症和溃疡的发生为主要病理表现[15,16]。相关研究表明,通过阻断 PI3K/Akt/mTOR 信号通路可以抑制核转录因子-κB(nuclear factor kappa B,NF-κB)的激活,减少相关炎性细胞因子的分泌与表达,从而缓解结肠黏膜炎性损伤[17-19]。PI3K 是一种可催化膜肌醇脂质磷酸化的细胞内酶,其所产生的肌醇脂质物质的第二信使PIP3 可作为具有PH 结构域的AKT 蛋白质膜的停泊点,促使AKT 上的苏氨酸及丝氨酸在磷脂酰肌醇依赖性蛋白激酶1,2 作用下发生磷酸化,继而激活下游靶点AKT[20],活化的AKT 可通过调节下游分子mTOR 发挥抗炎作用[21],而且活化的mTOR调节细胞自噬在肠道炎症中占据重要作用[22]。同时,PI3K 还可通过驱动NF-κB 的活化促进IL-6、IL-23 等细胞因子的表达与分泌[23]。也有研究发现,PI3K 信号传导在Toll 样受体介导的炎症中可促进抗炎因子IL-10 的产生[24]。另外,PI3K/Akt/mTOR 信号通路还可通过调节CD4+T 细胞,激活Th17 细胞分泌IL-17,导致IBD 的发生[25]。
本实验研究结果显示,与正常组相比,模型组大鼠结肠组织中PI3K、Akt、mTOR mRNA 及p-PI3K、p-Akt、p-mTOR 蛋白表达升高,同时,血清中IL-23、IL-17 水平升高,IL-10 水平降低。与模型组比较,经电针干预后各腧穴治疗组大鼠血清中IL-23、IL-17 水平降低,IL-10 水平升高,结肠组织中PI3K、Akt、mTOR mRNA 及 p-PI3K、p-Akt、p-mTOR 蛋白表达均有不同程度的降低,提示电针可能是通过抑制PI3K/Akt/mTOR 信号通路活化,调控促炎因子与抗炎因子的水平从而有效的治疗慢性结肠炎大鼠。进一步比较发现,上巨虚组对于炎性因子及PI3K/Akt/mTOR 信号通路相关蛋白的调节作用优于天枢、大肠俞及足三里组,提示上巨虚穴对于慢性结肠炎的治疗具有相对特异性,也在一定程度上印证了“合治内腑”的经典理论。另外本研究实验结果显示,天枢组的疗效优于大肠俞与足三里组,进一步提示“合募配穴”可作为治疗炎症性肠病的基础配穴,这与既往研究也相一致[26,27]。
综上所述,电针天枢、大肠俞、足三里、上巨虚穴皆可改善慢性结肠炎大鼠一般状况,对于肠道黏膜损伤及肠道炎症反应均具有不同程度的治疗作用,其作用机制可能是通过抑制PI3K/Akt/mTOR信号通路激活,进而调控促炎细胞因子IL-23、IL-17和抗炎细胞因子IL-10,缓解肠道炎症,调节机体免疫所实现的。其中上巨虚穴的效应最佳。
作者贡献度说明:
唐坤鹏:负责文章的撰写,动物模型的构建、电针干预,指标检测及数据的收集整理与统计分析;吕嘉琪、马梦娜、任华山:协助实验的执行并给予指导;文坛、张春青:参与指标检测及对实验数据进行统计与审核;闫丽萍:实验设计、指导与审校。
所有作者声明不存在利益冲突关系。
——用艾灸防治便秘(上)

