放射性金属核素及其核医学应用
张志豪,朱晨亿,丛容,张涛
成像和治疗是核医学两个重要的组成部分,两者相互补充。基于放射性核素的衰变类型和释放射线的特性,使其在核医学领域中有不同的应用场景。诊断用核素通过在衰变过程中发射光子而对疾病相关组织成像,获得其生理功能状态信息,包括γ释放核素和正电子(β+)释放核素;而治疗用核素则浓集结合于靶组织,依靠其发射的射线粒子(多为β-或α 粒子)破坏病变组织达到治疗疾病的目的[1]。自1990 年起,研究人员开始着力于将正电子发射核素(主要是放射性金属核素)引入医学领域。早期正电子发射体层成像(PET)一般使用18F、15O、13N、11C 等非金属核素,而近年发现金属核素因具有与生物学进程相适应的半衰期及温和的标记条件,为核医学的发展提供了新的选择。基于金属核素开发的核药物/放射性药物,已广泛应用于肿瘤、神经精神系统、心血管等重大疾病的诊断、治疗及实时监控,拓展了PET 等成像技术的临床应用空间[2]。本文综述了常用诊断和治疗性放射金属核素的物理化学性质和适用于放射性金属核素的螯合剂、代表分子探针/放射性药物及在生物医学中的应用前景。
1 诊断核素及发射计算机断层显像
核素诊断成像需要放射光子的放射性核素,如产生γ 射线或β+的湮灭光子,且不伴随α 或β-粒子发射。目前临床使用的显像设备多为γ射线探测器,如γ 相机及发射计算机体层成像(emission computed tomography,ECT)等,其中ECT 又分为单光子发射体层成像(SPECT)和PET 两类,使用ECT 对组织器官进行断层探测,可得到三维立体影像,对病变组织的定位更加精确。PET 与SPECT 这2 种成像技术的不同之处和优缺点见表1。

表1 SPECT 与PET 特征对比
1.1 PET PET 的成像原理是核素在衰变过程中可以发射出正电子,发出的正电子在与电子碰撞后发生湮灭,同时向相反方向发射一对能量为511 keV的γ 光子,PET 检查设备捕获这些光子后通过计算机校正,即可获得被测器官的三维影像[3]。此外,PET成像可定量测定体内药物或生物标志物,是评估某一治疗药物可否用于靶向受体的重要手段。PET 检查常用的金属核素的物理化学性质、放射性标记条件、代表性探针和应用领域见表2。
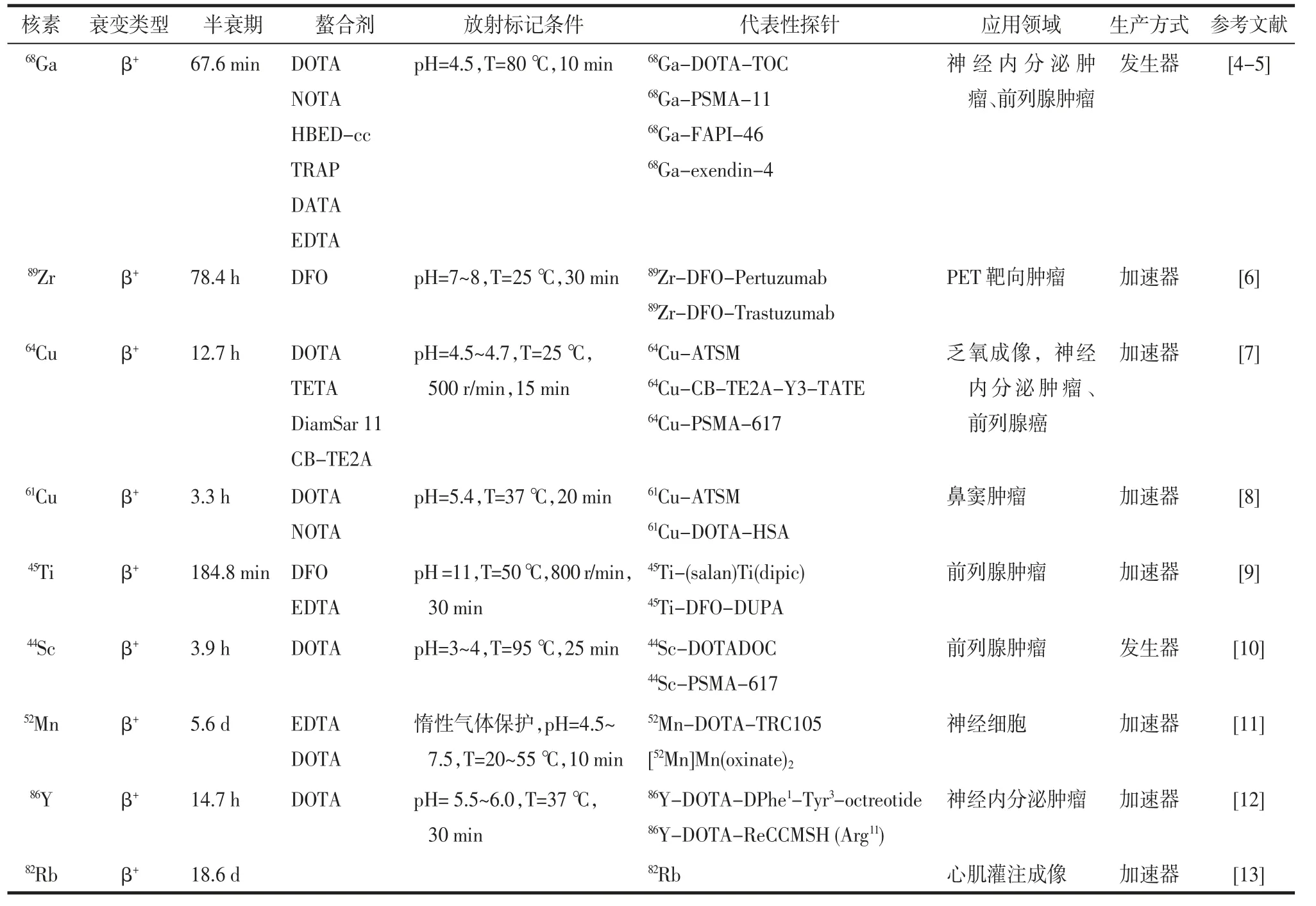
表2 PET 成像常用金属核素的理化性质、代表性探针和应用领域
1.1.168Ga 标记探针68Ga 具有较短的半衰期(67.6 min),这决定了68Ga 不适于运输,但68Ga 可以通过68Ge/68Ga 发生器获得,有效地解决了其供应的问题,也为核医学技师提供了充足的准备时间。68Ga 可与DOTA、NOTA、HBED-cc 等多种常见的螯合剂进行快速定量的放射性标记,在应用TRAP、DATA 等螯合剂时,甚至可在室温、温和pH(pH 值一般在3.5 或4.5 左右)及较低的底物浓度下进行标记。在通常情况下,68Ga 可与具备治疗性质的核素177Lu 联用,为“诊疗一体化”的方案提供了便利。基于68Ga 的优异特性,其成为研究和临床实践中常用的诊断核素,针对多种靶点的探针/药物都有采用68Ga 进行标记的实例。68Ga 标记化合物多采用DOTA 进行修饰,如针对生长抑制受体靶点的含奥曲肽类似物68Ga-DOTA-TOC、68Ga-DOTA-TATE、68Ga-DOTA-NOC[14]。Hofmann 等[15]研究发现68Ga-DOTA-TOC 用于检测神经内分泌瘤时表现优异,在其检测的病例中,68Ga-DOTA-TOC 的病灶检出率达到100%且具有较高的肿瘤显像对比度,与111In 标记的同类物质相比更具优势。针对CXC 族趋化因子受体4 研制的68Ga-Pentixafor 具有较好的体内稳定性及肿瘤摄取,该探针具有良好的亲水性,能够快速从肾脏清除[16]。以伊文思蓝结构为基础的68Ga-NOTA-NEB 在临床转化方面取得了较大进展。使用68Ga-NOTA-NEB 进行淋巴病变病人的PET 成像,PET 影像上可观察到病人的淋巴病变,获得的疾病信息多于99Tcm-SC 淋巴显像且更准确[5]。在临床研究及新药上市方面,68Ga 标记药物同样取得了较好的成绩。美国食品药品监督管理局(FDA)批准了68Ga-DOTA-TATE 药物用于生长抑制素受体阳性神经内分泌肿瘤的诊断。2020 年12 月1 日,FDA 批准了第1 个用于前列腺癌的前列腺特异性膜抗原(prostate specific membrane antigen,PSMA)阳性病变的PET 诊断剂68Ga-PSMA-11。68Ga-PSMA-11 通过PET 成像可以显示人体组织中PSMA 阳性的前列腺癌病变。除此之外,68Ga-Pentixafor、68Ga-FAPI 等药物也正在进行临床研究。
1.1.289Zr 标记探针89Zr 有较长的半衰期,与大多数抗体的生物代谢周期匹配良好。89Zr 与124I 和64Cu相比,89Zr 发射的正电子能量更低,因此对组织的损伤更小,并且PET 影像具有更高的分辨率,可以在低注射量的情况下更清晰地显示病变。89Zr 适配的螯合剂DFO 可以通过几种不同的共轭连接方式与抗体连接,为89Zr 标记的单克隆抗体提供了便利条件。目前,已经对89Zr 标记的单克隆抗体进行了大量临床前研究,以分析抗体药物在体内的代谢过程并评估肿瘤治疗的疗效。使用89Zr 的PET 免疫技术进行的临床前和临床研究表明,89Zr 免疫技术可以充分反映肿瘤病人体内抗体的分布和代谢[17]。
1.1.3 其他常见金属核素标记探针及临床研究进展 目前,用于PET 成像的64Cu、45Ti、52Mn、86Y 主要采用加速器制备,与反应堆生产相比,加速器生产放射性核素技术上更困难,规模更小,价格更昂贵。但加速器可生产无载体、高比活度的核素,以及某些不能用反应堆生产的缺中子、短寿命的放射性核素,成为获取医用放射性核素主要途径之一。近年来,64Cu、45Ti、52Mn、86Y 等标记的探针也取得了一些进展。例如,64Cu-ATSM 在乏氧显像中对肿瘤治疗前疗效预测及预后评估、早期疗效评估、优化治疗方案等方面具有重要临床应用价值[7]。Severin 等[18]开发的[45Ti](salan)Ti(dipic)具有用于肿瘤成像的潜力。Graves 等[19]成功地将p-SCN-DOTA 添加到TRC105,得到的52Mn-DOTA-TRC105 在动物实验中展现出良好的靶本比。86Y 标记促黑色素细胞激素(α-MSH)和促胃液素释放肽86Y-DOTAReCCMSH(Arg11),与64Cu-DOTA-ReCCMSH(Arg11)相比,86Y 标记的化合物具有更高的肿瘤摄取以及较低的肝脏滞留。
1.2 SPECT SPECT 成像原理是将放射性同位素组成的示踪剂注入人体。示踪剂浓聚在受试器官中后,受试器官被视为γ 射线源。数据通过连续旋转的探测器获得,随后通过计算机进行处理,便获得了器官的横截面影像。SPECT 成像常用的金属核素的理化性质、代表性探针及应用领域见表3。

表3 SPECT 成像常用金属核素的理化性质、代表性探针和应用领域
1.2.199Tcm标记探针99Tcm具有多种价态,可与多种螯合剂形成对应的配合物;半衰期(6.09 h)适中,适合放射性药物合成,便于分发到医院,按剂量制备、给药,且利于收集临床有用图像。另外,99Tcm可通过廉价的便携式99Mo/99Tcm发生器制备,这有效解决了全球配给的问题。99Tcm还具备无其他粒子辐射的优点,使用γ 相机即可获得对物体的辐射损伤小且具有良好分辨率的SPECT 成像。由于不会辐射杀伤红细胞辐射,对病人和工作人员的辐射伤害都较低。99Tcm标记的放射性药物的辐射有效剂量低于68Ga 标记的放射性药物。这些优点使99Tcm多年来一直用于临床。
目前,99Tcm标记的药物已广泛应用于甲状腺、心肌、骨相关疾病以及肿瘤的临床诊断与脏器功能的评估。20 世纪60 年代,基于99Tcm的新型显像剂的开发仅限于用于肺灌注成像的99TcmMAA 和用于肝脏成像的99Tcm-sulfur colloid 这类混合物。20 世纪70 年代末至80 年代初,首个在临床应用且化学特征明确的是心肌灌注剂的99Tcm-MIBI,这标志着99Tcm放射性药物的发展进入了一个新纪元。随后,其他用于心肌灌注成像的药物(tetrofosmin)、评估肝胆功能(N-羟乙基亚胺二乙酸,HIDA)和肾小管功能(亚锡巯乙甘肽,MAG3)的药物也相继问世。除此之外,99Tcm标记的尿素类PSMA 小分子抑制剂的研发取得了进展。99Tcm能用于指导手术治疗,Robu 等[21]首次应用99Tcm-PSMA-I&S 进行放射性导向手术,取得了较好的效果。由于99Tcm-PSMA-I&S 能够与血浆蛋白高度结合,其在体内清除缓慢,术中能发现所有在68Ga-PSMA-11 PET/CT 中观察到的可疑病灶。另外,99Tcm-MIP-1404 已完成Ⅰ期、Ⅱ期和Ⅲ期临床转化[22],应用于诊断局部复发或转移、监测治疗反应、评价前列腺癌病人是否原发及其分期,是极有希望批准投入临床使用的靶向PSMA 的放射性药物。
1.2.2111In 标记探针111In 的半衰期(2.8 d)较长,使得这种放射性核素可用于动力学缓慢的生物分子的SPECT 成像,如抗体及其片段采用111In 标记就具备优势。111In 标记的生物靶向剂,如111In 标记的HER2 纳米抗体已实现SPECT/CT 显像。Massa 等[23]研发的111In-DTPA-2Rs15d-HLC 探针结构式和相对分子质量明确,与HER2 的亲和力保持在纳摩尔水平,该探针在HER2 阳性SKOV3 肿瘤小鼠的SPECT/CT 成像显示,肿瘤组织吸收高,肝、肺等正常组织摄取值较低,为进一步的临床转化打下了基础。但由于111InCl3依靠回旋加速器生产,故生产成本较高,从而限制了其临床应用。
2 治疗核素
放射性治疗药物主要基于放射性α、β-治疗核素研制。病人通过口服或注射放射性药物能够高度选择性浓集在病变组织,靶向性地被病灶摄取,通过持续低剂量的射线产生局部电离辐射生物效应,从而抑制或杀死癌细胞而发挥治疗作用。放射性金属核素适宜的半衰期和标记条件也使其在治疗疾病方面的应用得到快速发展,近期FDA 批准的放射性治疗药物,大部分都是基于放射性金属核素设计出来的,充分发挥了放射性金属核素在临床治疗中的重要作用。
2.1 β 治疗核素 β-衰变粒子能量分布从0 到一个最大值,形成一个连续能谱,其电离能力比α 粒子弱,比γ 射线强。发生β-衰变的核素(如177Lu、90Y、67Cu)是目前临床研究使用的放射性治疗核素,常用的β-治疗金属核素的理化性质、代表性探针及应用领域见表4。
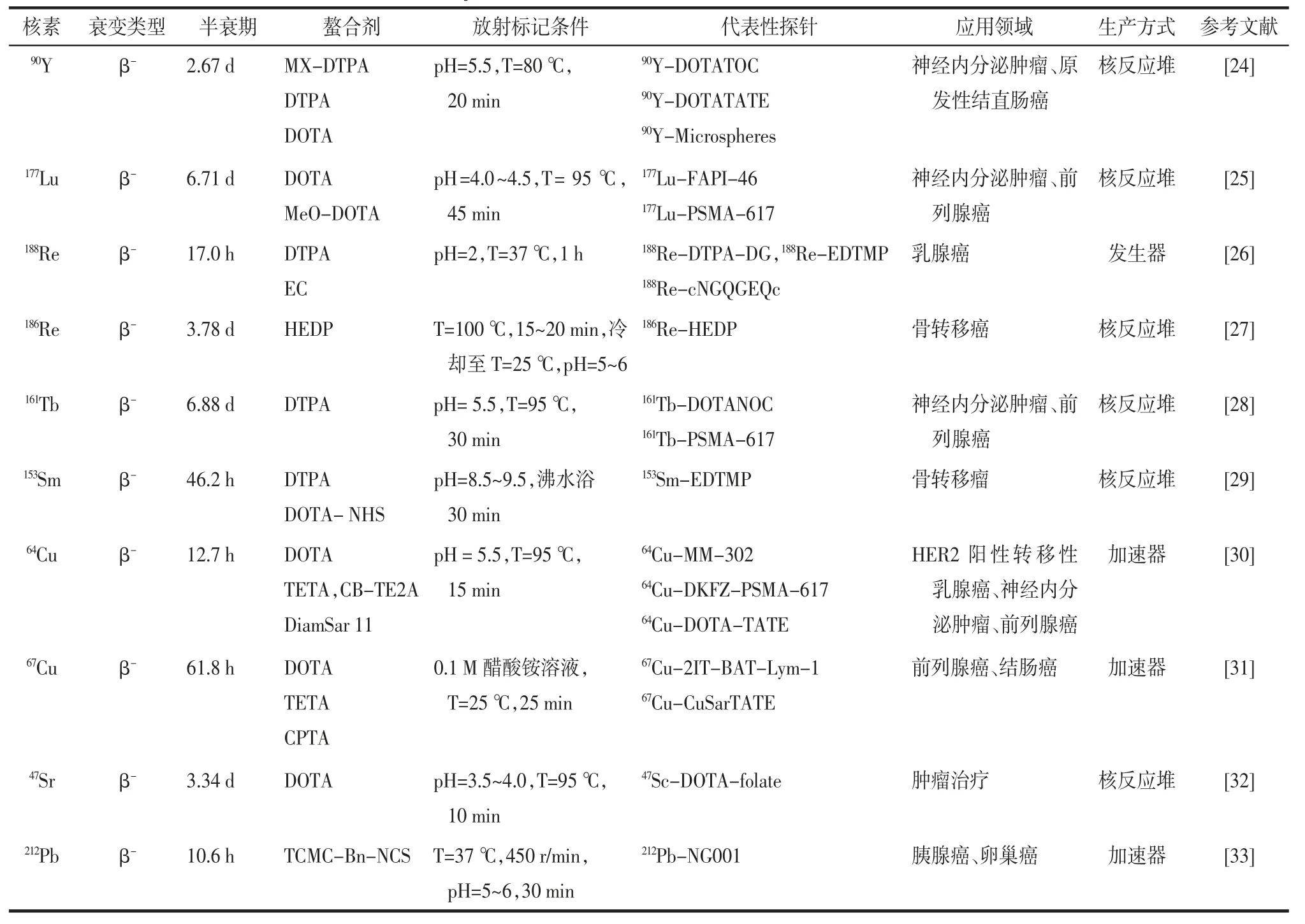
表4 常用β-治疗核素的理化性质、代表性探针和应用领域
177Lu 衰变产生低能β-粒子,其γ 辐射较弱、射程较短,因此对正常细胞的杀伤力较弱,是一种向微小转移病灶递送能量的理想核素。177Lu 因具有较好理化性质和较温和的标记方法,成为在实际临床实践中使用最广泛的治疗核素。
177Lu 标记的药物已在神经内分泌肿瘤、前列腺癌等恶性肿瘤的临床靶向放射性治疗中取得了显著疗效。在对转移性神经内分泌肿瘤病人的疗效系统评价中,177Lu-DOTATATE 肽受体放射性核素治疗具有良好的效果,且其副作用较小[34],是无法手术或转移性神经内分泌肿瘤病人有效的治疗方法,2018 年,177Lu-DOTATATE 被FDA 批准临床应用。同样地,177Lu 在前列腺癌治疗的应用也取得了进展,177Lu-J591 作为放射性免疫治疗药物,其中,人源化单克隆抗体J591 能靶向PSMA,177Lu 特异性输送到前列腺肿瘤部位,177Lu-J591 有望成为靶向放射性治疗药物,利于在肿瘤进展早期根除微转移病灶[25]。177Lu-PSMA 放射配体治疗是对标准治疗方案无效的晚期转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer,mCRPC)的有效治疗方案。其中,177Lu-PSMA-617 已于2022 年3 月被FDA 批准临床应用。
2.2 α 治疗核素 α 核素虽可达数百种,但能应用到靶向治疗药物的并不多。由于α 核素较短的射程,在衰变过程中释放的α 射线仅能穿透数个细胞,可以将其辐射的细胞毒作用局限于很小范围内,适合用于小体积、均质性肿瘤的靶向治疗。通过将α 核素辐射的杀伤作用局限于高度特异性的区域并严格控制其在非目标组织器官内的浓集,治疗的安全性得以提高。虽然α 核素在供应方面严重不足,但因其优良的理化性质,一直以来都是癌症靶向治疗的研究热点。常用的α 治疗金属核素的理化性质、代表性探针及应用领域见表5。

表5 常用α 治疗核素的理化性质、代表性探针和应用领域
2.2.1223Ra 标记探针 2013 年,首个应用于临床的α 核素药物223RaCl2(Xofigo)被FDA 批准,用于治疗伴有骨转移但无脏器转移的去势抵抗性前列腺癌(castration resistant prostate cancer, CRPC)。临床Ⅲ期研究表明,CRPC病人接受完整6 个周期的223Ra 治疗后可提高总生存期及减少骨痛[39]。223Ra 虽然缺乏与之匹配的螯合剂,但其可模拟钙离子单独成药,进而与骨骼中的羟基磷灰石形成复合物,实现选择性地靶向骨骼[40]。
2.2.2225Ac 标记探针225Ac 半衰期较长,可以远距离生产,这增加了225Ac 用于临床治疗的可能性。目前,225Ac 在治疗实体肿瘤方面的临床研究取得了进展,如对于生长抑素受体阳性实体瘤的治疗,Kratochwil 等[41]的研究表明单次剂量>40 MBq 或重复剂量>20 MBq225Ac-DOTATOC 时,每隔4 个月出现剂量依赖性急性血液毒性;2 例病人延迟超过4 年后出现治疗相关肾功能衰竭,但与给药放射性无关。这些数据为225Ac-DOTATOC 的进一步临床应用和研究奠定了基础。除此之外,225Ac-PSMA-617 治疗晚期mCRPC 疗效显著,文献[42]报道2 例临床难治性mCRPC 病人用225Ac-PSMA-617 治疗后出现完全缓解。对于晚期病人,每8 周重复1 次225Ac-PSMA-617(100 kBq/kg 体质量)可达到最佳效果[43]。
目前,各种α 射线核素标记的分子探针开展肿瘤靶向治疗的研究日益增多,α 射线核素靶向肿瘤治疗将成为继β-射线核素肿瘤治疗之外新的治疗方法。从理论而言,α 射线治疗具有诸多优点,但其高线性能量转移所致较强的细胞毒性在正常组织细胞也同样适用,所以α 射线治疗对分子探针的靶向性要求更高,α 射线治疗在真正进入临床之前,尚需进行系统的研究。
3 小结
放射性核素药物经过百余年的发展,在全球疾病诊断和治疗应用中具有不可替代的地位。近年来,金属核素因其具有与生物进程相适应的半衰期及温和的标记条件,为放射性药物的研发提供了新的选择,在临床实践中获得了更多的应用机会。诊断性核药作为PET/CT 或SPECT/CT 的示踪剂,一直占据核药主要市场。目前,89Zr 标记单抗已开展多项临床前应用研究,99Tcm-MIP-1404 已进入Ⅲ期临床,68Ga-DOTA-TATE、68Ga-PSMA-11 等已被FDA 批准用于临床,在利用金属核素用于诊断方面已取得了丰硕的成果。在β-治疗金属核素方面,177Lu-DOTATATE 和177Lu-PSMA-617 已被FDA批准用于临床,使创新核药得到广泛关注,诊疗一体化与靶向放射配体疗法成为研发热点。α 射线核素靶向肿瘤治疗将成为继β 射线核素肿瘤治疗之外新的治疗方法,α 射线特有的高传能线密度及低组织穿透性特征使其对肿瘤的治疗更为有效,并成为近年来核医学研究的热点。但在α 射线核素靶向肿瘤治疗真正进入临床之前,尚需进行考察。
4 展望
各方面性能都理想的核素事实上并不存在,未来的发展趋势将会基于不同的疾病类型、不同的目标器官与组织、不同的治疗目的,甚至是对于不同分期的癌症等因素选择合适的核素。另外,由于在临床中观察到病人存在很大的差异性,需要提供给病人最有效治疗的最佳剂量并且需要个性化每位病人的诊断和治疗方案,其行之有效的解决手段就是通过使用分子影像技术来评估放射性药物的药代动力学、体内清除率以及剂量测定。综上,提供这种个性化的放射性药物,运用核医学的手段解决临床实际问题,以提高每位病人的生存率和生活质量的趋势必将会持续增加。
随着核医学的不断发展,“冷”药与“热”药可互相转化,成为了目前新药研发的一个新途径。在核医学领域中,“热”药是指带有放射性元素的药物,相对应的不带有放射性元素的药物则称之为“冷”药。例如,奥曲肽作为“冷”药严格遵循剂量依赖,导致其有厌食、恶心、呕吐等不良反应,限制了其临床应用。而将奥曲肽转化为“热”药,仅注射辐射剂量,将其作为靶分子带领核素达到病灶,极大程度地减低了其不良反应,在临床治疗上得以应用。同样地,开发的“热”药是对原有“冷”药的结构进行一定程度的修饰才得以成功,研发的过程中获得了新的骨架,做到了“热”药反哺“冷”药。相信在不久的将来,“冷热药互化”这一概念,必将助力新药研发,切实做到服务临床精准诊疗。

