雪胆属转录组的EST-SSR分子标记开发
陈薇薇 幸宁




摘要 [目的]开发雪胆属表达序列标签简单重复序列(SSR)分子标记。[方法]对雪胆属肉花雪胆和母猪雪胆2个种进行转录组测序,检测SSR位点并设计引物,通过PCR扩增和毛细管电泳检验引物的有效性和多态性,并分析种间和种内遗传多样性。[结果]从200对引物中筛选出6对具有高多态性的引物,每对引物检测到的等位基因数5~8个,平均值6.333 3个。有效等位基因(Ne)为2.480 7~4.982 8个,平均值3.760 8个。多态信息含量(PIC)为0.549 5~0.758 3,平均值0.672 9。遗传多样性分析显示,种间和种内居群均存在明显的遗传分化。[结论]該研究开发的EST-SSR引物具有丰富的多态性,为雪胆属植物的遗传多样性研究提供参考依据。
关键词 雪胆属;转录组;EST-SSR分子标记;遗传多样性
中图分类号 R28 文献标识码 A 文章编号 0517-6611(2023)09-0160-04
doi:10.3969/j.issn.0517-6611.2023.09.039
Abstract [Objective]To develop SSR molecular markers in Hemsleya.[Method]Tow species of H. carnosiflora and H. villosipetala were RNA sequenced. SSR loci were detected and primers were designed,the validity and polymorphism of primers were detected by PCR amplification and capillary electrophoresis. The interspecific and intraspecific genetic diversity was analyzed. [Result] 6 pairs of primers with high polymorphism were selected form 200 pairs of primers.The number of alleles detected by each pair of primers was 5-8, with an average of 6.333 3. The effective alleles (Ne) was 2.480 7-4.982 8, with an average of 3.760 8. The polymorphic information content (PIC) was 0.549 5-0.758 3, with an average of 0.672 9. Genetic diversity analysis showed that there were obvious genetic differentiation in interspecific and intraspecific populations. [Conclusion]The ESTSSR primers developed in this study have rich polymorphism, which can provide reference basis for the study of genetic diversity of Hemsleya.
Key words Hemsleya;Transcriptome;ESTSSR molecular marker;Genetic diversity
基金项目 贵州省科技计划项目(黔科合 LH 字〔2017〕7053号); 贵州省教育厅青年科技人才成长项目(黔教合KY字〔2018〕324号)。
作者简介 陈薇薇(1982—),女,四川资中人,讲师,硕士,从事资源植物保护与利用研究。
雪胆属(Hemsleya)隶属葫芦科(Cucurbitaceae),该属植物均为多年生草本植物,属下共31种10变种[1],西南地区为该属植物的主要分布区,其中贵州地区分布约6种。雪胆属植物多可入药,药用部位为干燥块茎,有极高的药用价值,从该属植物中分离出的雪胆素载入1977年版《中国药典》一部[2],该属植物也是我国西南地区各民族常用的传统中草药。现代研究表明,其主要活性成分包括葫芦烷型四环三萜及其皂苷和齐墩果烷型五环三萜及其皂苷等,显现出良好的抗肿瘤与抗菌消炎作用[3-4],而近年的试验中更是显示出了抗 HIV-1的活性[5]。由于分布范围窄,野生资源有限,受人为过度采集的影响,雪胆属植物野生资源急剧减少,对雪胆属植物野生居群的保护和人工驯化迫在眉睫。
SSR(simple sequence repeats)标记即简单重复序列标记,是以特异引物PCR为基础的分子标记技术[6],具有高多态性、信息量丰富等优点,广泛用于遗传图谱的构建、品种鉴定、谱系分析、群体间遗传距离分析、进化和遗传多样性等研究中[7],主要包括基因组SSR和表达序列SSR。其中表达序列标签(experssed sequence tags,EST)SSR来自相对保守的转录组数据,能够直接获得基因表达的信息,同时在近缘和远缘物种间的通用性都较好[8-9]。雪胆属SSR标记开发滞后,目前仅见葫芦科甜瓜、黄瓜和西瓜等不同瓜类作物间有一定的通用性的引物报道[10-11]。因此,该研究对贵州药材市场主流的雪胆药材基源植物肉花雪胆(Hemsleya carnosiflora)、母猪雪胆(Hemsleya villosipetala)共17个居群进行转录组测序和数据分析,开发EST-SSR分子标记,以期为雪胆属植物的种质资源保护和分子标记辅助选育等工作提供理论依据。
1 材料与方法
1.1 试验材料
该研究使用的雪胆属种质资源共17份(表1),采集于贵州省不同地区,采集时间为2018—2021年每年7—8月,样品按照居群采样,同时为避免居群内个体重复取样,个体均采集于不同样地,各样地相距20 m以上。野外及时采集样品新鲜嫩叶,于硅胶中干燥待用,并将样品块茎带回,种植于安顺学院农学院实验地内。2021年5月,采集实验地内处于营养生长期的肉花雪胆和母猪雪胆2个种质的植株幼叶,液氮冷冻30 min后,放入-80 ℃冰箱保存,用于转录组测序。
1.2 试验方法
1.2.1 DNA提取。
采用TSINGKE植物基因組DNA试剂盒(北京擎科生物科技有限公司)提取总DNA,用1%琼脂糖凝胶电泳检测DNA的质量,紫外分光光度法检测DNA的质量浓度,最后稀释标定到20 ng/μL,放入-20 ℃冰箱保存备用。
1.2.2 引物来源与筛选。
采用TSINGKE植物RNA提取试剂盒(北京擎科生物科技有限公司)提取RNA。采用琼脂糖凝胶电泳检测提取RNA的质量。将RNA送北京擎科生物科技有限公司进行转录组测序。
根据转录组测序的生物信息学分析得到的SSR位点引物信息,利用MISA程序搜寻SSR位点,选择重复单元为2、3、4、5个碱基的位点,且保证仅有一种重复类型。通过与 Primer 3.0结合,对SSR引物实行批量设计,遵循基因所在的位置需分散、优先选取已有多态的位点、不同组合的重复单元需均衡选择等原则,初步筛选出适合扩增的位点不重复的200对引物。合成过程中,所有正向引物F的5’端加上通用Tag的16个碱基的引物序列,第一次扩增DNA时片段就多带一段Tag序列。第二轮筛选扩增条带理想的PCR产物进行荧光引物PCR,引物采用Tag修饰引物和各自对应的反向R引物。用Tag的修饰引物、带Tag序列的F引物和R引物共3条引物可以一起多重扩增达到目的。将最终扩增理想的荧光PCR产物在3730xl测序仪上进行检测,得到数据后用Genemapper软件进行分析,根据分析结果,判断不同引物是否具有片段多态性。
1.2.3 SSR-PCR筛选扩增及产物检测。
选取差异性较大的8个样品DNA用合成的200对引物分别进行扩增。PCR扩增体系为20 μL,其中含10 μL的2×Master Mix(blue)(北京擎科生物科技有限公司)、1 μL的10 μmol/L Primer F(加接头)、1 μL的10 μmol/L Primer R、1 μL的DNA样品,不足的用ddH2O补齐。PCR反应程序为94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸5 min,4 ℃冰箱冷藏保存。
扩增产物送北京擎科生物科技有限公司进行毛细管电泳检测(3730xl型仪器,美国ABI公司)。用Gene mapper 4.1软件计算SSR引物的多态性信息含量及位点数。
1.3 数据统计与分析
以条带大小(bp)的方式统计每个个体的特异性条带,根据Gene mapper 4.1分析的峰图建立原始数据矩阵。使用Popgen 32和GenAlEx version 6.501软件,分别计算SSR位点和群体的各项遗传多样性指标;使用SSRUCTURE version 2.3.3 软件,基于Evanno等[12]的方法,计算最适K值;在populations-1_2_30软件中构建UPGMA树。
2 结果与分析
2.1 SSR标记的多态性
从200对引物中筛选出6对能稳定扩增出条带、无杂峰且通用性较高的引物(表2),用17个雪胆种质样品所提取的DNA对其进行多态性评价。
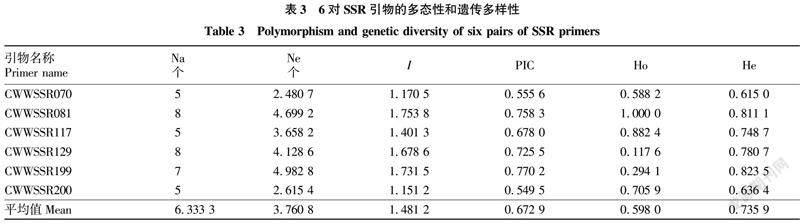
从表3可以看出,6对引物在17份样品中共检测出38个等位基因位点(Na),其中,最小等位基因数目为5个,最大等位基因数目为8个,平均值为6.333 3个;有效等位基因(Ne)总数为22.564 9个,最小有效等位基因数目为2.480 7个,最大有效等位基因数目为4.982 8个,平均值为3.760 8个;观测杂合度(Ho)为0.117 6~1.000 0,平均值为0.598 0;期望杂合度(He)为0.615 0~0.823 5,平均值为0.735 9。Shannon’s指数(I)为1.151 2~1.753 8,平均值为1.481 2;多态信息含量(PIC)为0.549 5~0.770 2,平均值为0.672 9,6对引物均具有较高的多态信息(PIC>0.5),两者参数值变化趋于一致。分析表明筛选出的6对EST-SSR引物在17份样品中的多态性较高,同时表明该研究收集的17份雪胆材料蕴含了较为丰富的遗传多样性。
2.2 基于雪胆属EST-SSR的群体结构分析
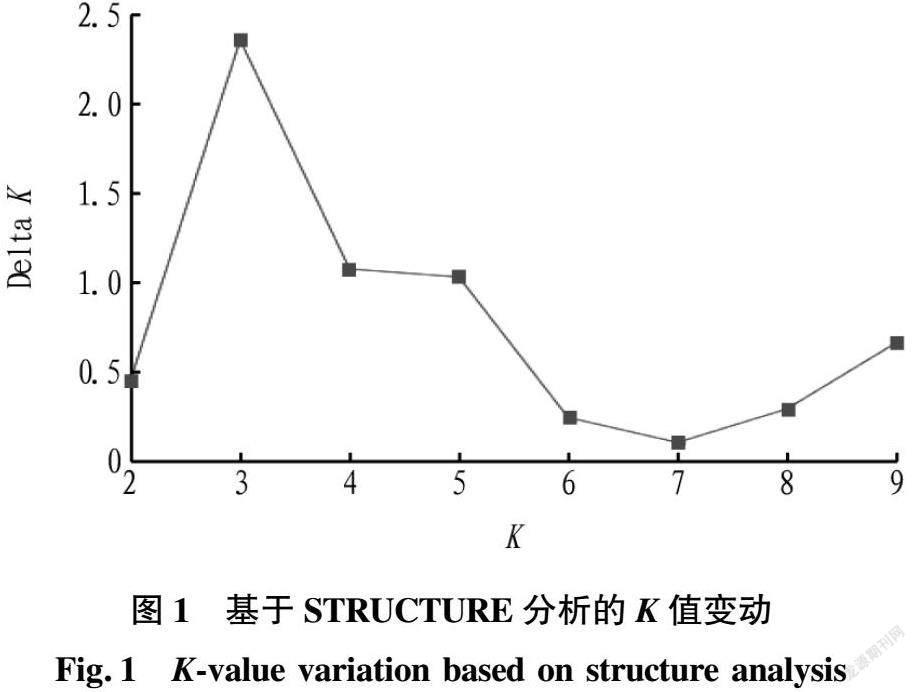
在Structure Harvester中根据Evanno等[12]的方法进行群体遗传结构分析,计算各K值对应的均值(图1),当K=3时,出现最大拐点,即群体遗传结构的理论群体数为3。如图2所示,不同颜色所占比重越大,则该种质划分到相应组群的可能性就越大,第I亚群(红色)来自织金、安顺、纳雍、黔南,均为肉花雪胆这一种的不同居群;第Ⅲ亚群(绿色)来自织金、凯里、纳雍、威宁、水城,含肉花雪胆和母猪雪胆2种的居群;而划分到第Ⅱ亚群(黄色)的种质可能性均较低,说明产区内雪胆种质资源存在群体结构较单一、遗传背景过于狭窄等问题。由此可见,17份样品可分为2个亚群。此外,织金、纳雍等主产区的多数样品分布于不同的亚群中,说明贵州省内分布的雪胆属植物群体结构已趋向多样化,同时与地理分布并不完全相关。
2.3 基于雪胆属EST-SSR的聚类分析
在遗传相似系数分析的基础上,对17份样品进行聚类分析,构建出亲缘关系树状图。从图3可以看出,17个样品可划分为4个组群,其中2份母猪雪胆(He16、He17)全部聚在第I组群;15份肉花雪胆分别聚在3个组群内,第Ⅱ组仅为凯里的1个居群(He8),第Ⅲ组来自纳雍、织金、威宁、水城和福泉(He4、He7、He11、He12、He13、He14、He15),第IV组来自织金、安顺和纳雍(He1、He2、He3、He5、He6、He9、He10),3个组群表现出较多的交叉混合,且存在于组间和群体间的个体中,体现了肉花雪胆群体内存在较多的遗传变异。来自纳雍、织金和安顺的种质亲缘关系较近,说明这些种质资源起源相似或相互有更多的基因交流[13];来自黔东南州凯里的居群(He8)与其他居群亲缘关系较远,相互之间缺乏基因交流。
3 小结与讨论
由群体结构与聚类分析结果可见,肉花雪胆和母猪雪胆存在明显的种间遗传分化。不同居群的肉花雪胆遗传结构并不严格按照分布地区划分,这表明不同居群的肉花雪胆存在较高程度的基因交流,其中,来自纳雍、织金和安顺的种质亲缘关系较近,从地理位置上看,纳雍和织金分布区处于相邻位置,而安顺与织金分布区距离较近,安顺居群为药农从野外采挖后栽培,据调查,该居群源于织金地区,且织金地区肉花雪胆种质资源数量较多,因此,这3个区域的肉花雪胆居群亲缘关系较近,存在基因交流;来自黔东南州凯里的居群与其他居群亲缘关系较远,是由于该居群所在地处于贵州省东南,与其他居群完全隔离,因此群体之间基本没有基因交流,导致凯里居群的遗传基础极为狭窄。从聚类结果还可以看出,有的种质虽然来源于同一地区,但并未聚在一起,而有的种质地理距离相隔较远却聚在同一类中,显示雪胆种质之间的亲缘关系较为复杂。
長久以来,雪胆属下分类存在很多分歧[14],Li等[15]基于ITS、rpl16、trnH-psbA、trnL 等分子序列对本属 23 种植物进行了分子系统的研究,但也无法解决属内的所有系统发育关系。该研究基于转录组数据,设计开发出EST-SSR引物,并利用筛选出的SSR引物分析雪胆属下种间和不同居群间的遗传多样性分析,结果表明,所开发的6对SSR引物多态性高,能将17份雪胆种质材料区分开来,不同地区的肉花雪胆和母猪雪胆均具有较丰富的遗传多样性。该研究为雪胆属植物的遗传多样性研究及后期分子标记辅助育种奠定了重要基础。
介于雪胆属种质间亲缘关系较复杂、遗传多样性较丰富,在对该属植物进行引种栽培时需注重种质的地理来源,保证其生态型的多元化,尽可能收集来源于多个地区的不同的居群或植株。同时,在选育过程中,应最大限度地覆盖雪胆属植物种质的基因库,进而保存更为丰富的遗传多样性,为下一步优良品种的选育奠定物质基础。
参考文献
[1] 中国科学院中国植物志编辑委员会.中国植物志:第73卷 第1册[M].北京:科学出版社,1986:102-129.
[2] 国家药典委员会.中华人民共和国药典:一部[S].北京:人民卫生出版社,1977:531.
[3] 李莹,徐晓婷,郑重飞,等.雪胆属植物的化学成分及生物活性研究进展[J].中草药,2015,46(18):2800-2808.
[4] 王志春,陈薇薇,郭小梅,等.贵州不同产地雪胆药材有效成分研究[J].亚太传统医药,2019,15(10):86-89.
[5] CHEN J C,ZHOU L,WANG Y H,et al.Cucurbitane triterpenoids from Hemsleya penxianensis[J].Nat Prod Bioprospect,2012,2(4):138-144.
[6] 忻雅,方献平,王淑珍,等.简单重复序列标记和序列相关扩增多态性标记在草莓遗传多样性分析中的比较[J].浙江大学学报(农业与生命科学版),2019,45(3):278-287.
[7] 梁小玉,季杨,胡远彬,等.菊苣EST-SSR分子标记开发及通用性分析[J].草地学报,2021,29(9):2081-2090.
[8] 李青竹,蔡友铭,张永春,等.基于石蒜属转录组序列的SSR分子标记开发应用[J].核农学报,2021,35(9):2002-2015.
[9] WU Y H,HE R Q,LU Y Z,et al.Development and evaluation of ESTSSR markers in Sorbus pohuashanensis(Hance)Hedl.and their application to other Sorbus species[J].Trees,2020,34(3):455-467.
[10] 李楠,张海英,陈年来,等.三种瓜类作物SSR扩增的通用性与多态性分析[J].华北农学报,2008,23(4):110-114.
[11] 王春蕾,朱子成,盛云燕.利用甜瓜SSR标记分析常见葫芦科作物亲缘关系[J].中国园艺文摘,2011,27(12):23-25,53.
[12] EVANNO G,REGNAUT S,GOUDET J.Detecting the number of clusters of individuals using the software STRUCTURE:A simulation study[J].Molecular ecology,2005,14(8):2611-2620.
[13] 班秋艳,潘宇婷,潘铖,等.基 于EST-SSR标记的陕西茶树种质资源遗传多样性研究[J].西北农林科技大学学报(自然科学版),2021,49(11):69-78.
[14] 曾祥飞,张洪武,李国栋,等.云南雪胆属植物药用资源的初步研究[J].中药材,2016,39(5):996-1001.
[15] LI H T,YANG J B,LI D Z,et al.A molecular phylogenetic study of Hemsleya(Cucurbitaceae)based on ITS,rpl16,trnHpsbA,and trnL DNA sequences[J].Plant Syst Evol,2010,285(1):23-32.

