小金蝠蛾幼虫血细胞对病原真菌的免疫防御研究
贺元川 游华建 陈仕江

摘要 [目的]研究小金蝠蛾幼蟲血细胞对不同病原菌侵染的细胞免疫响应差异,揭示拟棒束孢病害发生和冬虫夏草菌形成机理的细胞免疫差异。[方法]利用光学显微镜观察小金蝠蛾幼虫感染病原菌后血细胞的数量、形态变化、细胞免疫反应和黑化反应,以L-多巴为底物,采用分光光度法测定感染不同时间后的血淋巴中酚氧化酶活性。[结果]小金蝠蛾幼虫感染冬虫夏草菌的生存曲线无显著差异,血细胞对冬虫夏草菌无明显的集结、包囊、黑化等免疫作用,酚氧化酶活性侵染初期出现降低,然后逐渐恢复至健康幼虫水平;小金蝠蛾幼虫感染粉棒束孢的生存曲线具有显著差异,对感染早期血细胞具有明显的集结、包囊、黑化等免疫响应,酚氧化酶活性初期降低后逐渐升高。[结论]小金蝠蛾幼虫血细胞对病原真菌冬虫夏草菌和粉棒束孢免疫防御响应策略具有显著差异,血细胞对冬虫夏草菌无明显的免疫反应,对粉棒束孢虽然有强烈的免疫反应,但是不能阻止粉棒束孢的快速萌发而导致幼虫短期内死亡。
关键词 小金蝠蛾;血细胞;细胞免疫;粉棒束孢;冬虫夏草菌
中图分类号 Q962 文献标识码 A 文章编号 0517-6611(2023)09-0164-04
doi:10.3969/j.issn.0517-6611.2023.09.040
Abstract [Objective] To study the differences in cellular immune responses of the blood cells of the larvae of Thitarodes xiaojinensis to infection by different pathogens,and to reveal the differences in cellular immune responses to the occurrence of Isaria farinosa disease and the formation mechanism of Ophiocordyceps sinensis.[Method]Optical microscopy was used to observe the number,morphological changes,cellular immune responses and melanization reactions of blood cells in the larva of Thitarodes xiaojinensis after infection with pathogenic bacteria were observed,using Ldopa as the substrate,the activity of phenol oxidase in hemolymph after different times of infection was measured by spectrophotometry.[Result]There was no significant difference in the survival curve of the larvae infected with Ophiocordyceps sinensis,and there was no significant immune effect of blood cells on Ophiocordyceps sinensis,such as aggregation,encapsulation and melanization.The activity of phenol oxidase decreased at the initial stage of infection,and then gradually recovered to the level of healthy larvae.There was significant difference in the survival curve of the larvae infected with Isaria farinosa,the blood cells had significant immune responses such as aggregation,encapsulation and melanization in the early stage of infection,the phenol oxidase activity decreased initially and then gradually increased.[Conclusion]The immune defense response strategies of the blood cells of the larvae of Thitarodes xiaojinensis to the pathogenic fungi Ophiocordyceps sinensis and Isaria farinosa had significant differences.The blood cells had no significant immune response to Ophiocordyceps sinensis,and although they had a strong immune response to Isaria farinosa,they cannot prevent the rapid germination of Isaria farinosa,leading to the shortterm death of the larvae.
Key words Thitarodes xiaojinensis;Hemocytes;Cellular immunity;Isaria farinosa;Ophiocordyceps sinensis
基金项目 重庆市自然科学基金项目(cstc2019jcyj-msxmX0679);重庆市技术创新与应用发展专项面上项目(CSTB2022TIAD-GPX0067);重庆市科技局技术创新与应用发展专项项目(cstc2020jscx-msxmX0102)。
作者简介 贺元川(1985—),女,四川隆昌人,副研究员,硕士,从事冬虫夏草的人工培殖与野生抚育研究。*通信作者,研究员,从事冬虫夏草的培殖、野生抚育及开发利用研究。
冬虫夏草是藏区农牧民的主要经济来源,在经济和药用价值上具有重要的地位。冬虫夏草菌和粉棒束孢是蝙蝠蛾科幼虫的两大主要病原真菌,但是致死效率明显不同。在冬虫夏草的室内培殖中发现,小金蝠蛾幼虫若被粉棒束孢病害侵染,则在短期内死亡,并快速生长产生孢子继代传染,导致病害的暴发,造成严重的损失[1-2]。冬虫夏草菌侵染蝙蝠蛾幼虫后则在其体内长期共存,当体内虫菌体达到一定浓度时导致幼虫僵死,并形成珍稀名贵中药材冬虫夏草[3]。昆虫在长期的自然进化中慢慢形成了一套独特的先天免疫系统,主要通过细胞免疫和体液免疫共同抵御真菌、细菌、病毒等外源病原物的入侵。细胞免疫是昆虫免疫的首道屏障,血细胞通过对病原物进行吞噬、结节及包囊等作用,再通过信号传递,激活体液免疫的抗菌肽、溶菌酶、凝集素等细胞因子的表达,并配合血细胞免疫建立一个完整且开放的防御系统[4]。吞噬作用是由单个血细胞清除入侵病原物和细胞凋亡残体的过程,但是不同种类病原物血细胞的吞噬速度不同[5-8];结节和包囊作用是由血淋巴细胞在促进细胞黏附的细胞因子参与下在入侵病原物的表面层聚集形成“鞘”状结构,使病原物在包囊中窒息而死,或被昆虫自身产生的免疫相关因子消灭[9-10]。昆虫的血细胞从形态上区分,主要包括原血细胞、浆细胞、粒细胞、类绛色细胞和珠血细胞。原血细胞是分化其他几种血细胞的干细胞[10]。浆细胞和粒细胞在鳞翅目昆虫中所占比例最高,是昆虫细胞免疫的主力,主要黏附外源刺激物[11]。珠血细胞主要参与表皮的物质运输,类绛色细胞中富含酚氧化酶前体,主要参与黑化作用[10,12]。以家蚕为模式生物研究结果表明,鳞翅目幼虫感染早期反应是血细胞黏附的激活,导致吞噬作用、结节形成,粒细胞和浆细胞是参与这些反应的血细胞主要类型[13]。
小金蝠蛾(Thitarodes xiaojinensis)属于鳞翅目(Lepidoptera)蝙蝠蛾科(Hepialidae)昆虫,是冬虫夏草(Ophiocordyceps sinensis)的优势寄主昆虫之一[14],主要分布在四川省阿坝藏族羌族自治州小金县,其幼虫被冬虫夏草菌成功侵染后将形成名贵中药材冬虫夏草,具有抗肿瘤、抗过敏、双向免疫调节等功能[15],若被粉棒束孢侵染,则会短期内死亡,并逐渐感染周围幼虫,致使幼虫的大量死亡。小金蝠蛾幼虫的血细胞种类与鳞翅目昆虫血细胞的分类基本一致,其中粒细胞的占比最高。小金蝠蛾幼虫的血细胞免疫功能完善,对酿酒酵母的刺激可发生正常的吞噬和结节,对大型的外源物可正常发生包囊反应[16]。针对小金蝠蛾幼虫的2种常见病原真菌感染短期内出现截然不同的后果,目前鲜有文献报道,关于小金蝠蛾幼虫对不同病原真菌的免疫防御的研究仍为空白,为了探索小金蝠蛾幼虫对不同病原菌感染初期的细胞免疫差异,该研究主要以6龄小金蝠蛾幼虫为试验对象,观察小金蝠蛾幼虫对病原真菌感染的细胞免疫,测定幼虫血淋巴中参与黑化的酚氧化酶的活性变化,阐述小金蝠蛾幼虫对不同病原菌感染的免疫防御策略。
1 材料与方法
1.1 试验材料
1.1.1 供试昆虫。
小金蝠蛾幼虫为甘孜州康定贡嘎中华虫草产业有限公司康定基地室内人工繁育的第3代幼虫,取蜕皮后10 d的6龄小金蝠蛾幼虫,饲养温度12~15 ℃,相对湿度60%~80%,以珠芽蓼、鹅绒委陵菜饲喂。
1.1.2 试验用菌株。
冬虫夏草菌(Ophiocordyceps sinensis,OS)和粉棒束孢(Isaria farinosa,IF)均由重庆市中药研究院冬虫夏草研究所实验室提供。
1.1.3 主要试剂及器材。
Ringer’s生理盐水(RS)配制:NaCl 8.05 g、KCl 0.42 g、CaCl2 0.18 g,超纯水定容至1 L,pH调至7.4。过饱和PTU-Ringer’s生理盐水配制:将过量的苯基硫脲(PTU)加入至Ringer’s生理盐水(pH 7.4)中,振荡、溶解后,0.22 μm滤膜过滤后备用。德国徕卡 DM2500P偏光显微镜;G0146W酚氧化酶试剂盒,购于江苏格锐思生物科技有限公司;96孔细胞培养板,购于NEST公司。
1.2 试验方法
1.2.1 生存率曲线绘制。
分别将2 μL的Ringer’s生理盐水(RS)、冬虫夏草菌(OS)、粉棒束孢(IF)孢子液体注射至健康的6龄小金蝠蛾幼虫体内,并以生理盐水组的小金蝠蛾幼虫为对照,将感染组和对照组饲养7 d,每12 h记录幼虫的死亡头数,计算存活数,汇总记录结果输入DPS 9.50软件中,根据DPS 9.50软件中专业统计-生存分析项下的kaplan-Meier模型绘制生存曲线,并使用LogRank检验不同处理与生理盐水对照组之间差异显著性。
1.2.2 小金蝠蛾幼虫血常规涂片制作与观察。
各取健康的6龄小金蝠蛾幼虫6头,剪断腹足取血淋巴并收集至EP管后,将血淋巴与过饱和PTU-Ringer’s生理盐水等比混匀后2 μL于载玻片上,并用盖玻片覆盖,吸走多余液体,置于光学相差显微镜下观察各类血细胞形態并鉴别,记录同一视野中各类细胞的数量,计算各类细胞所占百分比。
1.2.3 小金蝠蛾幼虫血细胞对病原菌免疫防御观察。
分别将2 μL的Ringer’s生理盐水(RS)、1×105 CFU/mL的冬虫夏草菌(OS)、1×105 CFU/mL的粉棒束孢(IF)注射至健康的6龄小金蝠蛾幼虫体内,观察感染1 h血细胞与病原真菌的相互作用,并在1、12、24、48 h后取血淋巴计数。
1.2.4 小金蝠蛾幼虫血淋巴中酚氧化酶活力的测定。
分别将2 μL的Ringer’s生理盐水(RS)、1×105CFU/mL的冬虫夏草菌(OS)、1×105CFU/mL的粉棒束孢(IF)注射至健康的6龄小金蝠蛾幼虫体内,每次定时(1、4、8、12、24、48、72 h)抽取3头小金蝠蛾幼虫,剪断腹足取血淋巴收集预先加入苯基硫脲的1.5 mL EP管中防止黑化,4 ℃、4 000 r/min 离心20 min后,取上清作为待测液体,按照酚氧化酶试剂盒的说明书测定血淋巴上清液中酚氧化酶的活性。
2 结果与分析
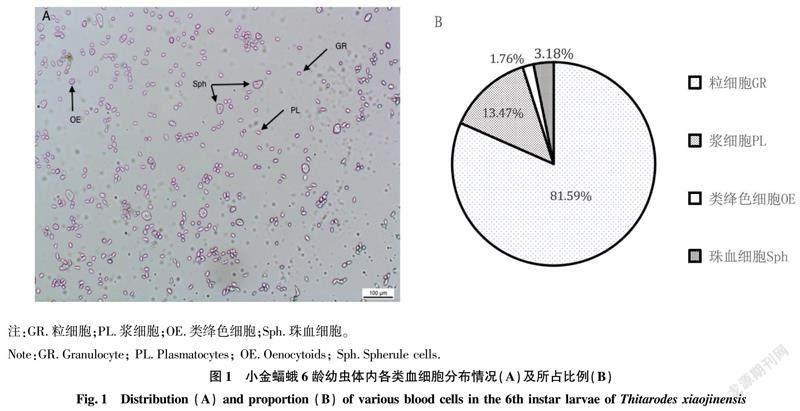
2.1 小金蝠蛾6龄幼虫血细胞种类
小金蝠蛾幼虫的血细胞与其他龄翅目昆虫一致,从形态上区分,主要包括粒细胞、浆细胞、类绛色细胞和珠血细胞,在6龄幼虫中未观察到明显的原血细胞(图1A),与倪若尧等[16]的研究结果基本一致。粒细胞被认为是主要的免疫细胞,可对外源入侵的异物进行吞噬,而浆细胞主要对异物进行包围,形成包被组织。
粒细胞和浆细胞细胞质内富含黑色的颗粒物,可能参与黑化免疫反应[10]。从图1B可以看出,小金蝠蛾6龄幼虫粒细胞所占比例最高,占比为81.59%,其次是浆细胞(13.47%)和珠血细胞(3.18%),占比最低的是类绛色细胞(1.76%),粒细胞和浆细胞所占比例高达95.06%,根据龄翅目昆虫血细胞的分类与功能,推测这2类血细胞可能也在小金蝠蛾幼虫血淋巴的细胞免疫功能中发挥重要作用[13]。
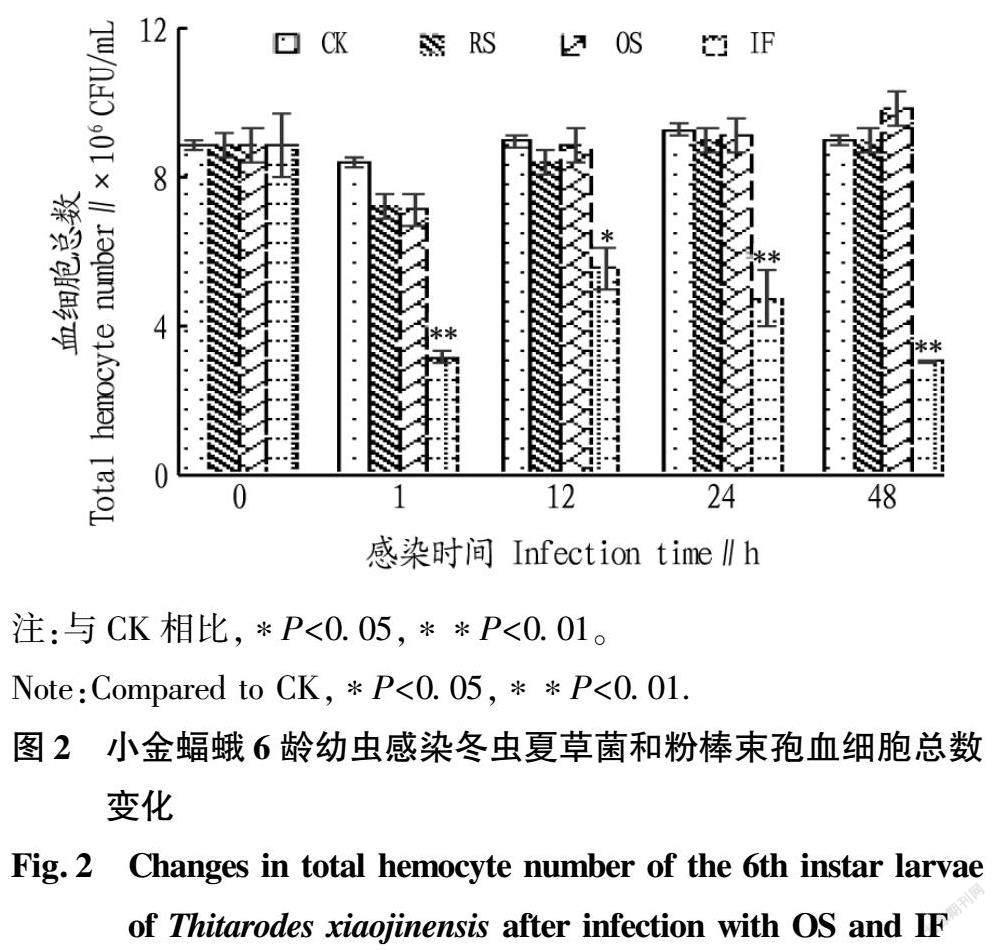
2.2 小金蝠蛾幼虫血细胞对病原真菌的免疫作用
分别统计了小金蝠蛾幼虫感染病原菌后血细胞的总数变化和小金蝠蛾幼虫体内注射病原菌后血细胞的免疫反应。图2显示小金蝠蛾幼虫注射生理盐水(RS)和冬虫夏草菌(OS)以后,血细胞数量有一个先降低后回升,血细胞总数48 h内略比健康幼虫多;但是感染粉棒束孢(IF)后,血细胞是先快速降低,然后略有回升,但是低于健康幼虫的血细胞数量,最后持续下降的过程。因该研究采用的注射感染有微小创伤,在1 h略引起了血细胞的下降,可能与血细胞参与伤口的修复有关。从图3可以看出,粉棒束孢感染刺激1 h后,可观察到粉棒束孢被多层血细胞包被,形成结节,并发生黑化反应;冬虫夏草菌侵染后,血细胞对冬虫夏草菌未发生明显的吞噬、结节等免疫反应,可能是因为血细胞的表面执行吞噬反应的伪足明显减少或是模式识别蛋白无法识别[17-18],但冬虫夏草菌感染后存活的幼虫,长时间观察血细胞数量逐渐缓慢减少[3]。对于粉棒束孢,则可观察明显的结节和黑化现象,这可能是引起早期血细胞数量极速减少的原因之一[19]。粉棒束孢侵染的幼虫的血淋巴体积略有变大,随着体积的变化,可能导致细胞质的渗漏,免疫功能被破坏,导致幼虫行动变化,随着时间延长,粉棒束孢在体内增殖,血细胞破裂、减少,粉棒束孢子萌发菌丝,虫体死亡。
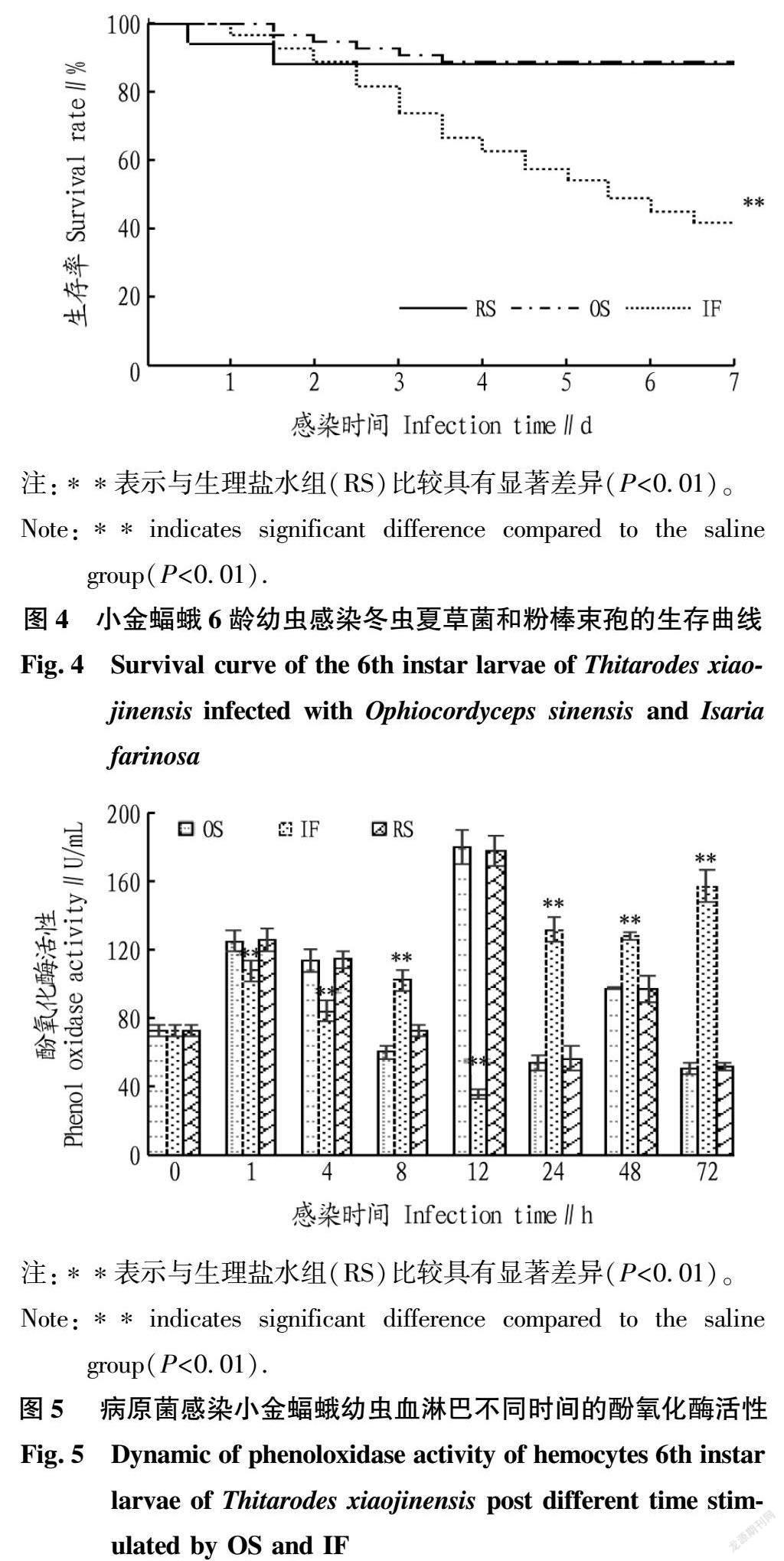
2.3 小金蝠蛾幼虫感染不同病原菌的生存曲线比较
为了观察小金蝠蛾幼虫对不同病原真菌感染的反应,每12 h记录感染幼虫的死亡数量,并绘制了各自的生存曲线,如图4所示。因采用注射方式快速感染,微小的创伤可能引起少量幼虫的死亡,但是在肉眼观察中发现存活的冬虫夏草菌感染的幼虫,体表无任何病征表现,取食正常,与生理盐水对照无显著差异。粉棒束孢感染2~3 d后逐渐有病征表现,行动变缓,取食减少,有的幼虫体表出现黑点或者黑斑,死亡逐漸增加,感染粉棒束孢7 d后小金蝠蛾幼虫的生存率下降至41.28%,感染粉棒束孢幼虫的体表特征与吕延华等[20]报道的一致。观察粉棒束孢感染的死亡幼虫的血淋巴发现,粉拟青霉致死的幼虫体内血淋巴有萌发的粉棒束孢的菌丝。Log-Rank检验生理盐水组幼虫死亡头数的观察值为2,而粉棒束孢感染组的理论值为9.54,P值<0.01,表明粉棒束孢的死亡率远远大于生理盐水组;而冬虫夏草菌感染组幼虫死亡头数的理论值为1.86,P值>0.05,表明冬虫夏草菌感染组的死亡率与生理盐水组无显著差异。
2.4 小金蝠蛾幼虫酚氧化酶的活性变化
酚氧化酶又称酪氨酸酶,主要参与昆虫的调控细胞吞噬及黑化等免疫防御过程。酚氧化酶的活性常作为评价昆虫免疫能力的指标。酚氧化酶在外源物的诱导下,通过酚氧化酶原级联系统活化酚氧化酶。从图5可以看出,在注射病原菌早期酚氧化酶的活性均上升,冬虫夏草菌感染的幼虫随酚氧化酶活性下降,最后出现上下波动,波动幅度逐渐缩小至注射前的水平,12 h的快速上升可能与激活表达有关;粉棒束孢感染的幼虫酚氧化酶活性缓慢波动下降后回升,一直处于较高的活力水平,推测幼虫可能一直处于较强的免疫防御过程,病原真菌的感染是一个长时间的过程,早期酚氧化酶主要参与细胞介导的免疫防御,后期酚氧化酶调控体液免疫对菌丝的黑化作用[21],因此推测粉棒束孢感染后,因无法被血细胞清理,而萌发出菌丝,可能激活了体液免疫的黑化作用。
3 讨论
冬虫夏草菌和粉棒束孢是蝙蝠蛾幼虫的2种重要的病原真菌,但是二者感染蝙蝠蛾幼虫后,发病的快慢存在显著差异。在冬虫夏草室内培殖过程中,通常将快速致死幼虫的粉棒束孢病原菌列为主要病害之一。该研究从幼虫细胞免疫入手,采用注射式的急性感染的方式观察小金蝠蛾幼虫血细胞对2种病原真菌的免疫响应差异和对小金蝠蛾幼虫生存曲线的影响。结果发现血细胞可能无法识别冬虫夏草菌,而未表现明显的吞噬和结节等免疫反应,这可能与冬虫夏草菌感染小金蝠蛾幼虫后,会引起血细胞表面伪足的变化,导致血细胞缺陷无法将冬虫夏草菌识别为外源物[17],冬虫夏草菌的虫菌体表面的光滑结构可能缺少被血细胞模式识别蛋白等结合的识别受体[3]。粉棒束孢感染小金蝠蛾幼虫后,虽然可观察到游离于血淋巴中的结节,可见被黑化的粉棒束孢有明显的结节、包被、黑化等免疫响应,但是粉棒束孢感染与白僵菌感染家蚕相似,孢子仍可快速萌发为菌丝,充斥虫体,甚至从气孔等处长出菌丝,导致到期内幼虫的致死[19]。虽然该研究观察到了血细胞对不同病原菌的免疫防御差异,但是关于冬虫夏草菌逃避血细胞的识别和粉棒束孢子黏附血细胞的机理还需要进一步研究。
4 结论
小金蝠蛾幼虫感染冬虫夏草菌的生存曲线无显著差异,而小金蝠蛾幼虫感染粉棒束孢的生存曲线具有显著差异。冬虫夏草菌感染初期,尚未观察到血细胞对冬虫夏草菌有明显的吞噬、结节等免疫防御,酚氧化酶活性侵染初期出现降低,然后逐渐恢复至健康幼虫水平,但是未发现黑化现象,冬虫夏草菌在幼虫体内以出芽形式繁殖。血细胞对粉棒束孢具有明显的吞噬、结节和黑化等免疫响应,酚氧化酶活性初期降低后逐渐升高,但是不能阻碍粉棒束孢孢子萌发为菌丝,导致幼虫的快速死亡。小金蝠蛾幼虫对不同病原菌的免疫防御为后续研究冬虫夏草菌侵染小金蝠蛾幼虫后逃避免疫的作用机理奠定基础。
参考文献
[1] 贺元川,游华建,鲁增辉,等.冬虫夏草培殖中粉棒束孢病害动态变化规律[J].西南农业学报,2020,33(12):2840-2845.
[2] LU Z H,SHI P,HE Y C,et al.Review on natural enemies and diseases in the artificial cultivation of Chinese caterpillar mushroom,Ophiocordyceps sinensis (ascomycetes) [J].International journal of medicinal mushrooms,2015,17(7):693-700.
[3] LI M M,MENG Q,ZHANG H,et al.Vegetative development and host immune interaction of Ophiocordyceps sinensis within the hemocoel of the ghost moth larva,Thitarodes xiaojinensis[J].Journal of inverterbrate pathology,2020,170:1-10.
[4] HILLYER J F.Insect immunology and hematopoiesis[J].Developmental & comparative immunology,2016,58:102-118.
[5] WILLIAMS M J.Drosophila hemopoiesis and cellular immunity [J].Journal of immunology,2007,178(8):4711-4716.
[6] LEVASHINA E A,MOITA L F,BLANDIN S,et al.Conserved role of a complementlike protein in phagocytosis revealed by dsRNA knockout in cultured cells of the mosquito,Anopheles gambiae[J].Cell,2001,104(5):709-718.
[7] HERNNDEZMARTNEZ S,LANZ H,RODRíGUEZ M H,et al.Cellularmediated reactions to foreign organisms inoculated into the hemocoel of Anopheles albimanus (Diptera:Culicidae) [J].Journal of medical entomology,2002,39(1):61-69.
[8] LAMPROU I,MAMALI I,DALLAS K,et al.Distinct signalling pathways promote phagocytosis of bacteria,latex beads and lipopolysaccharide in medfly haemocytes [J].Immunology,2007,121(3):314-327.
[9] NAPPI A J,OTTAVIANI E.Cytotoxicity and cytotoxic molecules in invertebrates[J].BioEssays,2000,22(5):469-480.
[10] LAVINE M D,STRAND M R.Insect hemocytes and their role in immunity[J].Insect biochemistry and mollecularb biology,2002,32(10):1295-1309.
[11] BLANCO L A A,CRISPIM J S,FERNANDES K M,et al.Differential cellular immune response of Galleria mellonella to Actinobacillus pleuropneumoniae[J].Cell tissue research,2017,370(1):153-168.
[12] DUBOVSKIY I M,KRYUKOVA N A,GLUPOV V V,et al.Encapsulation and nodulation in insects[J].Invertebrate survival journal,2016,13:229-246.
[13] JIANG H,VILCINSKAS A,KANOST M R.Immunity in Lepidopteran insects[J].Advance in experimental medicine & biology,2010,708:181-204.
[14] 賀元川,罗昌树,游华建,等.小金蝠蛾幼虫β-1,3-葡聚糖识别蛋白βGRP1基因的分子特征与生物信息学分析[J].安徽农业科学,2021,49(19):95-98,101.
[15] BELWAL T,BHATT I D,KASHYAP D,et al.Chapter 5.4Ophiocordyceps sinensis[M]//NABAVI S M,SILVA A S.Nonvitamin and nonmineral nutritional supplements.Cambridge:Academic Press,2019:527-537.
[16] 倪若尧,孟茜,张寰,等.小金蝠蛾幼虫血细胞的种类、形态及细胞免疫功能[J].昆虫学报,2018,61(4):432-438.
[17] 倪若尧.小金蝠蛾细胞免疫及其与冬虫夏草菌的免疫互作初步研究[D].保定:河北大学,2018:22.
[18] RAO X J,ZHAN M Y,PAN Y M,et al.Immune functions of insect βGRPs and their potential application[J].Developmental and comparative immunology,2018,83:80-88.
[19] 陆龙喜,时连根.家蚕血细胞对病原白僵菌的防御反应研究[J].浙江农业学报,2001,13(4):201-204.
[20] 吕延华,夏金明,张宗耀,等.蝙蝠蛾幼虫感染粉棒束孢后的病症、组织病理变化及侵入途径[J].菌物学报,2018,37(3):314-324.
[21] YASSINE H,KAMAREDDINE L,OSTA M A.The mosquito melanization response is implicated in defense against the entomopathogenic fungus Beauveria bassiana[J].PLoS pathogens,2012,8(11):1-13.

