CD20阳性的面部原发性皮肤CD30+间变大细胞淋巴瘤1例及文献回顾
谢春丽 杜素萍 马朝东 丁克云
【关键词】间变大细胞;原发性皮肤CD30+间变大细胞淋巴瘤;CD20阳性
中图分类号:R733.1 文献标识码:B 文章编号:1004-4949(2023)07-0151-04
原发性皮肤C D 3 0+间变大细胞淋巴瘤(primary cutaneous CD30-positive anaplastic large cell lymphoma,PC-ALCL)是一种罕见的原发于皮肤组织的CD30+ T细胞淋巴增殖性疾病,仅占皮肤原发恶性淋巴瘤的0.9%,占所有皮肤T细胞淋巴瘤的10%,皮损表现为单发性或局限性丘疹或结节,表面常有溃疡,20%患者表现为多发性损害,皮损可部分或完全消退,但易复发[1];男女发病比例为1.42∶1,好发部位为下肢和臀部,其次为头颈部,预后一般,5年生存率约为80.6%[2]。其中表达CD20阳性的更是罕见,检索国内外文献发现,目前仅一例英文文献有所报道[3]。现就我科诊断的1例面部原发性皮肤CD30+间变大细胞淋巴瘤进行分析,现报道如下。
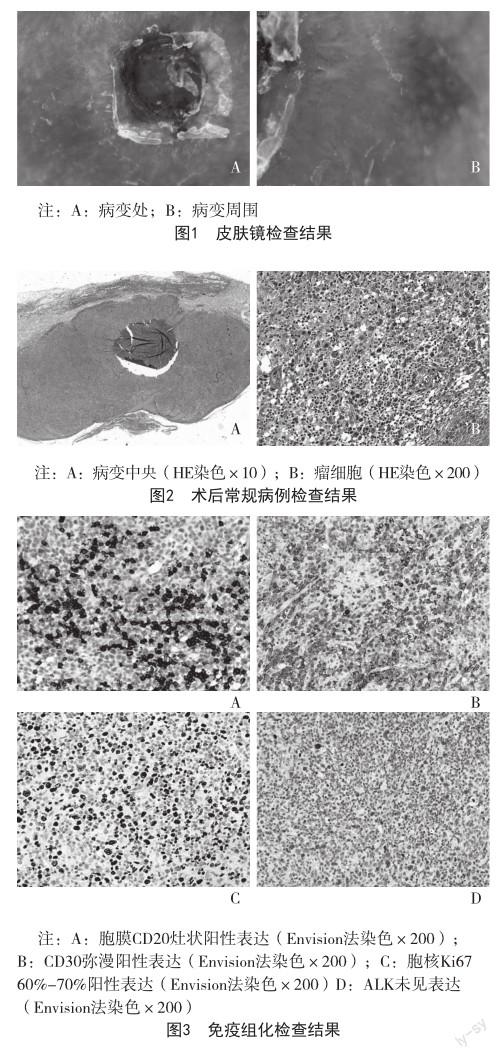
患者,男,87岁,因“右面颊肿物术后复发1月”于2021年11月26月收住入院。患者于2021年3月自右侧面颊部出现一处粟粒大小淡红色丘疹,中央凹陷,稍痒,无疼痛,缓慢增大至黄豆大小,表面渐出现溃疡。患者于2021年9月13日至江苏大学附属人民医院皮肤科就诊,皮肤镜示:病变为一处圆形翻卷蛋挞样皮损,边缘呈细堤状隆起,中央为淡黄色均质性改变;病变周围瓷白色改变,其下血管丰富,呈迂曲状、树枝状及袢状,见图1。予以活检考虑淋巴造血系统肿瘤,后于2021年9月28日予以手术完整切除。术后常规病理:病变中央表皮萎缩变薄,肿瘤位于真皮及皮下组织内,境界较清楚,呈弥漫状分布,见图2A;瘤细胞体积大,胞质丰富,呈圆形、卵圆形或马蹄形,染色质呈粗颗粒状,核仁明显,可见明显核分裂像,肿瘤细胞间可见小淋巴细胞,未见中性粒细胞、嗜酸性粒细胞等,见图2B。免疫组化检查:CD2、CD3、CD4、CD5、CD8、CD20(图3A)、CD30(图3B)、CD38、CD43、TIA-1阳性,Ki67 60%~70%(图3C);ALK(图3D)、CD21、CD56、EBER、Granzyme B均阴性。PET-CT及全身骨显象:右侧面颊高代谢灶,淋巴瘤浸润可能。结合临床、病理等,考虑面部原发性皮肤CD30+间变大细胞淋巴瘤。
皮疹完整切除2个月后,2021年11月原肿物处出现一处绿豆大小丘疹,偶痒,缓慢增大,且边缘区域出现一米粒大小破溃,与原皮疹类似,予以收住入院。患者既往有高血压病、冠心病及心脏起搏器植入史。入院查体:右侧面颊部一处蚕豆大小淡红色丘疹,质地坚实,中央凹陷、溃疡,无脓性分泌物,边缘堤状隆起,见图4。入院后血尿粪常规、肝肾功能、乳酸脱氢酶等无明显异常。心电图示一度房室传导阻滞、完全性右束支合并左前分支传导阻滞。心脏彩超:①高心病;②主动脉增宽主动脉瓣钙化伴中度反流;③轻度二尖瓣反流4中度肺高压伴轻中度三尖瓣反流。胸腹部CT:①轻度肺气肿,右上肺胸膜下钙化灶;②心脏起搏器置入后观。皮损处局麻后予以完整切除后再次常规病理:淋巴造血系统肿瘤,与前片相似,结合病史,诊断考虑面部原发性皮肤CD30+间变大细胞淋巴瘤。皮损予以手术切除后随访至今(13个月)未复发。
原发性皮肤CD30+间变大细胞淋巴瘤(PCALCL)属于原发性皮肤CD30+淋巴增生性疾病,发病率较低,但复发率高,如Kempf W等[4]的研究显示,一半以上的病例可复发,且预后一般。而影响预后的因素不一。如Sarfraz H等[2]进行的一项纳入501例PC-ALCL的SEER数据库回顾研究显示,预后与年龄及是否接受化疗有关,年龄越大(≥60岁),预后越差;接受化疗者较未接受化疗者预后更差;而Lee WJ等[5]的研究則认为预后与皮疹部位相关:皮疹位于下肢者预后更差,下肢有皮疹者5年生存率为76%,而未累及下肢者5年生存率为96%。
组织病理上PC-ALCL主要以真皮内为主弥漫或致密结节状分布大淋巴细胞浸润,肿瘤细胞大多呈间变性、多形性或免疫母细胞性,胞浆丰富淡染,核仁明显且呈嗜酸性,细胞核呈肾形、圆形,甚至出现典型“Hallmark”细胞(胞浆丰富,核仁明显,核呈马蹄状)[6]。肿瘤团块周边可有多少不等炎症细胞如中性粒细胞、嗜酸性瘤细胞、组织细胞等浸润[7]。免疫组化特征是大于75%肿瘤细胞表达CD30,而CD3、CD20、CD56等常为阴性。一般ALK阳性多提示系统型CD30+间变大细胞淋巴瘤累及表皮[8]。细胞毒相关抗体阳性如TIA-1、granzyme-B不常见,如果出现多与血管侵犯有关[9]。基因检测方面,PCALCL可检测 DUSP22(约占30%)和TP63(约占5%)的重排,一般存在DUSP22重排的ALCL患者临床预后良好,而TP63重排的ALCL患者临床预后较差[10]。

PC-ALCL通常需要与其他CD30+大细胞淋巴瘤鉴别,如淋巴瘤样丘疹病(LyP)、累及皮肤的系统性ALCL、向大细胞转化的蕈样肉芽肿(MF)及其他疾病如虫咬皮炎、黑素瘤等。LyP典型皮损为群集多发的红棕色丘疹或结节,中央可出血、坏死,无自觉症状。皮疹有自然消退倾向,丘疹结节消退后可遗留色素减退斑或色素沉着斑。组织病史上,A型和C型LyP可出现CD30阳性表达的大淋巴细胞,免疫组化方面可与PC-ALCL重叠。但LyP一般有表皮改变、淋巴细胞楔形浸润,炎症细胞较为混杂等特征,结合临床发展进程不同等特点,可与PCALCL鉴别[1]。累及皮肤的系统性ALCL一般在皮损发生前即有无痛性淋巴结肿大,常见的首发部位包括颈部、腹股沟、腋下和纵隔淋巴结,还常伴有其他症状:①不明原因的发热(38 ℃以上);②盗汗;③6个月内不明原因的体重下降超过10%[11];皮损多常表现为泛发性皮损;ALCL常出现细胞毒标志如TIA、GrB阳性[12]。仅根据组织病理学和免疫组化表型特征无法区别PC-ALCL与MF,正确诊断需要密切结合临床病史。MF患者一般都先有斑片、斑块或红皮病改变,缓慢进展到肿瘤期;而间变性大细胞淋巴瘤则无类似病程;此外PC-ALCL一般预后较好,而MF发生大细胞转化时预后很差,诊断大细胞转化到死亡的中位期是22个月[13]。
治疗上,一般局限性皮疹可予以手术切除或放射治疗[14];皮疹多发或泛发者可考虑单一药物治疗如甲氨蝶呤、本妥昔单抗、罗米地辛、普拉曲沙、吉西他滨、依托泊苷、柔红霉素等[15,16];如果皮肤进展较快或皮肤外区域受累也可采用联合方案如CHOP(环磷酰胺+多柔比星+长春新碱+泼尼松)等[17]。而2010版美国国立综合癌症网络指南中对于ALK-ALCL推荐选择联合化疗+受累野放疗,挽救治疗可选择高剂量化疗联合自体干细胞移植[18]。而Oka T等[19]的研究也认为异体/自体干细胞移植致者死亡率较高,通常只在其余方式无效时采用。同样,选择药物治疗时也需综合患者基础疾病、肝肾功能、药物副作用等择优选择,例如约65%患者应用本妥昔单抗后出现了周围神经病变,限制了该药物的推广使用[20]。
本病例特殊之处在于免疫组化结果中,肿瘤细胞CD2、CD3、CD4、CD8、CD43等均阳性,提示为T淋巴细胞来源肿瘤,但意外的是部分肿瘤细胞也同时表达CD20。检索文献发现,目前中文文献中尚无PC-ALCL表达CD20的报道,而外文文献中仅一例[3],该患者为53岁男性患者,皮疹为左大腿一处似化脓性肉芽肿样结节,其免疫组化结果为CD2、CD4、CD5、CD20、CD30阳性,ALK-1、CD3、CD7、CD8、CD10、CD43、CD79a 、BCL-6、EMA、PAX5、TIA-1、granzyme B、EBER均阴性,后该病例予以手术切除,随访情况未叙。而T细胞相关肿瘤里出现CD20阳性表达较为少见,目前报道的还有蕈样肉芽肿[21]、累及皮肤的NK-T细胞淋巴瘤[22]、外周T细胞淋巴瘤[23]等。针对这种CD20异常表达情况,目前提出两种可能的假说如下:一是正常循环CD20阳性T细胞正向肿瘤细胞转化;二是CD20可能是T细胞活化的标志,目前仍以第一种观点为主[24]。
另外,检索文献发现,目前国内外尚无原发性皮肤CD30+间变大细胞淋巴瘤的皮损的皮肤镜表现,本文提供了该病的皮肤镜表现,不足之处在于皮肤镜图片略模糊,但对于进一步学习该类疾病仍提供了新的思路;另外,该例患者予以手术完整切除后随访至今13个月未复发,提示原发性皮肤CD30+间变大细胞淋巴瘤如表现为局限性皮疹,手术完整切除不失为较优选择之一。
[1] Bolognia JL,Jorizzo JL Rapini RP,主编;朱学骏,王宝玺,孙建方,译.皮肤病学[M].北京:北京大学医学出版社,2015:2058-2061.
[2] Sarfraz H,Gentille C,Ensor J,et al.Primary cutaneous anaplastic large-cell lymphoma:a review of the SEER database from 2005 to 2016[J].Clin Exp Dermatol,2021,46(8):1420-1426.
[3] Mark E,Sutton M,Gru A.Primary Cutaneous Anaplastic Large-Cell Lymphoma With Aberrant CD20 Expression: Case Report and Review of the Literature[J].Am J Dermato pathol,2022,44(12):971-978.
[4] Kempf W,Kazakov DV,Paredes BE,et al.Primary cutaneous anaplastic large cell lymphoma with angioinvasive features and cytotoxic phenotype:a rare lymphoma variant within the spectrum of CD30+ lymphoproliferative disorders[J].De rmatology,2013,227(4):346-352.
[5] Lee WJ,Moon IJ,Lee SH,et al.Cutaneous anaplastic largecell lymphoma (ALCL):A comparative clinical feature and survival outcome analysis of 52 cases according to primary tumor site[J].J Am Acad Dermatol,2016,74(6):1135-1143.
[6] Gratzinger D,Million L,Kim YH.Occult Dermal Lymphatic Involvement Is Frequent in Primary Cutaneous Anaplastic Large Cell Lymphoma[J].Am J Dermatopath ol,2015,37(10):767-770.
[7] 宋昊,陳浩,张韡,等.原发皮肤 CD30阳性间变大细胞淋巴瘤七例临床病理分析[J].中华皮肤科杂志,2016,49(4):252-255.
[8] Pulitzer M,Ogunrinade O,Lin O,et al.ALK-positive(2p23 rearranged) anaplastic large cell lymphoma with localization to the skin in a pediatric patient[J].J Cutan Pathol,2015,42(3):182-187.
[9] Martires KJ,Ra S,Abdulla F,et al.Characterization of primary cutaneous CD8+/CD30+ lymphoproliferative disorders[J].Am J Dermatopathol,2015,37(11):822-833.
[10] Amador C,Feldman AL.How I Diagnose Anap-lastic Large Cell Lymphoma[J].Am J Clin Pathol,2021,155(4):479-497.
[11] 姜艳红,陈光意,盛家和,等.42例初治原发系统性间变大细胞淋巴瘤临床特点分析[J].现代肿瘤医学,2020,28(21):3790-3794.
[12] 李鑫静,陈宝珍,陈燕坪,等.系统性间变性大细胞淋巴瘤的免疫组织化学特征[J].临床与病理杂志,2017,37(5):970-974.
[13] Vergier B,de Muret A,Beylot-Barry M,et al.Transformation of mycosis fungoides:clinicopathological and prognostic features of 45 cases. French Study Group of Cutaneious Lymphomas[J].Blood,2000,95(7):2212-2218.
[14] Kempf W,Pfaltz K,Vermeer MH,et al.EORTC, ISCL, and USCLC consensus recommendations for the treatment of primary cutaneous CD30-positive lymphoproliferative disorders:lymphomatoid papulosis and primary cutaneous anaplastic large-cell lymphoma[J]. Blood,2011,118(15):4024-4035.
[15] Melchers RC,Willemze R,Bekkenk MW,et al.Evaluation of treatment results in multifocal primary cutaneous anaplastic large cell lymphoma: report of the Dutch Cutaneous Lymphoma Group[J].Br J Dermatol,2018,179(3):724-731.
[16] Stadler R,Assaf C,Klemke CD,et al.Short German guidelines: cutaneous lymphomas[J].J Dtsch Dermatol Ges,2008,6 Suppl 1:S25-S31.
[17] Willemze R,Hodak E,Zinzani PL,et al.Primary cutaneous lymphomas:ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J].Ann Oncol,2018,29(Suppl 4):iv30-iv40.
[18] Pardi E,Mariotti S,Pellegata NS,et al.Functional characterization of a CDKN1B mutation in a Sardinian kindred with multiple endocrine neoplasia type 4 (MEN4)[J].Endocr Connect,2015,4(1):1-8.
[19] Oka T,Sugaya M,Cury-Martins J,et al.Hematopoietic stem cell transplantation for cutaneous T-cell lymphoma: Summary of 11 cases from two facilities in Japan and Brazil[J].J Dermatol,2016,43(6):638-642.
[20] Duvic M,Tetzlaff MT,Gangar P,et al.Results of a Phase II Trial of Brentuximab Vedotin for CD30+ Cutaneous T-Cell Lymphoma and Lymphomatoid Papulosis[J].J Clin Oncol,2015,33(32):3759-3765.
[21] Harms KL,Harms PW,Anderson T,et al.Mycosis fungoides with CD20 expression:report of two cases and review of the literature[J].J Cutan Pathol,2014,41(6):494-503.
[22] Tsai YC,Chen CK,Wu YH.CD20-Positive nodal natural killer/T-cell lymphoma with cutaneous involvement[J].J Cutan Pathol,2015,42(9):639-644.
[23] Lee KY,Jeon SY,Hong JW,et al.CD20 Positive T Cell Lymphoma Involvement of Skin[J].Ann Dermatol,2011,23(4):529-535.
[24] Balmer NN,Hughey L,Busam KJ,et al.Primary cutaneous peripheral T-cell lymphoma with aberrant coexpression of CD20:case report and review of the literature[J].Am J Der matopathol,2009,31(2):187-192.
編辑 张孟丽

