重组早孕因子的原核表达及多克隆抗体制备
王 聪,王 菡,张海玲,肖毅然,郭禹汐,刘梦迪,李浩菘,吴宗澄,段芙春,卢士英
(1.吉林大学动物医学学院/人兽共患病研究教育部重点实验室,长春 130112;2.中国农业科学院特产研究所,长春 130112)
早孕因子(Early pregnancy factor,EPF)[1]是在哺乳动物早期妊娠血清中检测到的一种免疫抑制和生长调节的功能蛋白,是目前所知最早确认妊娠的生化指标之一,是判断胚胎活力的标志[2]。精子与卵子结合后的几个小时内EPF 含量迅速增高,小鼠受精后6 h、牛24 h、人48 h 即可从母体内检测到具有活性的EPF,比人绒毛膜促性腺激素(hCG)的检出时间较早[3],但当母体未成功受精时不分泌EPF。早孕因子在不同物种中具有相同的特异性,但不同物种间分子质量有很大差别,人体中EPF 分子质量为21.5 ku[4],与牛源序列完全一致[5],怀孕母猪体内EPF 分子质量为20~450 ku,但是在不同物种中EPF蛋白存在一个共同点:含有102 个氨基酸残基的多肽,是早孕因子的基本活性部分。Cheng 等[6]研究表明,当孕妇流产后随着时间推移,EPF 在体内含量逐步下降,在7 d 左右达到正常水平。此外,早孕因子在体内含量也与母体胚胎的状态相关[7],体内受精后分泌EPF 释放因子,保证胎儿在母体不被机体排斥。检测孕妇体中EPF 的含量有利于及时掌握受孕情况,也可应用在家畜的早孕检测,缩短动物的空怀时间,缩短产犊间隔,还可应用于胚胎监测、胚胎移植等领域[8]。
早孕因子作为一种免疫抑制蛋白,可以通过降低CD4+T 细胞的增殖来减弱T 淋巴细胞对机体的作用,以缓解疾病症状。在妊娠的早期,由于EPF 免疫抑制的保护作用,使胎儿不被母体视作异物清除[9,10]。临床方面,实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis,EAE)是一种CD4+T 细胞介导的自身免疫性疾病。研究表明,EPF 可作为生物制剂与β 干扰素联合用药对EAE 有明显的抑制作用[11]。Athanasas-platsis 等[12]被动免疫EPF 单抗到怀孕小鼠体内,导致怀孕小鼠流产,说明EPF 能保护胎儿免受母体的免疫排斥,从而保证外来胚胎的活力。Morton 等[10]通过pGEX-2T 构建重组表达质粒,原核表达获得了具有生物活性的人早孕因子重组蛋白(rEPF),并在此基础上,探讨人早孕因子重组蛋白与天然蛋白半衰期对比及二者对皮肤移植的时间影响,表明rEPF 可以减弱移植物排斥的影响,增加移植皮肤的存活时间,EPF 在移植器官移植方面会有更广泛的应用。
早孕因子原核表达质粒的成功构建,其重组蛋白在大肠杆菌中表达与纯化,是获得EPF 蛋白的成本低廉的方法。本研究利用基因工程技术原核表达牛源EPF 蛋白,获得高纯度的早孕因子重组蛋白,免疫动物制备EPF 多克隆抗体,为进一步研究EPF 高效灵敏检测方法和其免疫学应用提供基础。
1 材料与方法
1.1 材料
1.1.1 试验动物 成年雌性SPF 级新西兰大耳白兔购自辽宁长生生物技术公司。
1.1.2 主要试剂与仪器 大肠杆菌DH5α 感受态细胞和BL21(DE3)感受态细胞为实验室制备留存。透析袋(4 000 D)购自北京梦怡美生物科技有限公司,SUMO 蛋白酶、IPTG(异丙基硫代半乳糖苷)购自中国索莱宝科技有限公司,彩虹预染蛋白Marker、M5HiPer ECL Western HRP Substrate(超敏ECL 发光液)购自北京聚合美生物科技有限公司,TMB 显色液A 液、B 液购自北京梅科万德生物科技有限公司。
超净工作台购自天津市生物洁净设备厂;离心机、恒温培养箱、水浴锅购自美国Thermofisher公司。
1.2 方法
1.2.1 EPF 的生物信息学分析 利用Prot Param、Prot Scale、Signal P 4.1Server、Net Phos3.1 Server、TMHMM Server v.2.0 等软件对EPF 蛋白的生物信息进行系统分析和研究。
1.2.2 引物设计 从NCBI 网站中获取牛源EPF基因序列(序列号:NM 002157.3),选取CDS 区作为目的基因,序列的N 端加入多聚组氨酸(6×His)和SUMO 促溶标签,命名为srEPF。用Primer Premier5.0软件设计上下游引物,分别加入NcoⅠ和XhoⅠ两个酶切位点,上游引物:5′ CATGCCATGGGCCATCACCATCATC 3′;下游引物:5′ CGGCTCGAGTCAGTCGACATATTTCCCAAGAA 3′。引物由吉林省库美生物科技有限公司合成。
1.2.3 目的基因的扩增 以目的基因为模板,通过PCR 扩增序列。1.0%的琼脂糖凝胶电泳进行验证,并进行胶回收,将纯化好的目的片段与pMD-18T 载体连接后转化入DH5α 感受态细胞,接种于含氨苄抗性的LB 平板,37 ℃培养12 h 后挑取单个菌落进行菌液PCR 鉴定,将其命名为pMD-18T-srEPF。
1.2.4 pET-28a-EPF 重组质粒的构建 将pMD-18T-srEPF 质粒与pET-28a(+)空质粒用NcoⅠ和XhoⅠ双酶切,将目的基因与pET-28a(+)载体16 ℃连接过夜,转化至DH5α 感受态细胞中,接种于含卡那抗性的LB 固体平板上,37 ℃培养12 h 后挑单菌落进行菌液PCR 鉴定,将正确的质粒命名为pET-28a-srEPF。
1.2.5 srEPF 重组蛋白的诱导表达及可溶性分析将质粒pET-28a-srEPF 转入BL21(DE3)感受态细胞中,接种于含有卡那抗性的LB 固体平板,挑单菌落接种于LB 培养基中培养并鉴定。加入终浓度为1 mmol/L IPTG,37 ℃培养8 h 后进行SDS-PAGE 凝胶电泳并染色。确认目的蛋白表达成功后,将菌体收集重悬后超声破碎,确定目的蛋白表达形式。
1.2.6 srEPF 重组蛋白的纯化与酶切 将pET-28asrEPF 阳性菌液以1∶100 接种至1 L 含卡那抗性的液体LB 培养基中,按上述步骤进行诱导表达。超声波破碎后12 000 r/min 离心40 min,通过重力柱纯化,上清液与镍柱于4 ℃结合1 h,用不同咪唑浓度(40、80、150、200、220、250、300 mmol/L)的洗脱缓冲液梯度洗脱目的蛋白,收集洗脱液后PAGE 电泳鉴定,以确定将EPF 蛋白完全洗脱的咪唑浓度。洗脱下的蛋白缓冲液装入适当大小的透析袋中,在PBS溶液中透析3 次(3 h/次),用PEG 20 000 浓缩,通过BCA 试剂盒检测重组EPF 蛋白浓度。
将浓缩后的融合蛋白以每1 mg 融合蛋白加入2 μL SUMO 蛋白酶和20 μL SUMO Protease buffer 进行酶切,用ddH2O 补至1 mL,4 ℃切割过夜并进行SDS-PAGE 检测。切割后产物使用Ni 亲和柱纯化,His-SUMO 标签挂柱,目的蛋白从Ni亲和柱上流出,收集流穿液后进行PAGE 分析,通过BCA 试剂盒建立标准曲线,检测酶切后EPF 蛋白浓度。
1.2.7 多克隆抗体制备 采集未免疫时兔耳缘静脉的血液,作为阴性血清,将去除抑制区的EPF 蛋白背部皮下注射的方式免疫动物,皮下免疫4 次,每次免疫间隔7 d。初免时800 μg EPF 与弗氏完全佐剂等体积乳化,加强免疫用400 μg 重组蛋白与弗氏不完全佐剂等体积混匀后注射,4 免后3 d 耳缘静脉采血测其效价。
1.2.8 多克隆抗体效价的测定及其反应原性鉴定重组EPF 蛋白以5 μg/mL 浓度包被ELISA 板,37 ℃孵育2 h;PBST 洗3 次,用5%脱脂乳37 ℃封闭1 h;PBST 洗涤3 次,将兔抗EPF 多抗倍比稀释加入酶标板,100 μL 每孔,37 ℃孵育1 h;PBST 洗涤3 次,二抗使用HRP 标记的山羊抗兔IgG 抗体,1∶4 000 倍稀释,37 ℃孵育1 h;PBST 洗涤3 次,再加入TMB 显色液37 ℃避光8 min,加入50 μL 终止液,利用酶标仪450 nm 波长测定OD值。
通过Western blotting 方法检测反应原性,一抗为兔源EPF 多克隆抗体,用5%脱脂乳500 倍稀释后孵育;二抗为HRP 标记的羊抗兔IgG,用5%脱脂乳5 000 倍稀释。
2 结果与分析
2.1 EPF 蛋白的理化分析
通过理化性质分析软件Prot Param(https://web.expasy.org/protparam/)对EPF 的消光系数、不稳定系数、半衰期和平均亲水系数等进行分析。结果表明,牛源EPF 蛋白由102 个氨基酸组成,各氨基酸含量见表1。含负电荷氨基酸(Asp + Glu)13 个,其中Asp 8 个,Glu 5 个;含正电荷氨基酸(Arg+Lys)15 个,其中Lys 11 个,Arg 4 个。含量最高的是Val 和Gly(13.7%),其次是为Lys(10.8%)。分子式为C494H801N1294O145S2,原子总数为1 571 个,分子质量为10.9 ku,理论等电点5.87,偏酸性,消光系数为4 470 L/(mol·cm),半衰期为30 h,脂溶系数为95.39,平均亲水系数为-0.041,不稳定系数为23.75,为稳定蛋白。

表1 牛源EPF 蛋白的氨基酸组成
2.2 EPF 蛋白的亲/疏水性及跨膜区分析
利用Prot Scale(https://web.expasy.org/protscale/)分析EPF 蛋白的亲/疏水性;利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)分析EPF 蛋白是否含有跨膜区。结果表明,EPF 蛋白总平均亲水性为-0.041,氨基酸得分最大值为2.220,最小值为-1.611,为亲水性蛋白,亲水氨基酸数量多于疏水氨基酸(图1)。EPF 蛋白无信号肽和跨膜区(图2、图3),不属于跨膜蛋白,且亚细胞定位分析显示,主要分布于宿主的细胞质(56.5%)、细胞核(17.4%)和线粒体(8.7%)中。
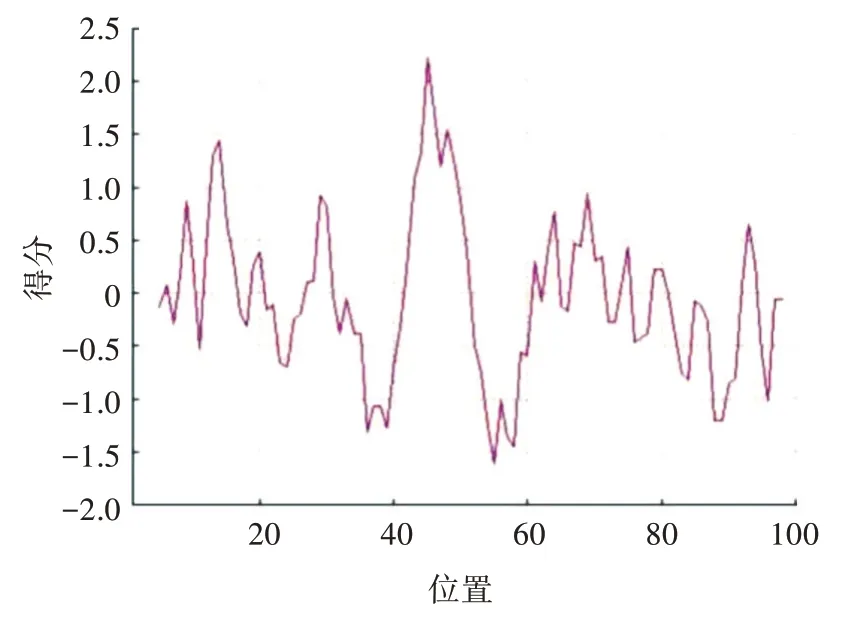
图1 EPF 蛋白的亲/疏水性分析

图2 EPF 蛋白的跨膜结构预测

图3 EPF 蛋白的信号肽预测
2.3 EPF 蛋白的二级结构和三级结构预测
通过SOPMA 和SWISS-MODEL(https://swissmodel.expasy.org/)分析EPF 蛋白的二级、三级结构。 二级结构分析显示,EPF 蛋白含有α-螺旋(Hh)30 个,占比29.41%,α-螺旋是一种稳定的二级结构,由此推测EPF 蛋白结构稳定;含有β 转角(Tt)13 个,占比12.75%;延长链(Ee)26 个,占比25.49%;无规则卷曲(Cc)33 个,占比32.35%(图4)。α-螺旋不易变形,较为稳定,一般在蛋白内部,不易形成抗原表位,β 转角和无规则卷曲键能较低,稳定性较差,常处于蛋白质外部,易形成B 细胞抗原表位,三级结构预测结果如图5 所示。

图4 EPF 蛋白的二级结构预测

图5 EPF 蛋白的三级结构预测
2.4 pET-28a-EPF 重组质粒的构建
对重组质粒进行双酶切鉴定后,将其转化到BL21 感受态细胞中进行菌液PCR 鉴定(图6),在641 bp 处有明亮的条带,与预期大小相符,表明pET-28a-EPF 重组质粒成功构建。

图6 菌液PCR 鉴定转化结果
2.5 srEPF 重组蛋白的诱导表达
SDS-PAGE 分析结果如图7 所示,经IPTG 诱导后,pET-28a 转化后菌株在26 ku 左右处出现1 条蛋白条带,与预期大小相符,表明srEPF 已经成功地在大肠杆菌中表达。

图7 SDS-PAGE 鉴定srEPF 的诱导表达
2.6 诱导条件的优化
如图8、图9 所示,当反应条件为37 ℃诱导8 h,加入IPTG 终浓度为0.2 mmol/L 时,重组蛋白表达量最多,诱导条件最终确定为终浓度0.2 mmol/L IPTG,37 ℃下诱导8 h,此时蛋白分子质量为26 ku。

图8 不同诱导时间下EPF 蛋白的表达

图9 不同浓度诱导剂下重组蛋白的表达
2.7 重组蛋白的可溶性表达与纯化
2.7.1 重组蛋白的可溶性表达 为确定重组蛋白的表达形式,方便后续纯化,采用超声波破碎方法破碎菌体蛋白,扩大培养菌体后将其超声波破碎,破碎后进行SDS-PAGE 分析,结果如图10 所示,重组蛋白上清表达量高于包涵体,表明重组蛋白为上清液表达,分子质量为26 ku,可用于重力柱亲和层析纯化。

图10 重组蛋白的可溶性表达
2.7.2 重组蛋白的纯化与酶切 将目的蛋白纯化,超声后上清液在咪唑浓度约为220 mmol/L 时完全被洗脱(图11)。将蛋白完全洗脱后根据浓度和酶切体系进行酶切,获得无标签的EPF 蛋白,酶切后蛋白大小约为11 ku,符合预期(图12),通过BCA 试剂盒检测酶切后EPF 蛋白浓度为1.1 mg/mL。

图11 重组蛋白镍柱纯化的SDS-PAGE

图12 纯化酶切后蛋白的结果
2.8 多克隆抗体的制备及抗体效价的测定
利用纯化的EPF 重组蛋白免疫动物制备多克隆抗体,通过间接ELISA 方法检测4 免后血清效价为1∶256 000(图13),表明纯化后的EPF 蛋白诱导大耳白兔获得高水平效价。

图13 多抗效价的测定

图14 EPF 蛋白的Western blotting 检测
2.9 多抗反应原性鉴定
Western blotting 鉴定结果表明,制备的多抗能够特异性识别重组EPF 蛋白和牛血清中的天然EPF蛋白,且与去除抑制区的EPF 蛋白发生交叉反应,该蛋白和抗体可用于后续探究其免疫抑制作用和建立快速、灵敏的检测方法。
3 结论与讨论
目前,EPF 是最早确认妊娠的生化指标之一。Fan 等[13]通过检测EPF 在怀孕母牛体内的含量,空怀奶牛准确率接近90%。Haq 等[14]在孕妇受精后24 h 内检测到活性EPF,明显早于人绒毛膜促性腺激素,EPF 活性也几乎存在于整个妊娠期。在临床上,EPF 可作为妊娠超早期诊断的指标之一,可应用于规模化养殖场,提高产犊效率,缩短动物空怀时间,降低空怀期的经济损失。
EPF 作用不仅局限于妊娠,EPF 也存在于肿瘤细胞,可应用于某些肿瘤的早期诊断及预后判断。Rolfe 等[4]研究显示在睾丸母细胞瘤病人血清可检测出EPF,而健康男性未检出。Fan 等[15]检测滋养细胞肿瘤的病人血清中EPF 活性情况,诊断肿瘤患者准确率高达90%,因此EPF 活性可作为判定滋养细胞瘤的指标之一,从滋养细胞瘤患者血清中获得EPF 抗原,并制备其单克隆抗体,通过检测患者血清中的EPF 探究肿瘤进程。
本研究针对牛源EPF基因构建了重组质粒pET-28a-srEPF,通过原核表达成功获得了纯度较高的srEPF,将EPF 作为免疫原获得高效价的兔源多克隆抗体。Western blotting 结果表明,制备的兔源多克隆抗体能够特异性识别srEPF 和去除抑制区的EPF,EPF 及其抗体的获得为奶牛早期诊断、肿瘤早期筛查等EPF 相关免疫学检测方法开发与应用提供了试验基础和必备材料。

