边鸡快长型与慢长型品系胚胎骨骼肌发育中差异可变剪切
魏清宇 吴鹏飞 叶红心 李培峰 崔少华 张旗 张丽 张跟喜


摘要: 骨骼肌生長发育对肉鸡产业至关重要,可变剪切(AS)作为生物体内一种普遍存在的调控机制,在骨骼肌发育过程中发挥着重要作用。本研究以快长型、慢长型边鸡品系为试验材料,收集受精蛋后孵化至14胚龄和20胚龄,然后采集鸡胚腿肌进行转录组测序,用于分析骨骼肌发育过程中的差异可变剪切事件。在14胚龄慢长型(S14)与14胚龄快长型(F14)比较组中共发生230个差异可变剪切事件,其对应了200个基因,在20胚龄慢长型(S20)与20胚龄快长型(F20)比较组中共发生373个差异可变剪切事件,其对应了324个基因,且2个比较组中存在47个相同的基因。GO富集分析结果表明,前20个富集条目中包括丝氨酸家族氨基酸分解代谢过程、肌球蛋白II细丝组装和肌动球蛋白结构组织等与骨骼肌发育相关的生物学过程。KEGG通路富集分析结果表明,前20条通路中有多条通路与骨骼肌发育相关,包括黏附连接、肌动蛋白细胞骨架调节和黏着斑等。基于STRING数据库对所有差异可变剪切事件的来源基因进行蛋白质互作网络分析,然后利用Cytoscape(3.8.2)软件中的插件CytoHubba筛选核心基因,结合富集分析结果在S14与F14比较组中发现TLN2、PARVB和ITGA6等多个关键候选基因,在S20与F20比较组中发现LDB3、PDLIM3、ITGB5、DMD、TNS3和RAC1等多个关键候选基因,同时,筛选到的PDLIM5和GIT1候选基因在14胚龄、20胚龄边鸡骨骼肌发育中均发挥重要作用。本研究结果为进一步解析骨骼肌发育调控机理奠定了基础,也为黄羽肉鸡的选育工作提供一定参考。
关键词: 骨骼肌;可变剪切;鸡
中图分类号: S831.2 文献标识码: A 文章编号: 1000-4440(2023)02-0444-09
Differential alternative splicing during embryonic skeletal muscle development in fast-growing and slow-growing strains of Bian chicken
WEI Qing-yu1, WU Peng-fei2, YE Hong-xin1, LI Pei-feng1, CUI Shao-hua1, ZHANG Qi1, ZHANG Li1, ZHANG Gen-xi2
(1.College of Animal Science, Shanxi Agricultural University, Taiyuan 030032, China;2.College of Animal Science and Technology, Yangzhou University, Yangzhou 225009, China)
Abstract: The growth and development of skeletal muscle is vital to the broiler industry. Alternative splicing (AS) is a universal regulation mechanism in organisms and plays an important role in the development of skeletal muscle. The fast-growing and slow-growing groups of Bian chicken were used as trial materials. After the fertilized eggs were collected and incubated to 14 and 20 days, the leg muscles of Bian chickens were collected for RNA-seq. Results showed that 230 and 373 differentially expressed alternative splicing events (DEAS) were found in S14 (14-day embryos of slow-growing chicken) vs F14 (14-day embryos of fast-growing chicken) and S20 (20-day embryos of slow-growing chicken) vs F20 (20-day embryos of fast-growing chicken) groups, corresponding to 200 and 324 host genes respectively. There were 47 same host genes in the two comparison groups. GO analysis results showed that biological processes (BP) terms related to skeletal muscle development in the top 20, such as serine family amino acid catabolic process, myosin II filament assembly and actomyosin structure organization, were obtained. KEGG enrichment analysis found that some of the top 20 pathways were also related to skeletal muscle development, including adherens junction, regulation of actin cytoskeleton and focal adhesion. Protein-protein interaction network (PPI) analysis was performed for the host genes of all the DEAS. Key candidate host genes were further screened using the plug-in CytoHubba combined with functional enrichment results. Key candidate host genes TLN2, PARVB and ITGA6 were found in S14 vs F14 group, and LDB3, PDLIM3, ITGB5, DMD, TNS3 and RAC1 were found in S20 vs F20 group. The results also showed that PDLIM5 and GIT1 were both important in the two comparison groups. These results can lay a foundation for further understanding and analyzing the regulation mechanism of skeletal muscle development, and also provide a reference for the breeding of yellow-feathered broilers.
Key words: skeletal muscle;alternative splicing;chicken
可變剪切(AS)是指前体mRNA在剪切体作用下选择性去除或保留外显子和内含子,最终形成成熟mRNA的过程[1-2],该过程普遍存在于高等真核生物中,它是真核生物体内基因表达调控的一种重要机制,是导致真核生物体中转录本差异和蛋白质组多样化的重要原因[3-6]。
人类基因组中发生可变剪切的基因达90%以上[3-4],可变剪切主要包含以下7种(图1)[3, 7]。近年来,可变剪切调控在人类疾病中的作用逐渐被重视并揭示[8-9],此外,广泛存在的各种形式的可变剪切还参与多种正常生命活动和生物学调控过程,包括骨骼肌的发育[10]。骨骼肌是保持人、动物身体健康并维持运动能力的基础。在畜禽行业,骨骼肌的生长发育情况决定了畜禽的屠宰性能,直接影响经济效益。心肌细胞增强因子2D(MEF2D)是转录因子MEF2家族成员,在肌生成调控过程中发挥着重要作用[11],MEF2D基因通过可变剪切形成互斥型外显子(MXE)剪切体亚型MEF2Dα1、MEF2Dα2[12],MEF2Dα1在肌肉分化过程中发挥抑制作用,而MEF2Dα2却发挥着促进作用。在骨骼肌中,胰岛素和胰岛素生长素1(IGF1)均能通过与胰岛素受体(INSR)结合激活PI3K/AKT/mTOR通路,调控肌肉肥大[13],然而,在转录过程中,INSR基因通过可变剪切能形成2种亚型INSR-A和INSR-B,其中,INSR-A亚型缺乏第11外显子,其编码的蛋白质与胰岛素、IGF1均不结合,反而与胰岛素生长素2(IGF2)结合,而INSR-B亚型包含第11外显子,其编码的蛋白质对胰岛素更加敏感,可调控肌肉肥大[14]。不同可变剪切对骨骼肌发育影响差异较大,甚至造成相反的功效,因此,对可变剪切的研究具有重要意义。
胚胎期是骨骼肌发育的关键时期,直接影响肌纤维的数量。本研究拟以慢长型、快长型边鸡品系为试验材料,分别在14胚龄和20胚龄运用转录组测序技术(RNA-seq)筛选胚胎期慢长型、快长型边鸡品系骨骼肌发育中的差异可变剪切事件,寻找影响骨骼肌发育的关键可变剪切事件及其来源基因,以期为进一步解析并完善骨骼肌发育中可变剪切的作用机理奠定基础。
1 材料与方法
1.1 试验材料
边鸡是山西省的优良地方鸡品种,具有耐严寒、耐粗饲料等特点。300日龄时,收集慢长型、快长型边鸡品系中具有半同胞关系的种蛋进行统一孵化,孵化至14胚龄、20胚龄时破除蛋壳,对胚胎进行质量称量,同时,在14胚龄时采集尿囊液、20胚龄时采集微量全血用于性别鉴定,最后,统一采集右侧腿肌置于液氮中保存。
母鸡发育过程中右侧性腺退化,通过解剖雏鸡初步判断其性别。然后利用鸡尿囊液或微量全血进行CHD1基因PCR扩增,快速准确鉴定其性别[15]。本研究中使用的CHD1基因引物为F:5′-GTTACTGATTCGTCTACGAGA-3′,R:5′-ATTGAAATGATCCAGTGCTTG-3′,使用的PCR试剂为2×Taq Plus Master Mix (Dye)。PCR反应体系为:尿囊液2.0 μl或血液0.5 μl,正、反向引物各2.0 μl(10.0 μmol/L)、2×Taq Plus Master Mix (Dye)25.0 μl,用灭菌双蒸水补足至50.0 μl。PCR反应条件为:94 ℃预变性2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,进行35个循环,72 ℃延伸5 min,4 ℃保温10 min。最后,在14胚龄快长型(F14)、14胚龄慢长型(S14)、20胚龄快长型(F20)和20胚龄慢长型(S20)中分别选择体质量最接近的4只母鸡的腿肌,提取RNA用于转录组测序。
1.2 总RNA提取及文库构建
采用传统TRIzol法提取鸡胚腿部组织RNA,样品质检合格后委托北京诺禾致源科技股份有限公司构建测序文库[16],测序文库质检合格后利用测序仪器NovaSeq 6000(Illumina公司产品)进行双端测序,测序原理是边合成边测序,最后生成150 bp长度的原始测序序列,用于后续生物信息学分析。
1.3 测序数据质控
原始数据中包含少量带有测序接头或测序质量较低的测序序列,需对其进行过滤:(1)去除带接头的测序序列;(2)去除N(N表示无法确定的碱基)占比大于0.002的测序序列;(3)去除低质量测序序列。
1.4 测序数据比对分析
将过滤得到的有效测序数据比对到基因组后用于后续分析,比对软件采用Hisat2(http://ccb.jhu.edu/software/hisat2)[17],参考基因组为GRCg6a(ftp://ftp.ensembl.org/pub/release-97/fasta/gallus_gallus/dna/)。
1.5 可变剪切事件差异分析及其功能富集
基于比对结果,利用rMATS软件[18]对可变剪切事件进行统计分析、定量分析和差异分析。rMATS软件可分析5种可变剪切事件,分别为外显子跳跃型可变剪切(SE)、内含子滞留型可变剪切(RI)、互斥外显子型可变剪切(MXE)、5′端可变剪切(A5SS)和3′端可变剪切(A3SS)。
差异可变剪切事件来源基因的功能富集分析涉及GO和KEGG。GO是描述基因功能的综合性数据库,包括分子功能(MF)、生物过程(BP)和细胞组成(CC)3个部分。KEGG[19]是整合了基因组和系统功能信息的综合性数据库,在生物体内,不同基因相互协调行使其生物学功能,通过KEGG通路富集分析可以探寻差异表达可变剪切事件来源基因参与的最主要生化代谢途径和信号转导途径。本研究利用GOseq[20]软件进行GO富集分析,用KOBAS(3.0)[21]软件进行KEGG通路富集分析。
1.6 基于蛋白质互作网络筛选关键核心基因
利用STRING数据库进一步对2个比较组中所有差异可变剪切事件来源基因进行蛋白质互作网络分析(PPI),用Cytoscape(3.8.2)软件中的插件CytoHubba采用最大集团中心性(MCC)算法筛选核心基因,筛选标准为MCC值>50。
1.7 统计分析方法
本研究利用SPSS13.0软件对体质量进行显著性分析,采用的方法为独立样本t检验,最终数据以平均值±标准差的形式进行表示。
2 结果与分析
2.1 个体体质量统计
对送样个体体质量进行统计,S14:(9.26±0.55) g;F14:(11.24±0.54) g;S20:(32.60±1.47) g;F20:(39.26±2.07) g。独立样本t检验结果显示,快长型个体14胚龄时的平均体质量极显著高于慢长型个体(P=0.005),20胚龄时快长型个体平均体质量也极显著高于慢长型个体(P=0.004)。说明快长型个体与慢长型个体的体质量在胚胎期具有较大的表型差异。
2.2 测序数据质控及比对结果分析
对原始数据进行质控分析,发现每个个体有效测序序列正确识别率>99.90%(Q30)的碱基数占93.99%以上,正确识别率>99.00%(Q20)的碱基数占98.00%以上。同时,每个个体有效测序序列中(G+C)含量为45.26%~48.49%,无碱基分离现象,以上结果表明测序数据良好。
与参考基因组进行比对,发现测序序列可比对到外显子、内含子和基因间区3个部分,且比对到外显子的比例最高,符合预期,可用于后续分析。
2.3 差异可变剪切事件统计结果
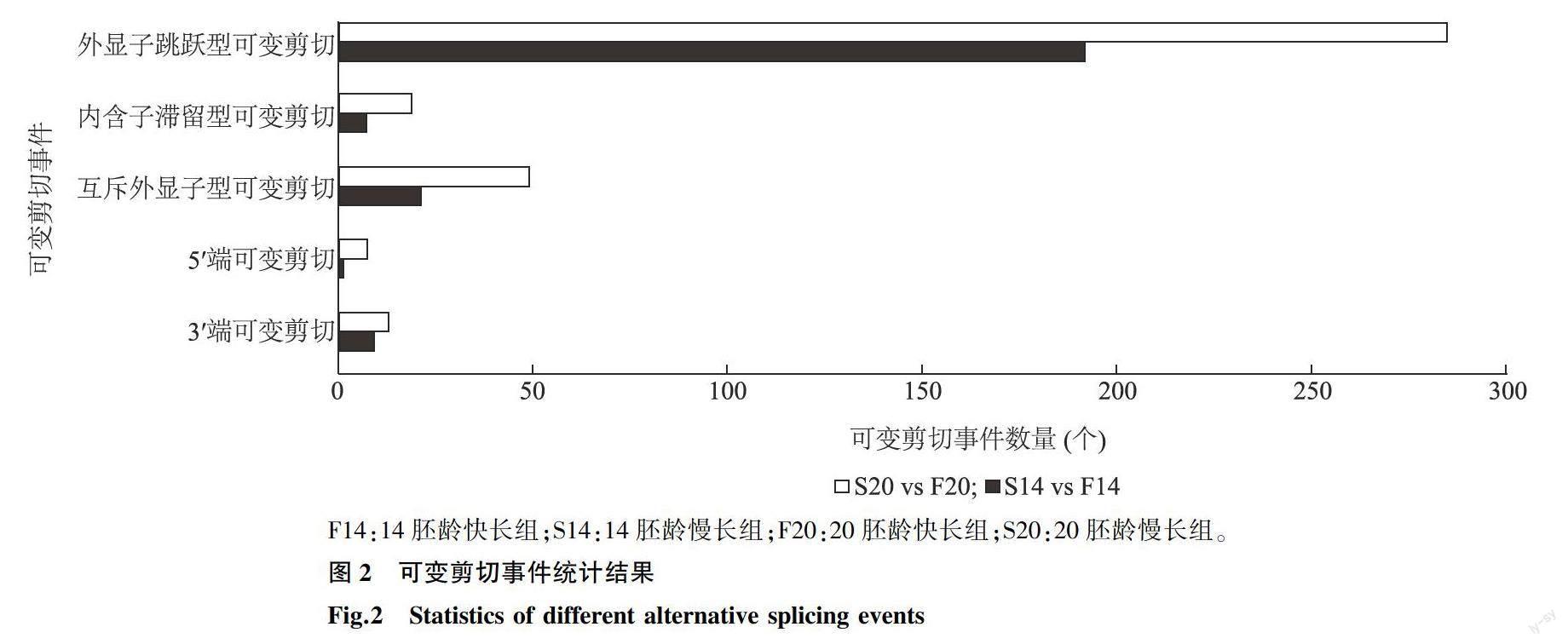
以错误发现率(FDR)≤0.01为筛选标准,对可变剪切事件进行统计(图2),在14胚龄快长型个体与14胚龄慢长型个体之间发生了230个差异可变剪切事件,其中外显子跳跃型可变剪切事件有192个,内含子滞留型可变剪切事件有7个,互斥外显子型可变剪切事件有21个,5′端可变剪切事件只有1个,3′端可变剪切事件有9个。对20胚龄快长型个体与20胚龄慢长型个体之间发生的可变剪切事件进行统计分析,共发现373个差异可变剪切事件,其中,外显子跳跃型可变剪切事件有285个,互斥外显子型可变剪切事件有49个。外显子跳跃型可变剪切事件在14胚龄快长型与慢长型比较组和20胚龄快长型与慢长型比较组中所占比例均为最高,且远高于其他类型,推测该种可变剪切在生物体内普遍存在并发挥着重要作用。
2.4 差异可变剪切事件来源基因功能富集分析
对差异结果进行深入分析,发现S14与F14比较组中得到的230个差异可变剪切事件对应了200个来源基因,S20与F20比较组中得到的373个差异可变剪切事件对应了324个来源基因,2个比较组中相同的来源基因共47个。分别对S14与F14、S20与F20比较组中得到的可变剪切事件来源基因进行GO富集分析和KEGG通路富集分析。GO富集分析结果(图3)表明,在S14与F14比较组中显著富集的前20个条目中有13个生物学过程(BP)条目,包含丝氨酸家族氨基酸分解代谢过程和肌球蛋白II细丝组装等与骨骼肌发育相关的条目;在S20与F20比较组中显著富集的前20个条目中只有3个BP条目,其中线粒体钙离子转运和肌动球蛋白结构组织与骨骼肌发育相关。此外,骨骼肌收缩的调节、肌原纤维组装和肌细胞内稳态等显著富集的前20个条目之外的其他BP條目也与骨骼肌发育相关。
KEGG通路富集分析结果(图4)表明,在S14与F14比较组中前20条富集通路中有4条达到显著水平,分别为细胞外基质(ECM)受体相互作用、2-氧羰基酸代谢、氨基酸的生物合成和黏附连接,它们均在动物骨骼肌发育过程中发挥重要作用;在S20与F20比较组中前20条KEGG通路中筛选到8条显著富集的通路,其中mTOR信号通路、肌动蛋白细胞骨架调节和黏附连接等对骨骼肌的生长发育具有重要调节作用。在2个比较组的前20条KEGG通路中发现4条共同富集的通路,分别为黏附连接、肌动蛋白细胞骨架调节、黏着斑和真核生物核糖体生物发生,其中黏附连接是唯一共同显著富集的通路,说明这4条通路及其基因以及发生的可变剪切事件可能在鸡胚14胚龄、20胚龄骨骼肌发育时均发挥着重要作用。
2.5 蛋白质互作网络筛选关键核心基因
利用STRING数据库进一步对2个比较组中差异可变剪切事件来源基因进行蛋白质互作网络分析,图5为前100个蛋白质的互作网络图,颜色越深表示其所处位置越核心。以MCC值>50为条件,同时结合KEGG分析结果,在S14与F14比较组中我们发现多个具有调控作用的核心蛋白质,包括TLN2、PARVB和ITGA6。同时,KEGG结果显示,在前20条通路中,TLN2、PARVB和ITGA6基因均富集在黏着斑通路中,ITGA6也富集在细胞外基质受体相互作用和肌动蛋白细胞骨架调节通路中;在S20与F20比较组中发现多个调控生长发育的核心蛋白质,包括LDB3、PDLIM3、ITGB5、DMD、TNS3和RAC1等,其中,LDB3的MCC值最高。KEGG结果显示,在前20条通路中,RAC1基因富集的通路高达5条,包括肌动蛋白细胞骨架调节、黏附连接、黏着斑等骨骼肌发育重要信号通路,ITGB5基因富集在肌动蛋白细胞骨架调节和黏着斑2条骨骼肌发育相关通路中。此外,我们发现PDLIM5和GIT1在14胚龄和20胚龄快长型、慢长型边鸡骨骼肌发育过程中均具有调控作用,结合可变剪切事件发生类型进行分析,发现在14胚龄快长型与慢长型比较组中PDLIM5基因发生了SE型和MXE型2种差异的可变剪切事件,而在20胚龄快长型与慢长型比较组中只发生SE型差异可变剪切事件,GIT1基因在2个不同胚龄快长型与慢长型比较组中均发生了SE型差异可变剪切事件。
3 讨论
可变剪切是真核生物体内一种重要的调控机制,它能使同一基因产生多种蛋白质,极大丰富了生物体内蛋白质的多样性[22]。目前,关于可变剪切的研究涉及癌症[23]、衰老[7]以及脂肪肝[24]等。同样,骨骼肌的发育也离不开可变剪切。Zhang等[25]通过Rbm24基因敲除的小鼠活体试验结果证明了Rbm24能通过调控MEF2D、Naca、Rock2和Lrrfip1等肌源性基因的可变剪切进而调节成年小鼠的骨骼肌再生;Li等[26]采集兔子的肥胖模型和对照个体腿肌后进行转录组测序和DNA甲基化测序联合分析,结果发现15个基因可通过可变剪切和DNA甲基化这2种类型的遗传修饰共同调控骨骼肌生长发育;Shu等[27]采集肌内脂肪含量不同的2种猪背最长肌用于转录组测序分析,结果发现MRPL27、AAR2、PYGM、PSMD、MYL1、TNNT3和TNNT1等基因的可变剪切亚型可调控肌内脂肪沉积。
鸡肉是人类获取动物蛋白质的重要来源,它具有“一高两低”(高蛋白质、低脂肪和低热量)的特点,同时利于人体吸收,在市场上广受欢迎。黄羽肉鸡作为中国地方品种种质资源,具有抗病力强,肉质鲜美等特点,满足了市场对优质肉鸡的需求,但黄羽肉鸡生长速度较慢,屠宰性能低,严重制约了产业化进程,因此,提升黄羽肉鸡生长速度迫在眉睫。腿肌是骨骼肌的重要组成部分,腿肌率是肉鸡屠宰性能测定中的一項重要指标,直接影响了鸡肉的产量,因此,研究腿肌生长发育的分子调控机理,对于提高黄羽肉鸡的生长速度具有重要指导作用。邹小利[28]的研究结果表明,14胚龄是地方鸡品种肌纤维形成的关键时期,17胚龄之后形成完整的肌纤维轮廓,肌纤维数量也基本确定,出生后主要通过肌纤维肥大促进骨骼肌发育[29],因此,胚胎期肌纤维的形成对骨骼肌发育至关重要。可变剪切在生物体内普遍存在,并且在多种生物学过程中发挥着重要作用,鸡的骨骼肌生长发育同样受可变剪切调控[10],然而对于可变剪切在鸡骨骼肌发育中所起作用的研究较少。
本研究分别收集慢长型、快长型边鸡群体的受精蛋,孵化过程中采集14胚龄(肌纤维形成关键时期)、20胚龄(肌纤维数量已固定且未出壳)母鸡腿肌用于转录组测序研究,对筛选得到的差异可变剪切事件来源基因进行GO功能富集和KEGG通路富集分析,同时结合STRING数据库预测得到蛋白质互作网络,进行关键候选基因分析。在S14与F14比较组中发现的关键候选来源基因包括TLN2、PARVB和ITGA6,在S20与F20比较组中发现的关键基因包括LDB3、PDLIM3、ITGB5、DMD、TNS3、RAC1等,同时,发现PDLIM5和GIT1对14胚龄、20胚龄边鸡的生长发育均具有调控作用。
在S14与F14比较组的前20条通路中,我们发现TLN2、PARVB和ITGA6均富集在黏着斑通路中,此外,ITGA6也富集在细胞外基质受体相互作用和肌动蛋白细胞骨架调节通路中。黏着斑是细胞中的一种特殊结构,这种结构中的整合素受体可以与细胞外基质和肌动蛋白细胞骨架相连,黏着斑在细胞中起着机械连接和信号传递的作用,与生长发育密切相关[30-31]。细胞外基质由不同的胶原蛋白、蛋白多糖和糖蛋白组成[32],与细胞表面受体相结合形成复杂的网络,可以进行信号传导,调控细胞生长、迁移和分化等[33]。肌动蛋白细胞骨架是细胞骨架的重要组成部分,它在骨骼肌的收缩过程中起着关键作用[34]。
在S20与F20比较组的前20条通路中,RAC1富集的通路高达5条,包括肌动蛋白细胞骨架调节、黏附连接、黏着斑等骨骼肌发育重要信号通路。有研究发现,RAC1可在骨骼肌分化后期发挥重要作用,在成肌细胞融合过程中必不可少[35];其次为ITGB5,本研究发现该基因主要富集在肌动蛋白细胞骨架调节和黏着斑2条骨骼肌发育相关通路中。通过蛋白质互作网络筛选关键核心基因,发现LDB3的MCC值最高。Yamashita等[36]汇总了6种LDB3的可变剪切亚型,发现肌强直性营养不良Ⅰ型患者体内包含外显子11的LDB3可变剪切亚型极显著升高,该亚型可能对骨骼肌发育造成不良影响。肌营养不良蛋白基因(DMD)突变可导致杜氏肌营养不良症,主要引起骨骼肌、心肌退化[37]。
在S14与F14、S20与F20比较组中我们同时发现了多条与骨骼肌发育相关的可变剪切事件,其来源基因包括PDLIM5和GIT1。He等[38]研究发现,PDLIM5可以通过激活p38丝裂原活化蛋白激酶(MAPK)信号通路进而调控鸡骨骼肌卫星细胞(SMSCs)的增殖和分化。Bahri等[39]证实了GIT1基因在果蝇胚胎肌肉发育中必不可少,对其发育具有引导作用。在14胚龄快长型与慢长型比较组中发现了PDLIM5基因SE型和MXE型2种差异的可变剪切事件,而在20胚龄快长型与慢长型比较组中只发现了SE型差异可变剪切事件;GIT1基因在2个不同胚龄快长型与慢长型比较组中均发生了SE型差异可变剪切事件,提示不同可变剪切在骨骼肌发育中作用不同,不同胚龄骨骼肌发育过程可能由相同或不同可变剪切调控。
4 结论
本研究利用转录组测序技术在快长型、慢长型边鸡品系胚胎期鉴定出多个与生长发育相关且存在差异的可变剪切事件,对其来源基因进行GO富集分析,结果发现前20个条目中肌球蛋白II细丝组装和肌动球蛋白结构组织等与骨骼肌发育相关。KEGG通路富集分析结果表明,前20条通路中包含了黏附连接和黏着斑等与骨骼肌发育相关的通路。对差异可变剪切事件来源基因进行蛋白质互作网络分析,鉴定出多个与骨骼肌发育相关的关键来源基因,包括TLN2、PARVB、LDB3、PDLIM3、RAC1、PDLIM5和GIT1等。以上研究结果对进一步理解和解析骨骼肌生长发育中可变剪切的调控机理具有重要意义,同时,本研究结果对边鸡及中国其他黄羽肉鸡的育种工作具有一定的参考作用。
参考文献:
[1] BUSH S J, CHEN L, TOVAR-CORONA J M, et al. Alternative splicing and the evolution of phenotypic novelty[J]. Philosophical Transactions of the Royal Society B-Biological Sciences, 2017, 372(1713): 20150474.
[2] COOMER A O, BLACK F, GREYSTOKE A, et al. Alternative splicing in lung cancer[J]. Biochimica et Biophysica Acta(BBA) Gene Regulatory Mechanisms, 2019, 1862(11/12): 194388.
[3] WANG E T, SANDBERG R, LUO S, et al. Alternative isoform regulation in human tissue transcriptomes[J]. Nature, 2008, 456(7221): 470-476.
[4] PAN Q, SHAI O, LEE L J, et al. Deep surveying of alternative splicing complexity in the human transcriptome by high-throughput sequencing[J]. Nature Genetics, 2008, 40(12): 1413-1415.
[5] NILSEN T W, GRAVELEY B R. Expansion of the eukaryotic proteome by alternative splicing[J]. Nature, 2010, 463(7280): 457-463.
[6] KEREN H, LEV-MAOR G, AST G. Alternative splicing and evolution: diversification, exon definition and function[J]. Nature Reviews Genetics, 2010, 11(5): 345-355.
[7] BHADRA M, HOWELL P, DUTTA S, et al. Alternative splicing in aging and longevity[J]. Human Genetics, 2020, 139(3): 357-369.
[8] JAKUBAUSKIENE E, KANOPKA A. Alternative splicing and hypoxia puzzle in Alzheimers and Parkinsons diseases[J]. Genes, 2021, 12(8): 1272.
[9] SCOTTI M M, SWANSON M S. RNA mis-splicing in disease[J]. Nature Reviews Genetics, 2016, 17(1): 19-32.
[10]NIKONOVA E, KAO S Y, SPLETTER M L. Contributions of alternative splicing to muscle type development and function[J]. Seminars in Cell & Developmental Biology, 2020, 104: 65-80.
[11]NAKKA K, GHIGNA C, GABELLINI D, et al. Diversification of the muscle proteome through alternative splicing[J]. Skeletal Muscle, 2018, 8(1): 8.
[12]SEBASTIAN S, FARALLI H, YAO Z, et al. Tissue-specific splicing of a ubiquitously expressed transcription factor is essential for muscle differentiation[J]. Genes & Development, 2013, 27(11): 1247-1259.
[13]BODINE S C, STITT T N, GONZALEZ M, et al. Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo[J]. Nature Cell Biology, 2001, 3(11): 1014-1019.
[14]HINKLE E R, WIEDNER H J, BLACK A J, et al. RNA processing in skeletal muscle biology and disease[J]. Transcription-Austin, 2019, 10(1): 1-20.
[15]王嘉力,賈存灵,苏利红,等. 家鸡CHD1基因PCR快速性别鉴定方法的建立及其在早期鸡胚中的应用[J]. 家禽科学, 2009(12): 3-7.
[16]PARKHOMCHUK D, BORODINA T, AMSTISLAVSKIY V, et al. Transcriptome analysis by strand-specific sequencing of complementary DNA[J]. Nucleic Acids Research, 2009, 37(18): e123.
[17]KIM D, LANGMEAD B, SALZBERG S L. HISAT: a fast spliced aligner with low memory requirements[J]. Nature Methods, 2015, 12(4): 357-360.
[18]SHEN S, PARK J W, LU Z X, et al. rMATS: robust and flexible detection of differential alternative splicing from replicate RNA-seq data[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(51): E5593-E5601.
[19]KANEHISA M, ARAKI M, GOTO S, et al. KEGG for linking genomes to life and the environment[J]. Nucleic Acids Research, 2008, 36: D480-D484.
[20]YOUNG M D, WAKEFIELD M J, SMYTH G K, et al. Gene ontology analysis for RNA-seq: accounting for selection bias[J]. Genome Biology, 2010, 11: R14.
[21]BU D, LUO H, HUO P, et al. KOBAS-i: intelligent prioritization and exploratory visualization of biological functions for gene enrichment analysis[J]. Nucleic Acids Research, 2021, 49(W1): W317-W325.
[22]BARALLE F E, GIUDICE J. Alternative splicing as a regulator of development and tissue identity[J]. Nature Reviews Molecular Cell Biology, 2017, 18(7): 437-451.
[23]YANG Q, ZHAO J, ZHANG W, et al. Aberrant alternative splicing in breast cancer[J]. Journal of Molecular Cell Biology, 2019, 11(10): 920-929.
[24]WU P, ZHANG M, WEBSTER N J G. Alternative RNA splicing in fatty liver disease[J]. Frontiers in Endocrinology, 2021, 12: 613213.
[25]ZHANG M, HAN Y, LIU J, et al. Rbm24 modulates adult skeletal muscle regeneration via regulation of alternative splicing[J]. Theranostics, 2020, 10(24): 11159-11177.
[26]LI Y, WANG J, ELZO M A, et al. Molecular profiling of DNA methylation and alternative splicing of genes in skeletal muscle of obese rabbits[J]. Current Issues in Molecular Biology, 2021, 43(3): 1558-1575.
[27]SHU Z, WANG L, WANG J, et al. Integrative analysis of nanopore and Illumina sequencing reveals alternative splicing complexity in pig longissimus dorsi muscle[J]. Frontiers in Genetics, 2022, 13: 877646.
[28]鄒小利. 不同品种鸡胚胎期腿肌与胸肌发育的形态学对比研究[D]. 广州:华南农业大学.
[29]李伯江,李平华,吴望军,等. 骨骼肌肌纤维形成机制的研究进展[J]. 中国农业科学, 2014, 47(6): 1200-1207.
[30]BURRIDGE K. Focal adhesions: a personal perspective on a half century of progress[J]. FEBS Journal, 2017, 284(20): 3355-3361.
[31]CHEN B, XU J, HE X, et al. A genome-wide mRNA screen and functional analysis reveal FOXO3 as a candidate gene for chicken growth[J]. PLoS One, 2015, 10(9): e0137087.
[32]JONES F S, JONES P L. The tenascin family of ECM glycoproteins: structure, function, and regulation during embryonic development and tissue remodeling[J]. Developmental Dynamics, 2000, 218(2): 235-259.
[33]THEOCHARIS A D, SKANDALIS S S, GIALELI C, et al. Extracellular matrix structure[J]. Advanced Drug Delivery Reviews, 2016, 97: 4-27.
[34]HENDERSON C A, GOMEZ C G, NOVAK S M, et al. Overview of the muscle cytoskeleton[J]. Comprehensive Physiology, 2017, 7(3): 891-944.
[35]RODRIGUEZ-FDEZ S, BUSTELO X R. Rho GTPases in skeletal muscle development and homeostasis[J]. Cells, 2021, 10(11): 2984.
[36]YAMASHITA Y, MATSUURA T, KUROSAKI T, et al. LDB3 splicing abnormalities are specific to skeletal muscles of patients with myotonic dystrophy type 1 and alter its PKC binding affinity[J]. Neurobiology of Disease, 2014, 69: 200-205.
[37]WANG J Z, WU P, SHI Z M, et al. The AAV-mediated and RNA-guided CRISPR/Cas9 system for gene therapy of DMD and BMD[J]. Brain & Development, 2017, 39(7): 547-556.
[38]HE H, YIN H, YU X, et al. PDLIM5 affects chicken skeletal muscle satellite cell proliferation and differentiation via the p38-MAPK pathway[J]. Animals, 2021, 11(4): 1016.
[39]BAHRI S M, CHOY J M, MANSER E, et al. The Drosophila homologue of Arf-GAP GIT1, dGIT, is required for proper muscle morphogenesis and guidance during embryogenesis[J]. Developmental Biology, 2009, 325(1): 15-23.
(責任编辑:王 妮)

