丛枝菌根真菌在甘薯生产中的应用研究进展
石琨 袁洁 叶佳敏 汪吉东 朱国鹏 王磊 张辉 张永春

摘要: 甘薯(Ipomoea batatas L.)是一种适应性强、高产、多用途的粮食作物。丛枝菌根真菌(AMF)是一种广泛分布的能与宿主建立互惠共生关系的真菌。AMF能够定殖于甘薯根系,其菌丝的延伸不仅扩大了根系吸收养分的范围,还促进了根系分泌有机碳等物质,起到改善宿主根际环境、活化土壤养分的作用。接种AMF能促进甘薯对养分的吸收利用,调控块根的形成和膨大。本文围绕甘薯与AMF的共生效应,综述AMF与甘薯共生关系的建立、AMF与甘薯共生效应的影响因素、AMF促进甘薯生长发育的作用机制。最后,分析了目前甘薯与AMF共生效应研究中的局限,并针对存在问题进行探讨和展望,为甘薯等作物可持续高效生产提供理论基础和应用依据。
关键词: 甘薯;丛枝菌根真菌;根际微生物;有机碳
中图分类号: S154.39 文献标识码: A 文章编号: 1000-4440(2023)02-0576-06
Advances in application of arbuscular mycorrhizal fungi on sweet potato production
SHI Kun1,2, YUAN Jie2, YE Jia-min2,3, WANG Ji-dong2, ZHU Guo-peng1, WANG Lei2, ZHANG Hui2, ZHANG Yong-chun2,3
(1.School of Horticulture, Hainan University, Haikou 570228, China;2.Institute of Agricultural Resources and Environment, Jiangsu Academy of Agricultural Sciences/National Agricultural Experimental Station for Agricultural Environment, Luhe, Nanjing 210014, China;3.College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China)
Abstract: Sweet potato (Ipomoea batatas L.) is an adaptable, high-yield and multi-purpose food crop. Arbuscular mycorrhiza fungi (AMF) are widely distributed fungi that can establish a symbiotic relationship with their hosts. AMF can colonize sweet potato roots. The extension of AMF mycelium not only expands the range of nutrient absorption by roots, but also promotes the secretion of organic carbon and other substances by roots, which plays a role in improving the host rhizosphere environment and activating soil nutrients. AMF inoculation can promote the absorption and utilization of nutrients in sweet potato, and regulate the formation and expansion of root tubers. In this paper, the establishment of symbiotic relationship between AMF and sweet potato, the influencing factors of symbiotic effect between AMF and sweet potato, and the mechanism of AMF promoting the growth and development of sweet potato were reviewed. Finally, the limitations of the current research on the symbiotic effect of sweet potato and AMF were analyzed, and the existing problems were discussed and prospected. This study provides theoretical basis and application basis for the sustainable and efficient production of sweet potato and other crops.
Key words: sweet potato;arbuscular mycorrhizal fungi;rhizosphere microorganisms;organic carbon
菌根是土壤中的真菌与植物根系形成的共生体。通过真菌菌丝的扩展延伸,菌根能为植物获取更多的养分和水分,植物的光合物质又为真菌的生长提供物质和能量。丛枝菌根真菌(AMF)是分布最廣、与农业生产关系最为密切的一种内生菌根真菌,能在植物根细胞内产生连续双叉分枝形成灌木状结构,同时根外菌丝通过延伸能为植物获取更多的资源,进而调控植物的生长发育[1]。甘薯(Ipomoea batatas L.)是继马铃薯、木薯之后的第三大薯类,在中国占据重要的地位,是粮食安全保障体系中重要的经济、饲料和粮食作物[2-3]。目前,AMF调控甘薯生长的研究得到了较好的开展。一般认为接种AMF能显著提高甘薯净光合速率、气孔导度和蒸腾速率等光合参数[4],促进甘薯对磷和钾的吸收[5],能调控甘薯地上部氮素向根部运输[6],增加甘薯产量[7-8]。AMF能够有效促进甘薯生长发育[9],相比块根膨大期和收获期,AMF对甘薯块根形成期(栽后30 d)产生的影响最为明显[10],这一时期根系的生长发育决定着甘薯的产量。与此同时,AMF还可以通过活化土壤养分、改善土壤的理化性质来调节植物生长[11]。本文围绕甘薯与AMF的共生效应,对AMF与甘薯共生关系的建立,影响AMF与甘薯共生效应的因素以及AMF促进甘薯生长发育的作用机制进行综述。最后就目前甘薯与AMF共生研究中存在的问题及未来发展方向进行探讨和展望,为促进菌根技术在甘薯生产中更广泛和科学的应用提供依据。
1 AMF与甘薯共生关系的建立
1.1 AMF与甘薯共生关系建立的标志
AMF侵染植物根系会产生典型的共生结构,包括丛枝、泡囊、菌丝等[12-14]。丛枝是AMF根内菌絲在根系皮层细胞内产生的灌木状结构,是AMF同宿主植物进行营养交换的主要场所;泡囊则是AMF根内菌丝末端膨大形成的泡状结构,具有贮存营养物质的作用[13-14]。Alhadidi等[15]、Yuan等[16]发现AMF侵染甘薯根系后能在根内细胞产生泡囊、丛枝、根内菌丝等结构,同时AMF定殖甘薯根系后,其根外菌丝能够在土壤中延伸,扩大根系吸收养分的范围[17]。
1.2 与甘薯共生的AMF物种多样性
迄今为止,中国已在烟草、小麦、玉米等作物的根际中分离得到了100多种AMF[18],在甘薯根区土壤中也分离出了大量AMF菌种。1990年彭生斌等[19]从昆明、广州和武汉的甘薯农田中分离得到丽孢无梗囊霉(Acaulospora elegans)和苏格兰斗管囊霉(Funneliformis caledonium)等菌种。盖京苹等[20]从中国北方甘薯根区土壤分离得到的AMF优势菌种为摩西斗管囊霉(Funneliformis mosseae)和幼套近明球囊霉(Claroideoglomus etunicatum)。根据最新的AMF分类体系及相关文献的细分类列表[18, 21],目前中国甘薯根区土壤中分离鉴定的AMF包含4属8种(表1)。其中幼套近明球囊霉(Cl. etunicatum)具有较高的选择竞争力,这是由于幼套近明球囊霉不仅显著影响甘薯生长发育,还能适应不同的土壤环境[22]。
2 影响AMF与甘薯共生效应的因素
2.1 AMF和甘薯之间的选择适应性
不同种类的AMF菌株在相同品种甘薯根系的侵染率存在差异。刘文科等[25]发现幼套近明球囊霉(Cl. etunicatum)对甘薯根系的侵染率显著低于摩西斗管囊霉(F. mosseae)和根内根孢囊霉(Rhizophagus intraradices)等菌种,混合AMF菌剂(R. intraradices和F. mosseae)的甘薯根系侵染率显著高于单一AMF菌剂,且混合菌剂具有更好的促生效果。相同的AMF菌剂对不同品种甘薯根系的侵染率和促生效应也存在差异。Yooyongwech等[26]研究结果表明,同样的AMF菌剂虽然能够与不耐干旱型和耐干旱型的两个品种甘薯建立共生关系,但AMF对耐干旱型品种甘薯根系的侵染率要高于不耐干旱型甘薯品种,同样AMF对耐干旱型品种甘薯的促生效果要更好。因此,AMF菌种和甘薯品种之间存在选择适应性,这种选择适应性在烟草和油橄榄等作物中亦有发现[27-28]。这种选择适应性产生的原因可能是根系分泌物对真菌定殖产生的诱导作用,如根系分泌的有机酸可以调控根际有益微生物的聚集[29],植物激素尤其是独脚金内酯(SL)可以调控AMF孢子的萌发和菌丝生长[30]。
2.2 AMF的生态适应性
中国的甘薯种植区划分为北方春薯区、北方夏薯区、长江流域夏薯区、南方夏秋薯区和南方秋冬薯区,5大甘薯种植区域的海拔、气候、地貌存在较大差异[31]。虽然表1显示近明球囊霉属、根孢囊霉属真菌仅在北方植薯区被发现,而斗管囊霉属和无梗囊霉属真菌则在不同气候区的甘薯田中均有发现,但由于调查范围的局限性,目前尚没有全国不同甘薯种植区确切的AMF适应性规律。
土壤类型、温度、湿度、酸碱度、养分水平等是影响AMF与甘薯共生效应的重要因素。Mukhongo等[32]比较了季节变化对甘薯根系AMF定殖的影响,发现雨水少的春季AMF定殖率高于雨水多的秋季,表明土壤适度缺水可能会促进AMF在甘薯根系定殖。刘文科等[25]比较了摩西斗管囊霉(F. mosseae)对种植在北京褐土和湖北棕壤中甘薯根系的侵染效果,发现AMF对种植在北京褐土中的甘薯根系侵染率(31.7%)高于种植在湖北棕壤中的甘薯根系侵染率(20.2%)。Arle等[33]的研究结果表明,中性土壤中微生物活动最活跃,而过酸和过碱的土壤环境会限制AMF孢子的萌发和菌丝的扩展。王幼珊等[34]发现土壤中速效磷含量在10 mg/kg左右时最有利于摩西斗管囊霉的繁殖和侵染植物根系。含磷量高的土壤环境会抑制宿主植物根际微生物的活动,同时也阻碍了根系与AMF的物质交换[35-37]。AMF具有生态适应性的原因可能是由于气候条件和土壤环境影响AMF的活性。
3AMF促进甘薯生长发育的作用机制
3.1 AMF影响甘薯对养分的吸收和分配
AMF与宿主植物建立共生关系多以养分为基础,菌根共生体及其引起的根际微生物活动有助于活化根际养分,进而促进植物对土壤养分的吸收利用,提高植物对贫瘠营养环境的适应性[38]。AMF菌丝产生的球囊霉素相关蛋白质(Glomalin-related Soil Protein,GRSP)是土壤中有机碳的重要来源,接种AMF能提高土壤有机碳含量[39-41];同时,GRSP作为一种直接的胶结剂,能够促进土壤团聚体的形成[42-43],改善土壤结构。此外,GRSP还能够螯合土壤中的氮、磷、钾以及中量、微量元素,起到活化土壤养分的作用[44]。AMF侵染根系时还可以通过菌丝向土壤中释放有机酸、氨基酸、糖类等根系分泌物,这些根系分泌物作为有益微生物的化学引诱剂,能刺激土壤微生物的活动[45-50],调控解磷菌、解钾菌、产脲酶菌等微生物在根际定殖[51],增强磷酸酶、过氧化氢酶、脲酶、蛋白酶的活性[52-53],进而驱动土壤养分活化[32,54-55]。
AMF 在促进土壤养分活化的同时,还能通过菌丝生长获取更多的资源,进而促进植物的生长。周晓月等[5]、李欢等[8]的研究结果表明接种AMF能够优化甘薯根系形态,显著增加根體积、根表面积、平均根直径等,促进甘薯根系对土壤养分的吸收。此外,接种AMF还能调控甘薯对养分的分配。张树海等[6]研究发现接种AMF能促进甘薯生长前期氮素向叶片分配,限制膨大期氮素向叶片分配、促进氮素向块根分配,这是由于接种AMF提高了块根中谷氨酸脱氢酶、谷氨酰胺合成酶和谷氨酸合成酶的活性,加速土壤中无机氮向有机氮的转化,进而促进氮素向地下部的转运。接种AMF还能促进了甘薯块根形成期磷和钾向块根的转运[5]。总之,接种AMF能影响甘薯的养分吸收与分配。
3.2 AMF影响甘薯光合生产和源库关系
光合产物合成及其向块根运输是甘薯块根形成和持续膨大的基础。接种AMF能促进土壤养分的活化及植物根系对养分的吸收,进而增强甘薯光合能力、促进光合产物的形成及向块根的运输分配[56-57]。徐西红等[4]研究结果表明接种AMF能显著提高甘薯叶片净光合速率、气孔导度和蒸腾速率等光合参数,增强甘薯叶片蔗糖合成酶、蔗糖磷酸合成酶活性,从而促进光合产物的积累和淀粉的合成。接种AMF还能促进潜在块根分化、增强干物质向块根的分配和转运[5],进而实现增产[58-60]。因此,AMF不但能扩库(促进块根分化),还能增源(增强光合能力),从而实现甘薯源库关系的平衡。
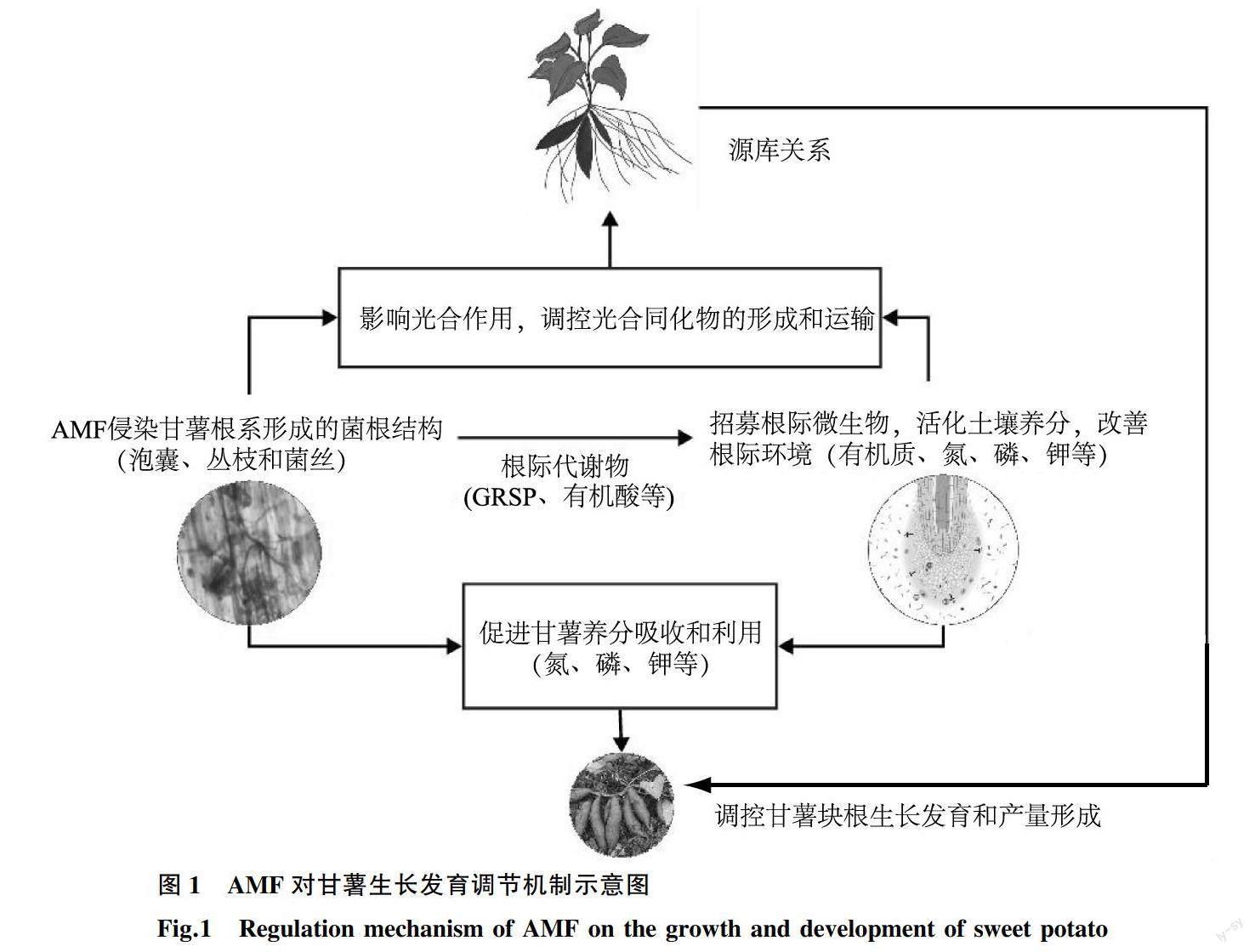
综上所述,甘薯与AMF建立的共生关系主要通过三个方面调控甘薯对养分的吸收利用,进而影响块根形成和膨大。①AMF侵染甘薯根系后,其菌丝的延伸扩大了根系吸收养分的范围。②AMF产生的GRSP可以螯合土壤养分,改善根际环境;AMF诱导甘薯根系分泌的有机酸有助于促使根际有益微生物聚集,提高土壤中多种酶的活性,活化土壤养分,促进甘薯对养分的吸收。③AMF通过增强甘薯的光合能力和潜在块根分化,调控源库关系。三方面共同影响甘薯对养分的吸收利用,调控甘薯块根形成和膨大,影响产量(图1)。
4 问题及展望
减肥增效、绿色生产是实现农业生态环境保护和粮食安全的保障。农田土壤中富含AMF,合理运用AMF可以改善土壤特性,促进作物养分吸收,有助于实现减肥增效、绿色生产。因此,菌根技术为甘薯产业发展提供了新的发展机遇。然而,菌根在甘薯上的应用研究还存在明显的局限性:①AMF在种植甘薯土壤中的分离鉴定研究不够完善。甘薯在中国被广泛种植,然而在种植甘薯土壤中分离出的真菌仅4属8种,实验室接种应用多以摩西斗管囊霉和幼套近明球囊霉为主[15-16,25]。由于,AMF和甘薯之间存在选择适应性,因此 开展更广泛的AMF菌种分离鉴定及其对不同品种甘薯的生长影响分析势在必行。②目前大多研究侧重AMF对甘薯的促生效应,但亦有研究发现施用AMF会对植物生长产生负效应,如高磷条件下AMF会阻碍甘薯块根的生长发育而导致减产[4],因此,对不同气候和土壤环境下AMF应用的合理性、适宜菌种的选择等还需要进一步的系统研究。③接种AMF会影响氮、磷、钾等营养元素的分配过程,调控甘薯对养分的吸收和利用,但目前这方面的研究大多侧重在生理方面,而对AMF介导的甘薯根系吸收利用养分的分子机制缺乏深入研究。Liu等[61]通过亚细胞定位分析和RT-PCR技术发现低钾胁迫下番茄菌根共生诱导的钾转运体基因SIHAK10在被菌丝侵染形成丛枝的细胞中特异表达,然而类似的分子生物学技术在甘薯菌根中还没有得到应用。
未来研究还可以利用微生物组和代谢组技术深入探究AMF侵染甘薯根系后差异代谢物作为信号分子在根际有益微生物募集中扮演的角色,丰富甘薯菌根的共生效应研究。
参考文献:
[1] 黄艳飞,吴庆丽,万 群,等. 丛枝菌根真菌的研究进展[J]. 现代农业, 2019(12): 9-12.
[2] 陆建珍,汪 翔,秦建军,等. 我国甘薯种植业时空布局分析及产业发展建议[J]. 天津农业科学, 2020, 26(3): 53-62.
[3] 弋凤蕊,刘瑞涵,李仁崑. 中国甘薯产业竞争力区域比较研究[J]. 农业展望, 2021, 17(7): 61-66.
[4] 徐西红,李腾腾,李 欢. 接种AM真菌对甘薯光合作用及碳磷代谢酶活性的影响[J]. 水土保持学报, 2016, 30(2): 255-259.
[5] 周晓月,袁 洁,石 琨,等. AMF对甘薯生物量、根系形态及钾素吸收的影响[J]. 江苏农业学报, 2022, 38(4): 939-948.
[6] 张树海,李 欢,刘 庆,等. 接种根内球囊霉提高氮素向甘薯块根转移和再分配的机理[J]. 植物营养与肥料学报, 2019, 25(9): 1542-1549.
[7] 盖京苹,冯 固,李晓林. 接种丛枝菌根真菌对甘薯生长的影响研究[J]. 中国生态农业学报, 2004, 12(1): 111-113.
[8] 李 欢,杜志勇,刘 庆,等. 蚯蚓菌根互作对土壤酶活、甘薯根系生长及养分吸收的影响[J]. 植物营养与肥料学报, 2016, 22(1): 209-215.
[9]?KEEFE D M, SYLVIA D M. Chronology and mechanisms of P uptake by mycorrhizal sweet potato plants[J]. New Phytologist, 1992, 122(4): 651-659.
[10]?KEEFE D M, SYLVIA D M. Seasonal dynamics of the association between sweet potato and vesicular-arbuscular mycorrhizal fungi[J]. Mycorrhiza, 1993, 3(3): 115-122.
[11]HARLEY J L. The significance of mycorrhiza[J]. Mycological Research, 1989, 92(2): 129-139.
[12]李艳红,李艳凤. 丛枝菌根与土壤碳截获的研究进展[J]. 安徽农业科学, 2019, 47(12): 6-9.
[13]WIPF D, KRAJINSKI F, TUINEN D, et al. Trading on the arbuscular mycorrhiza market: from arbuscules to common mycorrhizal networks[J]. New Phytologist, 2019, 223(3): 1127-1142.
[14]储 薇,郭信来,张 晨,等. 丛枝菌根真菌-植物-根际微生物互作研究进展与展望[J]. 中国生态农业学报(中英文), 2022, 30(11): 1709-1721.
[15]ALHADIDI N, PAP Z, LAD?NYI M, et al. Mycorrhizal inoculation effect on sweet potato (Ipomoea batatas (L.) Lam) seedlings[J]. Agronomy, 2021, 11(10): 2019.
[16]YUAN J, SHI K, ZHOU X Y, et al. Interactive impact of potassium and arbuscular mycorrhizal fungi on the root morphology and nutrient uptake of sweet potato (Ipomoea batatas L.) [J]. Frontiers in Microbiology, 2023, 13:1075957.
[17]MARSCHNER H, DELL B. Nutrient uptake in mycorrhizal symbiosis[J]. Plant and Soil, 1994, 159(1): 89-102.
[18]王幼珊,刘润进. 球囊菌门丛枝菌根真菌最新分类系统菌种名录[J]. 菌物学报, 2017, 36(7): 820-850.
[19]彭生斌,沈崇尧,裘维蕃. 中国的内囊霉科菌根真菌[J]. 真菌学报, 1990,9(3): 170-175.
[20]盖京苹,冯 固,李晓林. 我国北方农田土壤中AM真菌的多样性[J]. 生物多样性, 2004,12(4): 435-440.
[21]BORIS B, RENKER C, KAHMEN A, et al. Species composition of arbuscular mycorrhizal fungi in two mountain meadows with differing management types and levels of plant biodiversity[J]. Biology and Fertility of Soils, 2006, 42(4): 286-298.
[22]FARMER M J, LI X, FENG G, et al. Molecular monitoring of field-inoculated AMF to evaluate persistence in sweet potato crops in China[J]. Applied Soil Ecology, 2006, 35(3): 599-609.
[23]张美庆,王幼珊. 我国北部的七种VA菌根真菌[J]. 真菌學报, 1991,10(1): 13-21.
[24]张美庆,王幼珊,黄 磊. 我国北部的八种VA菌根真菌[J]. 真菌学报, 1992,11(4): 258-267.
[25]刘文科,冯 固,李晓林. AM真菌接种对甘薯产量和品质的影响[J]. 中国生态农业学报, 2006,14(4): 106-108.
[26]YOOYONGWECH S, SAMPHUMPHUANG T, TISARUM R, et al. Arbuscular mycorrhizal fungi (AMF) improved water deficit tolerance in two different sweet potato genotypes involves osmotic adjustments via soluble sugar and free proline[J]. Scientia Horticulturae, 2016, 198(1): 107-117.
[27]曹本福,姜海霞,陆引罡,等. 烟草与丛枝菌根真菌的共生效应研究进展[J]. 中国土壤与肥料, 2021(1): 327-338.
[28]孔维宝,陈 冬,杨树玲,等. 油橄榄与丛枝菌根真菌的共生效应研究进展[J]. 应用与环境生物学报, 2019, 25(3): 750-758.
[29]DING Y, JIN Y, HE K, et al. Low nitrogen fertilization alter rhizosphere microorganism community and improve sweet potato yield in a nitrogen-deficient rocky soil[J]. Frontiers in Microbiology, 2020, 11(1): 678.
[30]COSME M, RAMIREDDY E, FRANKEN P, et al. Shoot-and root-borne cytokinin influences arbuscular mycorrhizal symbiosis[J]. Mycorrhiza, 2016, 26(7): 709-720.
[31]刘 倩. 施钾对甘薯产量品质及营养元素吸收的影响[D]. 泰安:山东农业大学, 2014.
[32]MUKHONGO R W, TUMUHAIRWE J B, PETER E, et al. Combined application of biofertilizers and inorganic nutrients improves sweet potato yields[J]. Frontiers in Plant Science, 2017, 8(1): 219.
[33]ARLE I, SDERSTRM B, OLSSON P A. Growth and interactions of arbuscular mycorrhizal fungi in soils from limestone and acid rock habitats[J]. Soil Biology and Biochemistry, 2003, 35(12): 1557-1564.
[34]王幼珊,刘相梅,张美庆,等. 盆栽基质及营养液对AM真菌接种剂繁殖的影响[J]. 华北农学报, 2001, 16(4): 81-86.
[35]高雪冬. 菌根化育苗对田间不施磷玉米生长和养分吸收的影响[J]. 现代农业科技, 2021(5): 18-19.
[36]涂德辉,张 芳,毛明明,等. 丛枝菌根真菌对桑树根系氮积累及水通道蛋白表达的影响[J]. 植物生理学报, 2022, 58(8): 1607-1616.
[37]王雪霏,曹 哲,楊 钥,等. 北方黑土地花生根际丛枝菌根菌(AMF)分离鉴定及应用[J]. 高师理科学刊, 2022, 42(8): 71-76.
[38]NO R, KIERS E T. Mycorrhizal markets, firms, and coops[J]. Trends in Ecology & Evolution, 2018, 33(10): 777-789.
[39]郭良栋,田春杰. 菌根真菌的碳氮循环功能研究进展[J]. 微生物学通报, 2013, 40(1): 158-171.
[40]TRESEDER K K, TURNER K M. Glomalin in ecosystems[J]. Soil Science Society of America Journal, 2007, 71(4): 1257-1266.
[41]RILLIG M C. Arbuscular mycorrhizae, glomalin, and soil aggregation[J]. Canadian Journal of Soil Science, 2004, 84(44): 355-363.
[42]PARIHAR M, RAKSHIT A, MEENA V S, et al. The potential of arbuscular mycorrhizal fungi in C cycling: a review[J]. Archives of Microbiology, 2020, 202(7): 1581-1596.
[43]SIX J, BOSSUYT H, DEGRYZE S, et al. A history of research on the link between (micro) aggregates, soil biota, and soil organic matter dynamics[J]. Soil & Tillage Research, 2004, 79(1): 7-31.
[44]ROSIER C L, HOYE A T, RILLIG M C. Glomalin-related soil protein: assessment of current detection and quantification tools[J]. Soil Biology and Biochemistry, 2006, 38(8): 2205-2211.
[45]HERMAN D J, FIRESTONE M K, NUCCIO E, et al. Interactions between an arbuscular mycorrhizal fungus and a soil microbial community mediating litter decomposition[J]. FEMS Microbiology Ecology, 2012, 80(1): 236-247.
[46]PATERSON E, SIM A, DAVIDSON J, et al. Arbuscular mycorrhizal hyphae promote priming of native soil organic matter mineralisation[J]. Plant and Soil, 2016, 408(1/2): 243-254.
[47]TALBOT J M, ALLISON S D, TRESEDER K K. Decomposers in disguise: mycorrhizal fungi as regulators of soil C dynamics in ecosystems under global change[J]. Functional Ecology, 2008, 22(6): 955-963.
[48]KUZYAKOV Y. Sources of CO2efflux from soil and review of partitioning methods[J]. Soil Biology & Biochemistry, 2006, 38(3): 425-448.
[49]FENG H, ZHANG N, DU W, et al. Identification of chemotaxis compounds in root exudates and their sensing chemoreceptors in plant growth-promoting rhizobacteria Bacillus amyloliquefaciens SQR9[J]. Molecular Plant-Microbe Interactions, 2018, 31(10): 995-1005.
[50]ZHANG N, YANG D, WANG D, et al. Whole transcriptomic analysis of the plant-beneficial rhizobacterium Bacillus amyloliquefaciens SQR9 during enhanced biofilm formation regulated by maize root exudates[J]. BMC Genomics, 2015, 16(1): 685.
[51]CHAPARRO J M, BADRI D V, BAKKER M G, et al. Correction: root exudation of phytochemicals in arabidopsis follows specific patterns that are developmentally programmed and correlate with soil microbial functions[J]. PLoS One, 2013, 8(2): e55731.
[52]CARAVACA F, FIGUEROA D, BAREA J M, et al. Effect of mycorrhizal inoculation on the nutrient content, gas exchange and nitrate reductase activity of Retama sphaerocarpa and Olea europaea SBSP. Sylvestris under drought stress[J]. Journal of Plant Nutrition, 2004, 27(1): 57-74.
[53]BAGO B, ZIPFEL W, WILLIAMS R M, et al. Translocation and utilization of fungal storage lipid in the arbuscular mycorrhizal symbiosis[J]. Plant Physiology, 2002, 128(1): 108-124.
[54]GAO X, HOFFLAND E, STOMPH T, et al. Improving zinc bioavailability in transition from flooded to aerobic rice. A review[J]. Agronomy for Sustainable Development, 2012, 32(2): 465-478.
[55]竹嘉妮,黃 弘,杜 勇,等. 丛枝菌根真菌影响宿主植物蒺藜苜蓿根系酸性磷酸酶活性的跨世代效应[J]. 生态学杂志, 2022, 41(5): 912-918.
[56]GONG M, TANG M, CHEN H, et al. Effects of two Glomus species on the growth and physiological performance of Sophora davidii seedlings under water stress[J]. New Forests, 2013, 44(3): 399-408.
[57]PORCEL R, REDONDO-G?MEZ S, MATEOS-NARANJO E, et al. Arbuscular mycorrhizal symbiosis ameliorates the optimum quantum yield of photosystem II and reduces non-photochemical quenching in rice plants subjected to salt stress[J]. Journal of Plant Physiology, 2015, 185(1): 75-83.
[58]宁运旺,马洪波,张 辉,等. 氮、磷、钾对甘薯生长前期根系形态和植株内源激素含量的影响[J]. 江苏农业学报, 2013, 29(6): 1326-1332.
[59]梁清干,陈艳丽,刘永华,等. 磷素对甘薯生长前期源库关系建立和平衡的影响[J]. 热带作物学报, 2021, 42(10): 2915-2923.
[60]宁运旺,马洪波,张 辉,等. 甘薯源库关系建立、发展和平衡对氮肥用量的响应[J]. 作物学报, 2015, 41(3): 432-439.
[61]LIU J J, LIU J L, LIU J H, et al. The potassium transporter SlHAK10 is involved in mycorrhizal potassium uptake[J]. Plant Physiology, 2019, 180(1): 465-479.
(责任编辑:石春林)

