玉米种衣剂在土壤中的残留动态及对土壤酶活性和可培养细菌的影响
刘亚冬, 吕陈生, 申鸿, 武奕彤, 李开叶
1. 西南大学 资源环境学院,重庆 400715;2.重庆市农业资源与环境研究重点实验室,重庆 400715
新烟碱类杀虫剂和三唑类杀菌剂因其广谱高效的杀虫、 杀菌效果, 被广泛应用于全球农业和公共卫生领域, 尤其是用于种衣剂处理[1-2]. 然而, 已有的研究发现, 该内吸性农药在环境介质和农副产品中被高频检出, 严重威胁环境安全和人类健康[3-6]. 噻虫嗪为第二代新烟碱类杀虫剂, 因其特殊内吸性, 容易被环境介质中的动植物摄入, 对非靶标昆虫[7-8]、 水生无脊椎动物[9-10]、 食虫鸟类[11-12]、 人类[13-14]造成有害影响, 甚至破坏食物链及生态环境[15], 其结构图如图1所示. 苯醚甲环唑属于三唑类杀菌剂, 易残留于土壤中. 残留于土壤中的苯醚甲环唑[16-18]影响土壤微生物多样性[19-20]、 土壤酶活性[21-22]和土壤微生物数量[23]. 因此, 开展种衣剂对土壤酶活性和可培养细菌影响的研究对于土壤生态安全保护具有重要意义.
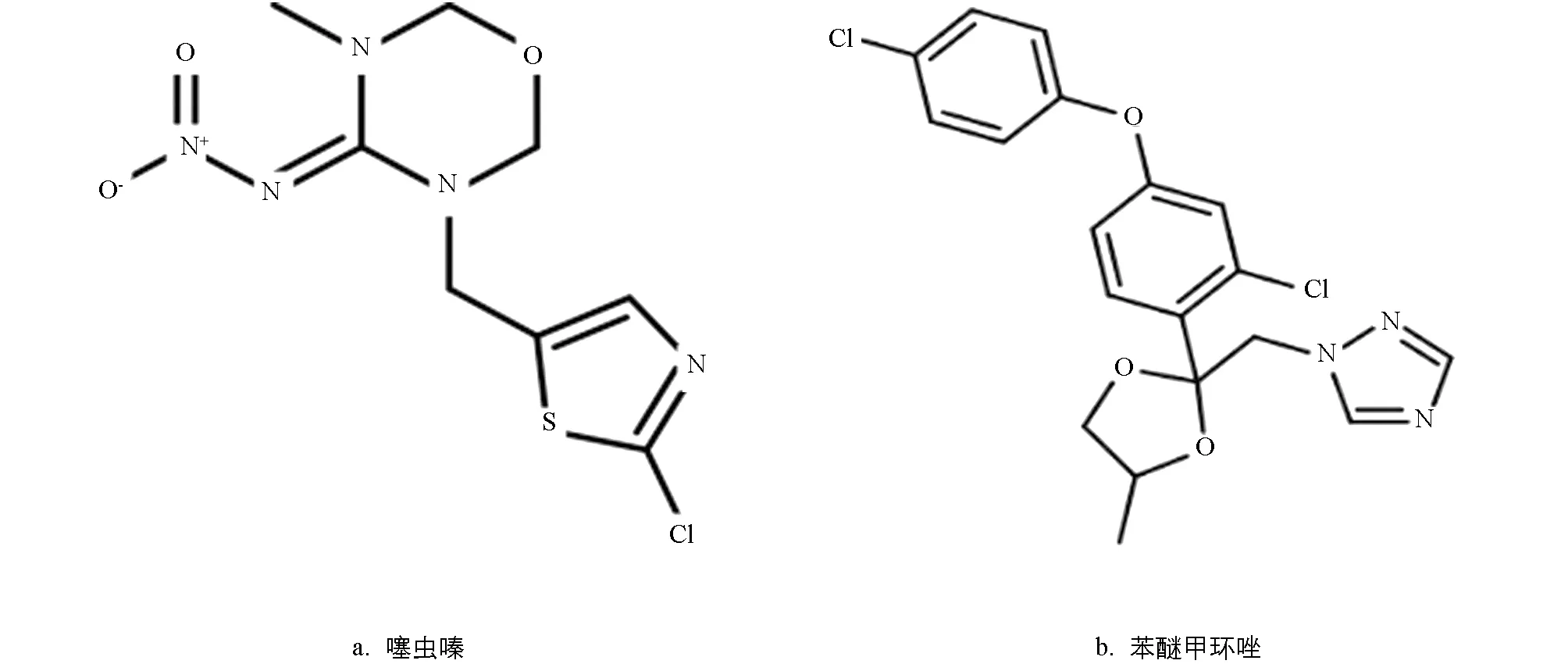
图1 噻虫嗪和苯醚甲环唑结构式
目前国内外对内吸性农药的生态毒理学研究主要集中于农药在土壤中的最终残留量, 以及对相关生物的直接负面影响等方面, 但是针对其在土壤中的动态迁移、 残留及其对土壤微生态环境影响的研究还较少. 土壤的物质循环、 能量流动及信息传递与土壤微生态环境密切相关, 土壤微生态环境良好是保证土壤物质正常循环、 土壤养分正常供应的前提[24-27]. 此外, 实际农业生产中不止用单一农药作为种子包衣剂, 通常将杀虫剂和杀菌剂联合施用以达到对作物更好的保护作用, 因此有必要探究复合农药对土壤微生态环境的影响. 本研究以噻虫嗪和噻虫嗪-苯醚甲环唑混剂作为2种玉米种衣剂施用, 通过田间试验, 监测内吸性农药在土壤中的残留动态, 分析土壤中可培养微生物的数量及土壤相关酶活性的状态, 揭示噻虫嗪和苯醚甲环唑对土壤微生态的潜在影响, 以期为噻虫嗪和苯醚甲环唑在种衣剂方面的安全使用提供评价依据.
1 材料与方法
1.1 试验场地与材料
试验地点: 试验于2020年5-7月在重庆市合川区渭沱镇西南大学试验农场基地(30°0′N, 106°7′E)进行, 该地区属亚热带季风气候, 5-7月的月均气温为26 ℃, 月均降水量为 208 mm. 土壤类型为冲积土, 基本性质为: pH值为8.4, 有机质质量分数为21.5 g/kg, 全氮质量分数为1.3 g/kg, 碱解氮质量分数为51.2 g/kg, 有效磷质量分数为28.7 mg/kg, 速效钾质量分数为89.0 mg/kg.
供试农药: 本试验使用农药悬浮剂噻虫嗪和混剂噻虫嗪-苯醚甲环唑, 由先正达公司生产, 农药登记号分别为PD20160110和PD20161551. 按说明书推荐剂量(600 mL/100 kg种子)在实验室进行玉米种子包衣.
供试玉米: 品种为“黑糯100”, 由重庆市农业科学院种子中心提供.
1.2 试验设计
采用田间试验研究噻虫嗪和噻虫嗪-苯醚甲环唑混剂作为玉米种衣剂对土壤微生态环境的影响. 将667 m2试验田平均划分为3个大区, 每个大区播种0.5 kg玉米种子, 每hm260 000株玉米. 3个大区分别为对照组(CG), 噻虫嗪组(Z)和噻虫嗪-苯醚甲环唑混剂组(ZW). 每个大区包括4个小区, 共计12个试验小区. 其他种植管理同当地玉米种植技术一致.
1.3 土壤样品采集
玉米种子于2020年5月10日播种, 等待采样. 采样时间为5月27日(18 d, 苗期阶段)、 6月10日(32 d, 拔节期)、 6月19日、 6月25日(47 d, 抽穗期)、 7月4日、 7月12日(64 d, 灌浆期)、 7月22日(74 d, 乳熟期). 随机抽取样本土壤, 采集根际土和非根际土, 采集的土壤一部分在试验室自然阴干, 用2 mm的筛子过筛, 放于-20 ℃的环境中等待农药残留检测; 另一部分放在液氮环境中保存, 运回试验室, 在-80 ℃条件下保存, 然后进行相关指标的测定. 其中, 5月27日的非根标土因野外不可控因素遗失.
1.4 测定方法
1.4.1 土壤农药残留测定
准确称取10.00 g 土壤样品置于锥形瓶中, 加入10 mL纯水后静置水化1 h, 加入20 mL乙腈, 180 r/min摇床振荡1 h, 称好5~7 g NaCl置于100 mL离心管中, 将上清液倒入其中, 锥形瓶中再加入20 mL乙腈, 再180 r/min摇床振摇1 h, 上清液倒入上述100 mL离心管中, 5 000 r/min 离心机离心5 min, 取2 mL上清液, 过0.22 μm滤膜, 置于进样小瓶中, 进样小瓶置于-20 ℃冰箱中, 送往科研监测所进行分析[28].
1.4.2 土壤酶活性测定
(1) 土壤脱氢酶
使用Solarbio©土壤脱氢酶(S-DHA)活性检测试剂盒检测. 具体步骤为: 测定管和对照管各加入0.1 g土样, 对照管加入试剂二1 mL, 测定管中加入试剂一0.5 mL和试剂二0.5 mL, 混匀后37 ℃暗培养6 h后立即冰浴5 min, 分别加入0.5 mL试剂三. 数次震荡后, 37 ℃保温10 min, 1 200 rpm、 4 ℃离心机离心5 min, 取上清液置于玻璃比色皿中, 用分光光度计在波长为485 nm条件下测定[29].
(2) 土壤过氧化氢酶
使用Solarbio©土壤过氧化氢酶(S-CAT)活性检测试剂盒检测. 具体步骤为: 无基质管和测定管各加入0.1 g土样, 测定管和无土管分别加入试剂一1 000 μL, 无基质管加入双蒸水1 000 μL, 25 ℃振荡培养20 min后, 三管分别加入试剂二25 μL, 混匀后于8 500 rpm、 25 ℃离心机离心5 min, 取全部上清液, 分别加入试剂三120 μL并混匀, 用分光光度计在波长为240 nm条件下测定[29].
1.4.3 土壤可培养细菌数量
采用稀释平板法测定土壤可培养细菌数量[30], 具体步骤为: 先测定土壤样品水分系数, 后称取5.00 g土样, 放入装有45 mL无菌水的三角瓶中, 振荡20 min, 使土样分布均匀, 土样溶液静置10 min, 成为土壤悬浮液; 取1 mL土壤悬浮液, 置于装有9 mL无菌水的试管中, 用振荡器使土壤悬浮液均匀分布, 用十倍稀释法将菌悬液稀释成10-4的梯度. 把稀释好的菌悬液接种到配置好的培养基中, 倒置 30 min. 置于37 ℃的恒温培养箱中12 h, 取数量适中、 菌落分布均匀的培养基计数.
1.5 数据处理方法
试验结果表示为平均数±准偏差(Mean±SD), 采用SPSS 21.0软件进行数据统计, 采用单因素方差分析, 显著水平设为0.05. 采用Origin 2018软件进行作图.
2 结果与讨论
2.1 噻虫嗪和噻虫嗪-苯醚甲环唑混剂在土壤中残留随时间的变化情况
对0~10 cm深度的土壤中农药残留情况进行了测定, 结果如表1所示. 单施噻虫嗪处理, 6月19日前可检测到噻虫嗪, 之后土壤中均未检测到农药的残留. 在5月27日、 6月10日及6月19日土壤中噻虫嗪总残留量分别为0.018,0.035,0.054 μg/g, 结果表明, 6月19日之前, 随着玉米植株的生长, 土壤中农药残留量逐渐增加. 施用噻虫嗪-苯醚甲环唑混剂处理, 5月27日、 6月10日、 6月19日均可检测到噻虫嗪, 残留量分别为0.036,0.024,0.019 μg/g, 其余时间均低于检出限, 说明玉米生长前期随着时间推移土壤中噻虫嗪残留量逐渐减少, 而苯醚甲环唑在玉米各个生长时期均低于检出限.
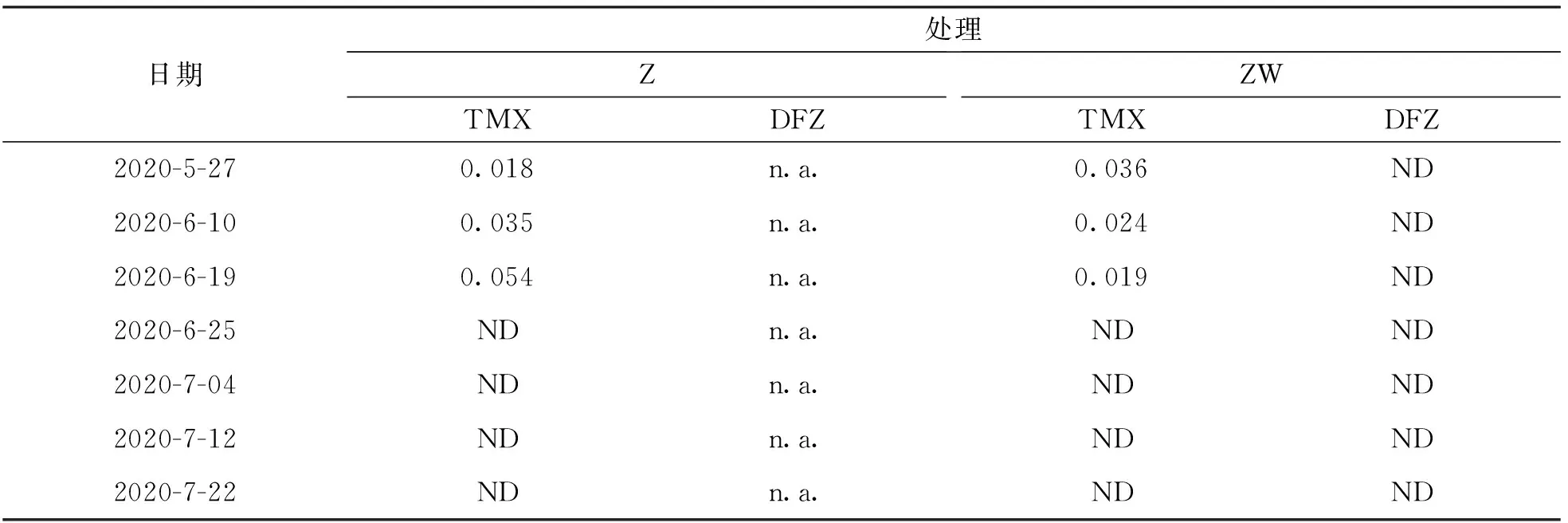
表1 不同种衣剂处理下土壤农药残留情况 μg·g-1
单施噻虫嗪时, 噻虫嗪在土壤中的残留量从5月27日至6月19日逐渐上升, 可能是因为玉米种子由种衣剂包裹, 种衣剂随玉米种子的生长缓慢释放, 致使土壤中噻虫嗪残留量逐渐增大. 噻虫嗪-苯醚甲环唑混剂处理玉米生长前期土壤噻虫嗪残留量减少, 可能是因为苯醚甲环唑的存在可导致噻虫嗪在前期的释放速率小于其分解速率和被植物吸收速率. 由本试验结果可知, 在玉米生长初期种衣剂中的农药绝大部分留在了土壤, 而不是被植物吸收. Wood等[31]研究也指出包衣剂中的有效成分只有约5%能被作物吸收, 其余部分可能会残留到土壤中. 另外, 吴俊学[32]通过温室土柱试验证明仅有不到10%的农药从种子中被作物体系吸收, 有大于90%的农药从种子转移到了土壤中. Anderson等[33]也报道, 根据施用方法和作物类型的不同, 仅有1.6%~28.0%的新烟碱杀虫剂被植物吸收, 而剩余的将进入土壤或渗透至地下水中. 因此残留在土壤中的农药会随着降雨及玉米植株的生长, 在土壤中发生一系列的降解以及迁移的行为, 从而会对土壤微生态环境构成潜在的危害.
2.2 噻虫嗪和噻虫嗪-苯醚甲环唑混剂对土壤酶活性的影响
2.2.1 噻虫嗪和噻虫嗪-苯醚甲环唑混剂对土壤脱氢酶活性的影响
图2显示了根际土的脱氢酶活性变化情况. 随着玉米的生长, 对照和种衣剂处理土壤脱氢酶活性均有降低的趋势, 5月27日(苗期)脱氢酶活性最大, 7月22日(乳熟期)脱氢酶活性最小. 在灌浆期前根际土土壤脱氢酶的活性呈下降趋势, 灌浆期后逐步恢复平稳, 原因可能是在种植玉米初期耕作活动比较频繁, 可以为土壤微生物带来生长繁殖所需的营养物质和氧气条件[34-35], 所以前期脱氢酶活性较高, 但土壤微生物在后期温度升高和农业活动减少的情况下生存环境转变, 能产生脱氢酶的微生物也受到影响, 进而导致土壤脱氢酶活性降低. 土壤脱氢酶在后期活性较稳定, 可能是因为很多耐受性厌氧微生物和兼性厌氧微生物的大量繁殖, 保证了土壤脱氢酶的平衡. 非根际土的脱氢酶活性比根际土酶活性低, 与根际土相似, 总体呈现先明显降低后趋于平稳的趋势, 单施噻虫嗪处理和噻虫嗪-苯醚甲环唑混施处理土壤脱氢酶活性均比对照组处理高.
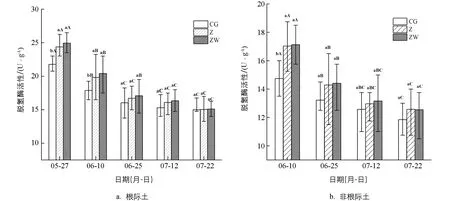
误差线代表平均值±标准偏差. 不同的小写字母表示同一时间不同处理之间差异有统计学意义(p<0.05), 不同的大写字母表示同一处理不同时间之间差异有统计学意义(p<0.05). 下同.图2 不同农药处理下的土壤脱氢酶活性
噻虫嗪和噻虫嗪-苯醚甲环唑混剂处理较对照组相比, 根际土土壤脱氢酶的活性分别提高0.27%~11.94%和0.73%~14.51%, 非根际土土壤脱氢酶活性分别提高3.1%~15.53%和4.69%~16.14%. 种衣剂处理能提高土壤脱氢酶活性可能是因为低浓度的农药会促进土壤脱氢酶的生长繁殖. 而土壤脱氢酶的活性与土壤微生物的状态密切相关, 可以作为土壤污染物降解程度和微生物生存状况的指标[36], 由此推测低浓度的农药可能是通过促进微生物的生长来促进脱氢酶活性升高的. 土壤酶还能和农药发生化学反应, 分解转化土壤中的有机污染物, 使农药对植物生长和对土壤健康的影响程度降低[37]. 随时间推移, 噻虫嗪和噻虫嗪-苯醚甲环唑混剂不断被土壤微生物分解, 农药残留量逐渐降低, 对土壤脱氢酶活性的促进作用也逐渐降低. 土壤中农药残留量的降低使其对土壤微生物的影响减弱, 但农药施用量少, 且前期可能是以农药促进产脱氢酶的微生物生长繁殖机制为主. 在两种机制的作用下, 农药对土壤脱氢酶的促进作用随农药残留的减少而减弱, 因此后期施用农药处理和对照处理的脱氢酶活性趋于相同.
2.2.2 噻虫嗪和噻虫嗪-苯醚甲环唑混剂对土壤过氧化氢酶活性的影响
土壤过氧化氢酶活性如图3所示, 对照组根际土过氧化氢酶活性随玉米的生长呈先上升后平稳的趋势, 而两种种衣剂处理根际土过氧化氢酶活性先下降后趋于稳定. 对照组过氧化氢酶的活性先显著升高后趋于平稳, 是因为玉米根系活力随玉米植株的生长而增强, 产生更多促进有机质降解的分泌物, 使得微生物的活动效率提高, 进而使土壤过氧化氢酶的活性增大. 为了给玉米的生长提供保证, 试验组与对照组都施加了同样的肥料, 而过氧化氢酶的活性与土壤肥力有良好的相关关系, 随着玉米的生长发育, 土壤过氧化氢酶的活性也趋于稳定. 非根际土的过氧化氢酶活性与根际土变化趋势相似, 随着时间的推移, 施用种衣剂处理后土壤过氧化氢酶活性先提高后逐渐与对照组水平一致, 非根际土过氧化氢酶活性比根际土低.

图3 不同农药处理下的土壤过氧化氢酶活性
相比对照处理, 噻虫嗪和噻虫嗪-苯醚甲环唑混剂处理使土壤过氧化氢酶的活性明显提高, 根际土分别提高1.10%~37.13%和0.64%~36.55%, 非根际土分别提高0.32%~31.68%和2.47%~29.94%, 与农药对土壤脱氢酶的影响相似. 可能是由于低浓度的农药对土壤过氧化氢酶的活性有促进作用. 土壤过氧化氢酶可以作为土壤好氧微生物的生存状况指标, 可以抑制对生物体有害的过氧化氢的含量, 过氧化氢酶的活性与土壤微生物的活性和数量等有密切的关系[38]. 低浓度的农药可能是通过产生大量的过氧化氢, 同时促进好氧微生物的生长繁殖, 进而使土壤过氧化氢酶的活性增加. 农药的残留随玉米植株的生长发育逐渐减少, 对过氧化氢酶的促进作用也逐渐变弱, 因此施用农药的处理与对照组的处理过氧化氢酶的活性后期趋于相同. 而单施噻虫嗪和施用噻虫嗪-苯醚甲环唑混剂2种处理的土壤过氧化氢酶活性并无显著差异, 可能是因为土壤中苯醚甲环唑在玉米的整个生长期间都在检出限以下, 残留量低, 且噻虫嗪与苯醚甲环唑无明显的联合毒性, 所以对土壤过氧化氢酶的活性影响不大.
2.3 噻虫嗪和噻虫嗪-苯醚甲环唑混剂对土壤可培养细菌数量的影响
由图4可知, 根际土可培养细菌数量随着玉米的生长呈降低趋势, 相比对照处理, 2种种衣剂处理均能减少土壤可培养细菌的数目, 随着时间的推移, 降低效果逐渐减弱, 乳熟期(7月22日)恢复与对照相同水平. 非根际土的可培养细菌数量在玉米植株的整个生长期内变化不大, 且比根际土低了一个数量级, 可能是因为非根际土距离玉米植株根系较远, 所受影响较小. 对照组的根际土可培养细菌数量变化趋势为先升高后降低, 在玉米拔节期(6月10日)时达最大值, 可能是因为玉米植株在生长过程中, 根部吸收土壤养分的同时也分泌了可以为土壤微生物提供养分的物质, 玉米植株生长前期根系发育较快, 释放的分泌物多, 从而使土壤可培养细菌数量增加, 而玉米植株生长中后期根系的生长速度减慢, 释放的分泌物减少, 土壤可培养细菌数量也减少.

图4 不同农药处理下的土壤可培养细菌数量
相比对照处理, 玉米植株生长前期, 单施噻虫嗪和施用噻虫嗪-苯醚甲环唑混剂2种处理的土壤可培养细菌数量均明显降低, 可能是由于低浓度的农药施用会抑制土壤可培养细菌数量; 也可能是目前通过试验室人工培养的方式分离的可培养细菌不足土壤细菌总量的1%[39], 这两种农药的施用对其他不可培养的微生物的生长繁殖有促进作用, 使土壤可培养细菌的生存资源减少, 进而使土壤可培养细菌数量降低. 两种情况均可能改变土壤微生物结构, 影响土壤微生态环境状况. 农药残留量随时间的推移逐渐减少, 土壤可培养细菌的数量也恢复至对照水平. 相比噻虫嗪-苯醚甲环唑混剂处理, 单施噻虫嗪处理在玉米植株生长前期土壤可培养细菌数量高, 可能是因为苯醚甲环唑对土壤可培养细菌有抑制作用, 但苯醚甲环唑施用量较少且随时间推移残留量减少, 因此后期2种处理的土壤可培养细菌数量差别不大.
3 结论
单施噻虫嗪及噻虫嗪-苯醚甲环唑混合施用时土壤中噻虫嗪的残留主要在0~10 cm土层处, 研究期内噻虫嗪在土壤中的最高质量分数分别为0.068 μg/g(2020年6月19日, 单施)和0.036 μg/g(2020年5月27日, 混剂), 苯醚甲环唑在各时期各土壤深度均未达到检出限.
与对照组相比, 噻虫嗪和噻虫嗪-苯醚甲环唑混剂处理对土壤脱氢酶和过氧化氢酶的活性均有激活作用, 根际土土壤脱氢酶和过氧化氢酶的活性分别提高0.27%~11.94%,0.73%~14.51%和1.10%~37.13%, 0.64%~36.55%. 随玉米植株的生长, 土壤酶活性均恢复到与对照组同一水平.
玉米生长前期, 噻虫嗪和噻虫嗪-苯醚甲环唑混剂处理对土壤可培养细菌均有明显抑制作用, 随玉米植株的生长, 抑制作用逐渐减弱直至乳熟期恢复与对照组同一水平.

