基于微流控芯片的细胞-细菌相互作用光电检测技术*
谭浩兰 何 红 龚 丽 葛 闯 徐 溢
(1)重庆大学新型微纳米器件与系统技术重点学科实验室,光电技术与系统教育部重点实验室,重庆 400044;2)重庆大学化学化工学院,重庆 401331;3)重庆大学光电工程学院,重庆 400044;4)重庆大学附属肿瘤医院肿瘤转移与个体化诊治转化研究重庆市重点实验室,重庆 400030;5)重庆航天职业技术学院继续教育学院,重庆 400021)
细胞-细菌的相互作用是指细菌或细菌代谢物作用于宿主后,引起宿主体内多种细胞发生不同程度应变的过程[1-2]。按照细胞类型的不同,可分为细菌与吞噬性细胞或与非吞噬性细胞的相互作用。吞噬性细胞一般指宿主体内的免疫细胞,会主动迁移到细菌感染处,吞噬并溶解入侵的细菌,在宿主免疫系统起到“哨兵”的作用[3-5]。非吞噬性细胞如上皮细胞、内皮细胞等,不具有吞噬性,但是具有侵袭性的细菌通过其特有的毒力机制会破坏细胞的屏障功能,诱导细胞骨架重排,促进非吞噬性细胞的内化作用,导致细胞状态受损[4,6]。
细菌-细胞的相互作用导致细菌性感染疾病,严重威胁着人体健康[7-8]。细菌感染检测分析已成为疾病机制研究及药物治疗效果评估的关键环节,细菌侵袭轨迹、细胞/细菌形态、细胞/细菌活性、细胞屏障、细胞/细菌代谢物等都是研究细胞-细菌相互作用机制的重要指标,对细胞-细菌相互作用机制进行更深层次的研究,以及对细菌侵袭细胞的不同阶段及其相应的变化规律进行探索,对于生命科学研究、解析病理机制、发现和筛选抗菌药物、选择和优化诊疗方案等领域具有重要的研究价值和指导意义。
传统的细胞-细菌体外实验研究方法包括孔板共培养、嵌入式细胞共培养法等,存在操作繁琐、样本需求量大、与人体真实环境差异大、过程表征难以深化阐述及信号获取困难等问题[9]。近年来,利用微机电系统(micro electro-mechanical system,MEMS)技术构建的具备多种结构和功能单元的微流控芯片,广泛用于细胞/细菌培养、细胞/细菌检测等领域,为细胞-细菌的研究提供了优质的平台[10-11]。本课题组长期从事微流控生化分析研究工作,发现利用微流体控制技术可对细胞-细菌生长的微环境进行时间和空间上的精确调控,模拟细胞-细菌生长的复杂微环境,通过在微流控芯片上集成传感监测模块,不仅可以在线监测细胞-细菌研究体系的变化过程,还可以实现多种检测模式高效结合,获取更多生化信息[12-13]。
本文简要介绍了细胞-细菌相互作用研究所需模型在微流控芯片上的构建途径,重点对芯片上细胞-细菌相互作用过程光电检测方法进展进行综述,探讨了光学检测法和电化学检测法在芯片上的集成,及其对细胞-细菌研究体系的测试效果及研究进展,对芯片上细胞-细菌相互作用研究的难点和发展趋势进行展望。
1 微流控芯片上细胞-细菌相互作用模型构建
1.1 细胞-细菌接触式共培养模型
微流控芯片被公认为是疾病研究理想的体外平台,微流体可通过控制生化梯度、机械刺激、生化因子等模拟更准确的疾病模型,MEMS 技术和生物材料的发展促进了细胞-细菌共培养模型的多样性[14-15]。Kim 等[16]在芯片上设计了内外两个微腔室,使用气动微阀升高或降低内部细胞培养微腔室的聚二甲基硅氧烷(polydimethylsiloxane,PDMS)壁,实现了从时空尺度控制细菌侵袭细胞过程。Park 等[17]将液滴与微腔室相结合,通过T 型接头装置,可产生最大频率为500 滴/s的液滴,用于不同微生物之间的长期共培养。结合微流控平台,3D 细胞培养还可构建更复杂的芯片上细胞球和类器官模型。Brackett 等[18]利用悬浮的微液滴实现了肿瘤细胞球的培养,并借助微流体技术模拟了细菌靶向肿瘤组织治疗的过程。水凝胶[19]、微孔[20]或U 型微腔室[21]等也是细胞球培养的常用手段。Puschhof等[22]从人体小肠标本中培养原代干细胞,开发了微流控肠道类器官模型,重建了人体小肠更多的关键功能,其模拟肠道疾病模型比2D 细胞模型有更好的反应。
微阀控制更加自动化、集成化,但存在一定的加工和操作难度。基于液滴的共培养具有高通量、并行性、样品消耗低等优势,超小体积利于实现单细胞水平分析,但也限制了更多生化信息的采集。随着微流体控制技术的发展,芯片上3D 细胞成为新的体外模型热点,细胞球是最简单且常用的3D细胞模型,类器官模型则概括了更多的人体器官的结构和生化信息,都可模拟更复杂的疾病,但需优化其生产方法以减少劳动力和成本,其分析方法也有待标准化[23-24]。
1.2 细胞-细菌非接触式共培养模型
非接触式共培养模型的策略主要是利用生物材料结构小于微生物尺寸,限制细胞/细菌的运动而允许小分子物质自由穿过[25-26]。Marzorati等[27]利用聚酰胺多孔膜构建了上下两个分别用于细菌/细胞培养的微腔室,建立了细菌毒性分泌物与细胞共培养的模型。细胞/细菌在水凝胶中难以实现空间上的迁移,但其分泌的小分子物质可通过水凝胶自由交流[28]。Hong 等[29]在微通道中利用胶原蛋白凝胶将细胞和细菌限制在不同区域,而细胞分泌的生化因子通过具有渗透性的凝胶作用于细菌,研究了细菌对不同细胞的趋化作用。纳米结构尺寸微小,也可作为物理屏障。Burmeister 等[30]在微通道中央设计了一排纳米围堰限制细胞和细菌的接触,纳米结构的尺寸可灵活设计,适用于研究细菌代谢物扩散速率不同对细胞的影响。
两种共培养方式的细胞模型是可以通用的,但侧重点不同,接触式共培养模型适用于细菌直接侵袭细胞并引起细胞吞噬细菌、细胞内细菌复制以及细胞裂解死亡等过程研究[31-32],非接触式共培养模型多用于研究细胞和细菌之间的信号交流,都为相关疾病机制的研究提供了可靠的平台。
2 微流控芯片上细胞-细菌相互作用过程的检测
微流控芯片与多种检测分析方法结合,为解析细胞-细菌相互作用机制提供了高效的研究平台。这里重点介绍光学检测法和电化学检测法,光学检测法最大优势是实现细胞水平上的可视化观测,电化学检测法则通过电信号的变化动态反映生化过程信息。
2.1 光学检测法
2.1.1 荧光法
微流控荧光技术不仅能够可视化细胞和细菌,还能提供细胞-细菌相互作用的动力学信息[33]。
针对细菌小尺寸和高分裂率的特性,常在细菌内导入表达荧光蛋白的质粒,从而产生明亮而稳定的荧光,为观察细菌侵袭细胞的过程提供了更多便利[34-35]。Delincé 等[36-37]通过荧光延时显微镜观测了表达橘红色荧光蛋白的海洋分枝杆菌感染盘基网柄菌(D. discoideum)细胞,在芯片上实现了细胞摄取细菌、胞内细菌复制到细胞裂解死亡过程的原位监测(图1a)。Ellett 等[38]在微腔室中培养表达绿色荧光蛋白的金黄色葡萄球菌(Staphylococcus aureus,S. aureus),在微腔室外圈培养蓝色荧光染料(Hoechst)标记的中性粒细胞,可视化监测了中性粒细胞感知、趋化、吞噬细菌过程(图1b)。本课题组借助荧光探针标记细菌成像,可视化观测了细菌生物膜的生长过程以及药物-细菌相互作用过程[39]。

Fig. 1 Cell-bacterial interactions detected by fluorescence analysis图1 荧光法检测细胞-细菌相互作用过程
免疫荧光检测技术基于特异性抗原-抗体反应,借助荧光探针标记和荧光显微镜技术,通过检测细胞-细菌相互作用过程中结构组分及细胞屏障的变化,进一步获得靶向蛋白的定性或定量信息[40]。Jing 等[41]使用带荧光探针的抗体分别对肠上皮细胞的Occludin和绒毛蛋白免疫荧光染色,发现肠上皮细胞与大肠杆菌在芯片上共培养24 h后,这两种蛋白质的荧光强度显著下降(图1c)。Deinhardt-Emmer 等[42]建立了S. aureus感染人体肺部的微流控模型,通过对内皮细胞的VE 钙黏蛋白(VEcadherin)、紧密连接蛋白(ZO-1)免疫荧光染色,观察到细菌感染引起内皮细胞的紧密连接蛋白荧光信号明显减弱(图1d)。这些结果表明,细菌的侵袭会导致细胞紧密连接受到不同程度的破坏,细胞屏障完整性难以维持。
荧光检测技术与微流控芯片集成,为细菌侵袭细胞过程的可视化监测提供了强有力手段,还能为体系中的一些细胞组分及其变化情况进行高效的定量分析。采用共聚焦激光扫描荧光显微镜,还可以实现从三维层面观测细胞内外细菌的定位及动态观测细胞/细菌行为,进一步拓展了微流控荧光检测技术在细胞/细菌分析中的应用。
2.1.2 拉曼光谱法
与荧光检测技术相比,拉曼光谱法无需标记及样本预处理,能够提供更丰富的分子信息。与显微技术结合,通过空间分辨和原位探测细胞结构的光谱特征,还能够可视化细胞内细菌感染过程[43-44]。
Grosse 等[45]利用拉曼显微技术以无标记、非侵入性的方式识别了细菌以及内皮细胞核周区域,观测了受感染EA.hy926 内皮细胞内S. aureus的分布,通过主成分分析和线性判别分析法预测了细菌处于细胞内/外状态,准确率达到85%(图2a)。Silge等[46]对戈登分枝杆菌(M. gordonae)产生的类胡萝卜素进行了原位拉曼光谱检测,结合重建的化学图像的空间信息和拉曼光谱图,区分了巨噬细胞摄取M. gordonae的不同状态,提供了受感染细胞的脱氧核糖核酸、脂质和蛋白质等代谢信息(图2b)。本课题组结合表面增强拉曼光谱(surfaceenhanced raman spectroscopy,SERS)和微流体控制技术,实时监测了抑菌药物作用于细菌过程中细菌内毒素的释放情况,还动态监测了细胞膜成分磷脂的氧化过程[47-48],体现了拉曼光谱法在监测生化过程的优势,为监测细胞-细菌相互作用过程提供了思路。

Fig. 2 Cell-bacterial interactions detected by Raman spectroscopy图2 拉曼光谱法检测细胞-细菌相互作用过程
拉曼光谱分析技术具有无损、非侵入和分子指纹特征的优势,通过在微流控芯片上集成具有微纳结构SERS基底,可以观测细菌对细胞的黏附,细胞内细菌的分布以及特定细胞/细菌成分的变化,提高靶标物的检测效率,深入探索细胞-细菌相互作用过程中复杂的代谢机制。
2.1.3 微分干涉显微技术
微分干涉对比 (differential interference contrast,DIC)显微镜是研究细胞结构的主要技术,可以清楚地观察细胞的形状变化及其运动,对于理解细胞相关生化过程非常重要[49]。
Ingber 等[50]开发了一种细菌感染肠道芯片模型(图3),借助DIC 显微镜观察到细菌会在上皮细胞的绒毛顶端过度生长,细胞炎症会导致绒毛损伤。进而,该团队还研发了微流控小肠类器官模型,DIC结果表明,动态流体和机械刺激可以促进小肠干细胞分化为具有绒毛的上皮细胞,形成明显的肠褶皱,并成功用于氧浓度梯度下肠道共生微生物与上皮细胞的相互作用研究[51-52],其研制的小鼠结肠类器官模型也成功实现与肠道共生细菌和致病菌的共培养[53]。
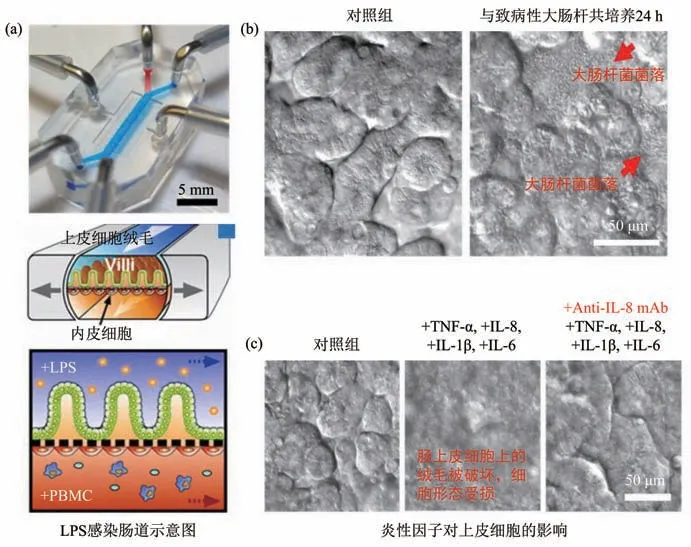
Fig. 3 DIC diagram of Escherichia coli infected intestinal epithelial cells and diagram of the intestinal chip[50]图3 大肠杆菌感染肠上皮细胞的DIC图及肠芯片示意图[50]
总之,微分干涉显微技术无需标记,可实现细胞形态和分化的评估,但其分辨率有限,通常和更高分辨率的荧光/共聚焦激光扫描显微技术结合,对亚细胞结构进行成像,几乎只用于细胞形态学变化研究。电子显微镜在生物成像中的应用也十分广泛,具有纳米尺度的分辨率,可同时表征细胞/细菌超微结构,比光学显微镜能够提供更多细节,在生物形态学研究中有较大的优势,但其制样要求较高,实现芯片上原位检测有一定的难度[54]。
2.2 电化学检测法
跨 上 皮/内 皮 细 胞 电 阻 (trans-epithelial electrical resistance,TEER)常用于评估体外模型中单层细胞紧密连接完整性及细胞屏障受损状况,是实时检测细胞-细菌相互作用的重要指标。芯片上TEER电化学测量方法要求细胞生长在多孔半透膜上,通过测量整张膜上的电阻或测量广泛频率范围内的阻抗来量化细胞屏障[55-56]。
2.2.1 电阻分析法
在基于电阻的TEER 测量系统中,采用标准STX2 电极,电极对的每根棒包含1 个用于测量电压的Ag/AgCl电极和1个用于通过电流的Ag电极,测量电阻时常以12.5 Hz,恒定的10 μA 交流电流进行[57]。芯片上TEER 测量非常适合实时监测上皮/内皮细胞屏障完整性如何受刺激的影响。Eain等[58]设计了细胞-微生物串扰的微流控模型(图4a),使用聚碳酸酯多孔膜作为细胞/细菌生长的载体,在膜两侧插入STX2电极,成功监测了上皮细胞的生长情况,反映细胞的屏障功能。Shin 等[59]使用该技术,发现肠道厌氧性共生细菌在低氧时显著增强细胞的屏障功能;当致病菌侵袭上皮细胞时,TEER值持续下降,表明致病菌对细胞屏障完整性具有破坏性[50,60]。由于两探针测量系统的电极与细胞的接触面积有限,易引起跨膜的电流分布不均匀,因此,研究者通过增加电极数量,提高细胞与电极的接触面积[61]。Booth 等[62]通过在膜两侧设计并行的两个AgCl 薄膜电极对,形成了一个四点探针的电极结构(图4b),增大了与细胞的接触面积,不仅能够促进离子流的均匀分布,消除接触和引线电阻的影响,还能提高检测灵敏度。

Fig. 4 Cell-bacterial interactions detected by resistance analysis图4 电阻分析法检测细胞-细菌相互作用过程
2.2.2 阻抗分析法
阻抗分析法将微电极集成到芯片上,当细胞附着、扩散或脱离电极时,会阻碍细胞-电极界面之间的电流交换,通过测量该界面的电流阻抗监测细胞行为[63]。
Brown 等[64]在芯片上集成了叉指微电极阵列(interdigital microelectrode array,IMA),发现脂多糖(LPS,lipopolysaccharide)导致肠道细胞屏障的TEER 值显著下降,益生菌治疗后,TEER值在3 d 后逐渐恢复,表明益生菌可有效治疗细菌感染(图5a)。Jeon等[65]在肠芯片底部集成了金微电极阵列(multi-electrode array,MEA),考察了血脑系统TEER值随LPS剂量和相互作用时间的变化规律,按照图5b 的等效电路拟合分析[66],发现LPS感染的前6 h,TEER值随LPS呈剂量依赖性方式降低,感染24 h 后,TEER值随LPS 呈剂量依赖性增加,表明LPS对血脑屏障的破坏并非不可逆,随着感染时间的增加,血脑屏障功能能够得到部分恢复。本课题组利用阻抗分析法研究了细胞表面聚糖和细菌的相互作用关系,对研究细菌黏附细胞、细菌与细胞之间的选择性识别具有参考意义[67-68]。

Fig. 5 Cell-bacterial interactions detected by electrochemical impedance spectroscopy图5 阻抗分析法检测细胞-细菌相互作用过程
电阻分析法和阻抗分析法可实时、非标记、原位监测细胞的屏障,具有快速分析、选择性好等优点。集成微电极的传感芯片可消除电极-介质界面电阻对阻抗计算的影响,缩短响应时间,提高检测灵敏度。总之,在芯片上集成电化学检测模块,为细胞-细菌相互作用研究提供了多样化的分析测试平台。
3 结论与展望
综上所述,微流控平台与光电检测技术结合,显示出高灵敏度、高分辨率、并行性和操作方便快捷的特点,其核心优势体现在可视化和动态监测细胞/细菌。光学显微技术用于成像观测,提供细胞/细菌形态学信息,与光谱技术结合,能够提供生化过程的分子信息。但是这些光学检测模型都属于“芯片外”检测策略,微流控芯片应在优化芯片结构的基础上,考虑与光纤传感器[69]、微透镜阵列[70]等小型化的光学传感模块高度集成。电化学检测技术多用于动态监测细胞屏障,芯片上集成微电极增加了检测设备的便携性,但其提供的信息是有限的。近年来,核磁共振仪[71]、液相色谱仪[72]、质谱仪[73]和流式细胞仪[74]等与芯片的结合发展迅速,可在芯片上进行多组学联合分析,提供细胞-细菌相互作用过程中基因、核糖核酸、代谢物、蛋白质组学分析及细胞/细菌结构相关信息[75],相信与光电检测技术结合,能够获取细胞-细菌相互作用过程中更整体、全面的信息,解析更深层次的细胞-细菌相互作用机制。

