基于微生物互作的新天然产物发掘研究进展
冉火苗,尹文兵
(中国科学院微生物研究所,真菌学国家重点实验室,北京 100101)
天然产物是一类由动植物和微生物等生物体代谢所产生的小分子化合物。结构的复杂性和多样性赋予许多天然产物强大的生物活性,使它们成为药物和药物先导化合物开发的巨大宝库[1]。1981—2019 年,共有约1 881 种具有治疗效果的小分子药物被批准上市,其中46%来源于未经修饰的天然产物或其衍生物[2]。微生物是生命世界的第一大类群,具有丰富多样的生物资源,一直被认为是活性新药的重要来源。在已知结构的160 000 种天然产物中,约50%来自微生物,其中约25%是具有生物活性的小分子,包括抗生素、抗肿瘤药物、免疫抑制剂、酶抑制剂和生物除草剂等,涉及人类生活的方方面面[3]。然而,由于环境污染、人口增长和病原微生物耐药性增强等原因,人们对药物产量及数量的需求越来越高,传统的天然药物获得方式已不能满足需求。因此,如何有效地挖掘微生物中新颖的活性分子已成为当今全球天然药物学家所面临的巨大机遇和挑战。
随着基因组测序技术和生物信息学的不断发展,越来越多的微生物基因组信息得到解析,科学家发现微生物中蕴含着大量负责天然产物(次级代谢产物)生物合成的基因簇,且该数量远远大于目前鉴定的化合物结构类型数量[4],表明在标准实验室条件下,微生物中的生物合成基因簇大多处于沉默状态,具有巨大的开发潜力。对此,研究人员做出了诸多尝试来激活沉默基因簇,包括利用遗传操作调控基因的表达、定向改造合成途径、异源表达特定基因簇等[5]。例如,通过敲除植物内生菌无花果拟盘多毛孢(Pestalotiopsis fici)中具有组蛋白修饰功能的表观遗传因子组蛋白H3 赖氨酸4 甲基转移酶(histone H3 lysine 4 methyltransferase)CclA 和组蛋白去乙酰化酶(histone deacetylase)HdaA,激活了一系列聚酮类次级代谢产物,包括15 个新结构[6];通过定向改造抗真菌药物卡泊芬净生物合成途径中的修饰基因,得到多个卡泊芬净衍生物,其中pneumocandins F 和G 展现出对念珠菌属和烟曲霉(Aspergillus fumigatus)的强抑制活性[7];利用启动子工程改造,在模式真菌构巢曲霉(Aspergillus nidulans)中建立高通量基因表达筛选平台,成功激活A. fumigatus中环四肽合成基因,鉴定出2 个新颖的潜在毒力因子fumiganins A 和B[8]。然而,以上策略均面临不同程度的技术瓶颈,例如,转录调控策略只能针对特定基因簇;定向改造需要确切的生物合成途径信息;异源表达和启动子工程依赖于菌株的可遗传操作水平。这些短板极大地降低了沉默基因簇的激活效率。因此,科研工作者迫切需要新策略、新技术来激活沉默基因簇,诱导新颖的活性小分子的产生,最大限度地挖掘微生物的化学潜能。
值得注意的是,次级代谢产物不是微生物生长所必需的,而是其在生长发育后期产生的一系列具有生物活性的小分子化合物,包括抗生素、生物碱、毒素、色素和生长激素等[9]。它们通常被认为是不同微生物之间相互作用的介质。基于这一理论,在过去的十几年间,从生态学的角度出发,通过共培养策略,将2 个或多个微生物在同一条件下共同培养,来诱发单独培养状态下沉默的生物合成途径,成为活性天然产物挖掘的有效手段[10]。本文总结了近年来基于不同微生物互作体系挖掘新颖天然产物的最新研究进展,综述了共培养策略下微生物之间的相互作用机制、沉默基因簇的诱导激活机制和新兴方法技术,以期为相关研究提供理论参考,也为更好地应用共培养策略挖掘新颖天然产物奠定基础。
1 基于不同微生物互作体系的新颖活性天然产物挖掘
自然生态下,微生物从不单独存在,而是以群落的状态维持生态系统的功能和稳定[11]。群落成员长期的共同进化导致了微生物之间存在着共生、互生、协作、竞争、寄生或者捕食等相互作用[12]。共培养技术通过模拟自然生态环境,利用微生物之间的相互作用,使越来越多的活性天然产物得到表征和挖掘[13-14]。基于微生物不同的菌落构成和生态关系,当前共培养体系主要分为3 种类型:细菌-细菌共培养、真菌-细菌共培养以及真菌-真菌共培养[15]。
1.1 细菌-细菌共培养
细菌作为个体微小、繁衍速度快的单细胞生物,是微生物生态群落中数量最多的成员。独特的生存方式使得细菌能够产生大量具有生物活性的次级代谢产物,尤其是具有抗菌、抗癌活性的潜在药物先导分子[16]。细菌来源的广谱抗生素,例如氯霉素、四环素、万古霉素和伊维菌素等的发现和应用拯救了数千万的生命。随着对微生物生态学的深入研究,人们逐渐意识到抗生素可能是微生物为了保卫其资源或领地免受潜在入侵者的侵害而产生的“化学武器”[17],只有环境中的生存威胁足够大时才能够刺激细菌产生抗生素类的活性代谢产物[18]。基于这一假设,越来越多的研究人员开始探索细菌之间的相互作用,以此作为新型化合物发现的重要手段。
Bugni 课题组基于基因组学和代谢组学构建了海洋无脊椎动物来源的细菌共培养平台,通过培养液粗提物的抑菌测试,筛选出Micromonosporasp.和Rhodococcussp.共培养体系,并从中分离得到新的双硝基糖基化蒽环类化合物keyicin(1)[19-20]。该化合物对革兰阳性病原菌枯草芽孢杆菌和甲氧西林敏感的金黄色葡萄球菌具有显著的抑制活性[最低抑制浓度(minimum inhibitory concentration,MIC)分别为9.9 和2.5 µmol · L-1]。对keyicin 的药物作用机制研究发现,该化合物有别于常规的蒽环类药物,其并非通过损伤DNA 来发挥生物活性,从而避免了使用过程中可能产生的细胞毒性,可作为潜在的低毒高效的抗癌抗菌类药物,具有巨大的商业价值[20-21]。Maglangit 等[22]从土壤中分离鉴定出链霉菌Streptomycessp. MA37,基因组测序发现该菌中存在大量沉默基因簇,通过与革兰阳性菌Pseudomonassp.共培养,诱导并分离得到具有较强抗肿瘤活性的吲哚生物碱类化合物BE-13793C(2)。芽孢杆菌与链霉菌共培养时,能够激活链霉菌中含有聚酮合酶-非核糖体多肽合成酶的杂合基因簇,诱导产生一类具有抗肿瘤和抗增殖活性的大环肽类化合物dentigerumycin E 及其衍生物(3 ~ 5)[23]。Hifnawy 等[24]将2 株放线菌属细菌Micromonosporasp. UR56 和Actinokinesporasp. EG49 共培养,鉴定出一系列吩嗪衍生物(6 ~ 15),其中化合物6 ~ 8和15 表现出较强的抑菌能力和抗生物膜活性,以及较弱的细胞毒性。
值得一提的是,多项研究发现,肺冢村菌(Tsukamurella pulmonis)能够诱导不同细菌产生多种类型的抗生素,是一种极具潜力的共培养诱导菌株。例如,将T. pulmonisTP-B059 与肉桂链霉菌(Streptomyces cinnamoneus)NBRC 13823 共培养,能够诱导S. cinnamoneus产生具有抗肿瘤活性的吲哚生物碱arcyriaflavin E(16)[25];当其与链霉菌Streptomycessp. CJ-5 共培养时,得到具有独特γ-丁内酯骨架的潜在抗肿瘤活性化合物chojalactones A-C(17 ~ 19)[26];当共培养对象换成Streptomyces endusS522 之后,能够诱导产生具有罕见的2H-四氢-4,6-二氧代-1,2-嗪环系统(2H-tetrahydro-4,6-dioxo-1,2-oxazine ring system,TDOR)的抗细菌类化合物alchivemycins A(20)[27]和B(21)[28]。通过细菌-细菌共培养产生的新代谢产物结构式见图1。
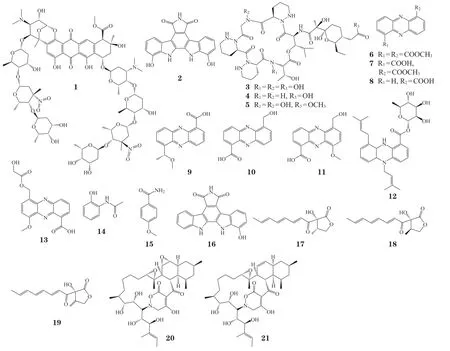
图1 细菌-细菌共培养诱导的新颖次级代谢产物Figure 1 Novel secondary metabolites isolated from bacteria-bacteria co-culture
1.2 真菌-细菌共培养
自然生态环境中,真菌与细菌之间的“跨界”互作也是微生物群落的常见组成形式。由于真菌和细菌不同的生殖方式和菌落形态,它们具有各自独特的养分获取途径和防御机制,并随着自身需求的变化,分泌活性分子,改变群落环境。例如黄色镰刀菌(Fusarium culmorum)通过释放挥发性有机物萜烯混合物来影响土壤栖息细菌Collimonas pratensisTer291 和Serraria plymuthicaPRI-2C 的集群运动能力,推测萜烯混合物在低浓度时能将互利细菌吸引到真菌周围,高浓度时则将有竞争关系的细菌驱除出生态群落[29]。大量研究表明,实验室条件下真菌与不同细菌之间的相互组合,能够引发多种沉默基因簇的表达以及新型次级代谢产物的产生(见图2)。
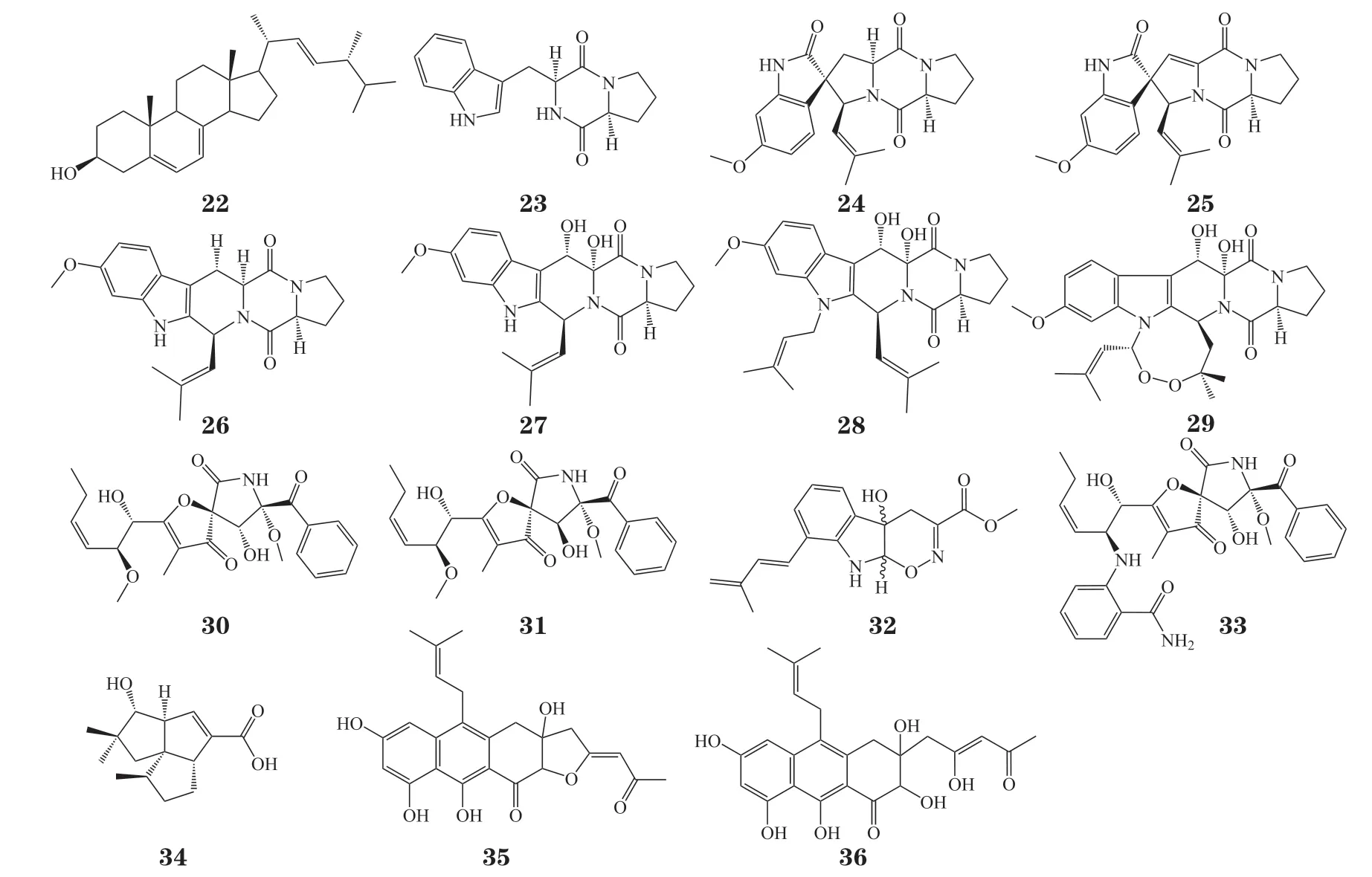
图2 真菌-细菌共培养诱导的新颖次级代谢产物Figure 2 Novel secondary metabolites isolated from fungus-bacteria co-culture
以A. fumigatus为例,A. fumigatus与链霉菌Streptomyces bullii共培养,能够诱导出10 种沉默次级代谢产物的表征,包括甾醇类化合物ergosterol(22);二酮哌嗪类化合物brevianamide F(23),spirotryprostatin A(24),spirotryprostatin B 及其衍生物(25 ~ 27),fumitremorgin B(28),verruculogen(29);螺环类化合物11-O-methylpseurotin A(30)及其异构体11-O-methylpseurotin A2(31)。活性筛选结果表明,除了化合物22,23 和30,其他化合物对原生动物均具有抑制活性。其中化合物28和29 在0.2 µmol · L-1的浓度下表现出对布氏锥虫的抑制活性,并且分别在3.1 和3.9 µmol · L-1的浓度下表现出对杜氏利什曼原虫的抑制活性,具有良好的应用前景[30]。Wakefield 等[31]利用2 株列文虎克链霉菌(Streptomyces leeuwenhoekii)C34 和C58 分别与A.fumigatus共培养,次级代谢图谱出现显著差异。相比于纯培养,S. leeuwenhoekiiC34 能够诱导A. fumigatus产生2 个新颖的非核糖体多肽类化合物luteoride D(32)和pseurotin G(33)以及已知化合物terezine D 和11-O-methylpseurotin A,菌株C58 则激活倍半萜类抗生素pentalenic acid(34)的产生。而雷帕菌素链霉菌(Streptomyces rapamycinicus)能够激活A.fumigatus的萜合酶合成基因簇(fccA),指导杂萜类化合物35 和36 的合成[32]。
1.3 真菌-真菌共培养
真菌几乎分布在地球上的每个生态环境中,有着非常丰富的物种多样性。真菌次级代谢产物具有化学结构新颖、生物活性多样和作用机制独特等特点,已成为除放线菌之外,微生物天然产物多样性挖掘的重要来源。统计数据显示,在过去的20 年中,新型真菌次级代谢产物的发现比例持续增加,迄今为止,约47%的微生物活性代谢产物为真菌来源[33],包括真菌毒素、抗生素和色素等各种类别。近年来,通过真菌-真菌之间的共培养,迫使微生物竞争环境资源,诱导独特的次级代谢产物合成,产生了许多具有抗细菌、抗真菌和抗肿瘤功能的活性天然产物(见图3)。
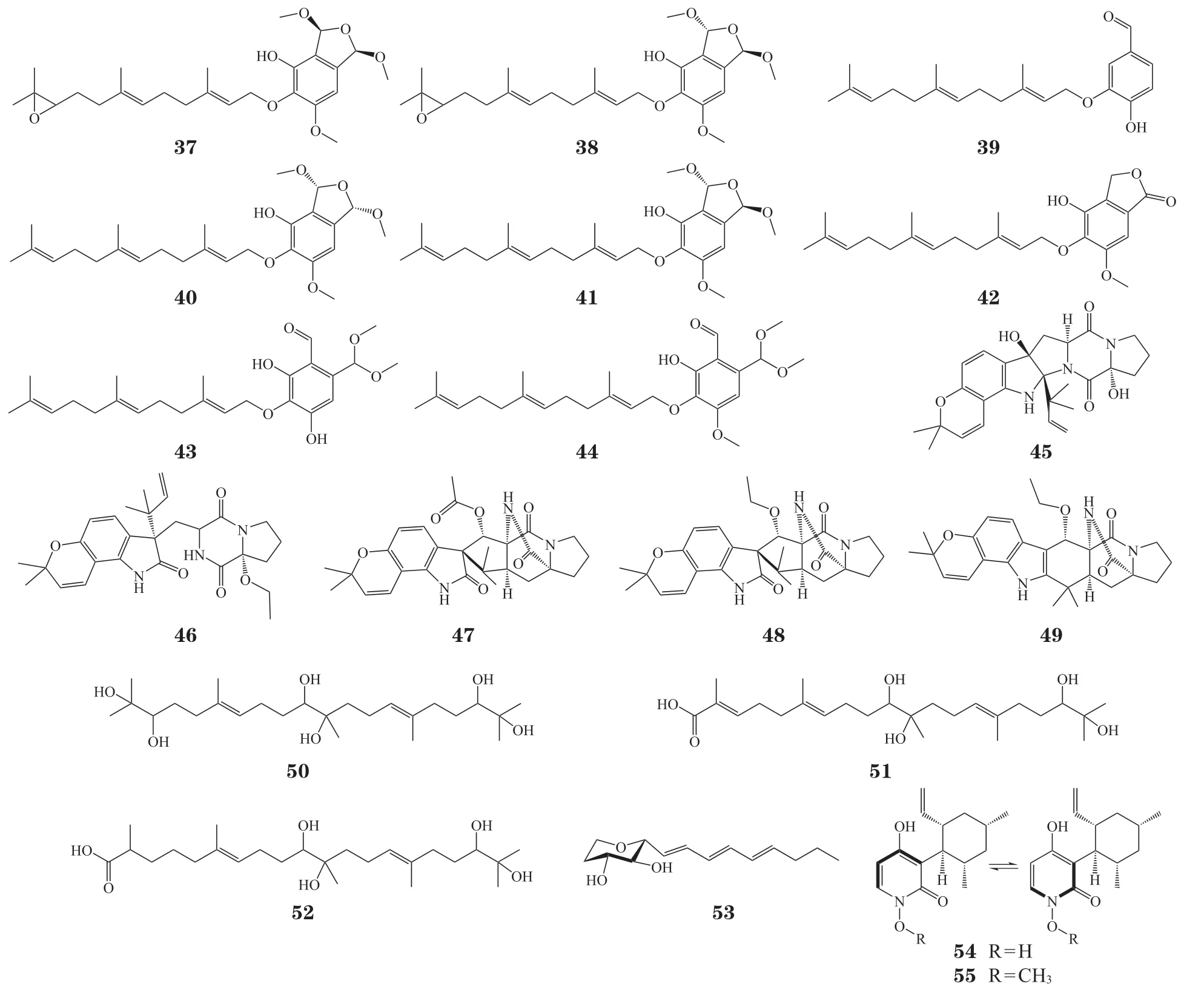
图3 真菌-真菌共培养诱导的新颖次级代谢产物Figure 3 Novel secondary metabolites isolated from fungus-fungus co-culture
笔者课题组以A. nidulans为“诱饵”,寻找环境中潜在的互作真菌,通过显著的孢子颜色变化,筛选出1 株附球属真菌石斛附球菌(Epicoccum dendrobii)。通过比较分析共培养前后A. nidulans的代谢组和转录组数据,发现E. dendrobii促使A.nidulans发生初级代谢以及次级代谢的全局性变化。通过分离纯化显著差异的化合物,共鉴定出2 个法尼基焦磷酸衍生物和12 个aspernidine 类衍生物,其中8 个聚酮合酶的产物(37 ~ 44)为新骨架。此外,将E. dendrobii与来自曲霉属、青霉属、木霉属和镰孢属的多株真菌共培养,发现E. dendrobii能够引起Aspergillus oryzae,Aspergillus terreus,Penicillium chrysogenum,Fusarium proliferatum和Trichoderma hypoxylon次级代谢产物的显著变化,表明E. dendrobii具有作为供体菌构建真菌-真菌共培养体系的巨大潜力[34]。
除了基于导向筛选的共培养体系,将来自同一/相似生态位(海洋、土壤、内生或附生环境)的多株真菌配对,也是有效的真菌-真菌共培养方法[14]。例如,Afiyatullov 等[35]从海洋真菌Aspergillus sulphureusKMM 4640 和Isaria felinaKMM 4639 的共培养物中分离出5 种新的异戊二烯化吲哚生物碱(45 ~ 49),其中化合物46 在10 µmol · L-1的浓度下表现出对人前列腺癌细胞22Rv1 的抑制活性。将从腐木上获得的2 株附生真菌Pleurotus ostreatus和Trametes robiniophilaMurr 共培养,能够产生3 个新的倍半萜类化合物postredienes A-C(50 ~ 52),均表现出抗真菌活性,其中postrediene A(50)对病原真菌新生隐球菌和白念珠菌表现出强抑制活性(MIC80分别为1 和2 mg · L-1),与临床药物氟康唑作用相当[36]。此外,Shang 等[37]将来自同一软体动物的2 株附生真菌Chaunopycnissp.和Trichoderma hamatum共培养,分离得到1 个罕见的2-烯基-四氢呋喃类化合物chaunopyran A(53),以及具有抗真菌活性的化合物pyridoxatin(54)及其甲基化衍生物methyl-pyridoxatin(55)。非常有趣的是,研究人员在马铃薯葡萄糖琼脂(potato dextrose agar,PDA)平板上培养这2 株真菌时,观察到了明显的生长抑制界面,通过对共培养后差异化合物产生菌的分析,作者推测Chaunopycnissp.为赢得生存优势激活了抗真菌化合物54 的生物合成,而作为响应,T. hamatum将化合物54 活性官能团甲基化,使其抗菌活性丧失,由此造成了化合物55的积累,这项研究揭示了真菌-真菌互作过程中分泌的活性小分子潜在的生物学功能。
2 微生物之间的相互作用机制
自然环境中微生物之间的生态关系非常复杂,存在着协同代谢、诱导代谢、竞争抑制、寄生捕食等多种类型,种内/种间的相互作用是推动微生物进化和维持群落生态稳定性的重要因素[38]。在共培养体系中,共享生存环境迫使微生物之间发生相互作用,并分泌具有生物活性的代谢产物,来识别其他物种并维持自身生存。这个过程涉及不同的作用机制,大致可以概括为3 类,包括:营养获取(provision of nutrients)、竞争和信号传递(competition and signaling)以及物理接触(physical contact)(见图4)[39]。对于微生物之间互作模式和机制的了解及研究,有助于高效建立共培养体系,有的放矢挖掘活性天然产物。
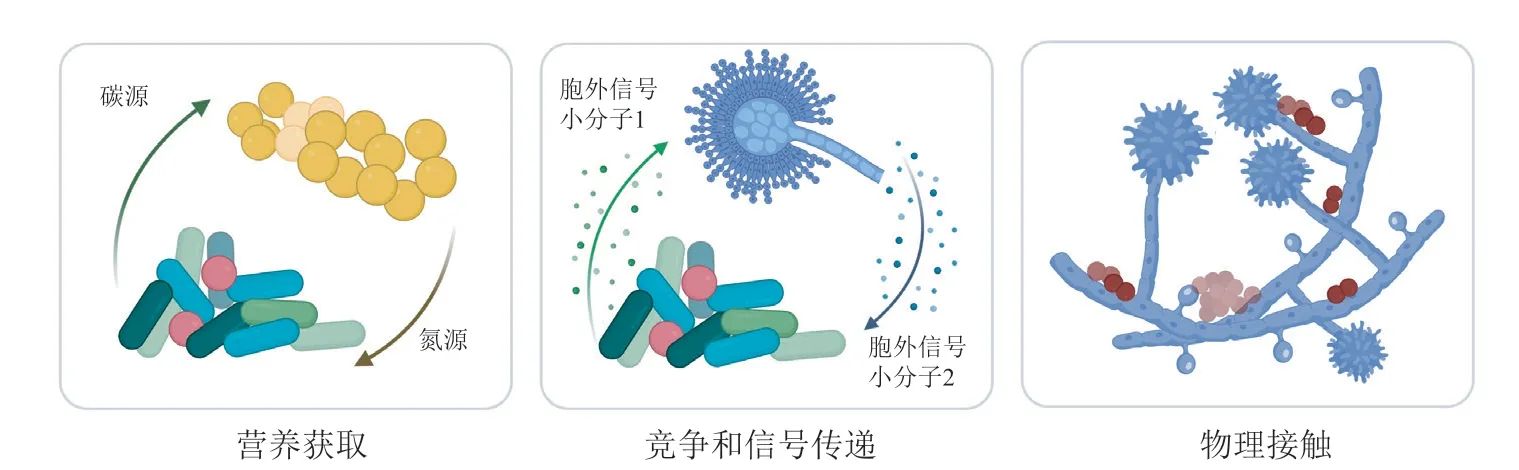
图4 微生物之间的相互作用机制[39]Figure 4 Mechanisms of interaction between microorganisms[39]
2.1 营养获取
在共培养体系中,面对有限的生存资源,菌落间有时会选择通力协作,相互提供营养物质。Bryant 等[40]首先提出了“Methanobacillus omelianskii”共生体的概念,他们发现早期分离鉴定的M. omelianskii其实是产乙酸菌与产甲烷菌的共培养物,在这一共培养体系中,产乙酸菌能够将乙醇转化为乙酸盐和氢气,产甲烷菌则能够利用氢气将二氧化碳还原为甲烷,为二者的生存提供基本的碳源。随后,人们陆续发现这种互惠共生的关系在微生物群落中普遍存在。例如,在厌氧条件下,沼泽红假单胞菌(Rhodopseudomonas palustris)会选择与大肠埃希菌(Escherichia coli)相互合作维持生存。E. coli在厌氧环境中会分解葡萄糖并产生有机酸,这种葡萄糖代谢产物为R. palustris提供了碳源;作为交换,R. palustris 产生NH4+,为E. coli提供必要的氮源[41]。在工业上混合发酵黏红酵母(Rhodotorula glutinis)和卡氏德巴利酵母(Debaryomyces castellii)时检测到多种类胡萝卜素的积累,仅R. glutinis存在时则产量极低。通过监测培养过程中的糖含量,推测其原因是D. castellii将培养基中的低聚糖水解为麦芽糖和葡萄糖,为R. glutinis合成类胡萝卜素提供能源;而当缺少共培养菌株时,R. glutinis由于缺乏基础营养,无法合成活性代谢产物[42]。除了以上提到的基础营养代谢物的交换,铁和铜等作为机体生存所必备的金属辅因子,也是菌株间相互作用的基础之一[43]。D'Onofrio 等[44]发现,藤黄微球菌(Micrococcus luteus)KLE1011 能够产生酰基-去铁胺铁载体,该铁载体能够作为辅助生长因子,使得多株无法培养的海洋来源的细菌生长,为不可培养微生物的挖掘和研究提供了新的思路。
2.2 竞争与信号传递
然而多数情况下,微生物是“自私”的,为了最大限度地获取有限的生存资源,往往会产生相互竞争。Lee 等[45]发现在铁源限制的共培养体系中,黄色黏球菌(Myxococcus xanthus)和天蓝色链霉菌(Streptomyces coelicolor)分别能够产生大量的铁载体myxochelin 和抗生素actinorhodin,表明M.xanthus为了抢占培养基中的铁元素,生产过量的铁载体myxochelin 来螯合铁离子以供自身生长发育,S. coelicolor则分泌抗生素actinorhodin 来减少体系中M. xanthus的生物量以维持自身的生态优势。真菌体系中也发现了类似的互作模式,A. fumigatus能够分泌异腈类化合物xanthocillin,具有铜结合活性,当环境中的铜元素含量过低时,A. fumigatus能够上调表达xanthocillin 生物合成基因簇,夺取环境中的铜元素,抑制其他微生物的生长[46]。
除了营养元素的争夺之外,微生物也进化出独特的交流方式,以胞外信号小分子(small extracellular signalling molecules,SSMs)实现种内、种间以及跨界的信号通讯,在微生物竞争或合作中发挥着重要作用[47]。例如,菌根促生链霉菌(Streptomyces)strain AcH 505 在与菌根促生真菌共培养时,产生促真菌生长因子auxofuran,辅助根系共生真菌的生长;当其与植物病原菌共培养时,则产生抗真菌类抗生素WS-5995 B 和C,抑制植物致病真菌的生长[48]。为了使这些小分子充当信号工具,它们必须能够从生产菌中扩散出来,与受体菌相互作用,从而引起响应,并且能以浓度依赖型的方式影响生产菌和受体菌[49]。基于不同的生存环境,微生物配备了不同类型的信号小分子,包括具有抑制活性的抗生素[50]、亲脂性的挥发性有机化合物[51]和自动诱导剂群体感应分子[52]。为了实现防御或交流的目标,微生物互作过程中产生的这些SSMs 往往是具有显著生物活性的代谢产物。抗生素和群体感应因子可作为潜在的药物先导化合物,挥发性有机物是一类化学结构多样的亲脂性分子且大多具有生物防治活性[47]。竞争与信号传递是微生物之间最为通用和常见的相互作用机制,由此产生的活性次级代谢产物是新型天然产物的重要来源。
2.3 物理接触
另外一种常见的微生物互作模式被归纳为直接的物理接触。在某些微生物共培养体系中,相互作用的微生物必须通过细胞与细胞之间的直接接触,才能够激活沉默的次级代谢产物基因簇。例如,在海洋真菌Libertellasp.与海洋变形杆菌α-proteobacterium CNJ-328 共培养的过程中,发现了一系列具有抗癌活性的二萜类化合物libertellenones A-D。研究人员将α-proteobacterium 的培养上清液或乙酸乙酯提取物加入Libertellasp.中,均无法诱导libertellenones 的产生,由此推测在这一共培养体系中,菌株间的物理接触是必要的[53]。Abe 教授课题组研究发现,病原细菌T. pulmonisTP-B0596 能够诱导变铅青链霉菌(Streptomyces lividans)TK-23产生色素类抗生素,扫描电子显微镜观察发现,共培养时S. lividansTK-23 将菌丝体缠绕在T. pulmonisTP-B0596 菌体表面,且只有T. pulmonisTP-B0596活细胞具有诱导效应,证明了共培养时S. lividansTK-23 通过物理接触识别T. pulmonisTP-B0596,并分泌抗生素作为响应[54]。
无距离的直接接触能够使微生物之间近距离地交换信息,是非常高效的交流方式。细菌能够通过细胞间的物理接触,将自身嵌入到胞外基质中,形成结构化群落,即生物膜,来抵抗环境中的不利因素[55]。真菌的菌丝或细胞同样也会发生相互缠绕或嵌入菌体内部,进行细胞间信号传导、代谢物交换和营养竞争[56]。在真菌-细菌相互作用中,真菌往往充当细菌的生物支架,细菌附着在真菌表面或深入菌丝内部,来实现菌落间的信号传递和代谢响应[13]。这些动态相互作用与微生物扩散、养分获取和抗生素抗性有关,且影响微生物的生长发育和次级代谢产物形成。
3 微生物共培养激活沉默基因簇的分子机制
尽管大量实验证明微生物之间的营养交换、信号通讯以及物理接触能够诱发沉默基因的激活,但互作之后引发调控激活的分子机制仍然缺乏理论基础研究。微生物,尤其是真菌中,次级代谢产物合成受到非常严格的监管,以确保仅在需要时产生有效的活性分子。即使激活单个沉默基因簇也需要精细的调控网络,涉及多个层面的调控,包括全局性调控、表观遗传调控和途径特异性转录调控等[57-58]。微生物相互作用的模式多种多样,其激活沉默基因簇的机制也十分复杂。以下列举了目前具有代表性的几种诱导调控机制,以期能为后续的研究提供思路。
3.1 全局性调控
真菌对于相互作用后的响应通常依赖于全局性调控因子,它们能够促使真菌改变自身的生长发育状态或次级代谢基因的表达,从而对外界刺激给予应答[59]。笔者课题组在对A. nidulans和植物内生真菌E. dendrobii互作的研究中发现,A. nidulans中部分功能缺失的VeA1 蛋白(缺失了VeA 的前36 个氨基酸)是诱发共培养后沉默基因簇激活的关键调控因子[34]。转录组学和代谢组学分析表明,共培养后A. nidulans中有15.4%的基因被显著上调,19%被显著下调,22 个次级代谢产物产量显著提高,包括一系列新颖的聚酮类aspernidines 衍生物,呈现全局性次级代谢变化。分析转录组数据并结合基因敲除和回补实验,发现A. nidulans中部分功能缺失的VeA1 蛋白并非无功能的偶发突变产物,而是作为响应微生物互作的关键元件,与全局性调控因子Velvet 复合体中的LaeA 和VelB 协同参与次级代谢基因的转录调控。对调控网络下游可能涉及的途径特异性转录因子进行基因显著差异表达分析,结合遗传学实验,证明了Zn(II)2Cys6型转录因子SclB的调控功能,影响aspernidines 等多个生物合成基因簇的表达。研究揭示了真菌中由VeA1 介导,通过LaeA-VeA1-VelB 复合体,再经由下游转录因子SclB 的复杂响应调控网络(见图5)。同时,这一调控网络也在A. fumigatus中得到了验证[34]。目前,笔者课题组对E. dendrobii在互作后产生的SSMs 以及其到达A. nidulans后的响应受体和相关信号转导机制的研究工作正在进行中,期待能够对真菌-真菌互作后诱导激活机制进行系统性解析。
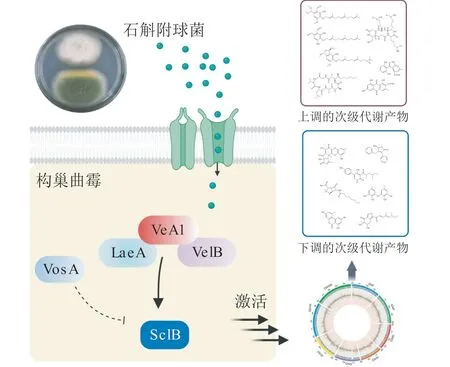
图5 构巢曲霉和石斛附球菌互作调控模式图[34]Figure 5 Regulatory network during interaction between Aspergillus nidulans and Epicoccum dendrobii[34]
3.2 表观遗传调控
与全局性调控类似,表观遗传调控也是真菌响应环境变化的有效手段,通过影响次级代谢产物生物合成基因簇的转录来实现对代谢产物的调控,包括染色质重塑、DNA 甲基化和组蛋白翻译后修饰等[60]。Brakhage 和Hertweck 课题组关注真菌-细菌物理接触后所引发的调控机制,揭示了S. rapamycinicus和A. nidulans之间通过细胞接触导致组蛋白翻译后修饰,从而激活沉默基因簇的分子机制(见图6)。最初,Schroeckh 等[61]将A.nidulans与58 种土壤放线菌共培养,筛选出1 株链霉菌S. rapamycinicus,该菌能够激活A. nidulans中负责聚酮类化合物orsellinic acid 合成的ors基因簇的表达。扫描电镜结果显示,ors簇的诱导表达依赖于链霉菌和真菌菌丝之间紧密的物理相互作用。通过基因敲除实验、染色质免疫沉淀测序技术(chromatin immunoprecipitation sequencing,Chipseq)结合实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测,证明链霉菌能够使Saga/Ada 复合体对染色质的组蛋白进行乙酰化修饰,从而引发表观遗传调控[62-63]。利用Chip-seq 分析和基因敲除验证,发现Myb-like类型转录因子BasR 是连接组蛋白修饰和次级代谢产物激活的关键调控节点,不仅参与调控ors基因簇的激活,也参与到dba,cic,mic和eas等多个基因簇的调控[64]。这项研究表明,物理接触能够引发A. nidulans的表观遗传调控,通过组蛋白乙酰化,激活或抑制真菌次级代谢生物合成基因簇的表达。
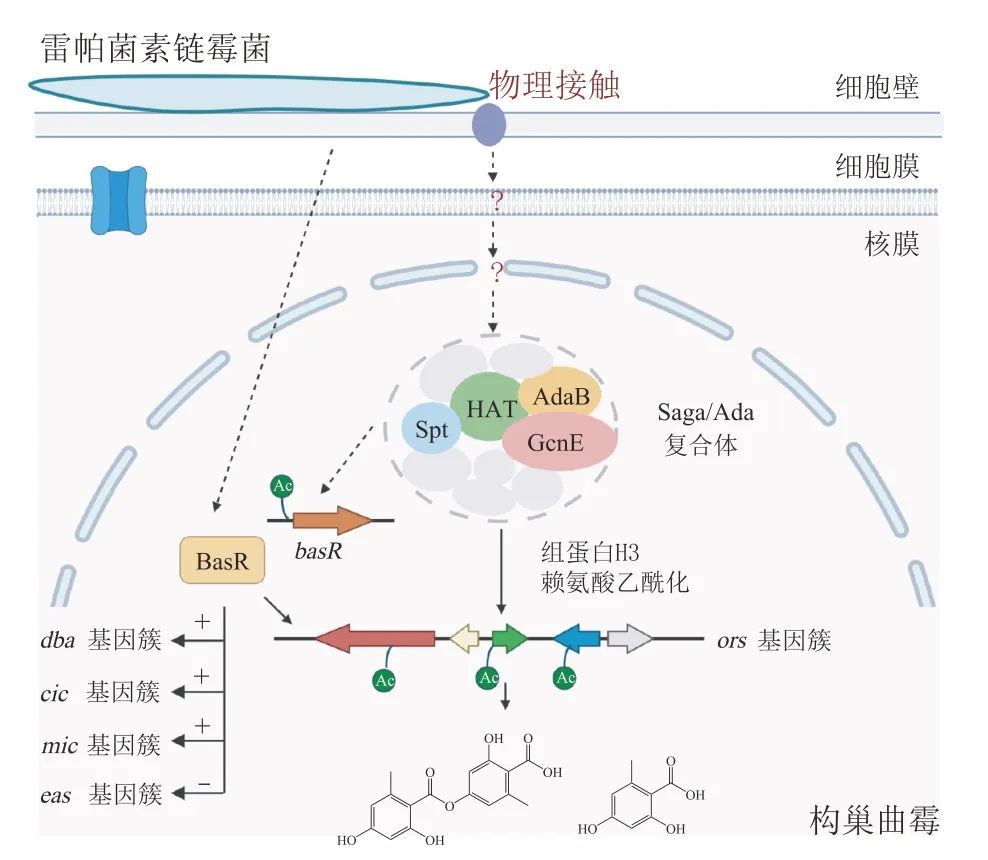
图6 构巢曲霉和雷帕菌素链霉菌互作调控模式图[62-63]Figure 6 Regulatory network during interaction between Aspergillus nidulans and Streptomyces rapamycinicus[62-63]
3.3 基因水平转移
细菌能够通过基因水平转移获得新的DNA,使其在与宿主的相互作用中获得竞争优势[65]。这样的现象也同样会发生在细菌与微生物的相互作用中。Sinskey 课题组在对缠绕红球菌(Rhodococcus fascians)307 和稠李链霉菌(Streptomyces padanus)共培养体系研究过程中发现,基因水平转移在共培养激活沉默基因簇机制中也起着重要作用(见图7)[66-67]。共培养能够诱导R. fascians307 产生新型氨基糖苷类抗生素rhodostreptomycins A 和B,对革兰阳性和阴性细菌具有广谱抗菌活性[66]。然而R. fascians307 本身并非抗生素产生菌,通过脉冲场凝胶电泳和免疫共沉淀分析,发现共培养后R. fascians307 中含有来自其互作菌株S. padanus的巨型质粒DNA,这个异源的DNA 片段与新型抗生素的产生有着直接的关联[67]。尽管基因水平转移和抗生素产生的详细机制尚未阐明,但通过基因水平转移,将原本沉默的基因簇异源转移到可表达宿主中,获得新颖次级代谢产物,可能是微生物互作产生新颖天然产物的重要手段。
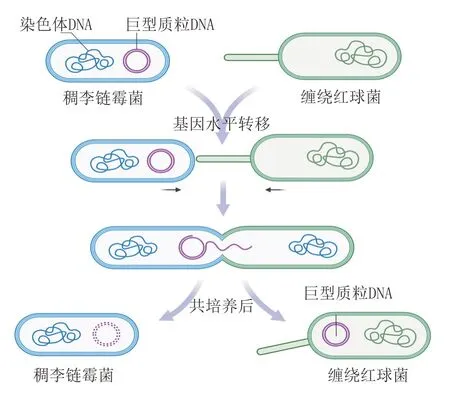
图7 缠绕红球菌和稠李链霉菌互作调控模式图Figure 7 Regulatory network during interaction between Rhodococcus fascians and Streptomyces padanus
4 新兴的微生物共培养技术
微生物共培养的目标之一就是排除与单独培养时相重叠的化合物,筛选新颖的次级代谢产物。获益于近代色谱技术的快速发展,越来越多高通量、高灵敏度以及高分辨率的培养和分析方法被应用到共培养策略中,实现复杂培养条件或者混合样品中代谢产物成分的精准检测[68-69]。
4.1 微流体共培养平台
微流体(microfluidic)共培养平台是新兴的共培养方法,其可采用微小体积液体培养的方法,在有限的空间内隔离出大量腔室,允许相邻的腔室对不同的微生物进行空间分离,通过连接纳米通道促进代谢产物的充分交流,并可利用电子显微镜实时监控细胞的生长状态[70]。该系统可通过实验装置最小化来实现高通量的共培养条件筛选,已经被广泛应用于微生物共培养研究中。
4.2 微流体液滴培养平台
微流体液滴(microfluidic droplet)培养平台以微流体液滴作为纳米级的生物反应器来培养微生物,能够实现“不可培养微生物”群落的构建[71]。该系统结合了微流体和膜扩散技术,被培养的群落之间可以通过可渗透的腔室实现生长因子和信号分子的转移,具有极大的应用潜力。
4.3 高分辨质谱成像技术
最新的高分辨质谱成像技术已经能够实现在微量样品或无需样品制备的情况下直接进行成分检测,实现次级代谢检测中特定微生物区域的总质谱分析[72]。例如,基质辅助激光解吸电离质谱成像(matrix-assisted laser desorption/ionization-mass spectrometry imaging,MALDI-MSI)和激光解吸后电离质谱成像(laser desorption postionization mass spectrometry imaging,LDPI-MSI)允许直接电离分析固体培养基上的真菌或细菌菌株的代谢物,实现指定区域的质谱成像,定位共培养体系中被激活的次级代谢产物的产生菌以及产生位置[73-74]。纳米喷雾解吸电喷雾电离质谱成像(nanospray desorption electrospray ionization mass spectrometry imaging,nano-DESI-MSI)同样无需样品制备,且能够更加精确地对相对分子质量较小的次级代谢产物进行分析[75],结合代谢分子网络绘制,能够直观反映出样本的不同来源,评估代谢产物之间的结构相似性[76]。
5 结语与展望
微生物次级代谢产物的产生得益于其群落为主的生存方式,不断变换的生存环境和物种间的相互作用促使微生物不断分泌功能性分子来确保自身的生存优势。近年来,随着科学家对次级代谢产物合成机制的积极研究和深入了解,微生物共培养策略逐渐被人们所重视。通过2 种或2 种以上微生物的混合培养,聚酮类、非核糖体多肽类、萜烯类和生物碱等多种类型的化合物得到分离鉴定,为创新药物的开发和利用提供了巨大的资源库。
然而这一极具前景的研究领域仍然面临着诸多挑战。首先,对于微生物共培养体系中互作菌株的筛选和组合仍是倾向随机的过程,需要大量的前期筛选工作,造成沉默基因激活的不确定性;其次,微生物之间的相互作用复杂多变,容易受到培养条件的影响,导致代谢产物变化的不稳定性;最后,相互作用时微生物用来响应的活性分子往往是微量的,造成了识别和检测上的困难。这些因素极大地限制了新型天然产物的挖掘和利用。究其根本,微生物互作所引发的次级代谢产物的产生机制研究缺乏理论基础,导致共培养微生物的随机组合,降低了沉默基因簇的激活效率。因此,未来研究亟需从分子机制入手,了解微生物互作后的作用模式,鉴定涉及的信号分子、关键响应受体以及相关信号转导通路;阐明共培养后激活沉默基因簇的转录调控网络;解析隐秘次级代谢产物的生物合成途径。除此之外,还需要结合微生物组学、基因组学、转录组学和代谢组学等多组学技术以及高通量、高精度的分析方法,实现差异化合物的精准快速检测。综上所述,加强生物、遗传、化学等多学科交叉融合,深入探索微生物相互作用的分子机制,将有利于深入了解和应用共培养挖掘新颖天然产物策略。相信随着科学技术的迭代更新,更多高效便捷的新方法、新技术将被应用于微生物共培养的研究,推动这一领域的蓬勃发展。

