全身免疫炎症指数评估溃疡性结肠炎严重程度的价值
郑淑贤 孟品 闫静 赵文君 李晓宇 徐永红


[摘要] 目的 探讨全身免疫炎症指数(SII)评估溃疡性结肠炎(UC)严重程度的临床价值。
方法 收集224例UC病人和224例健康对照者,比较两组的性别、年龄、体质量指数(BMI)、血红蛋白(Hb)、血小板(PLT)、中性粒细胞(NEU)、淋巴细胞(LYM)、单核细胞(MONO)、中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)、淋巴细胞与单核细胞比值(LMR)、SII的差异。根据改良Truelove和Witts评分(TWC)、Mayo内镜评分(MES)、溃疡性结肠炎肠道炎症负担程度(DUBLIN)、溃疡性结肠炎内镜下严重程度指数(UCEIS)评价UC活动性及严重程度,根据蒙特利尔分型评估肠道受累范围。分析SII、NLR、PLR、LMR与UC严重程度、病变范围的相关性,通过接受者操作特征曲线(ROC曲线)和多因素回归分析评估SII、NLR、PLR、LMR预测活动性UC的诊断效率。
结果 与对照组相比,UC组SII、NLR、PLR明显升高,LMR明显降低,差异均有统计学意义(Z=-12.47~-9.75,P<0.01)。UC組SII与TWC、MES、DUBLIN、UCEIS评分呈正相关(r=0.494~0.633,P<0.001),且不同严重程度分组间差异有统计学意义(Z=-7.12~-2.81,P<0.01),与蒙特利尔分型无相关性(r=0.007,P>0.05)。ROC曲线分析显示,SII的ROC曲线下面积(AUC=0.84)、NLR(AUC=0.78)、PLR(AUC=0.79)、LMR(AUC=0.74)对UC严重程度有预测价值(P<0.01)。多因素Logistic分析显示,SII是中重度UC的显著独立预测危险因素(OR=1.002,95%CI=1.001~1.003,P<0.05)。低体质量、正常体质量、体质量超标组间SII差异有统计学意义(Z=-9.10~-3.01,P<0.05)。
结论 SII是UC严重程度的独立危险因素, 其升高提示机体存在营养不良,可为评估UC严重程度提供临床依据。
[关键词] 结肠炎,溃疡性;全身炎症反应指数;内窥镜检查,胃肠道;疾病严重程度
[中图分类号] R574.62
[文献标志码] A
[文章编号] 2096-5532(2023)02-0183-06
doi:10.11712/jms.2096-5532.2023.59.066
[开放科学(资源服务)标识码(OSID)]
溃疡性结肠炎(UC)是一种慢性、非特异性的炎症性肠道疾病,可引起结肠持续的黏膜炎症。结肠镜在UC的诊断和病情评估中具有重要作用,其缺点为侵入性检查,存在病人无法耐受、穿孔、出血等风险。目前应用于UC疾病活动性评估的血清学指标主要包括C反应蛋白、红细胞沉降率、白细胞等,但易受感染和自身免疫性疾病的影响。有研究显示,中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)和淋巴细胞与单核细胞比值(LMR)有助于预测UC的活动性,但其灵敏度和特异度较低。全身免疫炎症指数(SII) 是血小板计数×中性粒细胞/淋巴细胞值,可以反映宿主的免疫和炎症平衡。有研究显示,SII升高与各种恶性实体瘤病人不良预后相关。目前SII与UC相关研究较少,本研究旨在探讨SII与UC疾病严重程度的相关性,为临床诊断提供依据。现将结果报告如下。
1 资料和方法
1.1 一般资料
2014年2月—2021年10月,收集就诊于我院且符合纳入标准的224例UC病人和224例健康查体者(对照组)作为研究对象。病人纳入标准:①根据2018年中华医学会消化病学分会炎症性肠病学组《炎症性肠病诊断与治疗的共识意见》诊断为UC;②一般临床资料及结肠镜图像资料齐全;③结肠镜检查前1周内血常规资料齐全。排除标准:①血液系统疾病、恶性肿瘤、高血压、冠心病、糖尿病、自身免疫性疾病和严重感染的病人;②严重肝肾功能不全者;③不能排除克罗恩病、肠结核或合并其他肠道疾病者;④临床资料不全者。本文研究经青岛大学附属医院医学伦理委员会批准。
1.2 检测指标及方法
采集病人的清晨空腹肘静脉血,检测血红蛋白(Hb)、血小板(PLT)、中性粒细胞(NEU)、淋巴细胞(LYM)、单核细胞(MONO),计算NLR、PLR、LMR、SII。
1.3 疾病严重程度分级标准
本文UC病人采用TRUELOV等疾病严重程度分型(TWC)标准分为轻、中、重度,根据蒙特利尔分型标准分为E1、E2和E3,根据梅奥内镜评分(MES)分为轻、中、重度。溃疡性结肠炎肠道炎症负担程度(DUBLIN)评分是结肠镜下炎症最严重肠段的MES与最大病变范围评分的乘积。溃疡性结肠炎内镜下严重程度指数(UCEIS)评分系统由血管纹理、出血与黏膜糜烂和溃疡组成。
1.4 统计学分析
采用SPSS 26.0软件进行统计分析。非正态分布的计量资料以M(P25~P75)表示,数据间比较采用秩和检验;计数资料比较采用χ2检验。通过接受者操作特征曲线(ROC曲线)和多因素回归分析评估SII、NLR、PLR、LMR预测活动性UC的诊断效率。以P<0.05为差异有显著性。
2 结果
2.1 UC组和对照组各指标比较
UC组和对照组平均年龄均为49.5岁,男女比分别为1∶0.85和1∶0.88,两组性别、年龄和身高差异无统计学意义(P>0.05)。与对照组相比,UC组的BMI、PLT、NEU、MONO、NLR、PLR、SII明显升高,体质量、Hb、LYM、LMR明显下降,差异均具有统计学意义(Z=-12.47~-5.92,P<0.01)。见表1。
2.2 UC组和对照组不同BMI间SII比较
根据中国人BMI标准分为低体质量(<18.5 kg/m2)、正常体质量(18.5~24.0 kg/m2)、体质量超标组(>24.0 kg/m2),UC组低体质量、正常体质量、体质量超标分别有38、114和72例,对照组分别有6、91和127例。与对照组相比较,UC组不同BMI病人SII水平明显升高,差异具有统计学意义(Z=-9.10~-3.01,P<0.01);对照组不同BMI间SII差异无统计学意义(P>0.05),UC组不同BMI间SII差异有统计学意义(H=18.33,P<0.05)。进一步两两比较,低体质量组、正常体质量组SII与体质量超标组间差异有统计学意义(Z=3.69、3.63,P<0.05)。见表2。
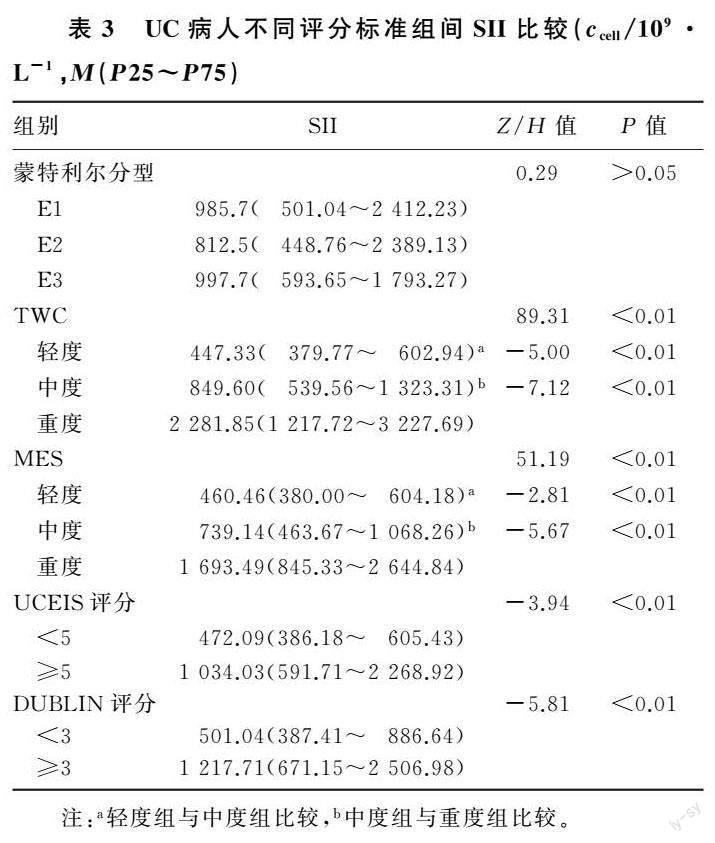
2.3 UC组不同评分标准间SII比较
E1、E2、E3组间SII差异无统计学意义(P>0.05),不同DUBLIN、UCEIS评分组间SII差异有统计学意义(Z=-3.94、-5.81,P<0.01)。TWC和MES轻、中、重度组间SII差异有统计学意义(Z=89.31、51.19,P<0.01),進一步两两比较发现,轻、中度组与重度组间SII差异有统计学意义(Z=-7.12~-2.81,P<0.01)。见表3。
2.4 UC病人SII、NLR、PLR、LMR与不同评分标准的相关性
TWC、MES、DUBLIN、UCEIS评分UC严重程度与NLR、PLR、SII呈正相关(r=0.494~0.633,P<0.001),而与LMR呈负相关(r=-0.391~-0.301,P<0.001)。SII、NLR、PLR、LMR与蒙特利尔分型之间无显著相关性(P>0.05)。见表4。
2.5 SII、NLR、PLR、LMR对不同评分标准中重度UC的预测价值
与MES、UCEIS、DUBLIN评分相比,TWC的ROC曲线下面积(AUC)最大,预测中重度UC价值最高。以TWC评定中重度UC为界值绘制ROC曲线,结果显示SII、NLR、PLR、LMR对中重度UC均具有预测价值(AUC=0.74~0.84,P<0.001),其中SII的AUC值(0.84)最大,预测价值相对较高,其最佳临界值为618.98×109/L,相应的灵敏度和特异度分别为78.57%和83.33%。见表5。
2.6 SII、NLR、PLR、LMR与UC严重程度的多因素分析
以TWC评定中重度UC为界值进行多因素分析显示,SII是中重度UC的独立危险因素(OR=1.002,95%CI=1.001~1.003,P<0.05),NLR、PLR、LMR不是中重度UC的独立危险因素(P>0.05)。见表6。
3 讨论
NEU、LYM、MONO、PLT在黏膜组织损伤的发病机制中起重要作用。在UC疾病进展中,无限制激活的NEU导致严重的组织损伤,抗凋亡蛋白A1的表达增加导致NEU延迟或减少凋亡,进而导致疾病慢性化。活动性UC病人的PLT数量明显高于缓解期UC病人和健康人群。PLT可以通过释放细胞因子和趋化因子参与炎症反应。相关研究表明,炎症性肠病病人的外周血和黏膜水平的LYM功能均不正常。浸润性LYM一般被认为是Th1细胞、Th17细胞和B细胞,它们产生能够激活肠道蛋白酶的促炎细胞因子,从而导致黏膜损伤。MONO计数在UC活动期会升高,且与疾病的严重程度相关。在炎症反应中,单核细胞通过释放促炎细胞因子、趋化因子被招募到炎症组织中。
NLR、PLR、LMR是基于NEU、PLT、LYM和MONO衍生的比值型炎症指标。相关研究发现,UC严重程度与NLR、PLR呈正相关,与LMR呈负相关,其中余静研究表明PLR对中重度UC的预测价值最高,CHEN等研究显示LMR对UC严重程度的预测价值优于NLR和PLR。本文研究发现,NLR、PLR、LMR与UC严重程度的相关性与上述文献结果一致,但PLR预测UC严重程度的价值高于NLR与LMR。NLR、PLR、LMR对UC严重程度预测价值尚存在争议,这可能与NLR、PLR、LMR易受感染和自身免疫性疾病的影响有关。
SII是血小板×中性粒细胞/淋巴细胞值,是评估宿主全身炎症和免疫应答之间平衡状态的客观标志。有研究显示,高水平SII是急性重症胰腺炎的诊断指标及独立危险因素。在肝癌、胃癌、结肠癌病人中,高水平SII与TNM分期相关,其增高可能促进肿瘤的增殖、进展和转移。目前关于SII与UC关系研究较少。MES是临床实践中广泛应用的内镜评分标准。DUBLIN评分通过MES与蒙特利尔疾病范围分型的乘积量化UC的炎症负担,UCEIS评分通过内镜下黏膜的血管模式、出血、糜烂和溃疡,详细地区分了内镜下黏膜病变的严重程度。ZHANG等研究发现,UC病人SII水平升高,与UCEIS、DUBLIN评分存在显著正相关。本文研究显示,UC病人与健康组间SII差异有显著性,SII与DUBLIN和UCEIS评分间存在正相关性,与ZHANG等研究结果一致。DUBLIN评分≥3分被定义为肠道高炎症负担,对于中重度UC的诊断具有最佳的灵敏度以及特异度。CORTE等研究显示,UCEIS评分≥5的UC病人需要药物及手术治疗,且随着病程延长,需药物或手术治疗的病人数明显多于UCEIS评分<5的病人。本文研究发现,DUBLIN评分≥3及UCEIS评分≥5与DUBLIN评分<3和UCEIS评分<5组比较SII水平显著升高,差异有统计学意义,表明SII可以作为评估UC病人内镜下疾病严重程度的可靠指标。ZHANG等研究发现,SII与MES无相关性。本研究结果显示SII与MES存在正相关,且MES轻、中、重度组间差异有统计学意义。本文结果与上述研究结果不一致,可能与ZHANG等研究病例数较少有关。蒙特利尔分型可以用来评估内镜下病变范围,有研究显示UC病人E1~E3组间SII差异有显著性。本研究结果显示,E1~E3组间SII差异无统计学意义,且SII与蒙特利尔分型之间无相关性,与XIE等研究结果不一致。原因可能与本研究中E1组病人样本量较小,也可能与蒙特利尔分型很难描述UC疾病严重程度有关。
TWC是包括每日排便次数、便血、脉率、体温、Hb和ESR的临床评分标准,目前没有TWC与SII相关性报道。本研究结果显示,UC病人的SII与TWC呈正相關,且轻、中、重度组间SII差异有统计学意义。表明SII不仅是评估UC内镜下严重程度的可靠指标,同时也是评估其临床严重程度的可靠指标。与MES、UCEIS、DUBLIN评分相比较,SII、NLR、PLR、LMR在TWC的AUC最大,表明应用TWC预测中重度UC价值最高。进一步以TWC为界值绘制ROC曲线,发现SII、NLR、PLR、LMR对中重度UC均具有预测价值,其中SII的AUC值最大,表明SII对中重度UC具有最高的预测价值。进一步对SII、NLR、PLR、LMR与UC严重程度关系进行多因素分析发现,SII是UC严重程度的独立危险因素。
BMI是反映机体营养状况的传统指标,20%~85%的UC病人BMI降低。XIE等研究结果显示,UC病人的SII水平越高,BMI数值越低,同时UC病人低体质量、正常体质量、体质量超标组间SII差异均有统计学意义。本文研究结果与其一致。UC病人SII水平越高,病人的肠道黏膜病变越重,越易导致机体的营养物质吸收障碍。
综上所述,SII、NLR、PLR、LMR可以预测UC严重程度,其中SII是最可靠的预测指标,具有较高的灵敏度和特异度。对于无法耐受肠镜检查的病人,SII是评价UC内镜下严重程度和临床严重程度的可靠指标,SII升高提示机体存在营养不良。
[参考文献]
MAGRO F, GIONCHETTI P, ELIAKIM R, et al. Third European evidence-based consensus on diagnosis and management of ulcerative colitis. part 1: definitions, diagnosis, extra-intestinal manifestations, pregnancy, cancer surveillance, surgery, and ileo-anal pouch disorders. Journal of Crohns & Colitis, 2017,11(6):649-670.
KOPYLOV U, BATTAT R, BENMASSAOUD A, et al. Hematologic indices as surrogate markers for monitoring thiopurine therapy in IBD. Digestive Diseases and Sciences, 2015,60(2):478-484.
SONOYAMA H, KAWASHIMA K, ISHIHARA S, et al. Capabilities of fecal calprotectin and blood biomarkers as surrogate endoscopic markers according to ulcerative colitis di-sease type. Journal of Clinical Biochemistry and Nutrition, 2019,64(3):265-270.
ACARTURK G, ACAY A, DEMIR K, et al. Neutrophil-to-lymphocyte ratio in inflammatory bowel disease-as a new predictor of disease severity. Bratislavske Lekarske Listy, 2015,116(4):213-217.
XU M Q, CEN M S, CHEN X L, et al. Correlation between serological biomarkers and disease activity in patients with inflammatory bowel disease. BioMed Research International, 2019, 2019:6517549.
卢加杰,李莉,木尼拉买买提,等. 溃疡性结肠炎患者中性粒细胞和淋巴细胞比值与疾病活动的相关性分析. 中国医师杂志, 2016,18(12):1837-1840.
HU B, YANG XR, XU Y, et al. Systemic immune-inflammation index predicts prognosis of patients after curative resection for hepatocellular carcinoma. Clin Cancer Res, 2014,20(23):6212-6222.
ZHANG Y, CHEN B, WANG L J, et al. Systemic immune-inflammation index is a promising noninvasive marker to predict survival of lung cancer: a meta-analysis. Medicine, 2019,98(3): e13788.
WANG K, DIAO F Y, YE Z J, et al. Prognostic value of systemic immune-inflammation index in patients with gastric cancer. Chinese Journal of Cancer, 2017,36(1):75.
FU H Y, ZHENG J, CAI J Y, et al. Systemic immune-inflammation index (SII) is useful to predict survival outcomes in patients after liver transplantation for hepatocellular carcinoma within Hangzhou criteria. Cellular Physiology and Biochemistry: International Journal of Experimental Cellular Physiology, Biochemistry, and Pharmacology, 2018,47(1):293-301.
中華医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2018年北京). 中华炎性肠病杂志(中英文), 2018,2(3):173-190.
TRUELOVE S C, WITTS L J. Cortisone in ulcerative colitis; final report on a therapeutic trial. British Medical Journal, 1955,2(4947):1041-1048.
SATSANGI J, SILVERBERG M S, VERMEIRE S, et al. The Montreal classification of inflammatory bowel disease: controversies, consensus, and implications. Gut, 2006,55(6):749-753.
SCHROEDER K W, TREMAINE W J, ILSTRUP D M. Coated oral 5-aminosalicylic acid therapy for mildly to moderately active ulcerative colitis. A randomized study. The New England Journal of Medicine, 1987,317(26):1625-1629.
MOHAMMED VASHIST N, SAMAAN M, MOSLI M H, et al. Endoscopic scoring indices for evaluation of disease activity in ulcerative colitis. The Cochrane Database of Systematic Reviews, 2018,1(1): CD011450.
DINALLO V, MARAFINI I, DI FUSCO D, et al. Neutrophil extracellular traps sustain inflammatory signals in ulcerative colitis. Journal of Crohns & Colitis, 2019,13(6):772-784.
WRA O, LANCELLOTTI P, OURY C. The dual role of neutrophils in inflammatory bowel diseases. Journal of Clinical Medicine, 2016,5(12):118.
KAPSORITAKIS A N, KOUKOURAKIS M I, SFIRIDAKI A, et al. Mean platelet volume: a useful marker of inflammatory bowel disease activity. The American Journal of Gastroenterology, 2001,96(3):776-781.
CHATTERJEE M, GEISLER T. Inflammatory contribution of platelets revisited: new players in the arena of inflammation. Seminars in Thrombosis and Hemostasis, 2016,42(3):205-214.
ROCHE J K, WATKINS M H, COOK S L. Inflammatory bowel disease: prevalence and level of activation of circulating T-lymphocyte subpopulations mediating suppressor/cytotoxic and helper function as defined by monoclonal antibodies. Clinical Immunology and Immunopathology, 1982,25(3):362-373.
GIUFFRIDA P, CORAZZA G R, DI SABATINO A. Old and new lymphocyte players in inflammatory bowel disease. Digestive Diseases and Sciences, 2018,63(2):277-288.
CHERFANE C E, GESSEL L, CIRILLO D, et al. Monocytosis and a low lymphocyte to monocyte ratio are effective biomarkers of ulcerative colitis disease activity. Inflammatory Bowel Diseases, 2015,21(8):1769-1775.
MACDONALD T T, MONTELEONE I, FANTINI M C, et al. Regulation of homeostasis and inflammation in the intestine. Gastroenterology, 2011,140(6):1768-1775.
余静. NLR、MLR、PLR与炎症性肠病活动性的相关性分析. 南昌:南昌大学, 2021.
CHEN Y H, WANG L, FENG S Y, et al. The relationship between C-reactive protein/albumin ratio and disease activity in patients with inflammatory bowel disease. Gastroentero-logy Research and Practice, 2020, 2020:3467419.
LIU X M, GUAN G X, CUI X Y, et al. Systemic immune-inflammation index (SII) can be an early indicator for predicting the severity of acute pancreatitis: a retrospective study. International Journal of General Medicine, 2021,14:9483-9489.
杭航,贾哲,朱佳丽,等. 全身免疫炎症指数在消化系统疾病中的研究进展. 新医学, 2022,53(6):400-403.
VUITTON L, PEYRIN-BIROULET L, COLOMBEL J F, et al. Defining endoscopic response and remission in ulcerative colitis clinical trials: an international consensus. Alimentary Pharmacology & Therapeutics, 2017,45(6):801-813.
ZHANG X F, LI P, DING X L, et al. Comparing the clinical application values of the Degree of Ulcerative Colitis Burden of Luminal Inflammation (DUBLIN) score and Ulcerative Colitis Endoscopic Index of Severity (UCEIS) in patients with ulcerative colitis. Gastroenterology Report, 2021,9(6):533-542.
ZHANG M H, WANG H, WANG H G, et al. Effective immune-inflammation index for ulcerative colitis and activity assessments. World Journal of Clinical Cases, 2021,9(2):334-343.
ROWAN C R, CULLEN G, MULCAHY H E, et al. DUBLIN score, a simple method to quantify inflammatory burden in ulcerative colitis. Journal of Crohns & Colitis, 2019,13(11):1365-1371.
SILVA J C, FERNANDES C, RODRIGUES J, et al. Endoscopic and histologic activity assessment considering disease extent and prediction of treatment failure in ulcerative colitis. Scandinavian Journal of Gastroenterology, 2020,55(10):1157-1162.
CORTE C, FERNANDOPULLE N, CATUNEANU A M, et al. Association between the ulcerative colitis endoscopic index of severity (UCEIS) and outcomes in acute severe ulcerative colitis. Journal of Crohns & Colitis, 2015,9(5):376-381.
XIE Y Y, ZHUANG T T, PING Y, et al. Elevated systemic immune inflammation index level is associated with disease activity in ulcerative colitis patients. Clinica Chimica Acta; International Journal of Clinical Chemistry, 2021,517:122-126.
YANG C H, CHEN X, DAI J, et al. The application of Montreal classification in inflammatory bowel disease. Zhonghua Nei Ke Za Zhi, 2008,47(1):7-10.
DA SILVA B C, LYRA A C, ROCHA R, et al. Epidemiology, demographic characteristics and prognostic predictors of ulcerative colitis. World Journal of Gastroenterology, 2014,20(28):9458-9467.
KAAZAN P, TAN Z, MAIYANI P, et al. Weight and BMI Patterns in a Biologicals-Treated IBD Cohort. Dig Dis Sci, 2022. doi:10.1007/s10620-022-07488-7.
(本文編辑 黄建乡)

