多靶点蛋白酪氨酸激酶抑制剂Ponatinib对人肝癌细胞SK-Hep-1增殖、黏附和迁移能力的影响
刘畅,裴晋红,穆秀丽,于保锋
1.长治医学院基础部生物化学与分子生物学教研室,山西 长治 046000;2.山西医科大学基础医学院生物化学与分子生物学教研室,山西 太原 030001
肝癌(hepatocellular carcinoma,HCC)发病率居全球癌症发病率第6 位,每年约100 万人罹患HCC,约60 万人死亡,致死率居全球癌症致死率第3 位[1-3]。HCC 的复发率和转移率均较高,患者术后5 年生存率仅为25%~50%[3]。研究表明,早期HCC患者术后平均生存期为5年,5年生存率为40%~70%,晚期患者术后平均生存期仅为10.7个月,5年生存率为10%~20%[3-4]。约90%的肿瘤患者死于复发和转移,因此,寻求可有效抑制HCC发生发展的药物是目前分子治疗领域的研究热点之一。
Ponatinib(AP24534)是一种用于口服的多靶点蛋白酪氨酸激酶抑制剂,能够抑制包括血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)、Src、血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)、肝配蛋白受体(ephrin receptor,EphR)和成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)在内约50 种蛋白酪氨酸激酶(protein tyrosine kinase,PTKs)的活性[5-6],美国食品药品监督管理局(Food and Drug Administration,FDA)已批准Ponatinib 用于治疗伊马替尼抗性的慢性粒细胞白血病[7-8]。Ponatinib能够抑制人脐静脉内皮细胞、结直肠癌细胞和肿瘤嗜酸性粒细胞的迁移[9-11],并能有效抑制人U87 恶性胶质母细胞瘤细胞、神经母细胞瘤细胞和子宫内膜癌细胞的侵袭和迁移[12-14]。另有研究表明,Ponatinib能够抑制乳腺癌肺转移(breast cancer lung metastasis,BCLM)[15]。目前,尚未见Ponatinib 对HCC 细胞间黏附和迁移影响的相关报道。因此,本研究通过MTT法、细胞缓慢聚集试验、细胞分离试验、划痕试验和Western blot法检测Ponatinib 对人肝癌细胞SK-Hep-1 增殖、黏附和迁移能力的影响,以期为Ponatinib 作为临床抗癌药物提供实验依据。
1 材料与方法
1.1 细胞 人肝癌细胞系SK-Hep-1购自中科院上海细胞库,且经短串联重复序列(short tandem repeat,STR)鉴定正确。
1.2 药物 Ponatinib 等24 种酪氨酸激酶抑制剂购自美国Selleck Chemicals公司。
1.3 主要试剂 胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司;DMEM高糖培养基购自美国HyClone公司;琼脂粉购自美国Sigma公司;MTT、DMSO、SDSPAGE凝胶制备试剂盒、RIPA裂解液及彩虹180广谱蛋白marker 均购自北京索莱宝科技有限公司;兔抗E-cadherin 单克隆抗体购自美国Cell Signaling Technology 公司;鼠抗GAPDH 单克隆抗体、HRP 标记的羊抗兔IgG 和HRP 标记的羊抗鼠IgG 均购自北京中杉金桥生物技术有限公司;ECL 发光试剂盒购自北京康为世纪生物技术有限公司。
1.4 细胞培养 将SK-Hep-1 细胞用含10% FBS 的DMEM 高糖培养基,于37 ℃,5% CO2细胞培养箱中培养,每隔2 d 换液1 次,培养3~5 d 进行传代,取第3代细胞进行后续试验。
1.5 酪氨酸激酶抑制剂对SK-Hep-1 细胞存活及增殖影响的检测 采用MTT法。将SK-Hep-1细胞接种至96孔板,(3~5)×103个/孔,37 ℃,5%CO2细胞培养箱中培养24 h;弃培养基,加入Ponatinib等24种酪氨酸激酶抑制剂(均1∶4稀释),200 μL/孔,继续培养72 h;加入5 mg/mL的MTT溶液,50 μL/孔,37 ℃避光孵育4 h;弃MTT,加入DMSO,200 μL/孔,37 ℃振荡培养10 min,用酶标仪检测A490和A570,并按下式计算细胞相对存活率。以药物浓度的对数值为横坐标,细胞相对存活率为纵坐标,绘制剂量效应曲线。应用Graphpad Prism 8软件计算IC50。
1.6 Ponatinib对SK-Hep-1细胞黏附影响的检测
1.6.1 细胞缓慢聚集试验 将SK-Hep-1 细胞加入6孔板,1×105个/孔,37 ℃培养至融合度达50%时,分别加入0.1、0.5 和1.0 μmol/L 的Ponatinib,2 mL/孔,室温处理24 h;用不含EDTA的0.25%胰酶消化细胞后,接种至96孔板,2×104个/孔,同时设对照组(不加Ponatinib),每组设6 个复孔,37 ℃培养12 h,显微镜下观察细胞聚集情况,计算各组细胞团数[16]。
1.6.2 细胞分离试验 按1.6.1项方法用Ponatinib处理SK-Hep-1细胞;经不含EDTA的0.25%胰酶消化细胞后,接种至48孔板,1×104个/孔,每组设6个复孔,于37 ℃培养至0融合度达90%时,分别加入含1 mmol/L EDTA(TE)和1 mmol/L CaCl2(TC)的0.1%胰酶溶液,同时设对照组(不加Ponatinib),37 ℃消化10 min,显微镜下观察细胞分离情况,计算各组细胞团数和单个细胞数(N),以NTC/NTE表示细胞分散程度[17]。
1.7 Ponatinib对SK-Hep-1细胞迁移影响的检测 采用划痕试验[18]。按1.6.1项方法用Ponatinib处理SKHep-1细胞;经不含EDTA的0.25%胰酶消化细胞后,接种至6 孔板,1 × 105个/孔,同时设对照组(不加Ponatinib),37 ℃培养;待细胞融合度达90%时,用灭菌移液枪枪头(10 μL)在单层细胞上呈“十”字垂直划痕,PBS 洗涤1 次,加入无血清DMEM 高糖培养基2 mL,于37 ℃分别培养0、24、48 h,显微镜下观察并拍照,应用Image J软件测量不同时间的划痕面积,并按下式计算迁移率。
1.8 Ponatinib对SK-Hep-1细胞中E-cadherin蛋白表达水平影响的检测 采用Western blot法。按1.6.1项方法用Ponatinib 处理SK-Hep-1 细胞,同时设对照组(不加Ponatinib)。用RIPA裂解液提取总蛋白,经10%SDSPAGE 分离后,转移至PVDF 膜上,用5%脱脂奶粉室温封闭1 h;加入兔抗E-cadherin 单克隆抗体(1∶500稀释)和鼠抗GAPDH 单克隆抗体(1∶1 000 稀释),4 ℃孵育过夜;TBST洗涤3次,加入HRP标记的羊抗兔IgG和HRP标记的羊抗鼠IgG(均1∶1 000稀释),室温作用1 h;ECL法显色,应用Image J软件计算蛋白表达水平。
1.9 统计学分析 应用SPSS 19.0 软件进行统计学分析,检测结果以3 次独立重复试验均值± 标准差()表示,两组均值间的比较采用独立样本t检验,多个样本均值间比较采用方差分析,均以P<0.05为差异有统计学意义。
2 结果
2.1 酪氨酸激酶抑制剂对SK-Hep-1 细胞存活和增殖的影响 24 种酪氨酸激酶抑制剂均能够抑制SKHep-1 细胞存活率,药物浓度越高抑制作用越强,呈浓度依赖性,见图1。大多数激酶抑制剂抑制SKHep-1 细胞的IC50>1 μmol/L,对Ponatinib 最敏感,IC50达(0.288±0.044)μmol/L,见图2。

图1 不同酪氨酸激酶抑制剂对SK-Hep-1细胞增殖的影响Fig.1 Effects of different tyrosine kinase inhibitors on proliferation of SK-Hep-1 cells

图2 SK-Hep-1细胞经不同酪氨酸激酶抑制剂处理后的IC50Fig.2 IC50 of SK-Hep-1 cells treated with different tyrosine kinase inhibitors
2.2 Ponatinib对SK-Hep-1细胞黏附的影响
2.2.1 细胞缓慢聚集试验 对照组SK-Hep-1细胞形成大量不规则的分散聚集体;随着Ponatinib 浓度的升高,SK-Hep-1细胞团块数减少,形成体积大且致密的聚集体,见图3。对照组、0.1、0.5 和1.0 μmol/L Ponatinib组细胞团块数分别为(162.3±6.1)、(87.0±5.3)、(2.3±1.5)和(2.0±1.0)个。与对照组比较,0.1、0.5 和1.0 μmol/L Ponatinib 组细胞团块数明显减少(t分别为16.143、44.002、44.853,P均<0.001)。表明Ponatinib可促进SK-Hep-1细胞聚集,且聚集能力随Ponatinib浓度升高而增强,呈浓度依赖性。
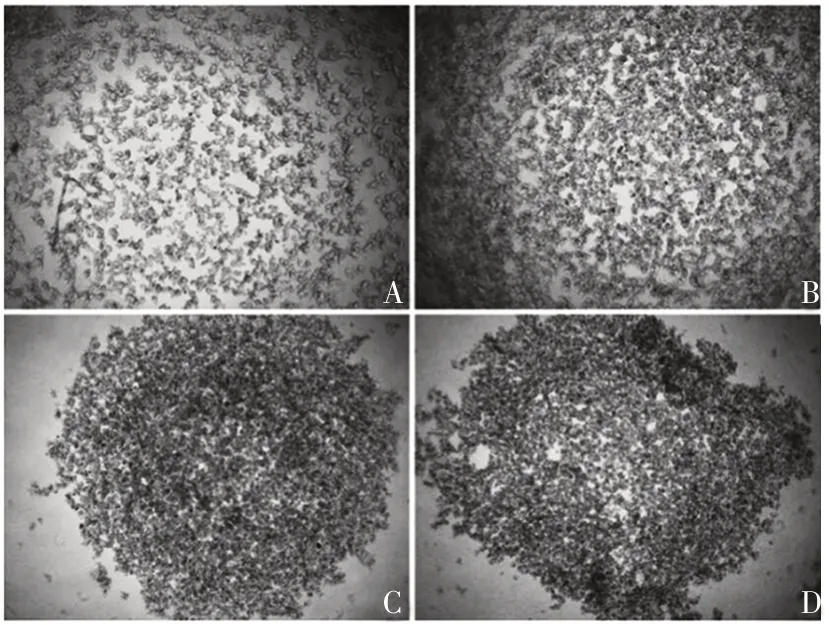
图3 各组SK-Hep-1细胞的聚集情况(×40)Fig.3 Aggregation of SK-Hep-1 cells in various groups(×40)
2.2.2 细胞分离试验 TC 组SK-Hep-1 细胞随着Ponatinib 浓度升高聚集形成明显团块,TE 组细胞均呈均匀分散,不形成团块,见图4。对照组、0.1、0.5和1.0 μmol/L Ponatinib 组 细 胞NTC/NTE分 别 为0.88±0.04、0.78±0.03、0.60±0.03和0.24± 0.02。与对照组比较,0.1、0.5和1.0 μmol/L Ponatinib组细胞NTC/NTE明显降低(t分别为4.276、10.625、27.571,P均<0.05)。表明Ponatinib可抑制SK-Hep-1细胞分散,促进细胞黏附,且黏附能力随Ponatinib 浓度升高而增强,呈浓度依赖性。

图4 各组SK-Hep-1细胞的分离情况(×100)Fig.4 Dissociation of SK-Hep-1 cells in various groups(×100)
2.3 Ponatinib 对SK-Hep-1 细胞迁移的影响 划痕24 及48 h 后,与对照组比较,0.1 μmol/L Ponatinib组细胞划痕迁移率差异无统计学意义(t分别为0.473和0.872,P均>0.05),但0.5及1.0 μmol/L Ponatinib组明显降低(t=6.272 ~16.733,P均<0.01)。见图5 和表1。表明Ponatinib 能够抑制SK-Hep-1 细胞迁移,且迁移能力随着Ponatinib 浓度升高而降低,呈浓度依赖性。
表1 各组SK-Hep-1细胞的迁移率(%,±s,n=3)Tab.1 Migration rate of SK-Hep-1 cells in various groups(%,±s,n=3)
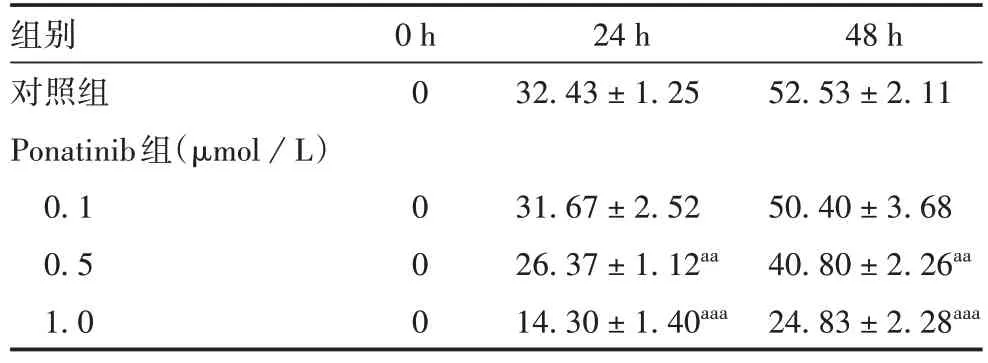
表1 各组SK-Hep-1细胞的迁移率(%,±s,n=3)Tab.1 Migration rate of SK-Hep-1 cells in various groups(%,±s,n=3)
注:与对照组比较,aa表示P <0.01,aaa表示P <0.001。
组别对照组Ponatinib组(μmol/L)0.1 0.5 1.0 0 h 0 0 0 0 24 h 32.43±1.25 48 h 52.53±2.11 31.67±2.52 26.37±1.12aa 14.30±1.40aaa 50.40±3.68 40.80±2.26aa 24.83±2.28aaa

图5 各组SK-Hep-1细胞的迁移能力(×100)Fig.5 Migration ability of SK-Hep-1 cells in various groups(×100)
2.4 Ponatinib 对SK-Hep-1细胞中E-cadherin 蛋白表达水平的影响 对照组、0.1、0.5和1.0 μmol/L Ponatinib组SK-Hep-1细胞中E-cadherin蛋白表达水平分别为0.07±0.01、0.11±0.01、0.16±0.03、0.17±0.02。与对照组比较,0.1、0.5 和1.0 μmol/L Ponatinib 组均显著升高(t分别为-3.757、-4.561、-6.922,P均<0.05),见图6。

图6 各组SK-Hep-1细胞中E-cadherin蛋白的表达情况Fig.6 Expression of E-cadherin protein in SK-Hep-1 cells of various groups
3 讨论
有研究表明,Ponatinib 能够抑制神经母细胞瘤细胞、携带FGFR2 突变的子宫内膜癌细胞和胆管癌细胞的侵袭和迁移[13-14,19],尚无Ponatinib对SK-Hep-1细胞影响的相关报道,因此,本研究通过多种方法评价了Ponatinib 对肝癌细胞SK-Hep-1 增殖、黏附和迁移能力的影响。
恶性肿瘤的发生与肿瘤细胞克服细胞间黏附作用,开始侵袭周围组织有关[20]。钙黏蛋白(cadherin)是一类介导Ca2+依赖性细胞黏附作用的整合膜蛋白[21],其中,E-cadherin 是上皮细胞中的主要黏附分子,其在人上皮细胞癌中表达水平较低[22-23]。大量研究表明,E-cadherin 表达水平降低会减弱细胞间黏附力,促进肿瘤细胞侵袭和迁移[20,24]。本研究通过细胞缓慢聚集试验和细胞分离试验检测Ponatinib 对SK-Hep-1 细胞黏附的影响,为实现体外检测细胞在悬浮状态下的聚集能力,本研究将热琼脂提前加入培养皿冷却凝固后再使用[25],结果表明,对照组形成的SK-Hep-1 细胞团块体积较小,疏松分散,黏附力弱;Ponatinib 处理后细胞间形成的团块体积增大,集中于孔中央,黏附力增强。细胞分离试验中,分别用含有Ca2+(CaCl2)和不含Ca2+(EDTA)的胰酶消化细胞,显微镜下观察细胞团形成情况,并将形成的细胞团数计作NTC,单个细胞数计作NTE。E-cadherin 介导的细胞黏附行为依赖于Ca2+,因此,使用含有Ca2+的胰酶消化细胞后,E-cadherin 能够正常介导细胞黏附,使细胞团块数增多,NTC小于NTE;而含有EDTA 的胰酶可螯合Ca2+,抑制E-cadherin介导的细胞间黏附,使细胞间黏附力减弱,单个细胞数增多。因此,NTC/NTE可反映细胞间黏附能力和E-cadherin 表达水平,NTC/NTE越小,细胞间黏附力越强,E-cadherin表达水平越高。结果表明,Ponatinib可促进肝癌细胞SK-Hep-1聚集,抑制细胞分离,并呈浓度依赖性。Western blot检测结果也证实,SK-Hep-1 细胞中E-cadherin 的表达水平随Ponatinib浓度升高而增加。
E-cadherin被认为是一种抑癌基因,其表达水平升高会促进细胞间黏附,抑制癌细胞迁移和侵袭[26]。癌细胞的侵袭和迁移水平是临床病理诊断的重要依据之一。本研究采用划痕试验检测Ponatinib 对SKHep-1 细胞迁移水平的影响,使用10 μL 移液枪枪头在单层细胞上呈“十”字垂直划痕,48 h后镜下观察细胞迁移面积,结果显示,48 h后0.5和1.0 μmol/L Ponatinib组细胞的迁移面积显著低于对照组(P<0.05)。
综上所述,Ponatinib 能够促进SK-Hep-1 细胞间黏附,抑制该细胞迁移。今后,将使用动物模型进一步探索Ponatinib 抑制HCC 细胞黏附和迁移的有效性及作用机制。

