基于生物信息学分析艾叶治疗慢性荨麻疹的分子机制
种凯艳 兰祝飚

[摘要] 目的 運用基因表达数据库(Gene Expression Omnibus,GEO)基因芯片挖掘、生物信息学及分子对接技术,分析艾叶治疗慢性荨麻疹(chronic urticaria,CU)的分子机制。方法 从GEO数据库下载CU的基因芯片数据集,利用R软件筛选出差异表达靶点,从中药系统药理学数据库(Traditional Chinese Medicine Systems Pharmacology Database,TCMSP)、药物靶标识别平台(Pharm Mapper)等数据库获取艾叶的化学成分、药物靶点,运用GENEMANIA平台及R软件,对药物–疾病交集靶点进行蛋白质互作网络(protein-protein interaction networks,PPI)分析、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genome,KEGG)富集分析,使用AutoDock Vina等软件进行分子对接验证。结果 得到CU靶点320个、药物靶点382个,筛选出药物–疾病交集靶点20个;PPI拓扑分析得出的核心靶点有ADAMTS4、FABP7、SRM、PDE5A、SOD2等;相关的化学成分有(2R)-5,7-二羟基-2-(4-羟苯基)、亚油酸乙酯、豆甾醇、槲皮素等;富集出涉及脂质和动脉粥样硬化、长寿调节信号通路、过氧化物酶体增殖活化因子受体(peroxisome proliferator-activated receptor,PPAR)信号通路、白细胞介素(interleukin,IL)-17信号通路、趋化因子信号通路等;9种化学成分与5个核心靶点间的分子对接显示,有40组对接具有结合活性(结合能<–4.25kcal/mol)。结论 艾叶对CU具有多靶点、多成分、多途径的作用机制,通过文献检索及分子对接验证本次分析结果具有可信性,可为后期的实验研究提供参考依据。
[关键词] 生物信息学;分子对接;慢性荨麻疹;作用机制
[中图分类号] R285 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2023.15.006
Analyze the molecular mechanism of Artemisia argyi in the treatment of chronic urticaria based on bioinformatics
CHONG Kaiyan, LAN Zhubiao
Department of Dermatology, Lishui Hospital of Traditional Chinese Medicine, Lishui 323000, Zhejiang, China
[Abstract] Objective To analyze the molecular mechanism of Artemisia argyi in the treatment of chronic urticaria (CU) by Gene Expression Omnibus (GEO) gene chip mining, bioinformatics and molecular docking techniques. Methods The gene chip dataset of CU was downloaded from GEO database, the differentially expressed targets were selected using R software, and the chemical composition and drug targets of Artemisia argyi were obtained from Traditional Chinese Medicine Systems Pharmacology Database (TCMSP), PharmMapper and other databases. Used GENEMANIA platform and R software, protein- protein interaction networks (PPI) topology analysis and Kyoto Encyclopedia of Genes and Genome (KEGG) enrichment analysis were performed for drug-disease intersection targets, and molecular docking validation was performed using AutoDock Vina and other software. Results 320 CU targets and 382 drug targets were obtained, and 20 drug-disease intersection targets were selected; The protein-protein interaction networks core targets obtained by PPI topology analysis were ADAMTS4, FABP7, SRM, PDE5A, SOD2, etc.; The related chemical components were (2R) -5, 7-dihydroxy-2- (4-hydroxyphenyl), ethyl linoleate, stigmasterol, quercetin, etc.; Enriched involving lipids and atherosclerosis, longevity regulatory signaling pathway, peroxisome proliferator-activated receptor (PPAR) signaling pathway, interleukin-17(IL-17) signaling pathway, chemokine signaling pathway, etc.; Molecular docking between 9 chemical components and 5 core targets showed that 40 groups of docking had binding activity (binding energy<–4.25kcal/mol). Conclusion Artemisia argyi has a mechanism of action of multiple targets, multiple components, and multiple pathways on CU, and the credibility of the results of this analysis is verified by literature search and molecular docking, which can provide a reference basis for later experimental studies.
[Key words] Bioinformatics; Molecular docking; Chronic urticaria; Mechanism of action
![]()
慢性荨麻疹(chronic urticaria,CU)是一种常见的皮肤过敏性疾病,临床特征为反复发作的风团伴红斑瘙痒[1];其反复发作的剧烈瘙痒严重影响患者的生活质量,有时还可出现全身症状,包括关节痛、头痛、疲劳、潮红和胃肠道不适等[2]。CU的发病机制非常复杂,约3/4的患者找不到病因,目前认为可能是肥大细胞和嗜碱性粒细胞等被活化后所产生的一系列反应[3]。CU治疗上以缓解症状为主,国内外指南均推荐使用二代H1抗组胺药物作为一线药物,但部分患者对该类药物反应差且病情易反复[4]。越来越多的研究表明,中医药治疗CU具有一定的优势,中西医协同治疗可增强临床疗效、减少不良反应、降低复发率[5-7]。艾叶为我国传统中药材,富含多种生物活性成分,包括挥发油、甾萜类、有机酸、黄酮类和多糖等。现代药理研究表明,艾叶具有抗菌、抗炎、抗过敏、止血、镇痛等药理作用[8]。本研究运用生物信息学、分子对接等技术,分析艾叶治疗CU的核心靶点、化学成分及作用通路。
1 资料与方法
1.1 挖掘GEO芯片获取CU靶点
从基因表达数据库(Gene Expression Omnibus,GEO)获取GSE57178、GSE72540基因芯片数据集,选取其中12例健康人的皮肤组织样本和16例CU患者的病变皮肤组织样本,下载2个芯片的表达数据及GPL6244、GPL16699注释文件。运用R软件“sva”程序包消除2个数据集之间的批次效应,然后使用“limma”程序包进行差异分析,差异表达基因的筛选条件为|logFC|≥1、FDR<0.05。
1.2 收集艾叶的化学成分及作用靶点
检索中药系统药理学数据库(Traditional Chinese Medicine Systems Pharmacology Database,TCMSP)获取艾叶的化学成分,并根据口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18进行筛选。通过PharmMapper数据库预测各化学成分的潜在作用靶点,运用UniProt平台匹配各靶点的GeneSymbol。
1.3 筛选共同靶点并构建蛋白质互作网络核心网络
运用R软件的“venn”程序包绘制药物–疾病靶点韦恩图,并映射筛选出药物–疾病交集靶点。将交集靶点提交至GENEMANIA平台获取蛋白质互作网络(protein-protein interaction networks,PPI),通过Score值筛选出艾叶治疗CU的核心靶点。
1.4 生物信息富集分析
将交集靶点导入R软件,应用“ClusterProfiler”等程序包进行基因本体学(gene ontology,GO)、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genome,KEGG)富集分析,包括生物学进程(biological process,BP)、细胞组分和分子功能(molecular funtion,MF),对主要条目进行可视化。
1.5 分子对接验证
选取核心靶点分别与化学成分进行分子对接验证,共45组。将化学成分作为小分子配体、核心靶点作为蛋白受体,从TCMSP数据库下载化学成分的MOL2文件,从蛋白质结构数据库(Protein Date Bank,PDB)下载核心靶点的PDB文件,使用PyMOL软件删除水分子及配体,通过AutoDock Vina软件进行分子对接。
2 结果
2.1 收集药物靶点和疾病靶点
通过TCMSP数据库进行检索、筛选,最终收集艾叶的9个化学成分并上传至PharmMapper平台获得382个药物靶点。对GSE57178、GSE72540两个数据集进行差异分析,共鉴定出320个差异表达基因,其中在CU样本中上调的基因256个、下调的基因64个。选取差异最显著的40个基因绘制热图,构建药物–疾病靶点韦恩图,共筛选出20个交集靶点。
2.2 构建蛋白质互作网络
将20个交集靶点上传至GENEMANIA平台构建PPI,该PPI包括20个预测靶点,下载该网络的连接数据,通过Score值筛选出前5个靶点,分别为ADAMTS4、FABP7、SRM、PDE5A、SOD2,提示这些靶点可能在艾叶治疗CU中发挥关键作用。
2.3 交集靶点富集分析
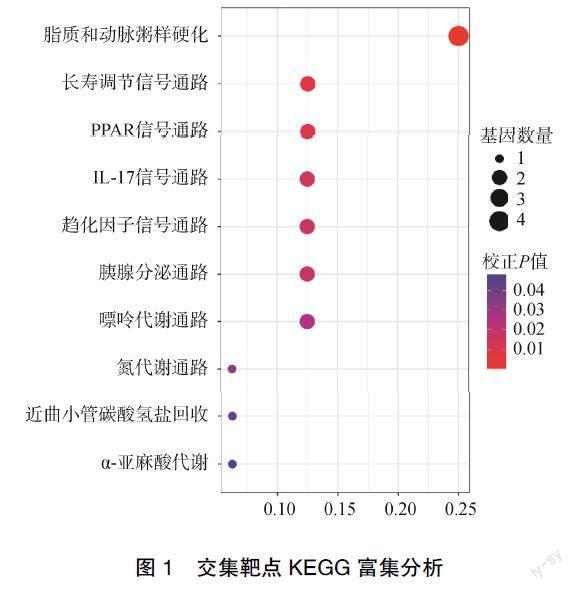
对20个交集靶点进行KEGG富集分析,结果显示,富集出脂质和动脉粥样硬化、长寿调节信号通路、过氧化物酶体增殖活化因子受体(peroxisome proliferator-activated receptor,PPAR)信號通路、白细胞介素(interleukin,IL)-17信号通路、趋化因子信号通路等,对主要条目进行绘图,见图1。
2.4 分子对接验证
对45组主要化学成分–核心靶点进行分子对接验证,一般认为结合能<–4.25kcal/mol则配体与靶点受体之间有结合活性,结合能<–5.0kcal/mol表明匹配活性较佳,结合能<–7.0kcal/mol提示具有强烈的对接活性[9]。分子对接结果见表1,45组分子对接平均结合能为–6.56kcal/mol,最低结合能为–3.1kcal/mol [油酸乙酯(NF)-FABP7],最高结合能为–9.7kcal/mol(槲皮素-ADAMTS4),45组中仅有5组无对接活性,其余均存在结合性,表明筛选出的靶点与化学成分间具有较好的匹配度。
3 讨论
CU是常见的皮肤病之一,终身患病率较高。CU作为一种慢性疾病因反复发作导致治疗较困难[10]。中医药治疗CU疗效确切,在常规使用脱敏药的同时,配合中医药的特色疗法,患者复发率低,病程缩短,作用迅速,成效显著[11]。艾叶化学成分复杂,挥发油类是其主要活性成分。现代药理学研究表明,艾叶具有抗过敏、抗炎、抗氧化等多种作用。研究发现艾叶可抑制部分炎症介质,如一氧化氮、前列腺素、活性氧、IL-6等,且抑制效果与剂量有关[12]。在抗过敏方面,艾叶能抑制由T细胞介导的迟发型变态反应,同时艾叶能促进小鼠脾脏细胞增殖,提高巨噬细胞吞噬功能,增加B细胞产生抗体能力及增强T淋巴细胞的增殖能力[13]。艾叶在抗氧化方面对羟基自由基、超氧阴离子自由基、黄嘌呤氧化酶等具有较好的抑制或清除效果[14]。侯其刚等[15]使用包含艾叶的中草药治疗荨麻疹患者,其疗效明显优于单用西医治疗,表明艾叶对CU具有一定的治疗效果,故本研究运用生物信息学等技术初步探索艾叶治疗CU的作用机制。
研究发现艾叶可通过20个靶点干预CU,包括ADAMTS4、FABP7、SRM、PDE5A、SOD2、MMP1、MMP12、HCK、CA2、PIM1、PNP、HSPA8、DPP4、PLA2G2A、SELE、UAP1、RND3、S100A9、CD1A、FAP,部分靶點在CU病程或炎症中起调节作用。如选择蛋白E(selectin E,SELE)是细胞黏附分子家族的相关基因,其编码的蛋白E-选择素是一种促炎因子,E-选择素通过炎症因子IL-1、脂多糖或肿瘤坏死因子-α(turmor necrosis factor-α,TNF-α)等介导中性粒细胞黏附血管上皮细胞,从而促进炎症反应[16]。SELE的表达水平与荨麻疹具有相关性,上调SELE可潜在促进肥大细胞释放大量TNF-α、同源限制因子、IL-6和组胺,参与荨麻疹的疾病发生和进程[17]。当SELE被沉默时,可通过抑制血管内皮细胞的细胞黏附能力抑制免疫接触性荨麻疹的发展[18]。
KEGG富集分析发现,艾叶对CU具有多方面的作用机制,涉及脂质和动脉粥样硬化、长寿调节信号通路、PPAR信号通路、IL-17信号通路、趋化因子信号通路等。PPAR是PPAR信号通路中一类依赖转录调节因子的配体,PPAR-γ作为PPAR主要亚型之一,与多种炎症细胞的活性和表达关系密切,具有改变巨噬细胞的转运、增加巨噬细胞吞噬功能等作用,可促进免疫反应的发生,同时可通过不同炎症途径的干扰控制所涉及的基因表达,影响炎症因子的产生和细胞募集,发挥抗炎作用[19-20]。研究发现,PPAR-γ可抑制多种皮肤病中的炎症反应,如PPAR-γ在特应性皮炎中起负性调节作用,抑制T细胞增殖,减少促炎因子的产生,参与Th1、Th2细胞分化,从而发挥免疫调节作用,而Th1、Th2的功能失衡与CU的发病关系密切,因此推测PPAR信号通路可能在CU复杂的发病机制中发挥调控作用[21-22]。研究表明,细胞免疫失衡也在CU发病中发挥重要作用,Th17细胞可增强抗原对Th2细胞的诱导作用,进而促进Th2细胞介导的嗜酸性粒细胞的炎症反应而参与过敏性疾病的发生。IL-17作为Th17细胞的核心因子,与部分炎症和自身免疫疾病密切相关,可通过增强Th2反应在CU的发生、发展中发挥一定作用[23]。秦凯炜等[24]发现IL-17在CU患者中的表达水平明显上调,且与病情严重程度呈正相关。研究证实IL-17是重度CU的潜在参与者和治疗靶点[25]。趋化因子异常分泌、表达及分布可引起T、B淋巴细胞的异常活化,产生多种自身抗体,可能导致CU的发病。研究表明,趋化因子可参与包括过敏性哮喘等超敏反应,在超敏反应的各个环节均发挥重要作用,通过趋化和聚集嗜酸性粒细胞,调节以Th2细胞为主的免疫应答[26-27]。
筛选发现,艾叶中具有9种活性成分能发挥抗炎、免疫调节等多成分协同作用,如β-谷甾醇、豆甾醇、槲皮素[28-30]等。通过分子对接预测化学成分与核心靶点之间的结合力,也能从侧面证实艾叶治疗CU的可靠性,45组分子对接中有40组具有结合活性,有38组结合力较佳,有19组具有强烈的结合活性,其中(2R)-5,7-二羟基-2-(4-羟苯基)、槲皮素与核心靶点间的对接得分最高,具有重要的研究参考价值。
综上所述,艾叶对CU具有多靶点、多成分、多途径的作用机制,通过文献检索及分子对接验证本次分析结果具有可信性,希望为后期进一步的实验研究提供参考依据。
[参考文献][1] ZUBERBIER T, ABDUL-LATIFF A H, ABUZAKOUK M, et al. The international EAACI/GA?LEN/EuroGuiDerm/ APAAACI guideline for the definition, classification, diagnosis, and management of urticaria[J]. Allergy, 2022, 77(3): 734–766.
[2] 潘娥, 孙仁山. 荨麻疹的流行病学研究进展[J]. 皮肤性病诊疗学杂志, 2020, 27(4): 291–294.
[18] THUMSER A E, MOORE J B, PLANT N J. Fatty acid binding proteins: Tissue-specific functions in health and disease[J]. Curr Opin Clin Nutr Metab Care, 2014, 17(2): 124–129.

