复方野菊花提取物对肝火亢盛型高血压模型大鼠的作用研究
魏柯健,俞静静,苏 洁,徐 洁,胡雪灵,周衡朴,何梓雯,颜美秋,陈素红,吕圭源*
复方野菊花提取物对肝火亢盛型高血压模型大鼠的作用研究
魏柯健1,俞静静1,苏 洁1,徐 洁1,胡雪灵1,周衡朴1,何梓雯1,颜美秋1,陈素红2*,吕圭源1*
1. 浙江中医药大学药学院,浙江 杭州 310053 2. 浙江工业大学,浙江 杭州 310014
探讨复方野菊花提取物对肝火亢盛型高血压大鼠模型的影响及降压作用机制。自发性高血压大鼠(spontaneously hypertensive rats,SHR)ig复方附子汤建立肝火亢盛型高血压大鼠模型,给予复方野菊花提取物干预后,检测大鼠中医证候指标、心率和血压,测定血清与肾脏中肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone dystem,RAAS)相关因子的含量,检测血清中一氧化氮(nitric oxide,NO)、内皮素-1(endothelin-1,ET-1)及血脂水平,观察靶器官组织形态学变化。复方野菊花提取物能显著降低模型大鼠眩晕恢复时间、面温、耳温、尿液吸光度(<0.01),增加唾液分泌量及粪便含水量(<0.01),缓解模型大鼠尖叫、攻击、打斗、撕咬等攻击性行为;显著降低模型大鼠心率、收缩压、舒张压和平均动脉压(<0.05、0.01);显著降低血清总胆固醇(total cholesterol,TC)、三酰甘油(triacylglycerol,TG)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)和ET-1水平(<0.01),升高NO水平(<0.01);改善心脏、肾脏及胸主动脉组织结构异常;降低血清中醛固酮(aldosterone,ALD)、肾素、血管紧张素-II(angiotensin-II,Ang-II)、血管紧张素转换酶(angiotensin converting enzyme,ACE)水平(<0.05、0.01),降低肾脏肾素、Ang-II、ACE和胸主动脉Ang-II的蛋白表达(<0.05、0.01),增加肾脏ACE2蛋白表达(<0.01)。复方野菊花提取物能够缓解高血压模型大鼠肝火亢盛证,改善模型大鼠的内皮状态,其降压机制可能与抑制RAAS过度激活有关。
野菊花;高血压;肝火亢盛证;肾素-血管紧张素-醛固酮系统;京尼平苷酸;金丝桃苷;蒙花苷
高血压属于我国传统医学“眩晕”“头痛”的范畴,可分为肝火亢盛、痰湿壅盛、阴虚阳亢、阴阳两虚等证型[1],其中,肝火亢盛型在高血压人群中占多数,且呈年轻化的趋势[2-3]。其原因与现代社会生活节奏的加快,人们精神压力变大,饮食娱乐生活丰富,或任意嗜辣,或通宵达旦,致使肝阴受损而加重肝火亢盛证有关[4-5]。研究发现,肝火亢盛型高血压病理机制多样,以肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)激活、交感神经亢奋及内皮功能异常为主[6-8]。其中,RAAS是平衡血压的重要途径,肾内RAAS的不适当激活是高血压的重要发病机制,其作用由醛固酮(aldosterone,ALD)、肾素、血管紧张素II(angiotensin-II,Ang-II)、血管紧张素转换酶(angiotensin converting enzyme,ACE)等多个受体共同负责[9]。内皮被认为是调节血管张力的重要组织,在多个心血管疾病尤其是高血压的发病机制中起着重要作用,同时内皮功能异常可能导致RAAS的过度激活[10]。
参照《中药新药临床研究指导原则》(2002年版)中《中药新药治疗高血压病的临床研究指导原则》诊断标准,肝火亢盛证主证为眩晕、头痛及急躁易怒,次症包括便秘、面红目赤、口苦口干、溲赤、舌红黄、脉弦数,中医多以清肝、平肝、泄火为高血压肝火亢盛证的主要治疗原则。本课题组根据高血压肝火亢盛证的病证特点,结合临床高血压“平肝潜阳、清热泻火、滋补肝肾”之治则,在现有中成药强力定眩片的处方基础上加减,辅以具“清泻肝火、平肝熄风”之功的罗布麻叶,与野菊花、杜仲共同配伍制成复方野菊花提取物,或可在改善眩晕、头痛之证的同时,起到缓解肝火亢盛证的作用。在对复方野菊花提取物的前期研究中发现[11],复方野菊花提取物具有降低血压的作用,其降压机制与抑制RAAS的过度激活有关,但尚未明确其对高血压中医证候的影响。因此,本研究对复方野菊花提取物进行成分分析,并采用课题组前期通过ig温燥药方法建立肝火亢盛型高血压大鼠模型[12],以眩晕恢复时间量化“眩晕”,性情分级量化“急躁易怒”,面部温度量化“面红”,唾液分泌量量化“口干”,粪便含水量量化“便秘”,尿液吸光度量化“溲赤”,结合其他药效指标综合评价复方野菊花提取物对肝火亢盛型高血压模型大鼠中医证候的改善作用,并基于前期药效研究探讨其降压机制,为复方野菊花提取物临床功能主治的确定提供依据。
1 材料
1.1 动物
SPF级WKY雄性大鼠10只,8周龄,体质量(200±10)g;SPF级雄性自发性高血压大鼠(spontaneously hypertensive rats,SHR)50只,8周龄,体质量(200±10)g;均由北京维通利华实验动物技术有限公司提供,许可证号SCXK(京)2021-0006,动物质量合格证号110011210112172413、110011210112172584。动物实验经浙江中医药大学伦理委员会批准(批准号ZSLL-2017-185)。
1.2 药品与试剂
复方附子汤由附子、干姜、肉桂组成,附子(批号201201)、干姜(批号210301)、肉桂(批号201901)均购自浙江中医药大学中药饮片有限公司,取上述药材(1∶1∶1),浸泡0.5 h,分别加12、10倍量水煎煮2次,每次1 h,滤过后混合浓缩为含生药1 g/mL的药液;复方野菊花提取物(批号202710)由浙江中医药大学现代中药与健康产品研究所提供,由野菊花、杜仲、罗布麻叶提取制得,以纯水配制成质量浓度为含生药量0.525、0.350、0.175 g/mL的药液;卡托普利片(批号20110511)购自常州制药厂有限公司,以纯水配制成1.0 mg/mL的混悬液备用;对照品京尼平苷酸(批号111828-201805)、蒙花苷(批号111528-201911)、金丝桃苷(批号111521-201809)均购自中国食品药品检定研究院,质量分数分别为98.1%、94.9%、98.5%;总胆固醇(total cholesterol,TC)试剂盒(批号210901201)、三酰甘油(triacylglycerol,TG)试剂盒(批号220623202)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)试剂盒(批号201015101)均购自美康生物科技股份有限公司;ALD、肾素、Ang-II、ACE试剂盒(批号分别为20220110-RXJ302392R、20220110-RX302359R、20220113-RX301962R、20211203-RX300267R)均购自泉州市睿信生物科技有限公司;内皮素-1(endothelin-1,ET-1)试剂盒(批号23011760)购自江苏酶免实业有限公司;一氧化氮(nitric oxide,NO)试剂盒(批号20220119)购自南京建成生物工程研究所;Ang-II抗体(批号ab155106)购自艾博抗(上海)贸易有限公司;肾素抗体(批号bs-6184R)购自北京博奥森生物技术有限公司;ACE、ACE2抗体(批号分别为24743-1-AP、21115-1-AP)购自武汉三鹰生物技术有限公司;兔源β-actin抗体(批号B9901)购自美国Immuno Way公司;HRP标记的山羊抗兔IgG抗体(批号HP0119)购自杭州华安生物技术有限公司。
1.3 仪器
1200型高效液相色谱仪、Chemstation色谱工作站(美国Agilent公司);BP-2010AUL型小动物无创测压系统(北京软隆生物科技有限公司);TBA-40FR型全自动生化分析仪(日本东芝三广医疗株式会社);Power wave340型酶标仪(美国Bio-Tek公司);YHW-2型红外测温仪(江苏鱼跃医疗设备股份有限公司);ZH-SZ型平衡旋转仪(淮北正华生物仪器设备有限公司);FLIR ONE Pro红外热像仪(美国FLIR公司);Tissue-Tek VIPTM 5Jr型全封闭组织脱水机(日本樱花检验仪器株式会社);EC360型包埋机(美康仪器设备制造高淳县有限公司);RM2245型半自动切片机(德国Leica公司)。
2 方法
2.1 复方野菊花提取物含量测定
2.1.1 色谱条件 Eclipse XDB C18色谱柱(250 mm×4.6 mm,5 µm);流动相为乙腈(A)-0.2%磷酸水溶液(B),梯度洗脱:0~5 min,7% A;5~15 min,7%~8% A;15~25 min,8%~13% A;25~30 min,13%~17% A;30~45 min,17%~19% A;45~50 min,19%~26% A;50~60 min,26%~27% A;体积流量1.0 mL/min;检测波长403 nm(0~5 min),240 nm(5~26 min),403 nm(26~37 min),256 nm(37~43 min),330 nm(43~60 min);柱温25 ℃;进样量10 μL。
2.1.2 溶液的制备
(1)对照品溶液的制备:精密称取对照品京尼平苷酸、金丝桃苷、蒙花苷各适量,置量瓶中,加甲醇溶解并稀释至刻度,密塞,摇匀,得分别含京尼平苷酸、金丝桃苷、蒙花苷0.124 8、0.148 0、0.173 2 mg/mL的混合对照品溶液。
(2)供试品溶液的制备:取复方野菊花提取物样品约0.5 g,精密称取,置具塞锥形瓶中,加50%甲醇25 mL,密塞,称定质量,超声处理40 min,放冷,再称定质量,用50%甲醇补足减失的质量,摇匀,滤过,即得。
2.1.3 线性关系的考察及测定 精密吸取混合对照品溶液0.5、1、2、3、4、5 mL,分别置于5 mL量瓶中,加甲醇稀释至刻度,配制成不同质量浓度的混合对照品溶液;分别精密吸取上述混合对照品溶液10 μL,注入高效液相色谱仪中,按“2.1.1”项色谱条件测定峰面积,以对照品质量浓度为横坐标(),峰面积为纵坐标(),绘制回归方程。取供试品续滤液,进样,测定峰面积,计算样品中京尼平苷酸、金丝桃苷、蒙花苷的含量。
2.2 分组、造模与给药
雄性SHR大鼠ig温燥药(0.2 g/mL复方附子汤)造模,连续造模5周后,通过血压监测及肝火亢盛证相关指标评估,选取造模成功,即血压稳定在收缩压≥220 mm Hg(1 mm Hg=133 Pa)且出现肝火亢盛证的大鼠。按血压值随机分为模型组、卡托普利(10 mg/kg)组和复方野菊花提取物高、中、低剂量(5.25、3.50、1.75 g/kg)组,每组10只;继续ig温燥药造模。另取WKY大鼠10只作为对照组。各给药组ig相应药物(0.01 mL/g),对照组和模型组ig等体积的生理盐水,1次/d,连续4周。
2.3 中医证候指标检测
2.3.1 性情变化 将大鼠性情变化分为I~IV级,分别为:I级,无明显表现;II级,有轻微抽搐;III级,发出叫声且用力抖动;IV级,用力挣脱且表现攻击趋向。于给药前、给药28 d后,观察大鼠性情并进行评级。
2.3.2 眩晕恢复时间 于给药前、给药28 d后,将大鼠置于平衡旋转仪上,1000 r/min旋转1 min后取下,然后将其放置于平台上,记录大鼠恢复正常状态所需时间。
2.3.3 面温 于给药前、给药28 d后,安静环境下,用非接触式红外测温仪对准大鼠面部,当测温仪稳定后记录所测数据,测定3次,取平均值。
2.3.4 唾液分泌量 于给药前、给药28 d后,将干燥棉签置于干燥小型密封袋中称定得到干质量,再以干燥棉签收集大鼠口腔中的唾液,将棉签再放入密封袋中,避免唾液蒸发,称定得到湿质量,计算唾液分泌量。
唾液分泌量=湿质量-干质量
2.3.5 粪便含水率 于给药前、给药28 d后,收集大鼠粪便,立即称定记为粪便湿质量,于70 ℃烘箱烘5 h,再次称定记为粪便干质量,计算粪便含水率。
粪便含水率=(粪便湿质量-粪便干质量)/粪便湿质量
2.3.6 尿液吸光度() 于给药前、给药28 d后,采用代谢笼收集大鼠新鲜尿液200 μL,在430 nm下测定值。
2.3.7 耳温 给药28 d后,在安静环境下,用FLIR ONE Pro红外热像仪对大鼠耳部进行红外拍摄,测得大鼠耳部温度。
2.4 血压、心率监测
于给药前以及给药1、3、7、14、21、28 d后,采用小动物无创测压系统,在大鼠清醒且安静环境下平行测定大鼠收缩压、舒张压和平均动脉压,于给药前、给药28 d后测定大鼠心率。
2.5 血脂水平检测
末次给药后,各组大鼠腹主动脉采血,4 ℃凝血2 h,3500 r/min离心15 min,取上层血清,采用全自动生化分析仪检测TG、TC、LDL-C水平。
2.6 血清NO和ET-1水平检测
取大鼠血清,按照ELISA试剂盒说明书检测血清中ET-1和NO含量。
2.7 血清ALD、ACE、Ang-II和肾素水平检测
取大鼠血清,按照ELISA试剂盒说明书检测血清中ALD、肾素、Ang-II和ACE的含量。
2.8 心脏、肾脏和胸主动脉组织病理学观察
末次给药后,ip 0.2 g/mL乌拉坦麻醉大鼠(5 mL/kg)。用镊子夹其脚趾无反应后,将大鼠仰卧在手术台上,沿腹中线解剖取大鼠心脏、肾脏和胸主动脉,放入盛有10%中性福尔马林缓冲液的瓶中。经固定、取材、脱水、包埋、切片,制得4 μm石蜡切片,采用苏木素-伊红(HE)和Masson染色,中性树脂封片,干燥后于显微镜下观察心脏、肾脏及胸主动脉组织病理变化。
2.9 免疫组化法检测肾脏中ACE、ACE2和胸主动脉Ang-II的蛋白表达
取肾脏和胸主动脉的石蜡切片(4 μm),经过消除内源性过氧化氢酶活性、抗原修复、牛血清白蛋白封闭后,滴加ACE、ACE2、Ang-II抗体,4 ℃孵育过夜;滴加二抗,37 ℃孵育30 min;经DAB显色、苏木素染色、乙醇脱水及中性树脂封片干燥后,于显微镜下观察肾脏中ACE、ACE2和胸主动脉Ang-II蛋白的表达情况,并用Image-Pro Plus 6.0软件进行分析。
2.10 Western blotting检测肾脏中肾素和Ang-II的蛋白表达
取肾脏组织,液氮充分研磨后,加入适量RIPA裂解液,冰上静置10 min,离心取上清,提取组织蛋白。BCA法测定蛋白浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,5%脱脂奶粉封闭2 h,分别加入肾素、Ang-II抗体,4 ℃孵育过夜;PBST洗膜3次,每次15 min;加入二抗,室温孵育2 h;PBST洗膜3次,每次15 min;加入ECL化学发光液后,采用Modena凝胶成像仪检测蛋白条带,并用Image J软件进行分析。
2.11 统计学分析

3 结果
3.1 复方野菊花提取物含量测定
分别取混合对照品溶液和供试品溶液,分别按“2.1.1”项下色谱条件进样分析,记录色谱图(图1)。复方野菊花提取物平行检测3次,测定成分的色谱峰分离度()均≥1.5,测得京尼平苷酸、金丝桃苷、蒙花苷的质量分数分别为(2.710±0.150)、(3.470±0.147)、(10.690±0.529)mg/g。

1-京尼平苷酸 2-金丝桃苷 3-蒙花苷
3.2 复方野菊花提取物对模型大鼠中医证候指标的影响
3.2.1 对性情的影响 如图2所示,与对照组比较,给药前各组大鼠具有显著的攻击表现(<0.01);给药28 d后,与模型组比较,各剂量的复方野菊花提取物均能显著降低模型大鼠的攻击性(<0.05、0.01)。
3.2.2 对眩晕恢复时间的影响 如图3所示,与对照组比较,给药前各组大鼠的眩晕恢复时间显著上升(<0.05、0.01);给药28 d后,与模型组比较,各剂量的复方野菊花提取物均能显著降低模型大鼠的眩晕恢复时间(<0.01)。

NC-对照组 MC-模型组 CAP-卡托普利组 FYH-复方野菊花提取物高剂量组 FYM-复方野菊花提取物中剂量组 FYL-复方野菊花提取物低剂量组 与对照组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01,下图同

图3 复方野菊花提取物对模型大鼠中医证候指标的影响(, n = 10)
3.2.3 对面温的影响 与对照组比较,给药前各组大鼠的面温显著上升(<0.01);给药28 d后,与模型组比较,各剂量的复方野菊花提取物均能显著降低模型大鼠的面温(<0.01)。
3.2.4 对唾液分泌量的影响 与对照组比较,给药前各组大鼠的唾液分泌量显著减少(<0.01);给药28 d后,与模型组比较,各剂量的复方野菊花提取物均能显著增加模型大鼠的唾液分泌量(<0.01)。
3.2.5 对粪便含水率的影响 与对照组比较,给药前各组大鼠的粪便含水率显著降低(<0.01);给药28 d后,与模型组比较,各剂量的复方野菊花提取物均能显著增加模型大鼠的粪便含水率(<0.01)。
3.2.6 对尿液值的影响 与对照组比较,给药前各组大鼠的尿液值均显著上升(<0.01);给药28 d后,与模型组比较,各剂量的复方野菊花提取物均能显著降低模型大鼠的尿液值(<0.01)。
3.2.7 对耳温的影响 与对照组比较,给药28 d后,模型组大鼠的平均耳温均显著上升(<0.01);与模型组比较,各剂量的复方野菊花提取物均能显著降低模型大鼠的平均耳温(<0.01)。
3.3 复方野菊花提取物对模型大鼠心率和血压的影响
3.3.1 对模型大鼠心率的影响 如图4所示,与对照组比较,给药前各组大鼠心率均明显升高(<0.05、0.01);给药28 d后,中、高剂量的复方野菊花提取物能显著降低模型大鼠心率(<0.01),复方野菊花提取物低剂量组心率有降低趋势。
3.3.2 对模型大鼠血压的影响 与对照组比较,给药前模型组在造模后不同时间点舒张压均显著升高(<0.01);与模型组比较,给药1、3、7、14、21、28 d后,各剂量的复方野菊花提取物均能稳定显著降低模型大鼠收缩压、舒张压、平均动脉压(<0.05、0.01)。
3.4 复方野菊花提取物对模型大鼠血脂水平的影响
如图5所示,给药28 d后,与模型组比较,各剂量的复方野菊花提取物均能显著降低模型大鼠血清中TC、LDL-C含量(<0.01),复方野菊花提取物高剂量组显著降低模型大鼠血清中TG含量(<0.01),复方野菊花提取物低、中剂量组对TG含量有降低趋势。

图4 复方野菊花提取物对模型大鼠心率和血压的影响(, n = 10)

图5 复方野菊花提取物对模型大鼠血液生化学指标的影响(, n = 10)
3.5 复方野菊花提取物对模型大鼠血清中NO及ET-1含量的影响
如图6所示,给药28 d后,与对照组比较,模型组大鼠血清中ET-1含量显著升高(<0.01),NO含量显著降低(<0.01);与模型组比较,各剂量的复方野菊花提取物均能显著降低血清中ET-1含量(<0.05、0.01),复方野菊花提取物高剂量组能显著升高血清中NO含量(<0.01),复方野菊花提取物低、中剂量组对NO含量有升高趋势。
3.6 复方野菊花提取物对模型大鼠血清RAAS相关指标的影响
如图7所示,给药28 d后,与对照组比较,模型组大鼠血清中肾素、Ang-II、ACE、ALD含量均显著升高(<0.01);与模型组比较,各剂量的复方野菊花提取物均能显著降低模型大鼠血清中肾素、Ang-II、ACE含量(<0.05、0.01),复方野菊花提取物低、高剂量组能显著降低ALD含量(<0.05),复方野菊花提取物中剂量组对ALD呈现降低趋势。
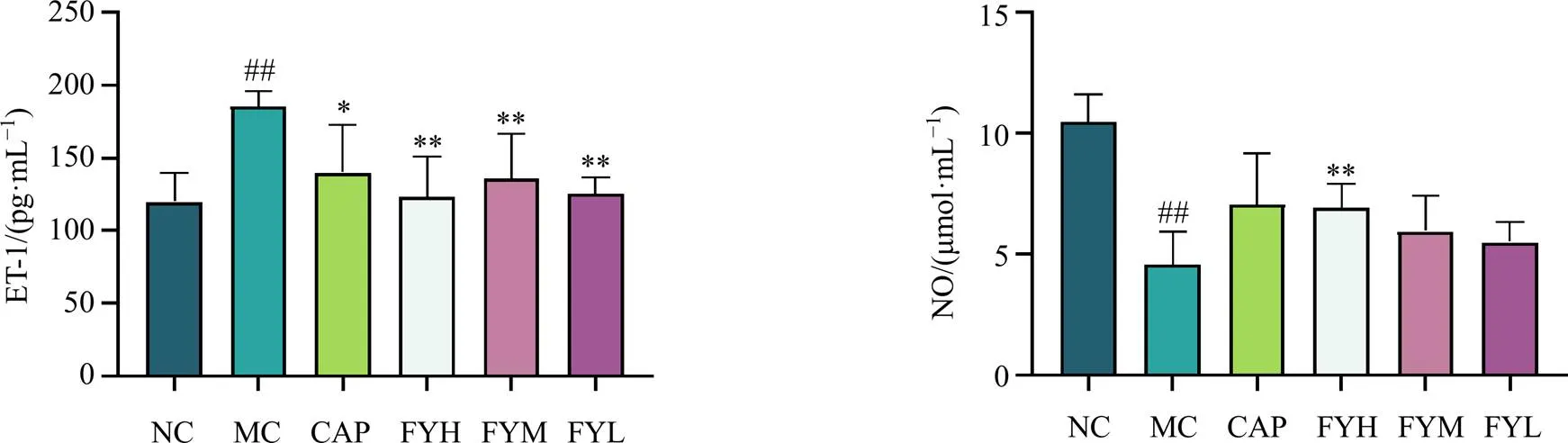
图6 复方野菊花提取物对模型大鼠血清中NO及ET-1含量影响(, n = 10)

图7 复方野菊花提取物对模型大鼠血清中RAAS相关指标的影响(, n = 10)
3.7 复方野菊花提取物对模型大鼠靶器官组织形态的影响
3.7.1 对模型大鼠肾脏组织形态的影响 如图8所示,与对照组比较,模型组大鼠肾脏组织HE染色可见肾小球萎缩,肾小管排列紊乱及间隙增大;Masson染色可见肾小管间隙出现大量蓝紫色胶原蛋白沉积。与模型组比较,各剂量的复方野菊花提取物对大鼠肾脏病变有不同程度的改善,肾小球、肾小管形态接近对照组,肾小球萎缩明显改善,肾小管间隙无显著胶原蛋白沉积。
3.7.2 对模型大鼠心脏组织形态的影响 如图9所示,与对照组比较,模型组大鼠心脏组织HE染色可见心肌纤维排列不规则,同时心肌细胞核深染、肥大、间距变宽、排列紊乱;Masson染色可见心肌纤维间出现大量蓝紫色胶原蛋白沉积。与模型组比较,各剂量的复方野菊花提取物均能使心肌组织结构趋于正常,横纹较清晰,心肌细胞肥大改善,形态较规则,心肌纤维间胶原蛋白沉积面积显著减小。
3.7.3 对模型大鼠胸主动脉组织形态的影响 如图10所示,与对照组比较,模型组大鼠胸主动脉组织HE染色可见中膜明显增厚,血管平滑肌细胞排列疏松、紊乱,血管内皮细胞排列不齐且部分脱落;Masson染色可见中膜出现大量蓝紫色的胶原蛋白沉积。与模型组比较,各剂量的复方野菊花提取物均可使胸主动脉中膜增厚、血管平滑肌细胞增生且排列紊乱等症状减轻,中膜胶原蛋白沉积显著减小。

图8 复方野菊花提取物对模型大鼠肾脏组织形态学的影响 (×200)

图9 复方野菊花提取物对模型大鼠心脏组织形态学的影响(×200)

图10 复方野菊花提取物对模型大鼠胸主动脉组织形态学的影响(×200)
3.8 复方野菊花提取物对模型大鼠肾脏ACE、ACE2及胸主动脉Ang-II表达的影响
3.8.1 对模型大鼠肾脏ACE和ACE2表达的影响 如图11所示,大鼠肾脏中ACE2、ACE染色阳性产物表达在肾小管细胞,呈棕黄色。与对照组比较,模型组大鼠肾脏中ACE2表达明显降低(<0.01),ACE表达明显升高(<0.01);与模型组比较,复方野菊花提取物各剂量组大鼠肾脏中ACE表达均显著降低(<0.01),ACE2表达均明显升高(<0.01)。
3.8.2 对模型大鼠胸主动脉Ang-II表达的影响 如图12所示,胸主动脉中Ang-II染色阳性产物表达在内皮细胞表面,呈棕黄色。与对照组比较,模型组大鼠胸主动脉中Ang-II表达显著增加(<0.01);与模型组比较,复方野菊花提取物各剂量组胸主动脉Ang-II蛋白表达显著减少(<0.01)。

图11 复方野菊花提取物对模型大鼠肾脏ACE和ACE2表达的影响(, n = 3)

图12 复方野菊花提取物对模型大鼠胸主动脉Ang-II表达的影响(, n = 3)
3.9 复方野菊花提取物对模型大鼠肾脏中肾素和Ang-II蛋白表达的影响
如图13所示,与对照组比较,模型组大鼠肾脏中肾素和Ang-II表达显著升高(<0.05、0.01);与模型组比较,复方野菊花提取物各剂量组肾脏中Ang-II表达明显减少(<0.05),复方野菊花提取物中、高剂量组肾素表达显著减少(<0.05),复方野菊花提取物低剂量组肾素的表达呈降低趋势。

图13 复方野菊花提取物对模型大鼠肾脏肾素和Ang-II蛋白表达的影响(, n = 3)
4 讨论
高血压的病因大致有“风、火、痰、瘀、虚”等[13],肝风、肾虚、痰浊则是其主要病理基础[14]。高血压病常伴有眩晕、头痛等主证,但不同证候类型的高压病其病因病机不同,其主次之证的侧重点亦不相同,如若饮食不节,多食肥甘厚味,痰湿内生,而发为痰湿壅盛型,其主证表现为胸闷、呕吐痰涎并伴有失眠、耳鸣、健忘等次证;年老体衰、久病体虚,肾阴亏虚,阳亢于上,形成阴虚阳亢型,其主证表现为腰酸、膝软、五心烦热,伴有失眠、耳鸣、健忘等次证;久病阴损及阳,则出现阴阳两虚,其主证表现为畏寒肢冷,伴有气短、夜尿频等次证[2]。而肝火亢盛证为实证,其病位在肝,病性为火,其主证主要表现为急躁易怒,并伴有面红、目赤、口干、口苦、便秘、瘦赤等次证[15]。
临床研究发现,肝火亢盛证为早期高血压病的主要证候,而高血压与肝的关系自古便有论述,如《素问·至真要大论》有言:“诸风掉眩,皆属于肝”。《临证指南医案》进一步指出:“所患眩晕者,非外来之邪,乃肝胆之风阳上冒耳”,而究其“火”之病性,多因情志不畅、饮食辛辣或作息不律致肝气郁结,滞而为火,火为阳邪,燔灼于内则耗气伤津,致肝阴不足。肝风遇火,风火相煽,发为眩晕[16]。故而肝火内炽、气火上逆是为肝火亢盛型高血压的主要病机。《黄帝内经》认为火气失常是某些疾病的重要原因[17],现代中医在肝火亢盛证的临床诊疗中亦发现“火”可致机体多方面的损伤或不适,如火性炎上,上扰清空可使神明不安,出现眩晕、头痛;肝火循经上攻于头目,进而气血随之上涌,出现面赤、目赤等症状[18],大多与肝火亢盛证的表现相符。本实验采用“大热”的温燥药进行造模,引火入肝,成功在自发性高血压的基础上使大鼠出现肝火亢盛高血压主证眩晕、急躁易怒,次症便秘、面红、口干、溲赤。
复方野菊花提取物以野菊花为君,其味苦辛、凉,入肝、心经,可清热解毒,泻火平肝[20],《本草纲目》中称有“利五脉、调四肢,治头风热、脑骨肿痛、养目血、去翳膜、主肝气不足”之功,主治头眩肿痛、头目风热等症;配以罗布麻叶平肝安神,清热利水[19],与野菊花共去肝脏邪火,以平肝阳眩晕;佐以杜仲,补肝肾不足[19],助野菊花复肝肾正气而治头晕目眩。诸药合用,共达清肝热、平肝阳、养肝肾、凉血散结之功,使人体趋于阴平阳秘、血脉平和,从而缓解肝火亢盛证。本研究发现复方野菊花提取物可有效降低模型大鼠的心率与血压,并改善模型大鼠性情状况,降低眩晕恢复时间、面温、耳温、尿液值,增加唾液分泌量、粪便含水量。证明复方野菊花提取物能够在降压的同时有效改善模型大鼠“眩晕”“急躁易怒”“口干”“溲赤”“耳赤”等证候指标。
现代医学发现高血压的病理机制是多个生物因子相互作用的结果。薛晓兴等[20]认为RAAS中Ang-II可作为高血压肝火亢盛证的标志性物质,Ang-II是RAAS的主要效应因子,是一种由肾素和ACE共同作用而形成的强效血管收缩剂[21-22]。同时,Ang-II可通过诱导活性氧的生成,从而抑制NO的生成和活性[23]。NO为内皮依赖性舒张血管因子,其含量与生物活性的变化能反映内皮功能的状态,与收缩血管因子ET-1构成了一对具有拮抗效应的血管活性物质[24]。而ET-1可刺激RAAS,并可介导Ang-II引起的心血管损伤[25]。此外,长期血压过高将导致脂代谢紊乱,而肝火亢盛证高血压病患者的TG、TC、LDL-C水平相对高于其他证型患者[26-27]。机体在LDL-C、TC水平长期升高的状态下,将导致血管内皮细胞损伤[28],内皮功能受到损害,使NO减少,造成内皮舒缩因子(ET-1/NO)的失衡,血压持续升高,促进高血压的发生发展[29]。另有研究表明TG是高血压的重要危险因素,控制TG水平可减缓高血压的发病[30]。目前,已有学者发现京尼平苷酸、金丝桃苷和蒙花苷可以起到降压作用,其中金丝桃苷和蒙花苷可有效抑制Ang-II的表达而降低高血压血管的张力[31-32]。本研究发现复方野菊花提取物能明显降低模型大鼠血清中ALD、肾素、Ang-II、ACE水平,下调肾脏中肾素、ACE、Ang-II和主动脉中Ang-II的蛋白表达,上调ACE2的蛋白表达。说明复方野菊花提取物可能是通过抑制循环和肾脏局部RAAS的过度激活而起到降低血压的作用。进一步对血清进行生化分析,发现复方野菊花提取物能够降低模型大鼠血清中TC、TG、LDL-C的水平,同时调节ET-1/NO的失衡,改善内皮功能。结合病理学观察,复方野菊花提取物能够有效改善模型大鼠肾、心、主动脉等脏器的损伤,减轻高血压对机体的损伤。
综上,复方野菊花提取物能够有效改善肝火亢盛诸证和心脏、肾脏、主动脉等靶器官的损伤,并通过抑制RAAS过度激活起到降压作用,同时调节血脂代谢进而改善血管内皮功能,最终起到改善肝火亢盛证高血压的作用。
利益冲突 所有作者均声明不存在利益冲突
[1] 王磊, 李兴广, 柴欣楼, 等. 夏藤复方对肝火亢盛型高血压大鼠血压及血管活性物质的影响 [J]. 河南中医, 2017, 37(3): 425-428.
[2] 许小泰, 唐杨. 高血压病中医证型分布规律的研究 [J]. 中医临床研究, 2022, 14(13): 86-89.
[3] 杨国棠, 黄金花. 高血压病中医证型分布规律的临床研究 [J]. 中医临床研究, 2013, 5(12): 34-35.
[4] 戴荣琼. 家族聚集性高血压肝火亢盛证发病的相关危险因素研究 [D]. 福州: 福建中医药大学, 2019.
[5] 刘海军. 高血压中医证型分布特点与心血管危险因素相关性分析 [J]. 陕西中医, 2016, 37(12): 1576-1577.
[6] 廖慧玲, 尹思源, 葛丽春, 等. 高血压病中医证型与AGT基因M235T多态性的相关性分析 [J]. 时珍国医国药, 2011, 22(6): 1508-1509.
[7] Xiong X J, Yang X C, Liu Y M,. Chinese herbal formulas for treating hypertension in traditional Chinese medicine: Perspective of modern science [J]., 2013, 36(7): 570-579.
[8] 马雪玲, 王田, 刘婧玮, 等. 从高血压肝火亢盛证的应激变化探讨肝主疏泄的生物学基础 [J]. 世界中医药, 2017, 12(12): 3063-3067.
[9] Nishiyama A, Kobori H. Independent regulation of renin-angiotensin-aldosterone system in the kidney [J]., 2018, 22(6): 1231-1239.
[10] Konukoglu D, Uzun H. Endothelial dysfunction and hypertension [J]., 2017, 956: 511-540.
[11] 徐洁, 苏洁, 魏柯健, 等. 复方野菊花提取物对代谢性高血压模型大鼠的降压作用研究 [J]. 中药新药与临床药理, 2022, 33(7): 893-901.
[12] 吕圭源, 陈素红, 陈宁, 等. 羚角降压方对高血压肝阳上亢证大鼠证侯影响的拆方研究 [J]. 中国药理学通报, 2010, 26(11): 1532-1534.
[13] 简维雄, 陈偶英, 张稳, 等. 基于高血压病中医药现代文献证型、病机特征研究 [J]. 中华中医药学刊, 2015, 33(12): 2871-2874.
[14] 谭元生, 黄露. 高血压病中医证型与证素分布规律的文献研究 [J]. 中华中医药学刊, 2015, 33(11): 2570-2573.
[15] 王宇, 朱羽硕, 李运伦, 等. 正常高值血压肝火亢盛证分级量化诊断标准的探索性研究 [J]. 中华中医药杂志, 2018, 33(7): 3035-3038.
[16] 鲁坪. 眩晕治疗十法[A] // 中华中医药学会学术年会——创新优秀论文集[C]. 杭州: 中华中医药学会, 2002: 2.
[17] 李海玉. 《黄帝内经》之“火”辨析 [J]. 中华中医药杂志, 2007, 22(5): 308-310.
[18] 何婷斐, 孔利君. 清肝降压汤治疗肝火亢盛型高血压病的临床疗效观察 [J]. 中国中医药科技, 2022, 29(4): 669-671.
[19] 中国药典 [S]. 一部. 2020: 172, 220, 328.
[20] 薛晓兴, 李玉波, 廉洪建, 等. 高血压肝火亢盛证动物模型相关指标的研究 [J]. 中国实验方剂学杂志, 2015, 21(8): 97-101.
[21] Carey R M. The intrarenal renin-angiotensin system in hypertension [J]., 2015, 22(3): 204-210.
[22] Rush J W E, Aultman C D. Vascular biology of angiotensin and the impact of physical activity [J]., 2008, 33(1): 162-172.
[23] Ghiadoni L, Taddei S, Virdis A. Hypertension and endothelial dysfunction: Therapeutic approach [J]., 2012, 10(1): 42-60.
[24] 王瑶瑶, 喇孝瑾, 张大伟, 等. 双清平化方对代谢综合征大鼠血压、胰岛素抵抗、RAS系统及血管内皮功能的影响 [J]. 现代中西医结合杂志, 2021, 30(20): 2172-2178.
[25] Palacios-Ramírez R, Hernanz R, Martín A,. Pioglitazone modulates the vascular contractility in hypertension by interference with ET-1 pathway [J]., 2019, 9(1): 16461.
[26] Emamian M, Hasanian S M, Tayefi M,. Association of hematocrit with blood pressure and hypertension [J]., 2017, 31(6): e22124.
[27] 曾美玲, 王恒和. 高血压病中医证型客观化研究进展 [J]. 辽宁中医药大学学报, 2020, 22(4): 209-212.
[28] 王岩, 朱冰. 阿托伐他汀钙对脑梗塞合并高脂血症及颈动脉粥样硬化斑块患者的影响 [J]. 中国地方病防治杂志, 2015, 30(1): 75.
[29] 朱宗敏, 王焕军, 于瑞雪, 等. 高血压病肝阳上亢证大鼠肝脏的脂质组学分析 [J]. 中华中医药杂志, 2018, 33(12): 5361-5365.
[30] 栾威, 汪俊华, 赵否曦, 等. 甘油三酯葡萄糖乘积指数与高血压发病风险关联的队列研究 [J]. 中国慢性病预防与控制, 2022, 30(10): 731-735.
[31] 王成, 郭长磊, 李霞, 等. 金丝桃苷对高血压大鼠降血压作用及与血管紧张素转化酶抑制作用的关系 [J]. 中药药理与临床, 2018, 34(5): 33-39.
[32] 苏洁, 俞静静, 颜美秋, 等. 基于主动脉Ang II/AT1通路研究蒙花苷对高血压血管重构的影响 [J]. 中草药, 2019, 50(20): 5003-5010.
Effect of compoundextract on hypertensive model rats with liver-fire hyperactivity syndrome
WEI Ke-jian1, YU Jing-jing1, SU Jie1, XU Jie1, HU Xue-ling1, ZHOU Heng-pu1, HE Zi-wen1, YAN Mei-qiu1, CHEN Su-hong2, LYU Gui-yuan1
1. School of Pharmaceutical Sciences, Zhejiang Chinese Medical University, Hangzhou 310053, China 2. Zhejiang University of Technology, Hangzhou 310014, China
To explore the effect and hypotensive mechanism of compoundextract on hypertensive model rats with liver-fire hyperactivity syndrome.Spontaneously hypertensive rats (SHR) were ig compound Fuzi Decoction (复方附子汤) to induce hypertensive model with liver-fire hyperactivity syndrome, after the intervention of compoundextract, the indexes of TCM syndromes, heart rate and blood pressure of rats were monitored, the contents of renin-angiotensin-aldosterone dystem (RAAS) related factors in serum and kidney were measured, the levels of nitric oxide (NO), endothelin-1 (ET-1) and blood lipids in serum were detected, and the histomorphological changes of kidney, heart and aorta were observed.Compoundextract could significantly reduce the recovery time of vertigo, face temperature, ear temperature and urine absorbance (< 0.01), increase saliva secretion and fecal water content (< 0.01), and alleviate the temperament changes of model rats such as screaming, fighting and biting. Compoundextract significantly decrease heart rate, systolic blood pressure, diastolic blood pressure and mean arterial pressure (< 0.05, 0.01), reduce total cholesterol (TC), triacylglycerol (TG), low density lipoprotein-cholesterol (LDL-C) and ET-1 levels in serum (< 0.01), while increase NO level (< 0.01). Compoundextract could improve the abnormal tissue structure of heart, kidney and thoracic aorta, reduce the levels of aldosterone (ALD), renin, angiotensin-II (Ang-II) and angiotensin converting enzyme (ACE) in serum (< 0.05, 0.01), reduce the protein expressions of renin, Ang-Ⅱ, ACE in kidney and Ang-Ⅱ in thoracic aorta (< 0.05, 0.01), increase the protein expression of ACE2 in kidney (< 0.01).Compoundextract can alleviate liver-fire hyperactivity syndrome in hypertensive model rats, improve the endothelial status of hypertensive model rats, and its hypotensive mechanism may be related to the inhibition of RAAS over activation.
(L.) Des Moul.; hypertension; liver-fire hyperactivity syndrome; renin-angiotensin-aldosterone system; geniposidic acid; hyperoside; buddleoside
R285.5
A
0253 - 2670(2023)14 - 4573 - 11
10.7501/j.issn.0253-2670.2023.14.018
2023-03-24
国家自然科学基金资助项目(81873036);国家自然科学基金资助项目(82003977);浙江省重点研发计划项目(2017C03052,2020C04020);浙江省重点实验室项目(2012E10002)
魏柯健,硕士研究生,主要从事中药药理与新产品开发研究。E-mail: wkj_955@163.com
吕圭源,教授,博士生导师,主要从事中药药理与新产品开发研究。E-mail: lv.gy@263.net
陈素红,研究员,博士生导师,主要从事中药药理与新产品开发研究。E-mail: chensuhong@zjut.edu.cn
[责任编辑 李亚楠]

