山核桃寡核苷酸探针开发及其应用*
苑 轲 黄坚钦 王克涛 夏国华 张启香 徐川梅
(浙江农林大学 省部共建亚热带森林培育国家重点实验室 杭州 311300)
山核桃属(Carya)是胡桃科(Juglandaceae)的一个重要的属,是珍贵的经济林树种,具有极高经济价值,特别是其中的山核桃(Carya cathayensis)和薄壳山核桃(C. illinoinensis),在浙江省干果产业中占重要的地位。山核桃属包括约18 个种,分为北美山核桃种和东亚山核桃种两大组,其中北美山核桃种约11 个种,包括薄壳山核桃、卵形山核桃(C. ovata)及佛罗里达山核桃(C. floridana)等,主要分布在北美;中国山核桃种约6 个种,包括山核桃、云南山核桃(C. tonkinensis)、湖南山核桃(C. hunanensis)、 大别山山核桃(C.dabieshanensis)、贵州山核桃(C. kweichowensis)及喙核桃(C. sinensis)等,分别分布于浙江、云南、湖南、安徽及贵州等省的偏远山区(Zhanget al.,2013;刘茂春等,1984)。目前,山核桃属植物相关的细胞遗传学研究多为在染色体计数及传统的核型分析等初级细胞遗传学水平,大部分山核桃种的细胞遗传学研究尚未开展(Chenet al.,1993;吕芳德等,2002;徐川梅,2017)。山核桃属植物染色体数目较多,且染色体形态较小,一些染色体极易断裂,染色体断片与一些小染色体在形态上非常相似,极难区分,严重干扰山核桃属植物染色体计数(徐川梅,2017)。山核桃属植物染色体物理标记非常缺乏,已成为制约山核桃属植物细胞遗传学研究的技术瓶颈。
寡核苷酸荧光原位杂交技术(oligonucleotide fluorescence in situ hybridization, Oligo-FISH)是一项新的荧光原位杂交技术(fluorescence in situ hybridization,FISH),该技术以长约几十碱基的单链寡核苷酸为探针,可实现对基因组、染色体和特定染色体区段进行精确鉴定和分析,具有简单、经济和高效的特点(Hanet al.,2015;Duet al.,2017;Brazet al.,2018)。根据序列来源特点,寡核苷酸探针可分为单拷贝序列寡核苷酸探针和重复序列寡核苷酸探针两种类型,其中单拷贝序列寡核苷酸探针主要依据一些染色体序列信息进行设计和开发,目前水稻(Oryza sativa)、玉米(Zea mays)、甘蔗(Saccharumofficinarum)及杨树(Populusspp.)等物种已实现单条染色体单拷贝寡核苷酸探针库的开发及染色体涂染(Liuet al.,2019;Albertet al.,2019;Yuet al.,2021;Xinet al.,2020);第二类为重复序列寡核苷酸探针,这类探针主要基于对植物全基因组测序数据的生物信息学分析,根据高度重复的串联重复序列核心元件进行设计和开发,目前小麦(Triticum aestivum)及花生(Arachis hypogaea)等物种已有很多报道(Duet al.,2016;2018),并在染色体研究和染色体工程育种领域得到大量利用。山核桃已完成全基因组测序工作,测序结果表明,其基因组大小为706.43 Mb,基因组中重复序列元件约占53.67%,说明山核桃具备开发重复序列寡核苷酸探针的潜力(Huanget al.,2019)。本研究利用生物信息学方法分析山核桃基因组中的重复序列,为山核桃开发出重复序列类型的寡核苷酸探针,并利用所开发的寡核苷酸探针对薄壳山核桃、大别山山核桃、云南山核桃、湖南山核桃、贵州山核桃及喙核桃等山核桃种染色体进行分析,以期该研究结果为其他山核桃品种相关研究提供参考。
1 材料与方法
1.1 试验材料
山核桃、湖南山核桃、大别山山核桃、云南山核桃、贵州山核桃、薄壳山核桃及喙核桃7 个不同的山核桃种,其中山核桃主要分布在浙江省天目山山脉,大别山山核桃主要分布在安徽省大别山一带,湖南山核桃主要分布在湖南省,云南山核桃主要分布在云南省哀牢山区,贵州山核桃和喙核桃主要分布在贵州省内,薄壳山核桃由美国引种,种植在浙江农林大学校园内。9—11 月山核桃成熟季节,从不同山核桃种产地收集山核桃、湖南山核桃、大别山山核桃、云南山核桃、贵州山核桃、薄壳山核桃及喙核桃的种子,采样信息见表1。

表1 供试材料Tab. 1 Materials used for this study
1.2 试验方法
1.2.1 材料培育及处理 将7 个不同山核桃种的种子,整齐的摆放到湿润的细沙中,24 ℃条件下催芽生根,待种子根长到3~5 cm 时,剪取不同山核桃种的嫩根,利用0.002 mol·L-1的8-羟基喹啉和0.1%的秋水仙素的混合液进行预处理,根尖利用固定液(甲醇:乙酸=3:1,v/v)进行固定,放入-20 ℃冰箱中保存备用。
1.2.2 染色体标本制备及制片预处理 染色体标本制备参照陈瑞阳等(2003)的方法略进行改进。利用ddH2O 和0.075 mol·L-1的KCl 对根尖进行前低渗处理,之后转入2.5%纤维素和果胶酶的混合液中37 ℃酶解2~2.5 h。酶解结束后,加入固定液制成悬浮细胞,进行染色体滴片。利用相差显微(Olympus BX51)对染色体制片进行观察和筛选,然后利用10 mg·mL-1的RNase A、4%(质量百分比)的胃蛋白酶和多聚甲醛等对制片进行预处理,之后进行荧光原杂交实验。
1.2.3 山核桃重复序列寡核苷酸探针设计和制备1)简单重复序列寡核苷酸探针设计,对于1~3 碱基重复的SSR 简并起来约16 种,分别为A、G、AT、GC、AG、AC、AAC、AAG、AGG、ACT、CAT、CAC、ACG、CAG、AAT 和GCC,对于这16 种SSR 按照30 nt 长度直接合成,并在5'进行荧光修饰。2)其他类型重复序列寡核苷酸探针设计,利用Tandem Repeat Finder 软件预测分析预测山核桃基因组中的串联重复序列(tandem repeats finder: a program to analyze DNA sequences)。具体参数为:匹配权重Match = 2;错配惩罚分值Mismatch = 7;插入缺失惩罚分值Delta = 7;匹配概率PM = 80;插入概率PI = 10;最小比对得分Minscore = 50;重复片段最大长度MaxPeriod = 2 000。预测结果通过Perl 脚本进行汇总分析,分别统计不同长度不同重复类型的重复序列在山核桃全基因组中的出现频率。过滤Period size > 4,筛选超过3 个碱基的复杂重复序列。为了更容易检测到荧光信号,根据此前经验,进一步筛选Copy number > 100,且Period size * Copy number > 3 000 的重复序列,用于设计高重复度的复杂重复序列探针。另外,分别利用小麦的5S rDNA 序列和45S rDNA 与山核桃基因组序列进行比对,根据比对结果,设计出山核桃的sht-5S 和sht-45S寡核苷酸探针序列,所有探针序列均在5'进行FAM或TAMRA 荧光修饰。
1.2.4 山核桃属寡核苷酸荧光原位杂交分析 山核桃寡核苷酸荧光原位杂交参照杜培(2017)的方法略进行改进,每张制片配制15 µL 杂交液(1.5 µL 20×SSC、0.5 µL ssDNA、7.5 µL dFA、2.0 µL 50% DS、1.5 µL 探针,加ddH2O 补充总体积至15 µL),杂交液和制片经变性处理后,37 ℃杂交过夜。杂交结束后,分别利用2×SSC 及1×PBS 进行洗片,利用荧光显微镜100 倍油镜对制片进行观察和拍照,每个山核桃种至少统计30 个细胞。
2 结果与分析
2.1 山核桃重复序列寡核苷酸探针筛选结果
利用山核桃中期染色体对近60 条不同类型的重复序列寡核苷酸探针进行荧光原位杂交分析,结果表明,sht-2、sht-3、sht-4、sht-5、sht-5S 和sht-45S 等6 个寡核苷酸探针可在山核桃染色体上产生相应的荧光信号,具体探针序列信息及修饰方式如表2 所示。 寡核苷酸探针sht-2、sht-3、sht-4 及sht-5 在山核桃染色体上分布情况相似,有2 对信号位点存在,其中1 对位点信号较强,另外1 对位点信号非常微弱,几乎检测不到,且这2 对信号均位于山核桃染色体的近着丝粒部位(图1a1—a4),2 个较强的信号位点极易断裂,特别是其中的1 个位点,已从信号中间或近中间部位完全断裂成2 段,如图1 虚线所示。sht-5S 是基于5Sr DNA 序列设计出的寡核苷酸探针,主要包括sht-5S-1,sht-5S-2 和sht-5S-3 等3 条不同的序列,这3 条序列等比例混合后,可在山核桃染色体上产生稳定的荧光信号(图2a1),且sht-5S 产生的荧光信号与质粒5S rDNA 的荧光信号完全重叠(图2a1--a3),这说明,寡核苷酸探针sht-5S 在功能上可代替质粒5S rDNA 探针进行使用。非常有趣的是,sht-5S 仅在单条山核桃染色体上产生相应的荧光信号,主要位于染色体的近着丝粒部位,另1 条同源染色体的对应位置并未检测到相应的荧光信号(图2a1, a2)。sht-45S 是基于45S rDNA 序列设计的寡核苷酸探针,主要包括sht-45S-1、sht-45S-2、 sht-45S-3、sht-45S-4、sht-45S-5、sht-45S-6、sht-45S-7 及sht-45S-8 等8 条不同的序列,结果表明,8条序列中,仅sht-45S-5 可在山核桃染色体上产生微弱的荧光信号,所产生的荧光信号如图3a1 和a2 虚线圈所示,但这8 条序列等比例混合使用时,所产的荧光信号明显增强(图3a3),进一步观察,可以发现,sht-45S 在山核桃染色体上有2 个信号位点存在,主要位于1 对同源染色体的近着丝粒部位,且其中1 个信号位点极易在中间或近中间部位断裂成2 段,如黄色箭头所示(图3a3),导致山核桃大量细胞中出现3 个明亮的信号位点。双色荧光原位杂交结果证实,寡核苷酸探针sht-45S 产生的荧光信号与质粒45S rDNA 荧光信号完全重叠(图4a1—a3),且信号强度与45S rDNA 相似,这说明寡核苷酸探针sht-45S 寡核苷酸探针在功能上可以代替质粒45S rDNA 探针进行使用。

图1 4 个不同寡核苷酸探针在山核桃染色体上的分布Fig. 1 The distribuiton of four oligo probes on the chromsome of C. cathayensis

图2 寡核苷酸探针sht-5S (绿色)和5S rDNA 探针(红色)在山核桃染色体上的共定位Fig. 2 Colocalization of oligo probe sht-5S (green) and plasmid probe 5S rDNA (red) on the chromsome of C. cathayensis
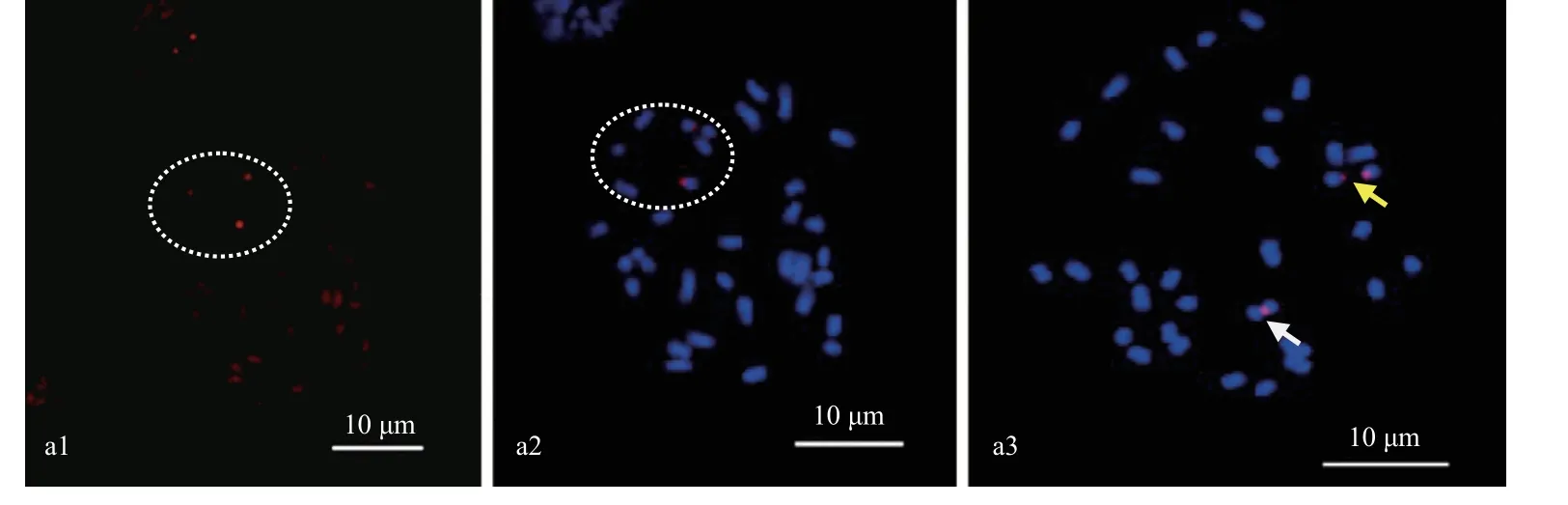
图3 寡核苷酸探针sht-45S-5 在山核桃染色体上的分布Fig. 3 Distribuiton of oligo probe sht-45S-5 on the chromsome of C. cathayensis
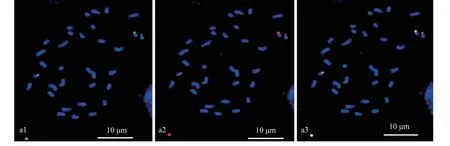
图4 寡核苷酸探针sht-45S (红色)与质粒45S rDNA(绿色)在山核桃染色体上的共定位Fig. 4 Colocalization of oligo probe sht-45S (red) and plasmid probe 5S rDNA (green) on the chromsome of C. cathayensis

表2 6 个不同寡核苷酸探针序列及修饰类型Tab. 2 The sequence and fluorescence modification information of six oligonucleotide probes
2.2 寡核苷酸探针sht-2、sht-3、sht-4 及sht-5 在山核桃染色体上位置关系分析
由于寡核苷酸探针sht-2、 sht-3、sht-4 及sht-5 在山核桃染色体上的分布模式相似,为了进一步对这4个不同寡核苷酸探针的位置关系进行明确,我们对这4 个探针进行了双色荧光原位杂交分析。结果表明,山核桃染色体上sht-2 的2 对信号位点与sht-4 所产生的2 对信号位点在分布位置上完全重叠(图5a1—a3),这说明,寡核苷酸探针sht-2 与sht-4 具有相同的功能。sht-3 与sht-4 在山核桃染色体上的双色荧光原位杂交结果表明,sht-3 在山核桃染色体上产生的信号位点与sht-4 所产生的信号位点在位置上也完全重叠(图5b1—b3),这说明寡核苷酸探针sht-3 与sht-4 具有相同的功能。sht-3 与sht-5 双色荧光原位杂交结果表明,sht-3 在山核桃染色体上的分布位置与sht-5 也完全重叠(图5c1—c3)。以上结果说明,sht-2、sht-3、sht-4 及sht-5 虽然序列不同,但这4 个探针具有相同的功能,可作为1 个探针进行使用。

图5 寡核苷酸探针sht-2、sht-3、sht-4 及sht-5 在山核桃染色体上共定位Fig. 5 Colocalization of oligo probe sht-2, sht-3, sht-4 and sht-5 on the chromsome of C. cathayensis
2.3 寡核苷酸探针sht-5、sht-45S 及sht-5S 在山核桃染色体上位置关系分析
因寡核苷酸探针sht-2,sht-3,sht-4 及sht-5 在山核桃染色体上分布位置完全重叠,我们选择sht-5 作为这4 个探针的代表,利用双色荧光原位杂交技术分析了sht-5、sht-45S、及sht-5S 在山核桃染色体上的位置关系。sht-5S 和sht-45S 双色荧光原位杂交结果表明,sht-5S 和sht-45S 分别分布于山核桃的不同染色体上,在分布位置上没有任何重叠(图6a1-a3)。sht-45S 和sht-5 双色荧光原位杂交结果表明,sht-45S 的信号与sht-5 中1 对较强的信号位点完全重叠,也即sht-5 包含了全部sht-45S 的信号,因sht-45S 其中1 个信号位点从近中间部位断开,我们实际观察到3 个较强的信号点(图6b1-b3)。sht-5S 与sht-5 双色荧光原位杂交结果表明,sht-5S 及sht-5 的信号是分布在山核桃的不同染色体上,彼此之间没有任何重叠(图6c1-c3)。
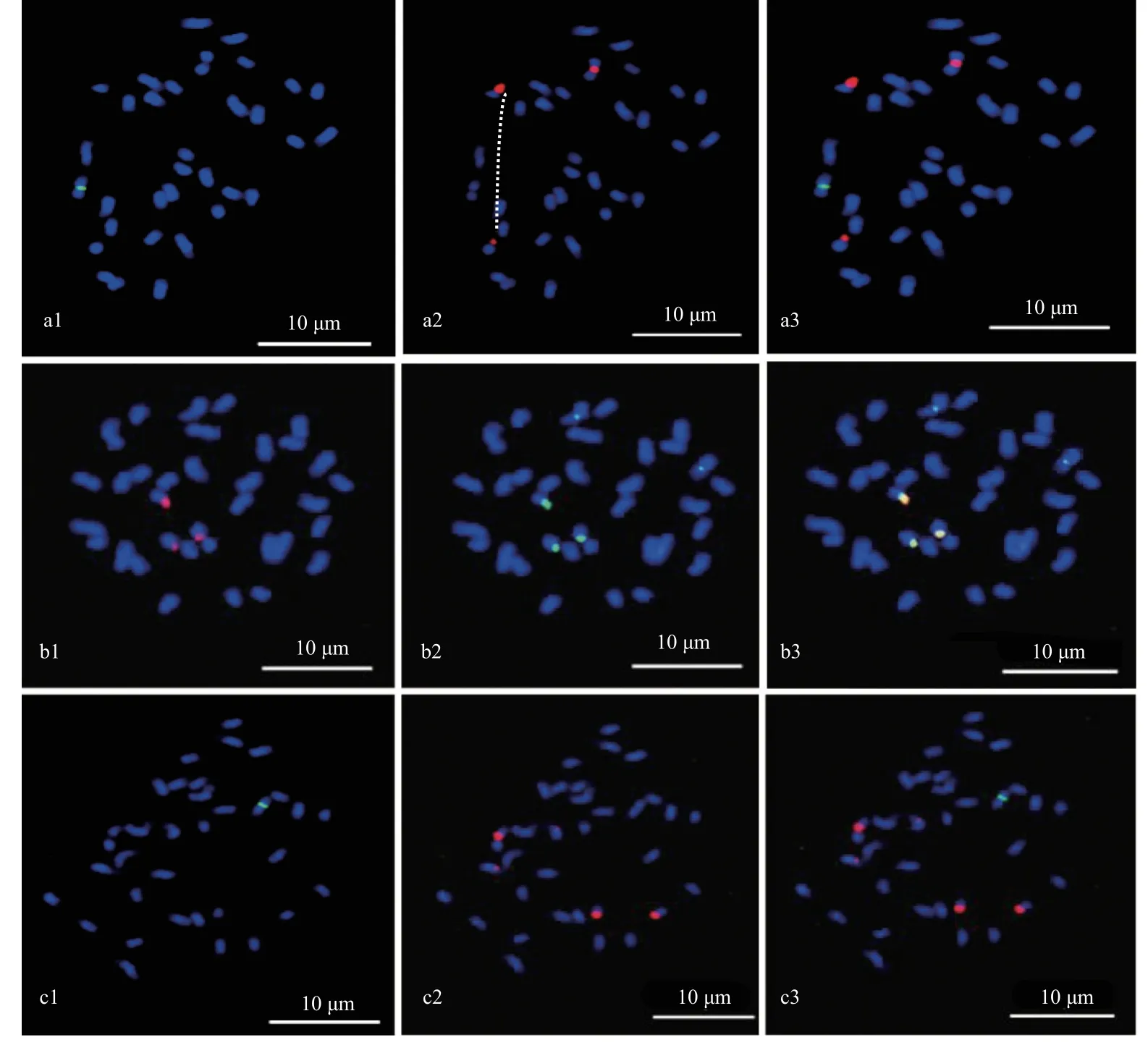
图6 寡核苷酸探针sht-45S、sht-5S 及sht-5 在山核桃染色体上共定位Fig. 6 Colocalization of oligo probe sht-45S, sht-5S and sht-5 on the on the chromsome of C. cathayensis
2.4 寡核苷酸探针sht-5、sht-45S 及sht-5S 在6 个山核桃近缘种染色体上分布
寡核苷酸探针sht-5、sht-45S 及sht-5S 主要是根据山核桃基因组测序数据进行设计和开发,为了进一步验证这3 个探针的应用范围,我们分析了sht-5、sht-45S 及sht-5S 在湖南山核桃、云南山核桃、大别山山核桃、贵州山核桃、薄壳山核桃及喙核桃中期染色体上的分布,这6 个山核桃种染色体数目与山核桃相同,染色体数目均为2n=32。结果表明,sht-5 在湖南山核桃、云南山核桃、大别山山核桃及贵州山核桃这4 个山核桃种染色体上均可产生相应的荧光信号,且信号分布模式与山核桃相似,均只有2 对强弱不同的信号位点存在,且其中一些染色体的信号位点也存在不同程度的断裂,例如湖南山核桃、大别山山核桃及贵州山核桃其中1 条染色体在信号位点处断裂成2 段,云南山核桃有2 条染色体发生了断裂(图7a1-a4),但sht-5 在薄壳山核桃和喙核桃2 个山核桃种染色体上没有任何信号分布(图7a5,a6)。

图7 寡核苷酸探针sht-5 在6 个不同山核桃种染色体上的分布Fig. 7 The distribuiton of oligo probe sht-5 on the chromsome of six different Carya species
另外,寡核苷酸探针sht-45S 和sht-5S 在6 个山核桃近缘野生种上的分布情况与sht-5 不同,所分析的6个山核桃种中,除喙核桃外,寡核苷酸探针sht-45S 和sht-5S 在湖南山核桃、云南山核桃、大别山山核桃、贵州山核桃及薄壳山核桃这5 个山核桃种染色体上均可产生相应的荧光信号(图7,8)。其中,寡核苷酸探针sht-45S 在湖南山核桃、大别山山核桃及贵州山核桃3 个山核桃种染色体上的分布模式相似,均只有1对信号位点存在,且这对信号位点极易断裂,例如大别山山核桃,其1 个sht-45S 信号位点已完全断开,断开的2 条染色体臂,其中1 条染色体臂保留了大部分sht-45S 荧光信号,另1 条断开的染色体臂仅保留少量的sht-45S 荧光信号,如白色虚线所示(图8a, c, d)。sht-45S 在云南山核桃染色体上有2 种不同的分布模式,第一种分布模式与山核桃情况相似,sht-45S 在云南山核桃染色体上有2 个信号位点存在,位于1 对同源染色体的近着丝粒处,且其中1 条染色体的sht-45S信号位点存在一定程度断裂,如白色虚线所示(图8b1),这种分布类型的细胞约占91.7%。第二种分布模式中,sht-45S 在云南山核桃染色体上有3 个信号位点存在,其中较强的1 对信号位点位于1 对同源染色体的近着丝粒处,第3 个位点非常微弱,有时甚至检测不到,单独位于1 条染色体的近着丝粒区域,如白色箭头所示(图8b2),另外,2 个较强的信号位点中,其中1 个位点极易断裂,如图中白色虚线所示(图8b2),这种分布类型的细胞所占比例约为8.3%。sht-45S 在薄壳山核桃染色体上主要有2 对信号位点存在,位于2 对同源染色体的近着丝粒区域,且其中1 对sht-45S 信号位点也存在一定程度的断裂(图8f)。
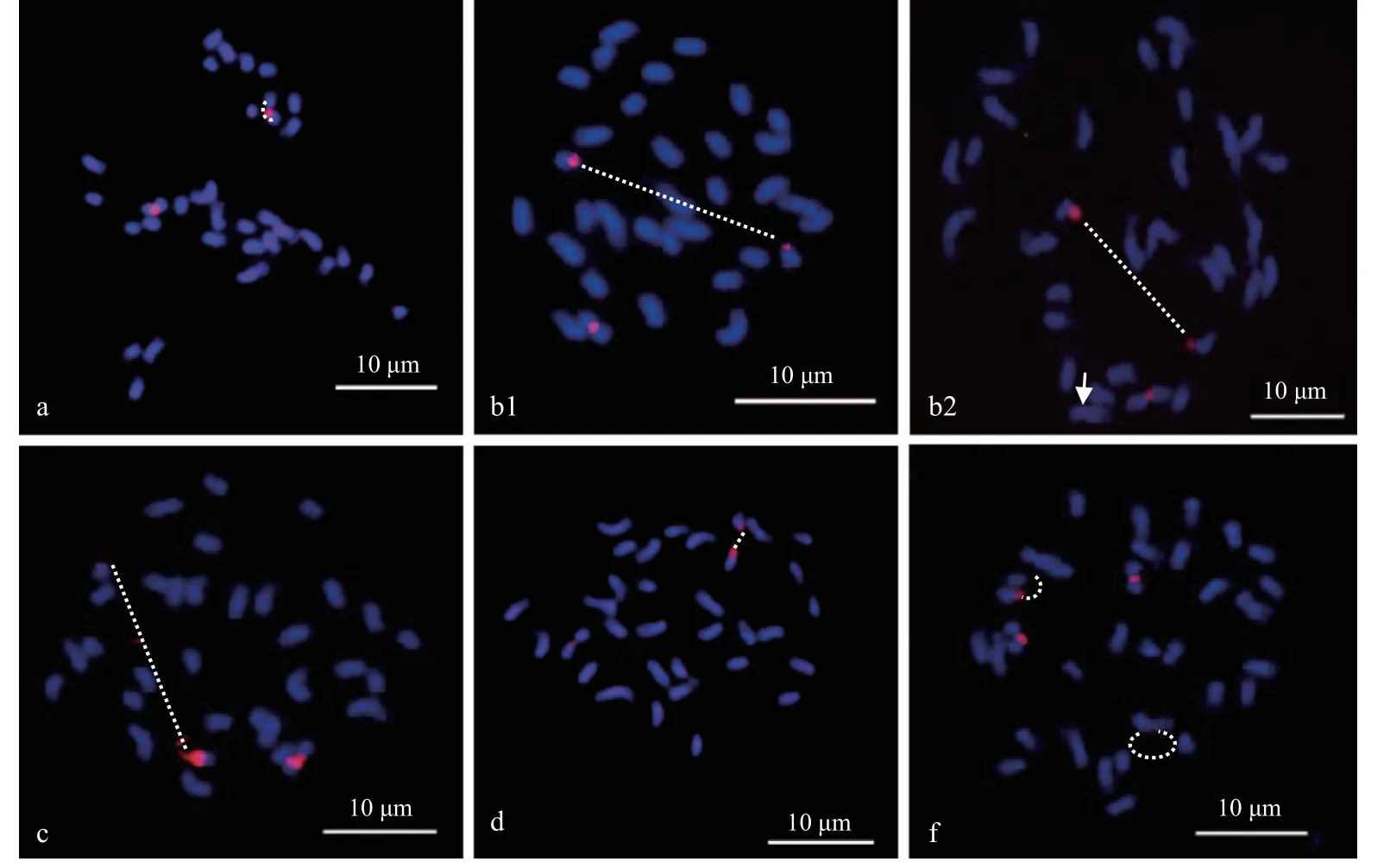
图8 寡核苷酸探针sht-45S 在5 个不同山核桃种染色体上的分布Fig. 8 The distribuiton of oligo probe sht-45S on the chromsome of five different Carya species
sht-5S 在湖南山核桃染色体上有2 种不同的分布模式,第一种分布模式与山核桃相似,仅在其单条染色体上产生相应的荧光信号,主要位于染色体的近着丝粒部位,另1 条同源染色体的对应位置并未检测到相应的荧光信号(图9a1),这种分布类型的细胞约占55.23%;第二种分布类型中,具有1 强1 弱2 个sht-5S信号位点,位于1 对同源染色体的近着丝粒区域,如图9 a2 箭头所示,这种分布类型的细胞约占44.77%。sht-5S 在云南山核桃及大别山山核桃分布情况相似,均只有1 对信号位点存在,分布于1 对同源染色体的近着丝粒区域(图9b,c),sht-5S 在贵州山核桃和薄壳山核桃染色体上的分布模式相似,具有1 强1 弱2 个sht-5S 信号位点,如箭头所示,位于1 对同源染色体的近着丝粒区域(图9d,e)。

图9 寡核苷酸探针sht-5S 在5 个不同山核桃种染色体上的分布结果Fig. 9 The distribuiton of oligo probe sht-5S on the chromsome of five different Carya species
3 讨论
在植物分子细胞遗传学研究中,荧光原位杂交技术是一项非常重要的实验技术,该技术在植物外源染色体鉴定、多倍体演化分析、染色体物理作图及核型分析等方面发挥了重要的作用(Jiang,2019;Donget al.,2000;Caiet al.,2014;Heet al.,2015)。利用该技术对植物染色体进行相关研究时,一般需要有充足合适的荧光探针,也即染色体物理标记,染色体物理标记的数量和种类在一定程度上对荧光原位杂交技术应用的广度和深度有着重要影响,例如水稻、黄瓜、玉米、小麦等一些农艺植物,其染色体物理标记数量和种类较多,因此其相关的分子细胞遗传学研究发展也非常迅速,且相关的细胞遗传学研究水平也远远高于染色体物理标记非常匮乏的一些物种。传统的染色体物理标记主要是通过筛选相应的BAC 或TAC 文库而获得,开发过程不仅繁琐,而且还需要有高精度的遗传图谱作参考,例如水稻、马铃薯等一些染色体特异物理标记均是利用遗传图谱上的遗传标记去筛选相应的BAC 文库而获得(Donget al.,2000;Chenget al.,2002)。对林木植物而言,多数林木植物童期长达10年或十年以上,很难大规模构建遗传作图群体,目前大多数林木植物没有相应的遗传图谱,在染色体物理标记开发方面存在较大难度,因此目前包括山核桃属植物在内的多数林木植物几乎没有可用的染色体物理标记,这也成为制约林木植物细胞遗传学发展的技术瓶颈。本研究首次从山核桃基因组中成功开发出了sht-2、sht-3、sht-4、sht-5、sht-5S 和sht-45S 等6 个不同的寡核苷酸类型的染色体物理标记,虽然开发的染色体物理标记数量较少,但该研究结果使山核桃属植物结束了无染色体物理标记可用的历史,同时也为山核桃属植物建立了一种新的染色体物理标记开发方法。
质粒探针在进行FISH 实验时,一般需要经过质粒提取、探针标记等繁琐步骤,且杂交时间较长,至少需要6 小时以上。与质粒探针相比,寡核苷酸探针具有很多独特的优势,寡核苷酸探针不仅省去了质粒提取和探针标记等繁琐步骤,而且杂交时间大幅度缩短,大部分寡核苷酸探针杂交2 小时即可检测到清晰的荧光信号,有些寡核苷酸探针,例如小麦的寡核苷酸探针(GAA)10、花生的寡核苷酸探针DP-2 和 DP-4 等,杂交30 分钟即可检测到清晰的荧光信号 (Duet al.,2019;杜培,2017) ,这极大地提高了荧光原位杂交的效率。更重要的是寡核苷酸探针主要是根据测序数据进行开发和设计,不需要相应的遗传图谱作参照,也不需要筛选相应的BAC 文库,这为林木植物相关的细胞遗传学研究提供了一个新的研究方向。本研究中的sht-45S 和sht-5S 是基于山核桃基因组中的45S rDNA 和5S rDNA 序列所开发的2 个寡核苷酸类型的探针,不仅可代替质粒探针45S rDNA 和5S rDNA对山核桃属植物染色体进行研究和分析,而且使山核桃属植物相关的荧光原位杂交技术流程变得更加简化和高效。
山核桃属植物在地理分布上呈典型的间断分布,间断分布于北美和东亚地区,一些分子系统学研究结果表明,包括薄壳山核桃在内的12 个美国山核桃种聚为一大类,山核桃、云南山核桃、湖南山核桃、贵州山核桃、大别山核桃及喙核桃等一些中国山核桃种聚为另一大类,与山核桃属植物间断分布的地理格局完全吻合(Zhanget al.,2013;Huanget al.,2019)。本研究从山核桃基因组中所开发的寡核苷酸探针sht-5,在5个中国山核桃种山核桃、云南山核桃、湖南山核桃、贵州山核桃及大别山核桃染色体上均有信号分布,但在美国山核桃种薄壳山核桃染色体上却没有相应的信号分布,这在一定程度上与山核桃属植物间断分布格局及相应的分子系统学研究结果存在一定的一致性。另外,sht-5 包含了sht-45S 的全部信号位点,有趣的是,在薄壳山核桃染色体上检测到了sht-45S 的信号位点,却未检测到sht-5 的荧光信号,我们推测,因45S rDNA 在植物进化过程中高度保守,在很多物种染色体上均可产生荧光信号(Roaet al.,2012),本研究所开发的寡核苷酸探针sht-45S 是基于山核桃基因组中的45S rDNA 序列而获得,具有较强的保守性,因此在薄壳山核桃染色体上产生了相应的荧光信号,而sht-5 在山核桃属植物中存在一定的分化,保守性没有sht-45S 强,因此在亲缘关系较近的云南山核桃、大别山山核桃、湖南山核桃及贵州山核桃染色体上有分布,而在亲缘关系较远的薄壳山核桃染色体上没有分布。另外,本研究所开发的寡核苷酸探针sht-5、sht-5S 和sht-45S 在喙核桃染色体上均未产生任何荧光信号,喙核桃在系统分类上,最初是归属到喙核桃属(Annamocarya),后来一些研究者根据一些分子生物学研究结果,将其归到山核桃属(Manoset al.,2001;Zhanget al.,2013),根据我们的细胞学研究结果,我们推测喙核桃与山核桃存在较远的亲缘关系,在系统分类上可能归到喙核桃属更为合适。
研究表明,植物染色体结构变异在自然界中经常发生,染色体结构变异主要包括断裂、融合、倒位、易位、重复和缺失等,例如苔属植物(Carex)、菊属植物(Reichardia)及兰属植物(Heterotaxis)等存在广泛的染色体断裂与融合现象(Chunget al.,2011;Moraeset al.,2016;Yakovlevet al.,2017)。本研究表明,山核桃、云南山核桃、大别山核桃、贵州山核桃、湖南山核桃及薄壳山核桃等山核桃种,其一些sht-5 或sht-45S 信号位点处存在明显的断裂现象,特别是其中的山核桃,其染色体上具有2 个(sht-45S)45S rDNA 信号位点,分布于1 对同源染色体近着丝点上,但是其中1 条染色体易从45S rDNA 位点的中间或近中间位置断开,断开后的45S rDNA 片段变成2 个荧光信号较强的位点,因此,在大量的细胞及染色体分裂相中观察到3 个清晰明亮的45S rDNA 信号位点(约95%以上),这对我们的实验结果判读造成了极干扰,我们课题组曾经将山核桃的45S rDNA 信号位点误判成3 个(徐川梅,2017)。一些研究证实,45S rDNA 是一个脆性位点,该区域的DNA 重复序列极易断裂,是一个重组热点区域(Rochaet al.,2015),山核桃、云南山核桃、湖南山核桃、贵州山核桃及大别山山核桃等山核桃种的45S rDNA 位点存在着不同程度的断裂,说明这些山核桃种的45S rDNA 区域也是一个脆性区域。
理论上同源染色体在序列组成上是相同的,对应的sht-5S(5S rDNA)分布模式也应完全相同,但山核桃和湖南山核桃5S rDNA 表现出了明显的异质性,只有1 条染色体上具有荧光信号,另1 条同源染色体上没有检测到任何荧光信号。一些研究证实,其他一些植物中也存在5SrDNA 异质分布现象,例如Philodendron bipennifolium具有3 个5S rDNA 位点,2 个以成对形式位于1 对同源染色体的长臂近端处,另外1 个位点单独位于1 条染色体的短臂处,Philodendron glaziovii2个5S rDNA 位点在形态大小及信号强度上存在极大差异(Vasconceloset al.,2018)。另外,我们课题组利用45S rDNA 和5S rDNA 对竹类植物染色体结构进行分析时,发现5S rDNA 在部分竹种染色体上也存在一定的异质性分布,例如金镶玉竹(Phyllostachys aureosulcataf.spectabilis)及紫竹(Phyllostachys nigra)等竹种,具有3 个5S rDNA 位点,明显不对称(数据即将发表)。一些研究者认为染色体间不等交换、易位、DNA 序列删除和丢失或者rDNA 区域染色体结构的快速重排等均可导致rDNA 异质性现象产生(Mondinet al.,2011)。因此,根据5S rDNA 在山核桃和湖南山核桃染色体上的分布结果,我们推测山核桃和湖南山核桃在染色体结构上可能也发生过诸如插入、缺失、易位及不等交换等类型的染色体重组现象,进而导致5S rDNA 在山核桃染色体上呈现出了一定的异质性分布。另外,还有一些研究表明,山核桃和湖南山核桃存在一定的无融合生殖现象,因此,存在异质分布的5S rDNA 可以通过母本稳定的遗传下去。
4 结论
本研究基于山核桃全基因组测序数据,首次为山核桃开发出为sht-2、sht-3、sht-4、sht-5、sht-45S 及sht-5S 等6 个不同的寡核苷酸探针,这6 个探针在山核桃、湖南山核桃、云南山核桃、大别山山核桃及贵州山核桃等5 个山核桃种染色体上均可产生稳定的荧光信号,可作为研究这5 个不同山核桃种染色体结构的物理标记。sht-2、sht-3、sht-4 及sht-5 虽然序列不同,但具有相同功能,可作为一个染色体物理标记进行使用。sht-45S 及sht-5S 是基于山核桃的45S rDNA 和5S rDNA 进行设计和开发,且sht-45S 和sht-5S 与质粒探针45S rDNA 和5S rDNA 在山核桃染色体上的分布位置完全重叠,且信号强度也与质粒探针相似,可用来代替45S rDNA 和5S rDNA 进行使用。另外,根据sht-5、sht-45S 及sht-5S 在山核桃、湖南山核桃、云南山核桃、大别山山核桃及贵州山核桃等5 个山核桃种染色体上分布特点,我们推测这5 个山核桃种的部分染色体在结构上可能发生过一定断裂或重接等遗传变异。

