具有脲酶抑制活性的喹啉类饲料添加剂的合成及活性研究
侯延生,王春光,汪贞贞,杨维晓
(河南湾流生物科技有限公司,河南 洛阳 471003)
饲料添加剂可以使饲料更好地发挥功效,弥补饲料营养不平衡,改善畜禽的质量,对畜禽的生长和疾病的预防都有着积极意义[1]。牛在饲养过程中会遇到发生胃肠炎等症状,引发牛胃肠炎的因素多种多样,如饲料变质、卫生条件差、病菌入侵等[2]。有研究发现,牛胃中脲酶水解尿素生成氨的速率过快,无法与挥发性脂肪酸的生成速度匹配,会导致氨在瘤胃中吸收入血,降低反刍动物对尿素氮的利用,可造成动物氨中毒[3]。牛胃中氨过多导致的氨中毒会损伤胃壁细胞,进而导致牛发生胃肠炎[4],如果有一种药物分子既能够抑制脲酶的活性,又能够提高牛的免疫力[5],对牛类饲养具有很重要的意义。
喹啉类化合物是重要的萘系含氮杂环化合物,因其具有广泛的生物活性,被广泛应用于药物及其他活性物质的研发中,是许多农药和医药的重要的骨架,如抗生素、抗疟药等[6-7]。由于喹啉环具有很强的生物活性,因此可以在其结构中引入不同的官能团来改变其活性[8]。例如在医药方面厄洛替尼和埃克替尼还有吉非替尼就是具有喹啉结构的经典临床药物[9]。我们团队联合南开大学,利用埃克替尼结构上具有端基炔的结构特点,通过点击反应得到一系列结构新颖的化合物,该类化合物针对IDO1具有良好的抑制效果。希望该类化合物能够在开发饲料添加剂中也有所应用,所以在喹啉结构上设计了结构新颖的化合物,希望对IDO1和脲酶都具有抑制作用。
1 实验部分
1.1 试剂与仪器
DF-102S恒温加热磁力搅拌器(河南予华仪器);YRE-2020旋转蒸发仪(河南予华仪器);Bruker AV400型核磁共振仪(布鲁克公司)。
N-Boc-3,4-二羟基苯胺(98%,偶合化学);2-氯乙基甲基醚(99%,国药集团);三光气(95%,阿拉丁试剂);三氯氧磷(98%,国药集团);4-碘苯胺(99%,阿拉丁试剂);三氟甲磺酸铜(98%,国药集团);对甲苯磺酰肼(98%,国药集团);1-氨基吡啶碘(98%,国药集团);2,4-二(三氟甲基)苯乙醛(98%,偶合化学);其余试剂均为市售分析纯。
1.2 合成方法
1.2.1 3,4-二(2-甲氧乙氧基)苯胺的合成

在反应瓶中把N-Boc-3,4-二羟基苯胺23 g和碳酸钾14 g加入到N,N-二甲基甲酰胺400 mL中,在氮气保护下加热至90 ℃搅拌30 min,然后再缓慢加入溶有2-氯乙基甲基醚25 g的N,N-二甲基甲酰胺溶液200 mL,在90 ℃条件下继续反应14 h,TLC监控N-Boc-3,4-二羟基苯胺反应完全,使用油泵真空蒸除N,N-二甲基甲酰胺约500 mL,然后把浓缩物加入二氯甲烷500 mL中,搅拌均匀后在0~10 ℃条件下加入2 mol/L的盐酸500 mL,搅拌反应5 h,分出有机相,水相再用二氯甲烷150 mL 萃取反应液4次,合并有机相,有机相再用氢氧化钠饱和溶液调节pH值为8,分出有机相,有机相经干燥后浓缩得到3,4-二(2-甲氧乙氧基)苯胺20.72 g;LC-MS(ESI):m/z 242 [M+H]+。
1.2.2 3,4-二(2-甲氧乙氧基)苯甲脒的合成
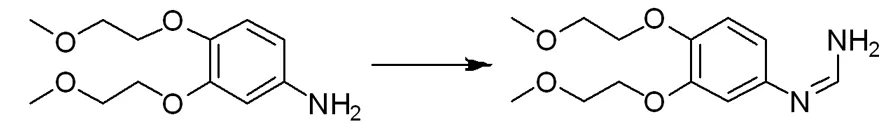
在反应瓶中把3,4-二(2-甲氧乙氧基)苯胺24 g加入甲酰胺400 mL中,再加入甲酸铵20 g,在氮气氛围下,缓慢加热至140 ℃,反应16 h,TLC监控3,4-二(2-甲氧乙氧基)苯胺反应完全,冷却至室温,向反应液中加入乙酸乙酯800 mL和水600 mL,搅拌1 h,然后分出有机相,再用乙酸乙酯200 mL萃取水相多次,合并有机相用饱和的氯化钠溶液300 mL洗涤两次,经无水硫酸镁干燥后在真空条件下浓缩后得到3,4-二(2-甲氧乙氧基)苯甲脒22.09 g;LC-MS(ESI):m/z 269[M+H]+。
1.2.3 6,7-二甲氧乙氧基喹唑啉-4-酮的合成
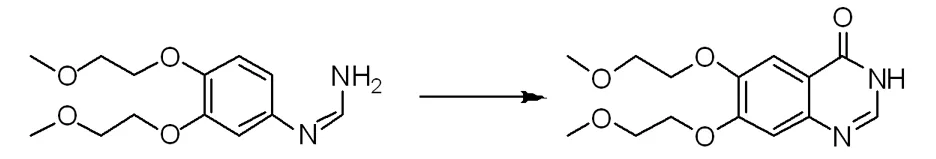
在带有氮气保护和温控装置的反应瓶中,把3,4-二(2-甲氧乙氧基)苯甲脒27 g加入氯仿500 mL中,搅拌均匀后降温至0 ℃,缓慢滴加溶有三光气36 g的氯仿300 mL,保持温度稳定,滴加完后搅拌1 h,浓缩反应液,在通过反复多次加入环己烷和乙腈的混合溶液200 mL(体积比为2∶1),真空蒸除进而除去反应体系中残余的水份和三光气的副产物,最后向浓缩的反应体系中加入四氢呋喃400 mL和乙醚200 mL的混合液,在氮气保护下,加入碘化铝4.2 g,0~10 ℃的条件下,搅拌均匀后保持氮气环境,缓慢滴加溶有三氟化硼乙醚20 g的乙醚溶液100 mL,滴加完全后搅拌反应1 h,再向反应体系中加入氯化硼2.4 g,保持氮气氛围,反应温度控制在不超过10 ℃,滴加结束后继续搅拌反应1 h,升至室温,过滤反应液,过滤后真空浓缩蒸除有机溶剂后加入苯和环己烷和丙酮的混合溶液400 mL(体积比为1∶1∶2),加热至回流,然后趁热过滤,后放至0 ℃结晶,抽滤后固体经硅胶柱层析分离得到6,7-二甲氧乙氧基喹唑啉-4-酮19.58 g;LC-MS(ESI):m/z 295 [M+H]+;1H NMR(400 MHz,DMSO-d6):δ7.97(s,1H),7.47(s,1H),7.16(s,1H),4.27~4.19(m,4H),3.74~3.70(m,4H),3.37~3.35(m,6H)。
1.2.4 4-氯-6,7-二(2-甲氧基乙氧基)喹唑啉的合成

在带有搅拌的反应瓶中把6,7-二甲氧乙氧基喹唑啉-4-酮30 g和三氯氧磷100 g加入到N,N-二甲基甲酰胺600 mL中,搅拌均匀后缓慢升温至110 ℃,搅拌4.5 h反应结束,在0~10 ℃条件下加入饱和碳酸氢钠溶液800 mL,搅拌20 min,用二氯甲烷300 mL萃取多次,合并有机相,然后用饱和食盐水200 mL洗涤一次,再用水100 mL洗涤多次,用无水硫酸钠干燥后浓缩得到4-氯-6,7-二(2-甲氧基乙氧基)喹唑啉26.43 g;LC-MS(ESI):m/z 313 [M+H]+。
1.2.5 4-胺基-6,7-二(2-甲氧基乙氧基)喹唑啉的合成
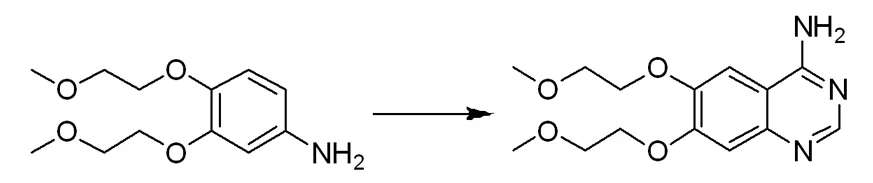
在反应瓶中把3,4-二(2-甲氧乙氧基)苯胺24 g加入二氯乙烷400 mL中,再加入N-氯代丁二酰亚胺15 g,加热至回流反应5 h后浓缩反应液并加入N,N-二甲基甲酰胺500 mL中,再加入甲酰胺5 g和氢氧化钡17 g和磷酸二氢钾14 g,缓慢加热至100 ℃,搅拌反应5 h,然后降温至50 ℃加入甲酰胺10 g和二(三苯基膦)二氯化钯2.4 g和碘化钾8.5 g和四氢呋喃200 mL,在氮气氛围下,缓慢加热至90 ℃搅拌反应7 h,真空蒸除四氢呋喃,然后把剩余的反应体系倒入水800 mL中,搅拌过滤,向滤液中加入乙酸乙酯800 mL,搅拌30 min后分出有机相,有机相用饱和的氯化钠溶液300 mL洗涤两次,经无水硫酸镁干燥后在真空条件下浓缩后得到4-胺基-6,7-二(2-甲氧基乙氧基)喹唑啉27.11 g;LC-MS(ESI):m/z 294[M+H]+。
1.2.6N-(4-乙酮苯基)-6,7-双(2-甲氧乙氧基)-4-喹啉胺的合成
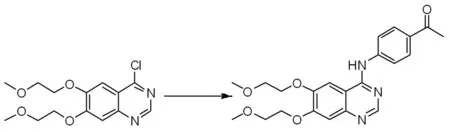
在带有搅拌的反应瓶中,把4-氯-6,7-二(2-甲氧基乙氧基)喹唑啉31 g加入N,N-二甲基甲酰胺1 000 mL中,再加入4-碘苯胺22 g,加热至80 ℃,反应5 h,然后降至室温后加入醋酸钯3.4 g和三苯基膦13 g和三乙胺10 g,在氮气保护下,室温条件下缓慢滴加溶有乙烯氧基三甲基硅烷17.5 g的二甲基亚砜溶液200 mL,保持室温条件缓慢滴加,滴加完全后在氮气保护下升温至90 ℃反应5 h,再次降至室温,过滤反应液,滤液中加入水1 000 mL搅拌,然后用二氯甲烷400 mL萃取多次,合并有机相,真空浓缩蒸除有机溶剂后经硅胶柱层析分离得到N-(4-乙酮苯基)-6,7-双(2-甲氧乙氧基)-4-喹啉胺31.17 g;1H NMR(600 MHz,CDCl3):11.43(s,1H),8.89(s,1H),8.41(s,1H),8.09~8.07(m,2H),7.95(d,J=12.0Hz,2H),7.40(s,1H),4.41~4.36(m,4H),3.80~3.76(m,4H),3.39(s,3H),3.36(s,3H),2.65(s,3H)。
1.2.7N-(3-乙酮苯基)-6,7-双(2-甲氧乙氧基)-4-喹啉胺的合成

在反应瓶中把4-胺基-6,7-二(2-甲氧基乙氧基)喹唑啉30 g加入N,N-二甲基甲酰胺1 200 mL中,再加入1,3-二碘苯33 g,加热至60 ℃,反应1 h后加入醋酸钯3.4 g和三苯基膦13 g 和三乙胺10 g,在氮气保护下,室温条件下,缓慢滴加溶有乙烯基丁基醚20 g的二甲基亚砜溶液250 mL,保持室温条件缓慢滴加,在氮气保护下升温至120 ℃反应2.5 h,再次降至室温,过滤反应液,滤液中加入水1 400 mL,然后用二氯甲烷500 mL萃取多次,合并有机相,真空浓缩蒸除有机溶剂后经硅胶柱层析分离得到N-(3-乙酮苯基)-6,7-双(2-甲氧乙氧基)-4-喹啉胺38.67 g;LC-MS(ESI): m/z 412 [M+H]+;1H NMR (600 MHz,DMSO-d6):δ11.05 (s,1H),8.86 (s,1H),8.21 (s,1H),8.16 (s,1H),8.00~7.98 (m,1H),7.92 (d,J=12.0 Hz,1H),7.68~7.66 (m,1H),7.30 (s,1H),4.36~4.32 (m,4H),3.81~3.78 (m,4H),3.38 (s,3H),3.37 (s,3H),2.64 (s,3H)。
1.2.8 目标化合物A的合成

在带有搅拌和分水器的反应瓶中,把N-(4-乙酮苯基)-6,7-双(2-甲氧乙氧基)-4-喹啉胺41 g和碘化钾17 g加入苯1 000 mL中,搅拌10 min加入三氟甲磺酸铜18 g,搅拌10 min后缓慢滴加溶有三氯氧磷19 g的苯溶液200 mL,加热至回流,通过分水器除去反应体系中的水,反应8.5 h,然后过滤反应液,真空浓缩除去大部分溶剂,然后倒入二氯甲烷1 000 mL中,搅拌状态下用碳酸钠饱和溶液调节体系pH值为中性,分出有机相,有机相用水洗涤多次,然后浓缩后加入二甲基亚砜1 000 mL中,加入对甲苯磺酰肼19 g和1-氨基吡啶碘22.5 g和碘17 g,加热至100 ℃搅拌反应1h,然后把反应液倒入水1 200 mL中,用二氯甲烷500 mL萃取多次,合并有机相,浓缩后经硅胶柱层析分离提纯得到化合物A 37.82 g; LC-MS(ESI): m/z 435[M+H]+;1H NMR (600 MHz,CDCl3)δ11.73 (s,1H),9.79~9.76 (m,1H),9.05 (s,1H),8.46 (s,1H),8.09~8.07 (m,1H),7.86 (s,1H),7.55 (s,1H),7.49 (t,J1=6.0Hz,J2=6.0 Hz,1H),4.35~4.32 (m,4H),3.79~3.76 (m,4H),3.38 (s,3H),3.36 (s,3H)。
1.2.9 目标化合物B的合成

在带有搅拌和分水器的反应瓶中把4-胺基-6,7-二(2-甲氧基乙氧基)喹唑啉30 g和碳酸钾14 g加入苯1 200 mL中,再加入2,4-二(三氟甲基)苯乙醛26 g,加热至100 ℃,反应1 h后加入碘化钾3.4 g和三氟甲磺酸铜18 g,在氮气保护下,保持室温条件缓慢滴加溶有三氯氧磷19 g的苯溶液200 mL,然后在氮气保护下升温至回流,通过分水器除去反应体系中的水,反应7.5 h降至室温,过滤反应液,滤液中加入水1 400 mL,然后用二氯甲烷500 mL萃取多次,合并有机相,真空浓缩蒸除有机溶剂后经硅胶柱层析分离得到化合物B 32.18 g;LC-MS(ESI): m/z 530[M+H]+;1H NMR (600 MHz,CDCl3)δ9.27 (s,1H),7.99 (s,1H),7.67~7.64 (m,2H),7.56 (s,1H),7.48 (d,J= 6.0 Hz,1H),7.45 (s,1H),4.36~4.32 (m,4H),3.77~3.74 (m,4H),3.39 (s,3H),3.37 (s,3H)。
1.2.10 目标化合物C的合成

在带有搅拌和分水器的反应瓶中,把4-氯-6,7-二(2-甲氧基乙氧基)喹唑啉31 g加入乙醇1 000 mL中,在0 ℃条件下,缓慢滴加水合肼50 g,滴加完后保持温度不超过10 ℃反应1.5 h,置于0 ℃搅拌过滤,再加入乙醇1 000 mL中,再加入三乙胺10 g和2-氟-4-溴-苯甲醛20 g,在氮气保护下,加热至回流反应5h,真空浓缩后加入苯1 000 mL中,再加入碘化钾3.4 g和三氟甲磺酸铜18 g,在氮气保护下,保持室温条件缓慢滴加溶有三氯氧磷19 g的苯溶液200 mL,在氮气保护下升温至回流,通过分水器除去反应体系中的水,反应7.5 h降至室温,过滤反应液,滤液中加入水1 400 mL,然后用二氯甲烷500 mL萃取多次,合并有机相,真空浓缩蒸除有机溶剂后经硅胶柱层析分离得到化合物C 41.07 g;LC-MS(ESI): m/z 491[M+H]+;1H NMR (600 MHz,CDCl3)δ9.25 (s,1H),7.64 (d,J=12.0 Hz,2H),7.57 (s,1H),7.43 (d,J= 6.0 Hz,1H),7.38~7.36 (m,1H),4.35~4.31 (m,4H),3.78~3.75 (m,4H),3.38 (s,3H),3.37 (s,3H)。
1.2.11 目标化合物D的合成

在带有搅拌的反应瓶中,把N-(3-乙酮苯基)-6,7-双(2-甲氧乙氧基)-4-喹啉胺41 g加入到N-甲基吡咯烷酮1 000 mL中,室温搅拌反应1 h,然后加入对甲苯磺酰肼20 g和氢氧化钡17 g和碘25 g,加热至80 ℃,保持该温度搅拌反应2.5 h,然后加入2-氟-4-溴苄胺20 g和醋酸铜9 g,在氧气氛围下,继续反应2 h,把反应体系中加入水2 000 mL,搅拌后过滤,滤液用二氯甲烷500 mL萃取多次,合并有机相后用无水硫酸镁50 g干燥后浓缩,最后经过硅胶柱层析分离得到化合物B 59.27 g;LC-MS(ESI): m/z 623 [M+H]+;1H NMR (400 MHz,DMSO-d6):δ9.58 (s,1H),8.63 (s,1H),8.26 (s,2H),7.91 (s,1H),7.66~7.37 (m,6H),5.71 (s,2H),4.32~4.30 (m,4H),3.79~3.77 (m,4H),3.39 (s,3H),3.37 (s,3H)。
1.3 IDO1酶抑制活性研究
通过基于Hela细胞的IDO1酶抑制活性测试方法,对化合物A,B,C,D进行抑制IDO1活性测试,发现这4个化合物针对IDO1的抑制活性IC50分别为9.63,0.79,1.82和0.93 μmol/L。
1.4 脲酶抑制活性研究
对针对IDO1抑制活性好的化合物B和D进行脲酶活性测试,牛经过饲喂1 h后,用特制瘤胃液采集器经人工瘤胃瘘管采集瘤胃液400 mL,通过4层纱布过滤后备用。每个培养管按表1 中的量加入相应的试剂后,滴加4滴液体石蜡,置(39.0±0.5) ℃恒温水浴振荡器上轻摇。分别在培养的8 h,从各组取出部分培养管,立即加入4滴饱和氯化汞溶液并摇匀,以终止反应。用凯氏半微量-饱和氧化镁蒸馏法测定各管氨态氮含量。
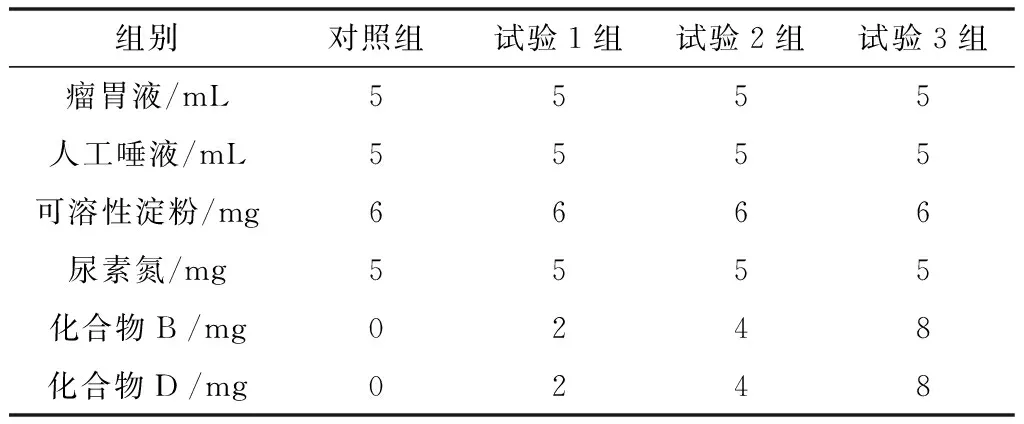
表1 实验材料配置方法
经过8 h的培育后,通过计算公式:抑制率(%)=(对照组氨含量-试验组氨含量)÷对照组氨含量×100%,可以计算每个化合物三个试验组的抑制率(表2所示),可以很直观发现,2个化合物都能够随着浓度的增加,对脲酶的抑制效果逐渐增加,都具有针对脲酶的抑制活性。

表2 4种化合物针对脲酶的抑制效果
2 结论
本文设计了几种结构新颖的喹啉类衍生物,通过活性实验,部分化合物针对IDO1酶具有良好的抑制效果,可以提高机体的免疫能力,同时发现这些化合物对黄牛胃液中采集的脲酶具有一定的抑制效果,可以作为潜在的饲料添加剂。

