三种猕猴桃茎中总生物碱提取工艺优化及抑菌活性分析
刘德江,郭乐乐,田立娟,李 黎,杨天竹,张慧明,李丽丽,夏 俊,
(1.佳木斯大学生物与农业学院,黑龙江佳木斯 154007;2.中-乌农林技术开发与应用国际合作联合实验室,黑龙江佳木斯 154007;3.中国科学武汉植物园,湖北武汉 430074;4.佳木斯大学基础医学院,黑龙江佳木斯 154007)
软枣猕猴桃(Actinidia arguta)、葛枣猕猴桃(Actinidia polygama)及狗枣猕猴桃(Actinidia kolomikta)作为猕猴桃科猕猴桃属三种多年生落叶攀缘藤本植物,分布于北方高寒地区,果实小,表面无毛,自然成熟口感好,含有多种氨基酸、脂肪、蛋白质及大量的三萜、生物碱、甾体及挥发油等各类化学成分,具有丰富的营养价值[1-3]和药用价值[4-6],三种猕猴桃均可作为药食同源的植物。近年来,软枣猕猴桃在东北三省种植面积不断扩大,葛枣猕猴桃和狗枣猕猴桃也有栽培,猕猴桃每年需要进行修剪,会产生大量废弃枝条被丢弃,造成了资源浪费。
研究发现,软枣猕猴桃、葛枣猕猴桃和狗枣猕猴桃中均含有生物碱类物质[7-9],生物碱是传统中药材中的重要活性成分之一,在植物中分布广泛,具有抗病、抗癌和抗肿瘤等作用[10-12]。大多数的生物碱可以抑制细菌细胞壁合成、抑制细菌代谢、抑制核酸和蛋白质合成等方法抑制细菌,具有广泛的抑菌性[13-15]。但是,目前对三种猕猴桃中总生物碱的提取工艺及抑菌活性研究鲜有报道。猕猴桃溃疡病是严重威胁猕猴桃产业发展的主要病害,其是由几种病原菌引起的,包括丁香假单胞杆菌猕猴桃致病变种,此种病菌传播速度快,且一旦感染将很有可能造成大面积植株死亡,造成经济损失。目前没有有效的方法防治猕猴桃溃疡病,使用的药剂大多为化学制剂,对环境、土壤有一定影响[16-18]。
为了解决上述问题,利用猕猴桃废弃枝条提取总生物碱,建立高效的提取方法,并将其应用于软枣猕猴桃溃疡病的防治上,本试验对软枣猕猴桃、葛枣猕猴桃和狗枣猕猴桃茎中总生物碱含量及提取工艺进行系统研究,考察液料比、超声功率、超声时间及乙醇浓度对总生物碱得率的影响,采用响应面法优化其最佳提取工艺,并探究总生物碱对引起猕猴桃病害的几种病原菌的抑菌活性。本研究内容不仅可以建立一种高效的从猕猴桃茎中提取总生物碱的工艺,达到猕猴桃废物利用增加其附加值的目的,并且可以将总生物碱应用于猕猴桃溃疡病的防治,解决传统药剂污染环境及土壤的问题。
1 材料与方法
1.1 材料与仪器
软枣猕猴桃、葛枣猕猴桃及狗枣猕猴桃的根、枝条、叶 均采摘于佳木斯大学农林试验示范基地,经佳木斯大学程海涛副教授鉴定为猕猴桃科猕猴桃属软枣猕猴桃(Actinidia arguta) 、葛枣猕猴桃(Actinidia polygama)及狗枣猕猴桃(Actinidia kolomikta)。将猕猴桃材料阴干,粉碎,过80 目筛,得供试样品,阴凉干燥处保存;无水乙醇、二氯甲烷、冰醋酸、氨水、磷钼酸等试剂 均为分析纯,购自辽宁泉瑞试剂有限公司;盐酸小檗碱标准品 质量分数≥98%,上海麦克林生化科技有限公司;灰葡萄孢菌(Botrytis cinerea,BC)、胶孢炭疽菌(Colletotrichum gloeosporioides,CG)、链格孢(Alternaria alternata,AA)、多主棒孢霉(Corynespora cassiicola,CC)和丁香假单胞杆菌猕猴桃致病变种(Pseudomonas syringaepv.Actinidiae,Psa) 由中国科学院武汉植物园提供。
UV-8000 型紫外可见分光光度计 上海元析仪器有限公司;KQ-500DE 型数控超声清理器 昆山布超声仪器有限公司;YRE-2011 型转转蒸发仪 巩义市予华仪器有限责任公司。
1.2 实验方法
1.2.1 总生物碱定性检测 采用碘-碘化钾法、碘化铋钾法、和磷钼酸法[19]对软枣猕猴桃、葛枣猕猴桃及狗枣猕猴桃的根、茎、叶中的总生物碱进行初步检测。将采集的软枣猕猴桃、葛枣猕猴桃及狗枣猕猴桃的根、茎、叶洗净烘干、粉碎至粉末状,过60 目筛,分别称取各部分粉末5.0 g 置于烧杯中,加入100 mL 95%乙醇浸泡24 h,超声功率400 W 超声30 min,过滤,滤液减压浓缩得浸膏,向浸膏中加入2%盐酸20 mL 酸化,静置,过滤,20 mL 的盐酸清洗残渣,过滤,合并滤液,用30 mL 二氯甲烷萃取,留二氯甲烷层重复萃取两次。在上层酸水层中加入浓氨水调节pH 至10,再用等体积二氯甲烷萃取3 次,合并所有氯仿层,旋转蒸发得浸膏,即为总生物碱样品。
将各部分旋转蒸发后所得浸膏溶于5 mL 二氯甲烷,制成总生物碱样品溶液。取各部分总生物碱样品溶液2 mL 置于试管中,分别加入1~2 滴新配制的碘-碘化钾溶液、改良碘化铋钾溶液、磷钼酸溶液,静置1 h,观察各试管现象。
1.2.2 标准品溶液及样品溶液的制备 按照刘旸旸[7]的方法制备标准品、样品溶液及生物碱得率测定,精密称取盐酸小檗碱标准品1.20 mg,置于10 mL容量瓶中,无水乙醇定容,得标准品溶液。准确称取三种猕猴桃不同部位样品粉末各3.0 g,按照1.2.1 的方法得到总生物碱浸膏,用二氯甲烷复溶,并定容在25 mL 容量瓶中,得总生物碱样品溶液。
1.2.3 检测波长的确定及标准曲线的绘制 取盐酸小檗碱标准品溶液及总生物碱样品溶液各1 mL,置于分液漏斗,加入6 mL 溴麝香草酚蓝缓冲液及6 mL二氯甲烷,振摇后静置30 min,取二氯甲烷层。另外取二氯甲烷1 mL,同样方法操作,得空白溶液。上述3 种溶液在190~800 nm 波长范围内进行全波长扫描,最大重叠吸收波长为382.5 nm,即为总生物碱检测波长。
精密量取盐酸小檗碱标准品母液0、0.2、0.4、0.6、0.8 和1.0 mL 于10 mL 容量瓶中,定溶,混匀,吸取不同浓度盐酸小檗碱标准品溶液各1 mL,按上述方法显色后在382.5 nm 处进行测定,横坐标为小檗碱标准品质量浓度X (mg/mL)、纵坐标为吸光度Y,绘制标准曲线,得回归方程Y=0.0664X-0.0964,R2=0.9981。
1.2.4 总生物碱得率测定 分别精密量取1 mL 三种猕猴桃总生物碱样品溶液,加入6 mL 溴麝香草酚蓝及6 mL 二氯甲烷振荡后静置30 min,以盐酸小檗碱为标准品,二氯甲烷为空白对照在382.5 nm 处测吸光度,依照刘旸旸[7]方法,通过下式计算三种猕猴桃总生物碱得率。
其中:C 为总生物碱提取液的质量浓度(mg/mL);V 为提取液定容的体积(mL);M 为猕猴桃样品粉末的质量(g)。
1.2.5 单因素实验设计 前期实验中发现三种猕猴桃茎部总生物碱得率较高,且茎部的资源丰富,后续实验利用三种猕猴桃茎部进行总生物碱提取优化试验。准确称取三种猕猴桃茎部粉末各3.0 g,按液料比20 mL/g、浸泡时间24 h、超声功率400 W、超声时间30 min,考察不同乙醇浓度(40%、60%、80%、90%和100%)对总生物碱得率的影响;以乙醇浓度为100%、浸泡时间24 h、超声功率400 W、超声时间30 min,考察液料比(10、20、30、40 和50 mL/g)对总生物碱得率的影响;以乙醇浓度为100%、液料比20 mL/g、浸泡时间24 h、超声时间30 min,考察超声功率(100、200、300、400 和500 W)对总生物碱得率的影响;以乙醇浓度为100%、液料比20 mL/g、浸泡时间24 h、超声功率400 W,考察超声时间(0、10、20、30 和40 min)对总生物碱得率的影响;在乙醇浓度为100%、液料比20 mL/g、超声功率400 W、超声时间30 min 的条件下,考察不同浸泡时间(0、1、2、4、8、12 和24 h)对总生物碱得率的影响,静置,精密吸取上层样品溶液4 mL,高速(12000 r/min)离心10min,取上清,测定总生物碱得率。每个样品重复3 次,结果取平均值。
1.2.6 响应面试验设计 使用软件Design-Expert 8.0.6.1 采用Box-Behnken 设计法进行数据分析,建立数学模型,优化最佳提取条件,各因素水平见表1。

表1 响应面试验因素水平设计Table 1 Experimental design factors and levels of response surface methodology
1.2.7 抑菌活性测定 采用陈静等[20]的方法制作菌悬液,稍加改动。将Psa 菌株划线培养于LB(牛肉膏蛋白胨培养基)固体培养基中,37 ℃培养24 h,挑单菌落接种于LB 液体培养基中,37 ℃摇床培养24 h,调整菌液浓度OD600为0.5,将其放置于4 ℃环境保存,备用。将4 种真菌接种于马铃薯葡萄糖琼脂(PDA)培养基,28 ℃恒温培养5 d 后,用载玻片将菌丝轻轻刮下,用无菌水制备孢子浓度为1×106个mL-1的菌悬液。将其放置于4 ℃环境保存,备用[21]。
采用滤纸片法,吸取5 种菌悬液0.2 mL 滴加于已制备好的培养基上(真菌采用PDA 培养基,细菌采用LB 固体培养基),涂布棒涂布均匀。用灭菌的滤纸片Φ=6 mm,参考张永欣等[22]及肖倩等[23]方法,分别浸入3 种猕猴桃茎部总生物碱提取液中(80mg/L),总生物碱提取液按照刘旸旸[7]的方法纯化后平均纯度达56.7%,取出后在无菌条件下晾干。将浸过总生物碱的滤纸片均匀放在含菌平板上(3 片一皿),浸过二氯甲烷的滤纸片为对照。真菌于28 ℃恒温培养箱中倒置培养24 h,细菌于37 ℃恒温培养箱中倒置培养24 h,观察各种菌的生长情况。
针对有抑制效果的菌悬液,配制3 个不同浓度的总生物碱提取液,灭菌后的滤纸片浸没浓度为50、100 和150 mg/L 的总生物碱提取液后均匀放在含菌的平板上,浸过二氯甲烷的滤纸片为对照,分别按照真菌及细菌的培养条件于恒温培养箱中倒置培养24 h,使用游标卡尺十字交叉测定抑菌圈直径,取平均值,每组平行3 次。
1.3 数据处理
采用Excel 2018 录入和整理数据,试验重复3 次,数据以平均值±标准差表示;GraphPad Prism 6.0.1 绘图;SPSS 26.0 统计软件进行差异显著性分析;Design-Expert 8.0.6.1 软件进行响应面试验设计和数据分析。
2 结果与分析
2.1 三种猕猴桃不同部位总生物碱得率比较
由显色反应结果图1 发现,三种试剂中均有沉淀生成,说明三种猕猴桃不同部位均含有生物碱类物质,结合表2 可知,三种猕猴桃的根与茎中总生物碱含量均高于叶中,且不同部位的差异性显著。除叶部以外,葛枣猕猴桃根与茎中所含的总生物碱得率均高于其他两种猕猴桃相同部位所含总生物碱得率,而狗枣猕猴桃叶中的总生物得率高于其他两种猕猴桃叶片中总生物碱得率。这可能是由于根茎部位为次生代谢产物富集的位置,而生物碱为植物次生代谢产物之一。

图1 三种猕猴桃根、茎、叶生物碱定性检测Fig.1 Qualitative determination of alkaloids in roots, stems and leaves of three species of Actinidia
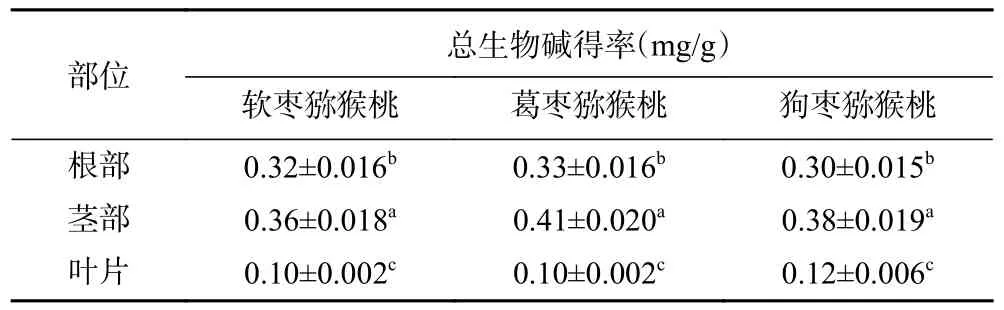
表2 软枣猕猴桃、葛枣猕猴桃、狗枣猕猴桃不同部位总生物碱得率Table 2 Yield of total alkaloids in different parts of Actinidia arguta, Actinidia polygama and Actinidia kolomikta
2.2 单因素实验
2.2.1 乙醇浓度对总生物碱提取效果的影响 如图2所示,当乙醇浓度从40%增加到80%,三种猕猴桃茎中总生物碱得率迅速增大,狗枣猕猴桃总生物碱得率变化最大,继续增加乙醇浓度,三种猕猴桃茎中总生物碱得率显著上升(P<0.05),这与刘旸旸[7]发现的实验结果相似,在乙醇浓度较高时总生物碱得率达到最高。这是由于植物组织中含有的脂溶性生物碱的含量较水溶性生物碱的含量高,因此增加乙醇浓度能够使脂溶性生物碱溶解率增加,从而使得总生物碱得率明显提高。基于此,选择乙醇浓度80%~100%进行响应面优化试验。
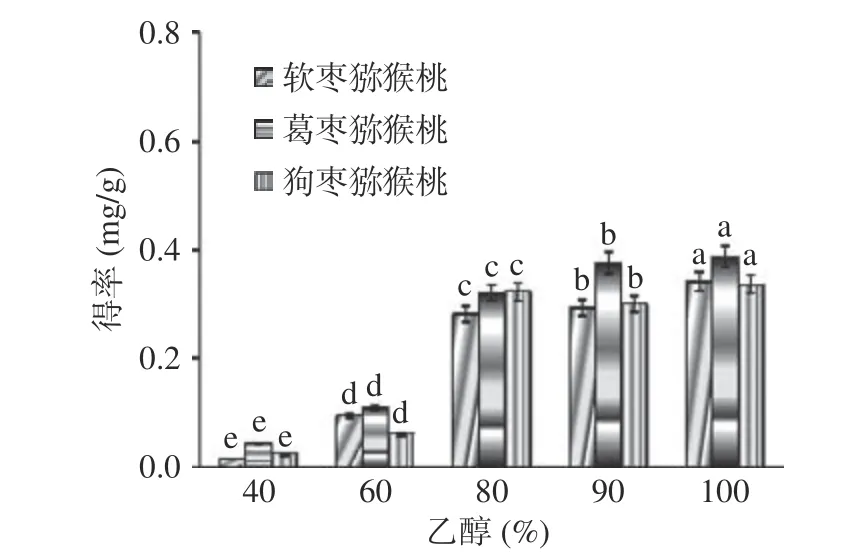
图2 乙醇浓度对总生物碱得率的影响Fig.2 Effect of ethanol concentration on yield of total alkaloids
2.2.2 液料比对总生物碱提取效果的影响 如图3所示,当液料比从10 mL/g 增加到50 mL/g 时,软枣猕猴桃茎部总生物碱得率呈显著性上升,其余两种猕猴桃总生物碱得率虽有所上升,但未出现显著性差异(P>0.05)。这是由于溶剂量增大可以增加溶质的溶解度,与杜彦影等[24]所得结果相似,料液比的增加会使得率增加,但总体影响较小,且在液料比为20 mL/g时总生物碱得率基本呈现最大值,选用液料比为20 mL/g 进行后续实验。
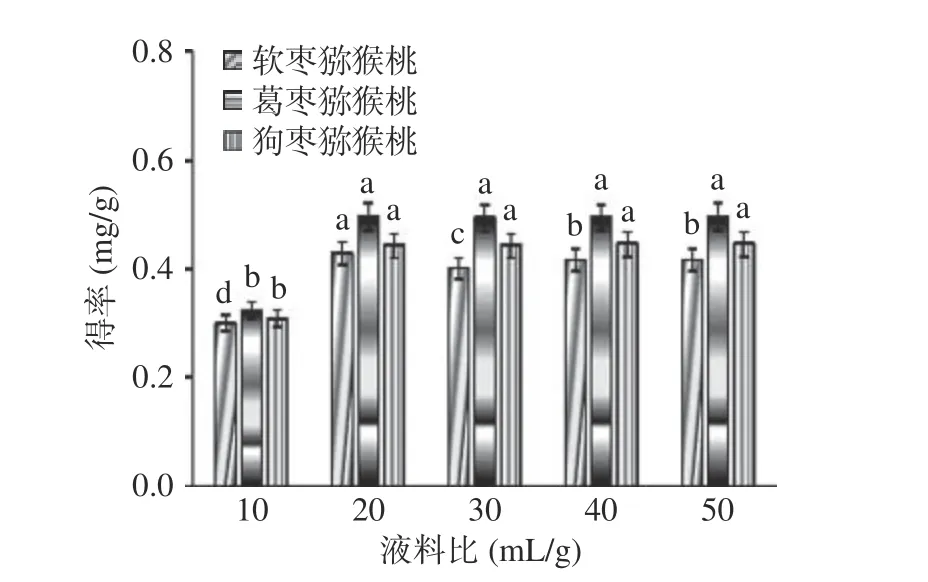
图3 液料比对总生物碱得率的影响Fig.3 Effect of liquid-solid ratio on the yield of total alkaloids
2.2.3 超声功率对总生物碱提取效果的影响 如图4所示,三种猕猴桃总生物碱得率随着超声功率的增加而逐渐增大,当超声功率为400 W 时,总生物碱得率达到最大,继续加大超声功率至500 W,总生物碱得率并没有显著性变化(P>0.05),为节约成本,选择200~400 W 进行响应面优化实验。
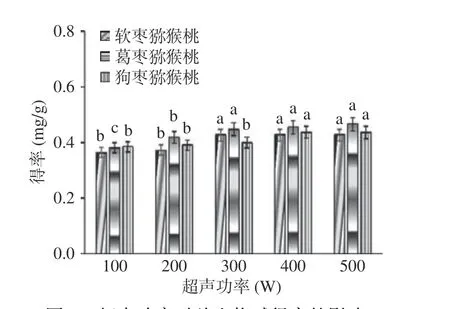
图4 超声功率对总生物碱得率的影响Fig.4 Effect of ultrasonic power on the yield of total alkaloids
2.2.4 超声时间对总生物碱提取效果的影响 如图5所示,随着超声时间的增加三种猕猴桃总生物碱得率均显著性增加(P<0.05),且在20 min 时总生物碱得率达到最大。而20 min 以后总生物碱得率虽随着时间的延长增加,但未出现显著性差异(P>0.05)。这是由于超声波可以使植物细胞破碎,从而使细胞结构松散,细胞内的物质更容易溶解在溶剂中[25]。因此,选择超声时间10~30 min 进行响应面优化试验。
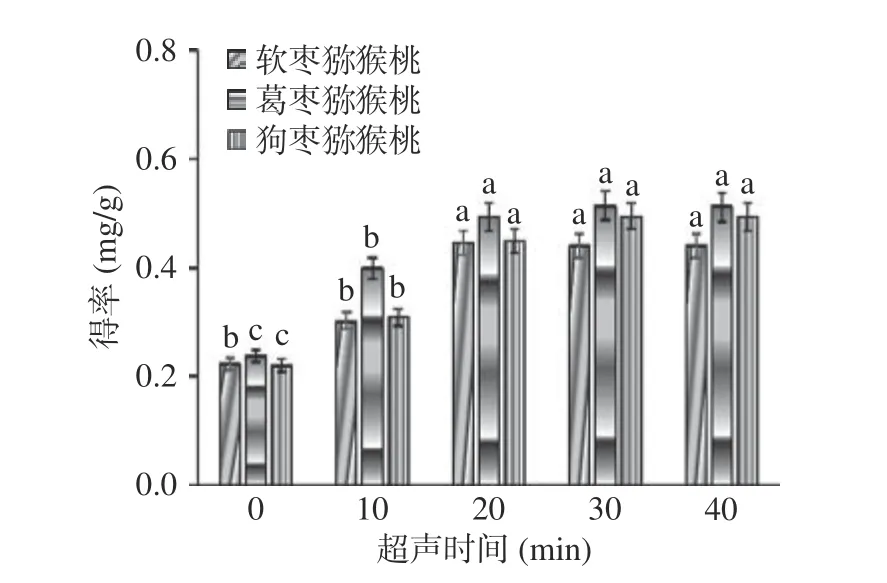
图5 超声时间对总生物碱得率的影响Fig.5 Effect of ultrasonic time on the yield of total alkaloids
2.2.5 浸泡时间对总生物碱提取效果的影响 如图6所示,浸泡时间对三种猕猴桃茎中总生物碱得率皆有影响。当浸泡时间达到1 h 时总生物碱得率较高,继续延长提取时间,总生物碱得率虽有所增加并没有显著性变化(P>0.05),这是由于充足的浸泡时间可以使植物细胞膨胀,细胞膜容易胀破,增加内容物的溶出[26]。因此,为了提高总生物碱得率以及节省提取时间,后续实验过程中浸泡时间为1 h。
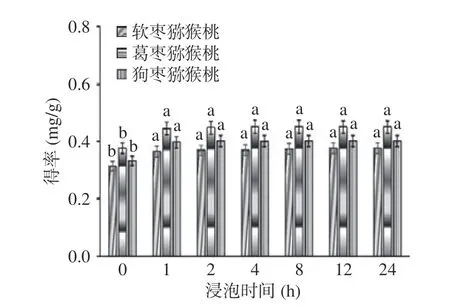
图6 浸泡时间对总生物碱得率的影响Fig.6 Effect of soaking time on yield of total alkaloids
2.3 响应面试验
在单因素实验的基础上,采用Box-Behnken 设计法对影响三种猕猴桃茎部总生物碱得率的3 个主要因素,即乙醇浓度(A)、超声功率(B)和超声时间(C)进行响应面试验。
由表3 可知,在软枣猕猴桃、葛枣猕猴桃及狗枣猕猴桃茎中总生物碱响应面试验中,软枣猕猴桃、葛枣猕猴桃及狗枣猕猴桃茎部总生物碱响应面试验中,3 个因子经过拟合得到的三组多元回归方程为:Y1=0.37+0.011A+0.014B+0.033C-2.500×10-3AB+2.500×10-4AC+8.750×10-3BC-0.011A2-0.028B2-1.200×10-3C2,Y1表示软枣猕猴桃茎总生物碱得率的预测值,决定系数R12=0.9829;Y2=0.420+0.012A+4.500×10-3B+0.039C-3.000×10-3AB-1.250×10-3AC+0.000BC-0.014A2-6.875×10-3B2-0.023C2,Y2表示葛枣猕猴桃茎总生物碱得率的预测值,决定系数R22=0.9796;Y3=0.38+7.50010-4A+4.500×10-3+0.023C-3.250×10-3AB-4.250×10-3AC+1.250×10-3BC-2.725×10-3A2-0.018B2-0.028C2,Y3表示葛枣猕猴桃茎总生物碱得率的预测值,决定系数R32=0.9530。三组因变量和所选自变量之间均拟合度良好,准确性高,能反映响应值的变化。ANOVA 分析见表4~表6,三组响应面模型F值分别为44.84、37.29 和15.78,P值均<0.001,表明其具有高度的显著性,失拟项P值均>0.05,失拟项对于纯误差不显著,回归方程不存在失拟性因素,随机误差导致残差对试验干扰较小。

表3 响应面试验结果Table 3 Results of response surface test
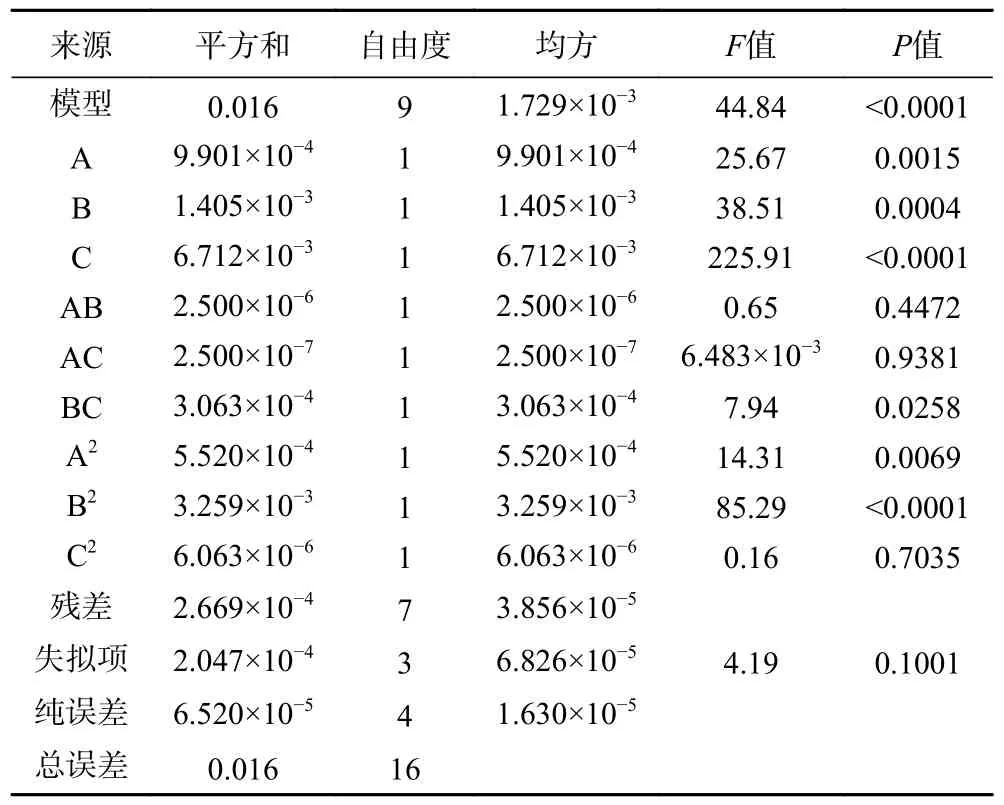
表4 软枣猕猴桃茎总生物碱得率ANOVA 分析结果Table 4 ANOVA analysis results of total alkaloids yield from Actinidia arguta stems
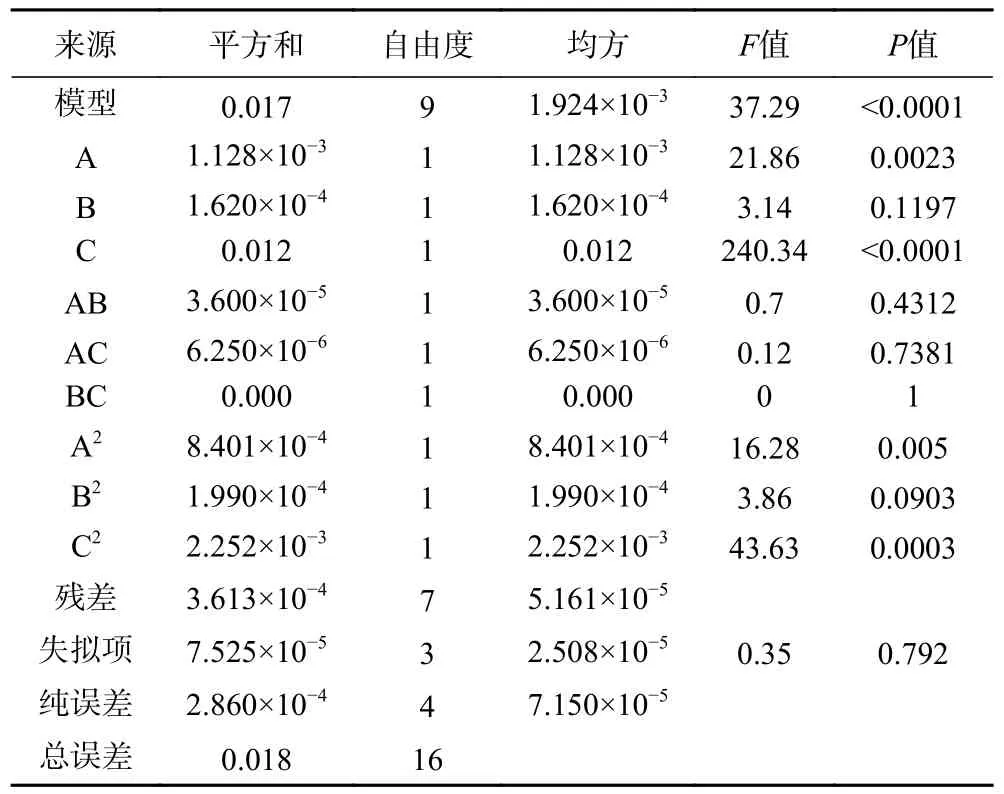
表5 葛枣猕猴桃茎总生物碱得率ANOVA 分析结果Table 5 ANOVA analysis results of total alkaloids yield from Actinidia polygama stems
如图7~图9 可知,乙醇体积分数、超声功率及超声时间的改变均会影响三种猕猴桃茎中总生物碱的得率,乙醇体积分数、超声功率和超声时间三者之间均存在交互作用,有一定的促进作用,结果与回归方程中方差分析结果相符。三个因素中,超声时间对响应值的影响比乙醇浓度及超声功率大。
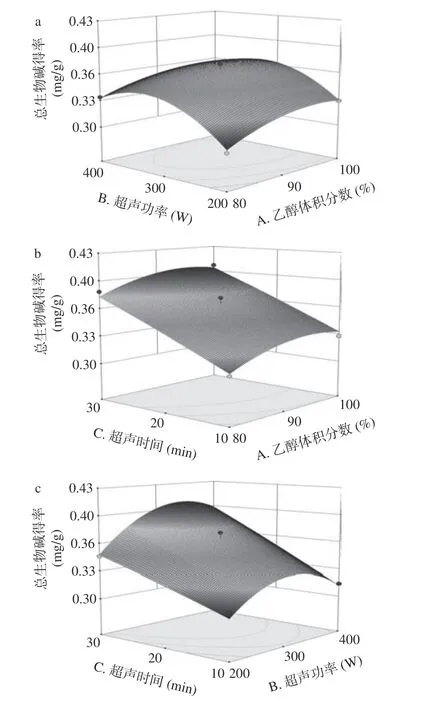
图7 不同因素对软枣猕猴桃茎总生物碱得率交互作用3D 图Fig.7 Response surface 3D map of Actinidia arguta stems

图8 不同因素对葛枣猕猴桃茎总生物碱得率交互作用3D 图Fig.8 Response surface 3D map of Actinidia polygama stems

图9 不同因素对狗枣猕猴桃茎总生物碱得率交互作用3D 图Fig.9 Response surface 3D map of Actinidia kolomikta stems
2.4 验证试验
试验得出软枣猕猴桃茎部总生物碱理论提取条件:乙醇体积分数为89.50%,超声功率340.74 W,超声时间29.90 min,总生物碱平均得率为0.40 mg/g;葛枣猕猴桃茎部总生物碱理论提取条件:乙醇体积分数为91.53%,超声功率298.96 W,超声时间28.64 min,总生物碱平均得率为0.44 mg/g;狗枣猕猴桃茎部总生物碱理论提取条件:乙醇体积分数为88.28%,超声功率321.92 W,超声24.10 min,总生物碱平均得率为0.39 mg/g。为进一步考察同时满足提取猕猴桃属总生物碱的条件,将计算公式目标设定为三种猕猴桃得率最大值,得出理论提取条件:乙醇体积分数为92.56%,超声功率324 W,超声27.55 min,软枣猕猴桃、葛枣猕猴桃及狗枣猕猴桃茎中总生物碱平均得率分别为0.40、0.44 和0.39 mg/g。考虑到实际操作条件,三种猕猴桃茎中总生物碱提取最佳工艺为乙醇体积分数为93%,液料比20 mL/g,超声功率300 W,超声30 min,三种猕猴桃茎中总生物碱平均得率分别为0.41、0.43 和0.39 mg/g,验证试验结果与理论值相对误差分别为2.5%、2.3%和2.3%,说明该三种模型均可较好的预测三种猕猴桃茎中总生物碱得率。
2.5 抑菌活性实验
如图10 和图11 所示,使用滤纸片法测定三种猕猴桃茎中总生物碱抑菌活性研究结果发现,低浓度总生物碱提取液对BC、CG、AA 及CC 等真菌的抑制效果并不明显,三种猕猴桃总生物碱的浓度为80 mg/L 时,对Psa 菌株均有抑制效果,软枣猕猴桃茎中生物碱的抑制效果更明显,另外两种猕猴桃总生物碱对其抑制效果不明显。这可能是由于三种猕猴桃总生物碱中的单体组成不同,从而导致抑制效果的差异性。相关研究证明,软枣猕猴桃中含有小檗碱,其对金黄色葡萄球菌、霍乱弧菌等都具有非常强的抑制作用,对肺炎杆菌等多种杆菌亦有效[27],而软枣猕猴桃茎部总生物碱中很有可能也含有小檗碱。如表7 所示,得到软枣猕猴桃茎中总生物碱对Psa 的MIC(最小抑菌浓度)为50 mg/L,总生物碱浓度达MIC 值时,随着三种猕猴桃茎总生物碱浓度的增加,其抑菌能力也随之增强,且不同浓度的抑菌效果差异显著。这可能是由于生物碱类物质抑制了Psa 菌体的活性,或者限制了菌体的运动,还有可能破坏了菌体的结构[28]。
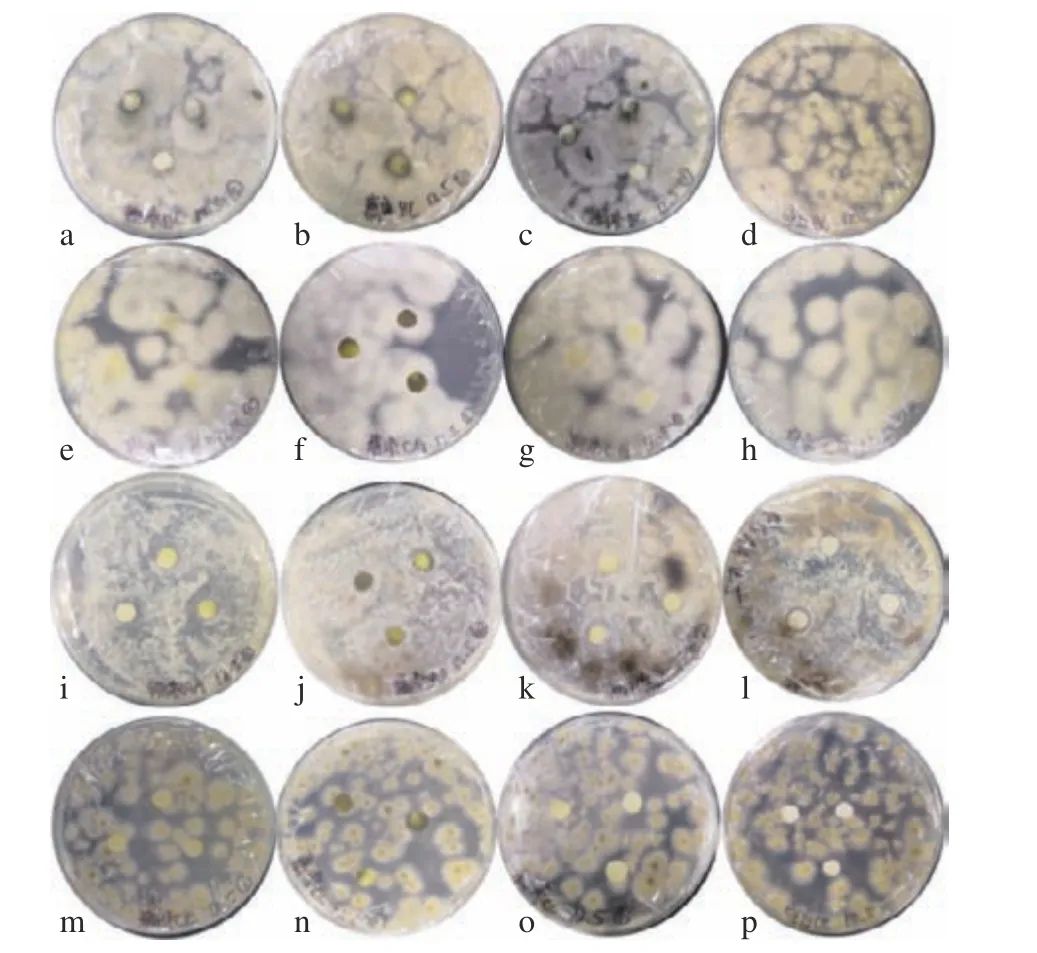
图10 软枣猕猴(a, e, i, m)、葛枣猕猴桃(b, f, j, n)、狗枣猕猴桃(c, g, k, o)茎总生物碱及空白(d, h, l, p)对BC (a, b, c 和d), CG (e, f, g, h), AA (i, j, k, l) 以及CC (m, n, o, p)四种真菌的抑制效果Fig.10 Inhibitory effect of total alkaloids from the Actinidia arguta (a, e, i, m), Actinidia polygama (b, f, j, n), Actinidia kolomikta (c, g, k, o) and the control (d, h, l, p) on BC (a, b, c, d),CG (e, f, g, h), AA (i, j, k, l) and CC (m, n, o, p)

图11 软枣猕猴桃(a)、葛枣猕猴桃(b)和狗枣猕猴桃(c)茎总生物碱对Psa 抑菌效果Fig.11 Inhibitory effect of total alkaloids from Actinidia arguta (a), Actinidia polygama (b) and Actinidia kolomikta (c) on Psa

表7 不同浓度总生物碱对Psa 的抑菌效果Table 7 Inhibitory effect of different concentration total alkaloid on Psa
3 结论与讨论
本试验对三种猕猴桃不同部位的生物碱的含量进行对比研究,发现三种猕猴桃根茎中均有生物碱类物质,且以茎中含量最高。本研究利用超声波辅助法提取三种猕猴桃茎部总生物碱,通过单因素实验,发现液料比、乙醇浓度以及超声时间改变均显著影响总生物碱的得率。通过响应面实验进一步确定了三种猕猴桃茎部总生物碱最佳提取条件,在此条件下三种猕猴桃茎部总生物碱的实际值分别为0.41、0.43和0.39 mg/g。实验结果略低于杜彦影测定的软枣猕猴桃茎部总生物碱的实际值,原因可能与猕猴桃不同种植环境有关[24]。黑龙江地域气候更为寒冷,植物此生代谢产物会受到气候、土壤及水源等因素的影响,不同地区的猕猴桃不同部位含有的总生物碱得率及种类是否具有差异仍需进一步对比研究[29]。抑菌试验发现,针对BC、CG、AA 及CC 四种真菌,三种猕猴桃茎部总生物碱对其均没有明显抑制效果,后续进一步增加总生物碱的浓度,依旧没有明显的抑制效果,推测三种猕猴桃茎部总生物碱不含对这四种真菌抑制作用的成分。软枣猕猴挑茎中总生物碱对细菌Psa 有明显抑制效果,而其他两种猕猴桃总生物碱对Psa 抑制效果不明显。本研究初步证实软枣猕猴桃茎中总生物碱具有良好的抑制Psa 的活性,但主要抑菌成分以及抑菌机制有待进一步研究。

