响应面法优化低共熔溶剂提取迷迭香中迷迭香酸和鼠尾草酸的工艺
李凌娜,杨继威,张丽芬,赵梦健,王振华,马成俊
(烟台大学生命科学学院,山东烟台 264005)
迷迭香(Rosmarinus officinalisL.)是唇形科迷迭香属植物[1],原产于地中海地区[2],我国多地均有种植,药食两用,是一种重要的香料,亦常用作化妆品、医药、食品等领域的原料[3],在我国“迷迭香提取物”作为天然抗氧化食品添加剂(GB 1886.172-2016,食品安全国家标准,食品添加剂)[4],广泛应用于油脂、肉类及海鲜等的运输、贮藏和加工过程中的抗氧化和保鲜[5-9]。迷迭香提取物中抗氧化活性成分以萜类物质为主[10],包括迷迭香酚、迷迭香酸、鼠尾草酚、鼠尾草酸等[11],其中代表性成分为水溶性的迷迭香酸(Rosmarinic acid,RA)和脂溶性的鼠尾草酸(Carnosic acid,CA)(化学结构如图1)[12],在“迷迭香提取物”国家标准中,将迷迭香酸和鼠尾草酸的含量作为迷迭香提取物质量控制的成分,许多研究也表明迷迭香酸和鼠尾草酸具有预防糖尿病和肥胖[13]、抗肿瘤[14]、神经保护[15]、保肝[16]和抗菌[17]等作用。
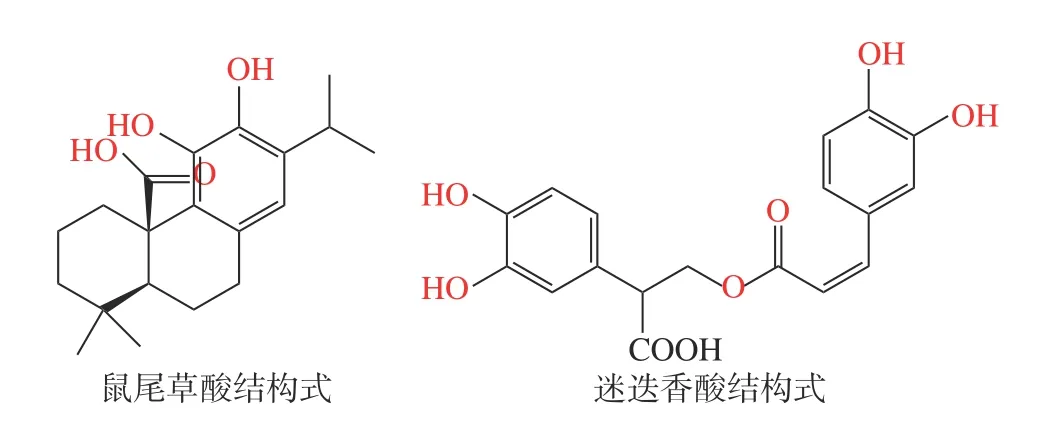
图1 鼠尾草酸和迷迭香酸化学结构式Fig.1 Chemical structural formulae of carnosic acid and rosmarinic acid
目前,做为食品添加剂的“迷迭香提取物”提取方法主要有乙醇热回流法、正己烷冷浸法和超临界流体萃取法[4]。超临界流体萃取法和正己烷冷浸提取法仅获得脂溶性成分[18];乙醇加热回流提取容易使其中鼠尾草酸氧化成中间产物鼠尾草酚,迷迭香酸也易氧化降解,使得提取物抗氧化性能显著降低[19]。总之,现有的提取方法存在设备成本高、提取耗能耗时、所用溶剂易燃易爆、提取效率低等问题[20-22]。
低共熔溶剂(Deep Eutectic Solvent,DESs)这一概念最早在2003 年由Abboot 等[23]提出,它是由氢键受体(Hydrogen Bond Acceptors,HBAs)和氢键供体(Hydrogen Bond Donors,HBDs)混合而成的两组分或三组分低共熔混合物[24],因其具有无毒、易于合成、成本低、提取效率高、保护活性物质、可回收降解、安全性高、节约能耗等特点[25-26],已被广泛应用于多酚[27-28]、黄酮[29-30]、有机酸[31]等天然活性物质的提取。
Wojeicchowski 等[31]研究了疏水性DESs 提取迷迭香中的脂溶性成分鼠尾草酸和鼠尾草酚。Vladimir-Knežević等[32]研究了亲水性DESs 提取迷迭香中的水溶性成分迷迭香酸等。Vieira 等[33]研究了两相(疏水性和亲水性)DESs 同时提取迷迭香中脂溶性和水溶性成分。到目前为止,未见采用单相DESs 同时提取迷迭香中脂溶性和水溶性有效成分的报道。本研究以同时提取迷迭香中的代表成分迷迭香酸和鼠尾草酸为目标,从多种可能的DESs 组合中,筛选出组成和组分比例最优的DESs 作为提取试剂,通过单因素实验和响应面法优化探索迷迭香中主要抗氧化活性成分的提取工艺,为高效快速提取迷迭香抗氧化物及其资源开发提供参考依据。
1 材料与方法
1.1 材料与仪器
迷迭香药材 购自安徽亳州药材市场,经烟台大学药学院生药室李桂生博士鉴定为迷迭香枝叶(Rosmarinus officinalisL.);迷迭香酸对照品 纯度98.9%,中国食品药品检定研究院;鼠尾草酸对照品纯度≥99%,成都瑞芬思德丹生物科技有限公司;乳酸、柠檬酸、氯化胆碱、甜菜碱、1,2-丙二醇、尿素、1,4-丁二醇、1,3-丁二醇、苹果酸、葡萄糖、异丙醇、丙三醇、乙二醇、L 脯氨酸、L 精氨酸、薄荷醇、月桂酸、壬酸、癸酸、无水乙醇 均为国产分析纯。
Agilent 1260 型高效液相色谱仪(配DAD 检测器) 美国Agilent 公司;DF-101T 集热式恒温加热磁力搅拌器 上海秋佐科学仪器有限公司;AR1140型电子天平 梅特勒-托利多仪器(上海)有限公司;MS-12Pro 高速离心机 群安实验仪器有限公司;AHA-A 数显恒温振荡器 常州天瑞仪器有限公司。
1.2 实验方法
1.2.1 低共熔溶剂的制备及筛选
1.2.1.1 低共熔溶剂的制备 分别选取氢键受体和氢键供体,二者混合后加入适量水,采用加热震荡方式进行制备,在80 ℃水浴下进行震荡使其形成稳定、均一体系的DESs[31],冷却备用,不能互溶或者分层则不能形成DESs。
1.2.1.2 低共熔溶剂的筛选 分别以氯化胆碱、甜菜碱、柠檬酸和乳酸为HBA 和选择的HBD 按照摩尔比1:2,含水量30%共计37 种组合(表1),组合包含亲水性DESs 和疏水性DESs[34-35],以相同的提取条件进行迷迭香中RA 和CA 的提取,考察不同DESs对RA 和CA 的提取得率,选择提取得率最高的DESs做后续工艺优化研究。

表1 不同组分DESs 的制备Table 1 Preparation of DESs with different components
1.2.2 迷迭香中RA 和CA 的提取 称取经粉碎过60 目筛的迷迭香粉末约0.1 g,按液固比20:1(mL/g)加入DESs,45 ℃加热提取40 min,离心5 min(转速12000 r/min),取上清液稀释,用0.22 μm 微孔滤膜过滤,即待测样品。
1.2.3 RA 和CA 含量的测定及标准曲线绘制
1.2.3.1 RA 和CA 含量的测定 参考文献[4],采用高效液相色谱法(HPLC)同时测定RA 和CA 的含量。色谱柱Symmetry C18(4.6×250 mm,5 μm);进样量20 μL,流速1 mL/min,柱温35 ℃;流动相:A 相为0.2%磷酸水溶液,B 相为乙腈,梯度洗脱见表2。DAD 检测器扫描范围为230~360 nm。将待测样品以上述色谱条件进行HPLC 分析,按照下式计算RA 和CA 的得率。

表2 流动相梯度洗脱程序Table 2 Mobile phase gradient elution procedure
RA(CA)得率(mg/g)=提取液中RA(CA)浓度×提取液体积/迷迭香粉质量(g)
1.2.3.2 标准曲线绘制 精密称取迷迭香酸标准品20.87 mg 和鼠尾草酸标准品34.78 mg,置于25 mL容量瓶中,以甲醇稀释定容作为母液。分别吸取1、2、3、4、5 mL 于10 mL 容量瓶中并以甲醇稀释定容,作为系列混合对照品溶液。分别吸取20 μL 上述混合对照品溶液,注入高效液相色谱仪中,记录色谱峰面积。
1.2.4 单因素实验 使用选择的DESs 最优组合,依照1.2.2 提取方法,固定提取温度35 ℃,提取时间30 min,含水量30%,液固比20:1 g/mL,考察不同摩尔比(1:1、1:2、1:3、1:4)对RA 和CA 提取得率的影响,确定最佳摩尔比。分别设定含水量,液固比,提取时间,提取温度4 个影响提取得率的因素在以下条件进行单因素实验:含水量0、10%、20%、30%、40%、50%(提取温度35 ℃,提取时间30 min,液固比20:1 g/mL,摩尔比1:2);液固比10:1、20:1、30:1、40:1、50:1、60:1 g/mL(提取温度35 ℃,提取时间30 min,摩尔比1:2,含水量10%);提取时间30、60、90、120 min(提取温度35 ℃,含水量10%,液固比为20:1 g/mL,摩尔比1:2);提取温度25、35、45、55、65 ℃(提取时间60 min,含水量10%,液固比20:1 g/mL,摩尔比1:2)。
1.2.5 响应面优选提取方法 参考单因素实验结果,以提取时间(A),DESs 含水量(B),液固比(C),提取温度(D)作为考察因素,以RA 和CA 的得率为考察指标,利用Box-Behnken Design(BBD)法设计四因素三水平的响应面优化试验,试验因素与水平见表3。
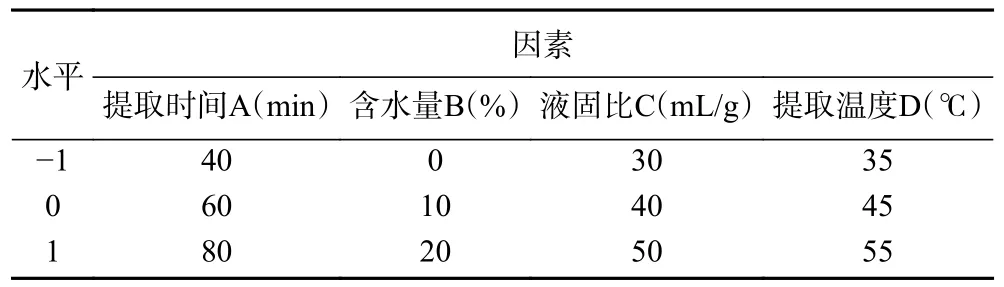
表3 响应面因素水平设计Table 3 Factors and levels of response surface methodology
1.2.6 传统有机溶剂提取迷迭香中的抗氧化成分参考文献[3,36],采用80%乙醇回流提取和正己烷冷浸法提取迷迭香中的有效成分RA 和CA,和DESs提取液比较其提取率和体外清除DPPH 自由基的能力。取迷迭香0.5 g,加入80%乙醇25 mL,回流提取1 h,放冷后过滤,用80%乙醇定容至25 mL,作为乙醇回流提取液;取迷迭香0.5 g,用25 mL 正己烷室温下浸提24 h,过滤,旋蒸除去溶剂,用80%乙醇溶解并定容至25 mL,作为正己烷冷浸提取液。按照1.2.3 项下“含量测定”方法,分别测定不同方法提取RA 和CA 的得率。
1.2.7 抗氧化活性测定 比较不同提取方法所得提取液DPPH 自由基清除能力。参考文献[37],用无水乙醇配制0.1 mmol/L DPPH 溶液,避光备用,精密称取3.0 mg 维生素C 定容于100 mL 容量瓶中,避光保存。取4 支试管,分别加入DESs、乙醇、正己烷提取液各1 mL,并加入3 mL 的DPPH 溶液,避光反应30 min,此为样品组,记为A1;取1 mL 提取液并加入3 mL 无水乙醇,此为空白组,记作A2;取1 mL 双蒸水加入3 mL 的DPPH 溶液,此为对照组,记为A0。在517 nm 测吸光度。按照下列公式计算各自对DPPH 自由基清除率:
1.3 数据处理
本实验中所有实验均重复3 次,单因素实验数据处理使用SPSS 20.0 和Origin 8.0,响应面试验设计及数据处理使用Design expert 12。
2 结果与分析
2.1 RA 和CA 标准曲线及样品检测
以对照品浓度为横坐标,色谱峰峰面积为纵坐标进行线性回归分析,得到的迷迭香酸的回归方程为:y=16593x+305.29,R2=0.9978,表明在0.03843~0.8348 mg/mL 范围内线性良好;鼠尾草酸的回归方程为:y=16593x+305.29,R2=0.9978,表明在0.6956~1.39120 mg/mL 范围内线性良好。图2 为高效液相含量测定色谱图。
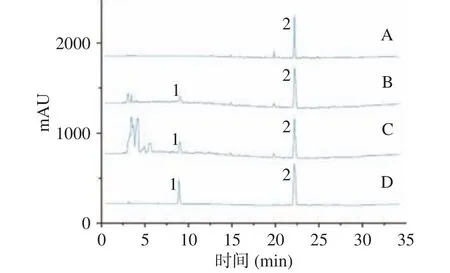
图2 正己烷(A)、乙醇(B)和DESs(C)提取所得RA(1)和CA(2)及标准品(D)的HPLC 色谱图Fig.2 HPLC chromatograms of RA (1) and CA (2) and standards (D) obtained by extraction with n-hexane (A), ethanol(B), and DESs (C)
2.2 DESs 的筛选
经过筛选舍去不能形成DESs 的组合,采用其余37 种组合以相同的方法提取迷迭香中的RA 和CA,以二者得率为考察指标,结果如图3 所示。由图3 得知,以乳酸作为氢键受体,1,4-丁二醇作为氢键供体,RA 和CA 的得率最高,分别达到11.78 和21.14 mg/g。因此选择以乳酸/1,4-丁二醇构成的DESs 体系提取迷迭香中的RA 和CA。
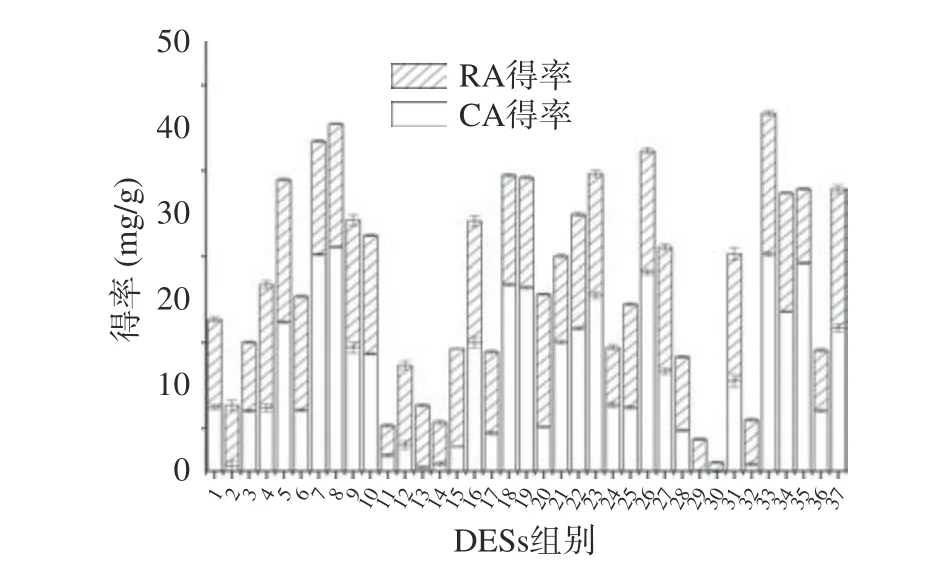
图3 Ss 组合筛选Fig.3 DESs combination screening
2.3 单因素实验结果
2.3.1 摩尔比对提取的影响 以乳酸/1,4-丁二醇构成的DESs 体系,考察二者摩尔比对RA 和CA 提取得率的影响,结果见图4。由图4 得知,随着氢键受体乳酸和氢键供体1,4-丁二醇摩尔比的增加,RA 和CA 的得率均呈现先增加后略降低的趋势。DESs 是由HBA 和HBD 通过分子间氢键形成的一种在室温下均一稳定的液态混合物,二者摩尔比影响DESs 的电导率和凝固点[28],从而影响到DESs 的形成和提取效果,在摩尔比1:2 时,RA 和CA 的得率均较高,可能是1,4-丁二醇增强了溶剂离子对RA 和CA 的亲和力,从而增强了其溶出速率;随着供体的增加,DESs 中氢键受体的比例降低,相对减弱了其对RA和CA 的分子作用力,使得两者的得率均下降。因此选择乳酸/1,4-丁二醇的摩尔比为1:2。
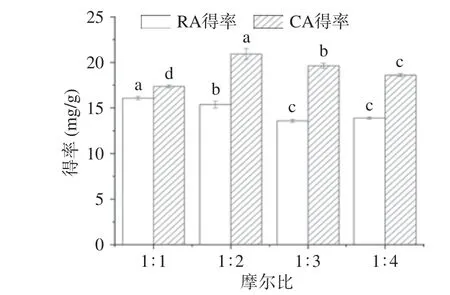
图4 摩尔比对提取的影响Fig.4 Effect of molar ratio on extraction
2.3.2 含水量对提取的影响 含水量对RA 和CA提取得率的影响见图5。由图5 得知,当DESs 的含水量从0%至10%时,RA 和CA 得率均逐渐提高,当含水量达到10%,RA 和CA 的得率分别达到最大值17.24 和29.88 mg/g,之后随着含水量的继续增加,RE 和CA 的得率均下降,其中CA 的下降明显快于RA。乳酸/1,4-丁二醇为亲水性DESs,本身具有一定的流动性,适当增加含水量,可以进一步降低DESs 的黏度从而增加了溶剂的传效率,有利于CA和RA 的溶出,然而随着含水量的不断增加,DESs的极性进一步增强,极性过大会引起分子间氢键的断裂,降低了DESs 和CA 及RA 之间的相互作用[34],这种影响对脂溶性的CA 最为突出。因此选择含水量10%作为提取条件。
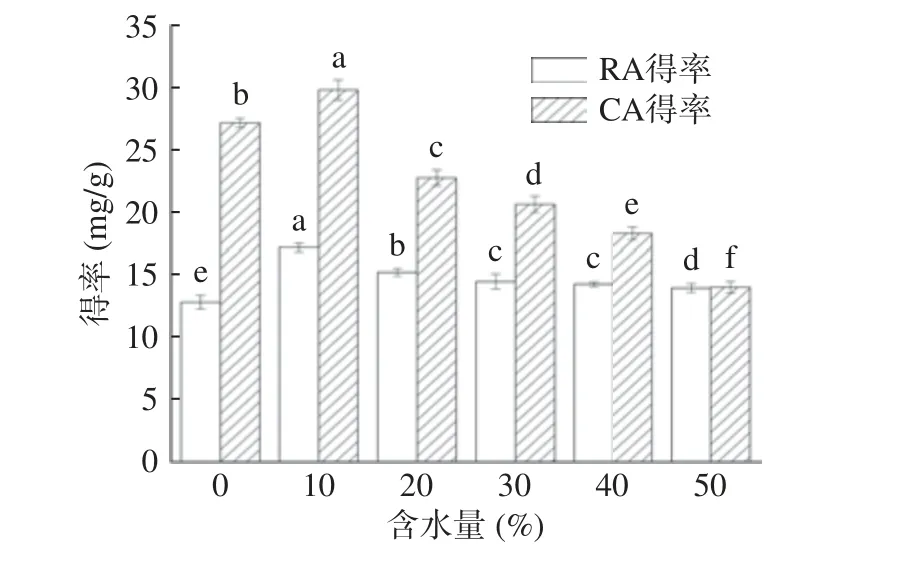
图5 含水量对提取的影响Fig.5 Effect of water content on extraction
2.3.3 液固比对提取的影响 考察了不同液固比对CA 和RA 提取效率的影响,结果如图6 所示,随着液固比的增加,DESs 对CA 和RA 的提取得率均呈现先增加后下降的趋势,当液固比达到40:1 g/mL时,RA 和CA 的得率达到最高,分别为18.81 和30.02 mg/g,以后随着溶剂的增加,二者得率逐步下降。可能是随着提取液增加,逐步增大了迷迭香粉末及细胞与提取液的接触机会,有利于CA 和RA 的溶出;但当液固比增加到一定程度后,二者在DESs 中的溶解达到饱和,继续增加液固比会降低它们的浓度,导致细胞内外渗透压下降,影响其溶出[28,35],进而使CA 和RA 的得率下降,提取量降低,故选择液固比40:1 g/mL 进一步优化。

图6 液固比对提取的影响Fig.6 Effect of liquid-solid ratio on extraction
2.3.4 提取时间对提取的影响 一般来说,提取时间长短决定被提取物能否充分溶出。提取时间对CA 和RA 的影响见图7。由图7 可知,提取时间短时,RA 和CA 的溶出量少,得率低,当提取时间增加到60 min 时,RA 和CA 的得率分别为22.18 和37.49 mg/g,达到最大值,以后随着提取时间的延长,二者得率呈现下降趋势。这种现象可能是随着提取时间的增加,溶剂透过细胞壁进入细胞内,使得目的物在细胞内外产生浓度差,目的物溶出度加大,提取时间达到60 min 时,大多数目的物溶出,继续延长提取时间,会造成大量杂质溶出而使目标物溶出受限;另外,由于CA 和RA 结构不稳定,过长的提取时间造成其氧化降解[28]。因此,提取时间选择为60 min。
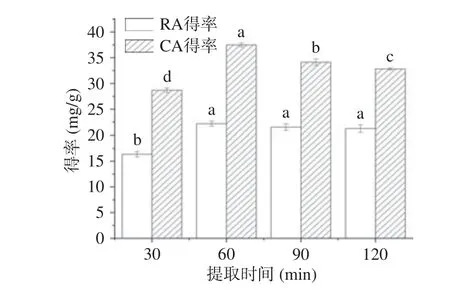
图7 提取时间对提取的影响Fig.7 Effect of extraction time on extraction
2.3.5 温度对提取的影响 温度是影响提取效果的重要因素,因为温度影响DESs 的扩散系数、黏度,从而影响DESs 对RA 和CA 的得率。不同温度对RA 和CA 得率的影响结果如图8 所示,随着温度的升高,RA 和CA 的得率呈现先增大后减小的趋势,当温度从25 ℃上升到45 ℃时,RA 和CA 的提取得率随着温度提高而上升,可能是因为温度升高降低了DESs 的黏度同时增加了RA 和CA 的溶解度和扩散系数[28],使得RA 和CA 的得率增加,温度在45 ℃时,得率最高,分别为18.79 和32.54 mg/g。当温度超过45 ℃,RA 的得率基本保持不变,但CA 的得率逐步降低,这可能是由于CA 的化学结构相对于RA 不稳定,温度的升高加速了CA 的氧化从而导致CA 的得率下降[36]。
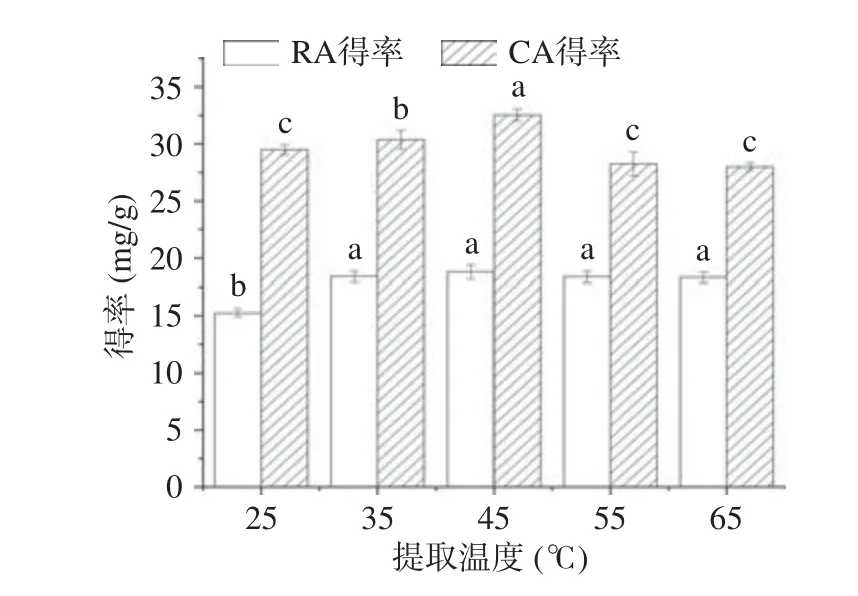
图8 提取温度对提取的影响Fig.8 Effect of extraction temperature on extraction
2.4 响应面试验优化结果
2.4.1 回归模型建立与方差分析 在单因素实验结果的基础上,确定以提取时间(A)、含水量(B)、液固比(C)和提取温度(D)4 个因素,每个因素3 水平,以RA 和CA 的得率为指标,共计29 组进行BBD 实验,通过Design-Expert 12 软件进行二次响应面回归分析,其结果见表4~表6。
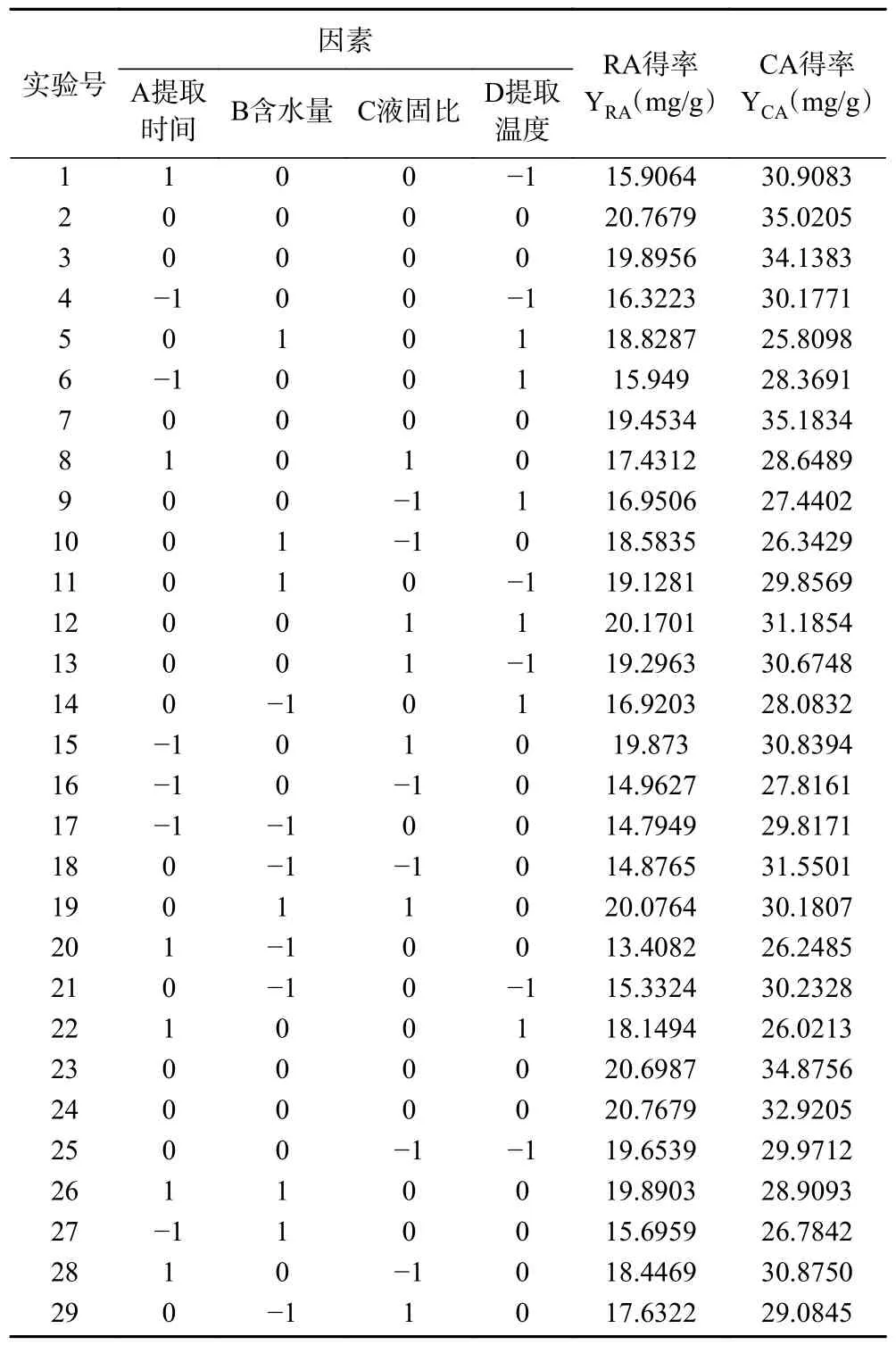
表4 响应面试验设计与结果Table 4 Response surface experimental design and results
根据表4 得出的RA 得率的回归方程如下:
方差分析结果如表5 所示,模型P<0.01,表示模型显著有效;R2=0.9590,校正决定系数R2Adj=0.9180,失拟项P>0.05 不显著,表明模型拟合度好,预测值与真实值偏差不大,实验误差对于实验结果影响较小。在设定的四个因素中,各因素对RA 的提取影响:含水量(B)>液固比(C)>提取时间(A)>提取温度(D),说明在所设因素范围内,含水量和液固比对RA 的提取影响是极显著的,其次是提取时间,提取温度对其影响不显著。
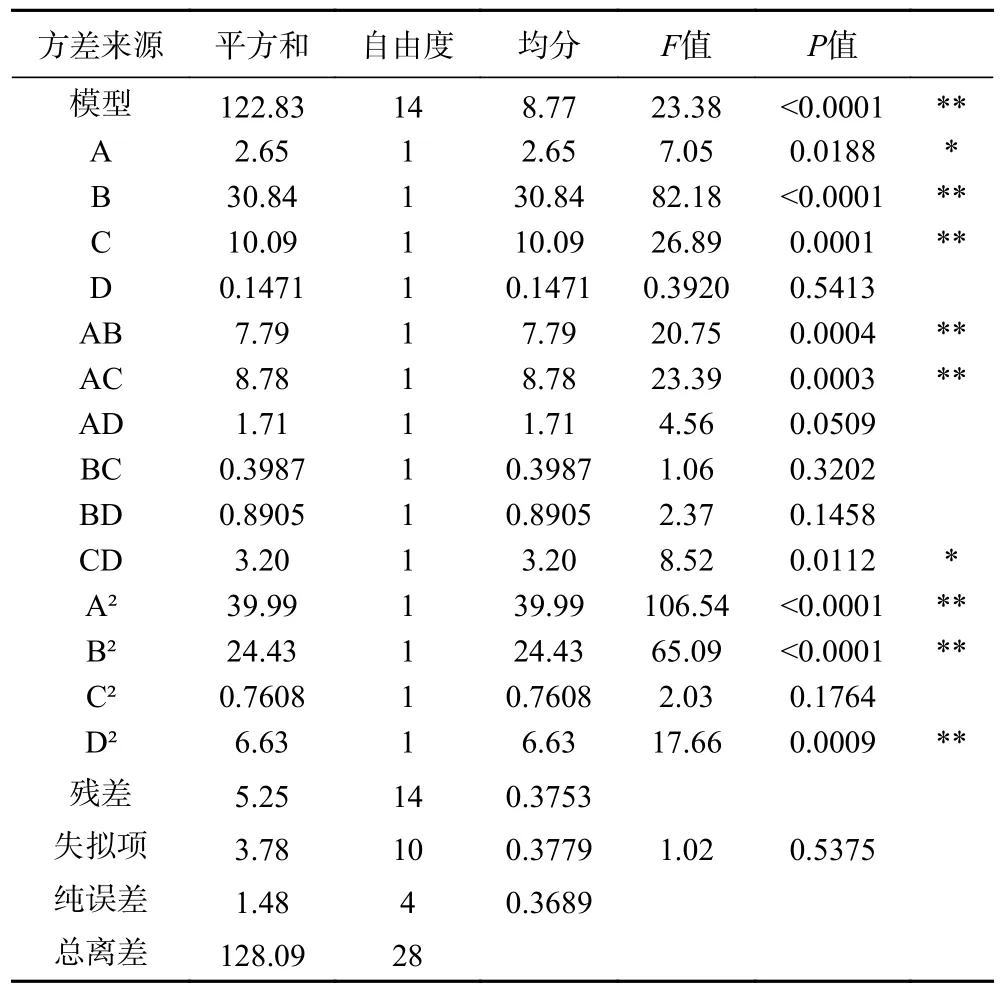
表5 迷迭香酸得率的方差分析结果Table 5 Analysis of variance of rosmarinic acid
图9 为不同因素交互作用对RA 得率影响的响应面,由图9 可知,各因素之间的交互作用对RA 的得率有着较大的影响,对模型中的各因素进行交互分析发现,AB、AC、CD 之间交互作用对响应值的影响是显著的,只改变提取时间时,RA 的得率先上升再趋于平缓,可见随着时间的增加RA 已经基本提取完全。当固定其他因素时,RA 的得率随着含水量的增加呈现先上升再平缓再下降的趋势,原因是RA 是水溶性良好的成分,在一定范围内含水量的增加会使得RA 的得率增加,但过多的水会破坏DESs 体系从而影响RA 的得率。当其他因素不变时,RA 的得率随着液固比的改变变化较小,原因可能是RA 在DESs 溶剂中达到饱和。当其他因素固定时,提取温度改变时,RA 的得率先增加后减小但总体变化不大,原因是温度升高可以降低DESs 的粘度,增加其与迷迭香的接触和分子间的碰撞,但温度过高会导致RA 不稳定,可能会影响得率,但变化不大可能是RA 已经饱和。影响RA 得率的交互作用影响顺序AC>AB>CD>AD>BD>BC。
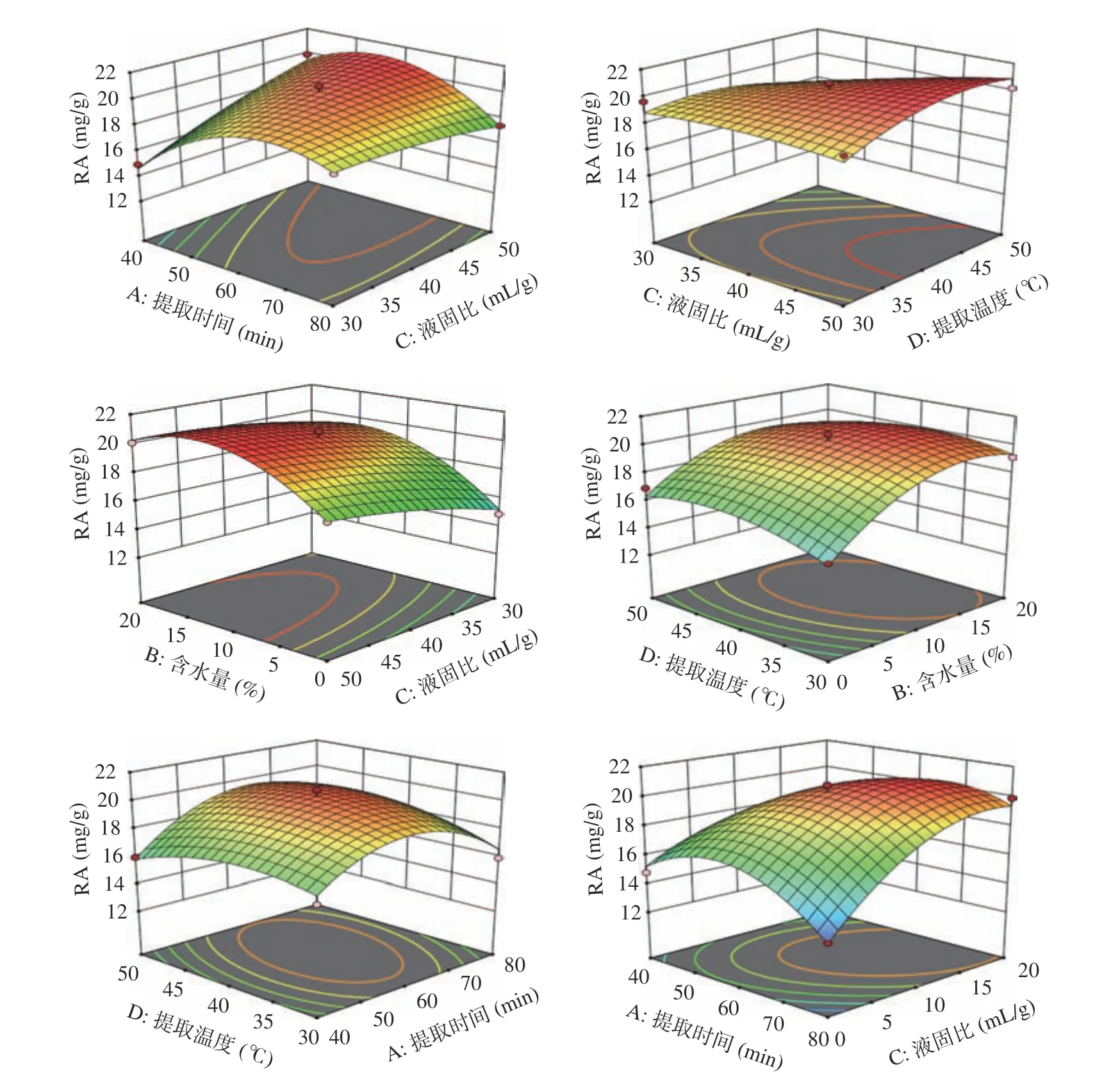
图9 迷迭香酸得率各因素交互作用响应面图Fig.9 Rosmarinic acid response surface of interaction of various factors
根据表4 得出的CA 的回归方程如下:
方差分析如表6 所示,模型P<0.01,表示模型显著可靠,R2=0.9422,校正决定系数R2Adj=0.8844,失拟项P>0.05,不显著,证明模型相关度良好,拟合度良好。由上表可知,四种因素中,料液比和提取温度对鼠尾草酸的提取影响是显著的,各因素对鼠尾草酸提取的影响:提取温度(D)>含水量(B)>液固比(C)>提取时间(A)。对模型中各因素交互作用分析发现,各因素交互作用对鼠尾草酸提取的影响顺序BC>AB>AC>AD>CD>BD,其中BC、AB 和AC 的交互作用对鼠尾草酸的提取效果影响显著。
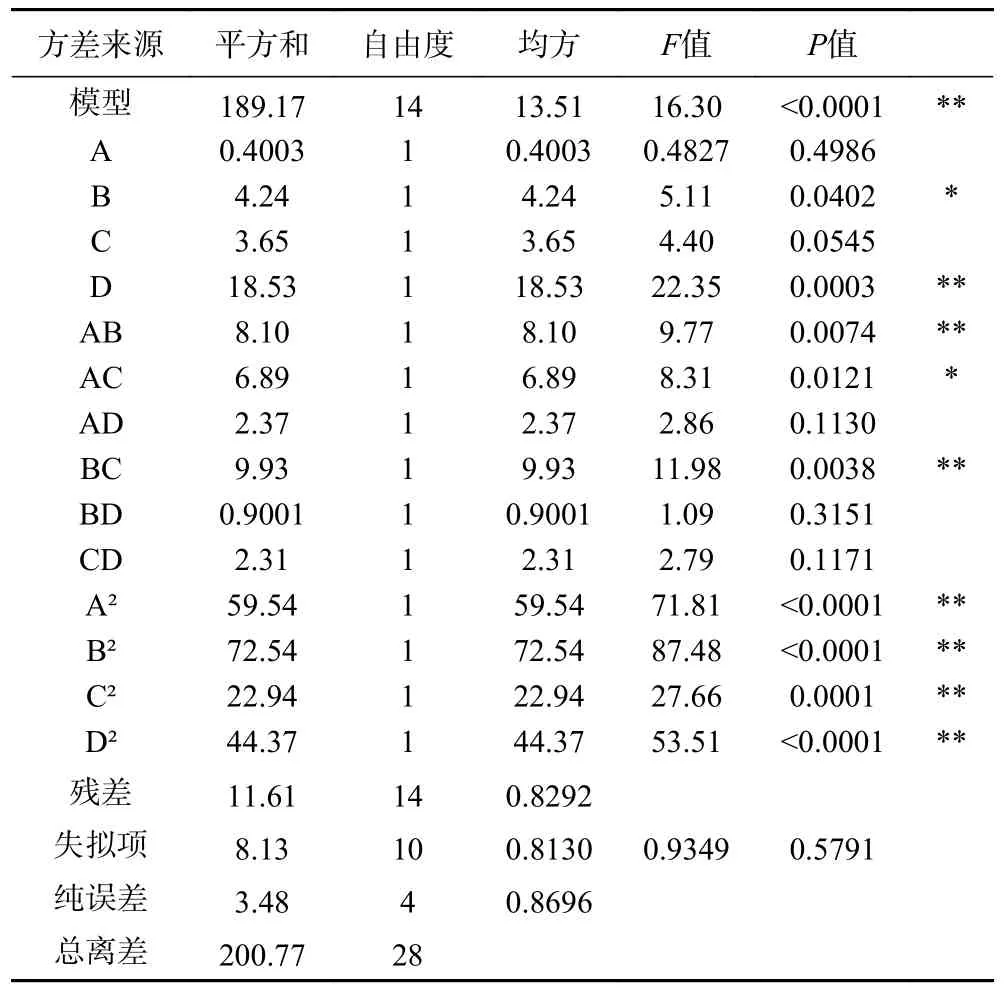
表6 鼠尾草酸得率的方差分析Table 6 Analysis of variance of carnosic acid
图10 为不同因素交互作用对DESs 提取迷迭香中CA 得率的影响的响应面图,当其他因素固定不变时,CA 得率随着提取时间的增加呈现轻微的先增后降的趋势,这可能是因为DESs 具有高效的提取效率,能够短时间溶解迷迭香中的有效成分,但随着时间的延长,CA 具有的不稳定性和强氧化性会使得自身转变成为其他成分,从而降低得率。当其他因素不变时,CA 的得率随着含水量的增加而减少,因为CA 本身为脂溶性物质,水的增多不利于CA 的提取[38]。当其他因素不变时,液固比对CA 得率的影响较小,但随着液固比的增加,CA 的得率也有所增加,因为DESs 溶剂的增多更能够将迷迭香中的CA 有效提取,但过多的溶剂反而可能将其余杂质提出。当其他因素不变,提取温度改变时,对CA 得率,呈现随着温度的上升先升后降的情况,原因是CA 对于温度比较敏感,过高的温度可能会破坏CA 的结构导致得率的下降。
2.4.2 验证实验 通过Design Expert 12.0 软件优化得到的最佳的DESs 提取RA 和CA 的工艺为:提取时间59.44 min,含水量11.54%,液固比43.84:1 mL/g,提取温度39.23 ℃,预测RA 理论上的得率是20.761 mg/g,CA 理论上的得率是34.357 mg/g。但考虑实际情况,最后设定提取时间60 min,含水量12%,液固比为44:1,提取温度为40 ℃,平行三组实验最后测得RA 的得率是20.247 mg/g,与软件预测误差为2.476%,CA 的实际得率为34.086 mg/g,与软件预测误差为0.795%,实际与模型误差较小,证明模型的有效性。
2.5 不同提取方法得率比较
在相同的液固比条件下,比较了80%乙醇回流提取1 h、正己烷冷浸提取24 h 和优选出的DESs提取迷迭香中的RA 和CA,结果见表7。
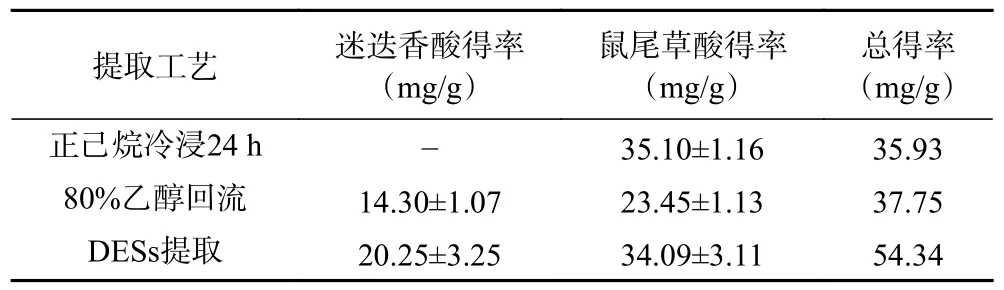
表7 传统提取方法提迷迭香中RA 和CA 的得率Table 7 Yields of RA and CA from Rosmarinus officinalis L.by traditional extraction methods
由表7 可知,传统的正己烷冷浸提取仅能提出脂溶性的CA,根据相似相溶原理,作为非极性有机溶剂的正己烷很难提出水溶性的RA。DESs 是依靠氢键供体和氢键受体结合产生的氢键作用力,并且不同的组合对提取物具有不同的选择性,十分灵活。Vieira 等[33]研究了亲水性和疏水性DESs提取迷迭香中化学成分的差异,以薄荷醇/月桂酸(摩尔比2:1)组成的疏水性DESs 从迷迭香中提到的是脂溶性的鼠尾草酸和鼠尾草酚;以乳酸/葡萄糖(摩尔比5:1)组成的亲水性DESs 从迷迭香中提取得到的是水溶性的迷迭香酸;将两种DESs 溶剂按照1:1 比例混合形成双相DESs,可以将迷迭香中的鼠尾草酸和迷迭香酸同时提出,分别分布在上下两相中。本试验采用的乳酸/1,4-丁二醇(摩尔比1:2)单相DESs体系,能够将鼠尾草酸和迷迭香酸同时提出,表明极性和80%乙醇相近,但是相较于DESs 提取,80%乙醇回流因其过高的提取温度,RA 和CA 不同程度的氧化,使得得率显著低于DESs 提取。
2.6 抗氧化能力测定结果
不同提取方法所得提取液DPPH 自由基清除能力实验结果见图11。由图11 可知,迷迭香DESs 提取物、80%乙醇回流提物、正己烷冷浸提取物(三者均为0.625 mg/mL 迷迭香提取液)和维生素C(0.03 mg/mL)的DPPH 清除率分别为73.17%、66.93%、62.57%和89.77%。从抗氧化方面进一步验证了建立的DESs 提取工艺相较于传统的迷迭香提取方法,更好的保留了抗氧化活性成分RA 和CA。
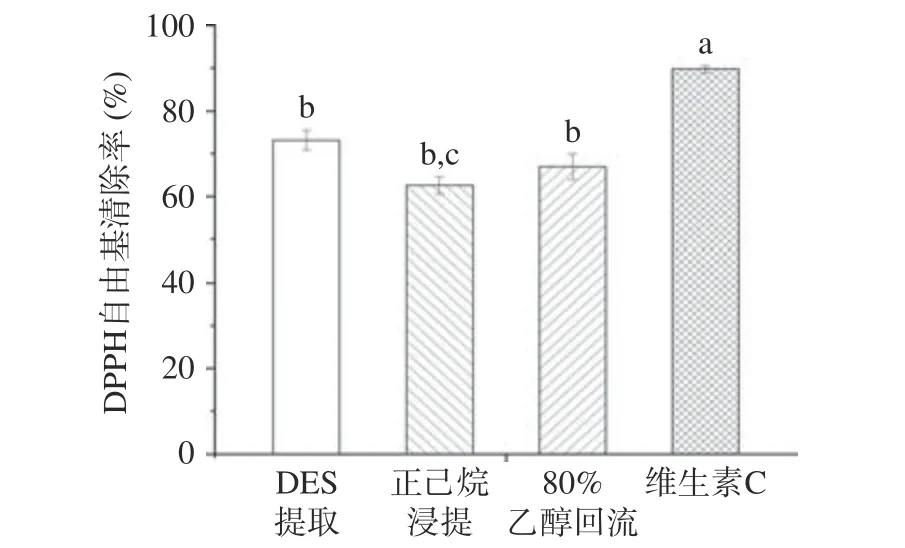
图11 不同提取方法所得提取液与维生素C 的DPPH 清除能力Fig.11 DPPH scavenging capacity of extracts obtained by different extraction methods
3 结论
本实验研究建立了DESs 同时提取迷迭香中水溶性成分RA 和脂溶性成分CA 的新工艺。以RA和CA 的最高提取得率为指标,从合成的37 种DESs体系中,筛选出以乳酸/1,4-丁二醇(摩尔比1:2)构成的最适DESs 体系。在单因素实验的基础上,采用响应面法优化出了同时提取迷迭香中RA 和CA 的最佳提取工艺(含水量12%、液固比44:1 mL/g、提取时间60 min,提取温度40 ℃),在此条件下,RA 和CA 的得率分别为20.247 和34.086 mg/g,相较于乙醇回流和正己烷冷浸传统提取工艺,DESs 提取RA 和CA 总得率分别提高了1.4 倍和1.5 倍;通过DPPH 自由基清除实验,进一步验证了DESs 提取迷迭香所得迷迭香抗氧化物,其质量明显优于传统的有机溶剂提取。和已有文献[31-33]报道的DESs 提取迷迭香抗氧化物成分工艺相比,能够实现单相DESs同时将水溶性迷迭香酸和脂溶性鼠尾草酸提出。本研究为高效快速提取迷迭香抗氧化物及其资源开发利用提供科学依据。

