红芸豆多糖联合运动改善饮食诱导的肥胖小鼠糖脂代谢紊乱
袁 彬,杨永红,周海洋
(漯河医学高等专科学校,河南漯河 462002)
高脂饮食(High fat diet,HFD)引起的代谢紊乱可导致多种疾病,包括动脉粥样硬化、炎症、高脂血症和肝脂质过氧化,还可增加心血管疾病和2 型糖尿病的风险。由于不健康的饮食习惯和缺乏运动,人类正面临着肥胖及其并发症的巨大挑战[1]。越来越多的研究表明,过多的脂质刺激导致细胞因子的异常,包括肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、瘦素,并引发脂肪沉积,诱导肥胖相关代谢疾病的发生[2]。此外,代谢障碍已被证明与系统氧化应激密切相关,肥胖受试者体内氧化应激较高。动物研究还发现,喂食HFD 的小鼠可导致肝脏中活性氧(ROS)水平升高,降低线粒体代谢功能[3]。
目前,饮食调整和体育锻炼干预仍被认为是调节代谢的有效方案[4],许多天然提取物已被证明对代谢紊乱具有一定的疗效。前瞻性研究表明,膳食多糖作为低热量生物活性物质,具有保护肝脏、抗糖尿病、抗炎、抗肿瘤和抗氧化作用,对糖脂代谢和肠道菌群有显著影响[5]。红芸豆中含有丰富的多糖(Polysaccharides from red kidney bean,PRK),能有效的改善小鼠糖脂代谢[6]。有证据表明,体育锻炼对能量稳态有积极影响,并对各种肥胖所致疾病起到预防作用,激活线粒体、组织更好得能量供应链,改善能量平衡并更好地调节人体代谢[7]。体育运动已被证明可以增加骨骼肌细胞中线粒体的容量,提高线粒体氧化酶的活性,并调节线粒体中脂质的含量,从而改善线粒体功能以充分促进糖脂氧化[8]。然而,PRK 联合运动(Exercise,E)是否能更好地调节肥胖引起的代谢紊乱尚未在体内进行研究。与此同时,这种联合干预如何发挥其保护作用,在很大程度上仍未得到研究。在此,阐明其调控机制具有重要意义。因此,本研究采用高脂饮食诱导肥胖小鼠糖脂代谢紊乱,采用PRK 灌胃结合运动进行处理,考察其通过Nrf2/NQO1/HO-1 信号通路发挥降糖、降脂以及抗氧化作用,并分析及其潜在的分子机制。
1 材料与方法
1.1 材料与仪器
雄性C57BL/6 小鼠(SPF 级,18~22g,4 周龄)购自中国科学院上海动物实验中心,动物合格证号SCXK(沪)2017-0005。将小鼠置于(24±0.5)℃,相对湿度60%的条件下,光照/黑暗循环12 h,在研究期间可自由进食和饮水;所有动物实验均经校动物伦理委员会批准(批准号:2021-0107);红芸豆 购自于河南省漯河市许慎市场;耐高温α-淀粉酶 广州华钰生物科技有限公司;无水乙醇 山东蓄福源化工有限公司;木瓜蛋白酶 北京奥博星生物技术责任有限公司;氯仿、正丁醇 阿尔塔科技有限公司;AB-8 大孔树脂 天津浩聚树脂科技有限公司;试剂盒TC、TG、LDL-C、HDL、SOD、MDA、GSH-Px、胰岛素、TNF-α、IL-6、IL-1β南京建成生物工程研究所;10%多聚甲醛、兔抗人PPARα、FASN、Nrf2、NQO1、HO-1、β-actin、HRP 标记的羊抗兔IgG 二抗 碧云天生物技术有限公司。
CKX41-C31B 倒置荧光显微镜 奥林巴斯(中国)有限公司;ELx800 全自动酶标仪 美国BioTek公司;BIO-RAD 伯乐电泳成像系统 美国BIO-RAD公司;电热鼓风干燥箱 上海一恒科学仪器有限公司;GF02100 g 多功能粉碎机 上海霸辉工具有限公司;DF-101S 集热式恒温加热磁力搅拌器 巩义市予华仪器责任有限公司;冷冻干燥机 Thermo Savant 公司;V-800 型真空旋转蒸发仪 BUCH 公司。
1.2 实验方法
1.2.1 红芸豆多糖的提取 500 g 红芸豆,电热鼓风干燥箱50 ℃烘干,GF02100 g 多功能粉碎机粉碎过60 目筛制成豆荚粉,加入5000 mL 蒸馏水在磁力搅拌器中充分混合。95 ℃下加入10 mL 耐高温α-淀粉酶(40000 U/g),持续搅拌30 min,冷却至60 ℃。然后在混合物中加入12 mg 木瓜蛋白酶溶液(2000U/mg),在60 °C 水浴中孵育30 min,持续搅拌,以3500 r/min 离心15 min,取上清、浓缩,用四倍体积的无水乙醇在4 ℃下沉淀12 h,得到粗多糖。粗多糖用蒸馏水重新溶解,与1/3 体积的Sevag 试剂(氯仿/正丁醇(4:1,v/v))混合。充分搅拌30 min 后,以3500 r/min 离心10 min,重复脱蛋白3 次。所得溶液,浓缩至1/4 体积,AB-8 大孔树脂纯化,蒸馏水洗脱,收集滤液,旋转蒸发仪浓缩、冷冻干燥机冷冻干燥得到红芸豆多糖[9],经苯酚-浓硫酸法检测多糖含量为91.2%。
1.2.2 动物分组 小鼠随机分为5 组(每组n=8),即对照组,正常饮食;模型组,高脂饮食;PRK 组,高脂饮食+400 mg/kg/d PRK;E 组,高脂饮食+运动;PRK+E 组,高脂饮食+400 mg/kg/天PRK+运动。
1.2.2.1 饮食喂养及给药 小鼠正常饮食,含量为碳水化合物(72.1%)、蛋白质(22.1%)和脂类(5.7%),总热值约为3100 kcal/kg,或由碳水化合物(27.5%)、蛋白质(14.5%)和脂类(58.8%)组成的高脂肪饮食,包括正常饲料585.4 g/kg,黄油310.9 g/kg,酪蛋白73.2 g/kg,矿物质混合物24.6 g/kg,维生素混合物4.1 g/kg,DL-蛋氨酸1.8 g/kg。所有小鼠均给予正常自来水。同时PRK 组和PRK+E 组小鼠按照400 mg/kg剂量灌胃[9],其余组给予等量的蒸馏水灌胃,每天1 次,连续12 周。在整个实验期间,每周监测体重。
1.2.2.2 运动实验 PRK+E 组、E 组的所有小鼠每周连续进行5 次运动训练,连续12 周。从1 到4周,采用温和的强度进行,在跑步机上运行的速度首先5 m/min 运动5 min,其次10 m/min 的速度运动30 min,然后以5 m/min 的速度运动5 min。从5 到12 周,小鼠首先5 m/min 运动5min,其次13 m/min速度运动30 min,然后5 m/min 运动5 min[10]。
1.2.3 口服葡萄糖耐量试验(OGTT) 在干预第12 周进行OGTT 实验。在小鼠禁食过夜后,给小鼠注射葡萄糖(1 g/kg 体重)。每30 min 从尾静脉抽血,持续2 h 以上,采用血糖仪测试空腹血糖(FBG)水平。
1.2.4 样本采集 干预12 周后禁食过夜,异氟醚麻醉后摘除眼球处死。采集血样,3500 r/min 离心15 min,得到血清。收集肝脏清洗并称重,将肝组织分为两部分,一部分用10%福尔马林保存,另一部分在磷酸盐缓冲液中均质,3500 r/min 离心15min,得上清,备用。
1.2.5 生化指标检测 生化分析仪测定血清或肝脏生化指标,包括血糖、胰岛素、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)。肝脏上清采用试剂盒进行TC、TG、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)分析。采用酶联免疫试剂盒(南京建成)检测血液中胰岛素、肝脏上清中肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、IL-1β含量。
1.2.6 组织病理学分析 取肝组织,用预冷的磷酸盐缓冲液(PBS,pH7.2~7.4)冲洗,然后固定于10%多聚甲醛溶液中。处理后的组织用石蜡包埋,切片(厚度4~5 μm),用苏木精和伊红染色(H&E),显微镜观察。
1.2.7 Western Blot 实验 将相同重量的组织放入加冰预冷的玻璃均质器中,加入裂解液和蛋白酶抑制剂(比例为100:1)。冰浴环境中进行研磨,静置后,置于4 ℃,12000 r/min 离心15 min。吸取上清,用BCA 法测定其蛋白浓度。SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,并电泳转移到聚偏二氟乙烯(PVDF)膜。然后加入5%脱脂奶粉封闭1 h,加入以下一抗,4 ℃过夜:兔抗PPARα(1:1000)、FASN(1:1000)、Nrf2(1:1000)、NQO1(1:1000)、HO-1(1:1000)。TBST 洗涤三次,相应的二抗(1:1000)在室温下孵育1 h,用TBST 清洗三次。β-肌动蛋白作为内参,增强化学发光溶液(ECL)处理条带,Image J 软件分析蛋白条带。
1.3 数据处理
所有数值均以均数±标准差表示。采用Graph Pad Prism(5.0 版)进行统计分析,采用单因素方差分析和Newman-Keuls 多重比较检验。P<0.05 为差异显著,P<0.01 为差异极显著。
2 结果与分析
2.1 红芸豆多糖联合运动对机体重量和肝脏重量的影响
由图1 可知,与对照组比较,模型组小鼠的体重和肝质量极显著增加(P<0.01),提示高脂饮食会影响小鼠的正常代谢,导致小鼠的体重和脂肪增加,堆积过多的能量超过了身体在脂肪组织中储存脂肪的能力,各种来源甘油三酯溢出到非脂肪组织,增加脂肪组织的肥大和增生,最终导致代谢紊乱[11-12]。本研究中,与PRK 组和E 组相比,PRK+E 组体重和肝质量极显著下降(P<0.05,P<0.01),说明PRK 和E 对高脂饮食所致糖脂代谢紊乱具有一定的调节作用,这与Li 等[13]的研究基本一致,这说明营养与运动干预相结合可能是一种比单纯饮食更有效的改善代谢综合征进展的策略[14]。
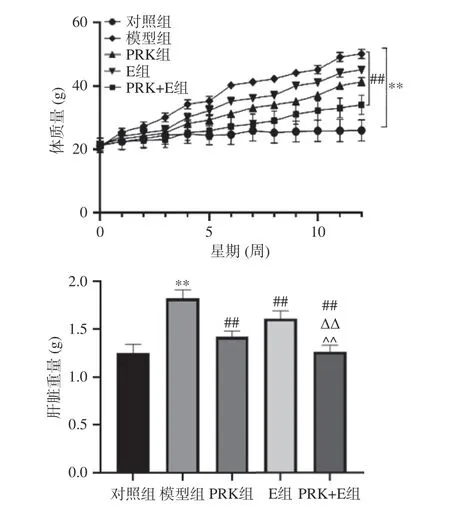
图1 红芸豆多糖联合运动对机体质量和肝脏重量的影响Fig.1 Effects of polysaccharide from red kidney bean combined with exercise on body weight and liver weight
2.2 红芸豆多糖联合运动对机体血糖的影响
本研究评价了从红芸豆中分离出的多糖对高脂喂养小鼠代谢障碍的影响,由图2 可知,与对照组比较,模型组血糖、胰岛素水平极显著增加(P<0.01),提示模型组存在潜在的胰岛素拮抗。胰岛素抵抗是肥胖的主要特征之一,过量摄入高脂食物会产生胰岛素拮抗,严重时出现2 型糖尿病、肥胖、血脂异常等代谢并发症[15]。研究显示,与模型组比较,PRK 组、E 组和PRK+E 组血糖、胰岛素水平极显著降低(P<0.01),表明多糖或(和)运动均可以缓解高脂肪和高能量摄入引起的代谢障碍[16]。而且,与PRK 组、E 组比较,PRK+E 组血糖、胰岛素水平极显著降低(P<0.01),表明说明PRK 和E 联合干预能更有效改善胰岛素拮抗。而且已有文献[17]报道多糖可以缓解高脂肪和高能量摄入引起的肥胖和代谢障碍,并调控血糖水平和代谢性疾病[18]。

图2 红芸豆多糖联合运动对机体血糖的影响Fig.2 Effects of polysaccharide from red kidney bean combined with exercise on blood glucose
2.3 红芸豆多糖联合运动对血脂的影响
血脂包括甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL)和高密度脂蛋白(HDL)。由图3 可知,与对照组比较,模型组小鼠TG、TC、LDL含量极显著升高,HDL 极显著降低(P<0.01),说明肥胖和食用高脂食品与血清和肝脏脂类(包括甘油三酯、总胆固醇、游离脂肪酸和低密度脂蛋白胆固醇)的积累密切相关[19]。研究显示,与模型组比较,PRK组、E 组和PRK+E 组TG、TC、LDL 含量极显著降低(P<0.01),HDL 极显著增加(P<0.01),证实PRK和(或)运动均可以减轻高脂饮食引起脂类代谢紊乱[20]。与PRK 组、E 组比较,PRK+E 组TG、TC、LDL 含量极显著降低(P<0.01),HDL 极显著增加(P<0.01),说明红芸豆多糖结合运动干预能有效缓解高脂饮食所引起的脂代谢紊乱。
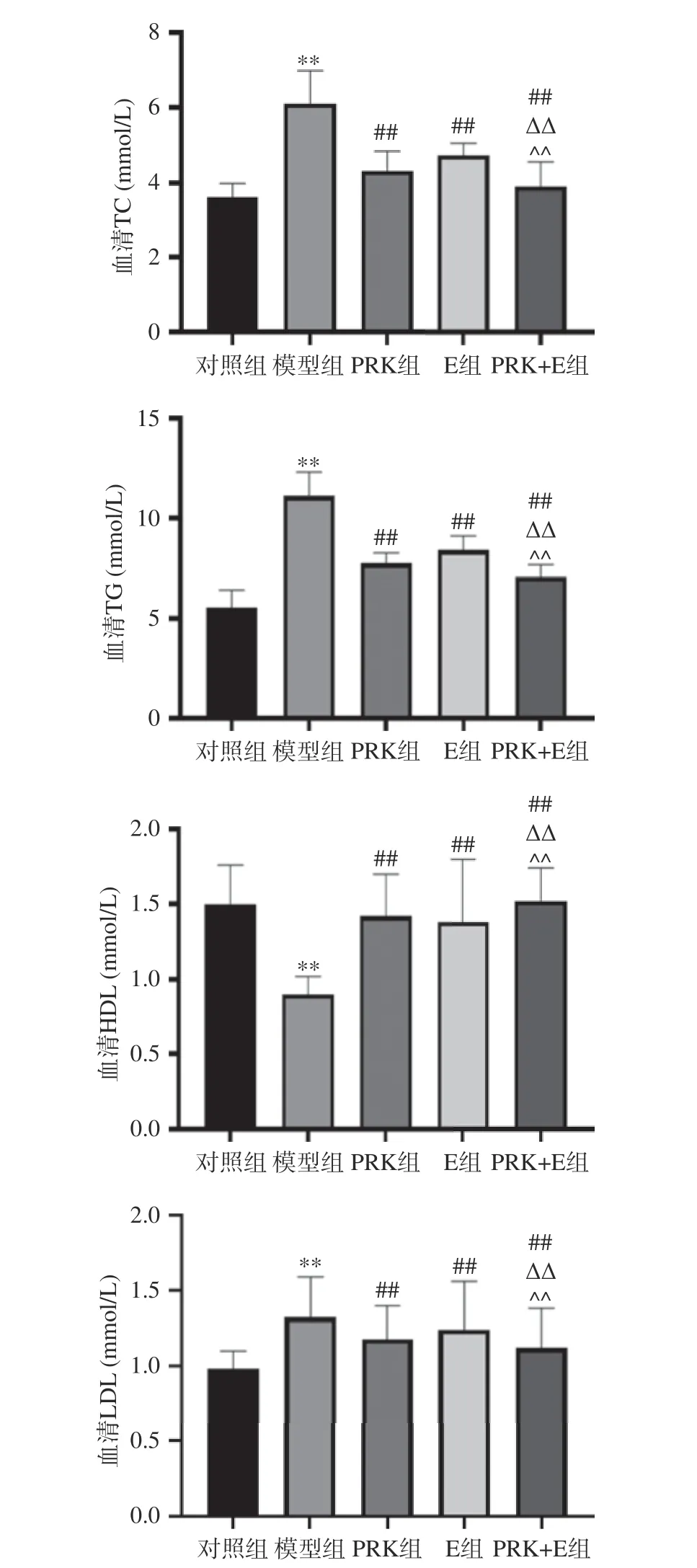
图3 红芸豆多糖联合运动对机体血脂的影响Fig.3 Effects of polysaccharide from red kidney bean combined with exercise on body blood lipid
2.4 红芸豆多糖联合运动对机体肝脏炎症因子的影响
肥胖中常见的氧化应激和ROS 生成可激活核因子κB(NF-κB)通路,进而促进促炎细胞因子包括TNF-α、IL-6 和IL-1β的增加。由图4 可知,与对照组比较,模型组的TNF-α、IL-6 和IL-1β极显著增加(P<0.01),提示模型组小鼠可能存在炎症反应。而且已有研究表明,高脂饮食和氧化应激可导致炎症因子分泌过多,引起慢性炎症,慢性炎症通过脂肪组织分泌促炎细胞因子在肥胖的发病机制中起着重要作用[21]。研究显示,与模型组比较,PRK 组、E 组和PRK+E 组TNF-α、IL-6 和IL-1β含量极显著降低(P<0.01),表明PRK 和(或)运动均可以减轻高脂饮食喂养所致高浓度的TNF-α、IL-6 和IL-1β。与PRK 组、E 组比较,PRK+E 组TNF-α、IL-6 和IL-1β水平显著降低(P<0.05),表明PRK 联合运动均可显著降低肝脏中TNF-α、IL-6 和IL-1β的浓度,缓解炎症反应,从而减轻肝脏损伤。
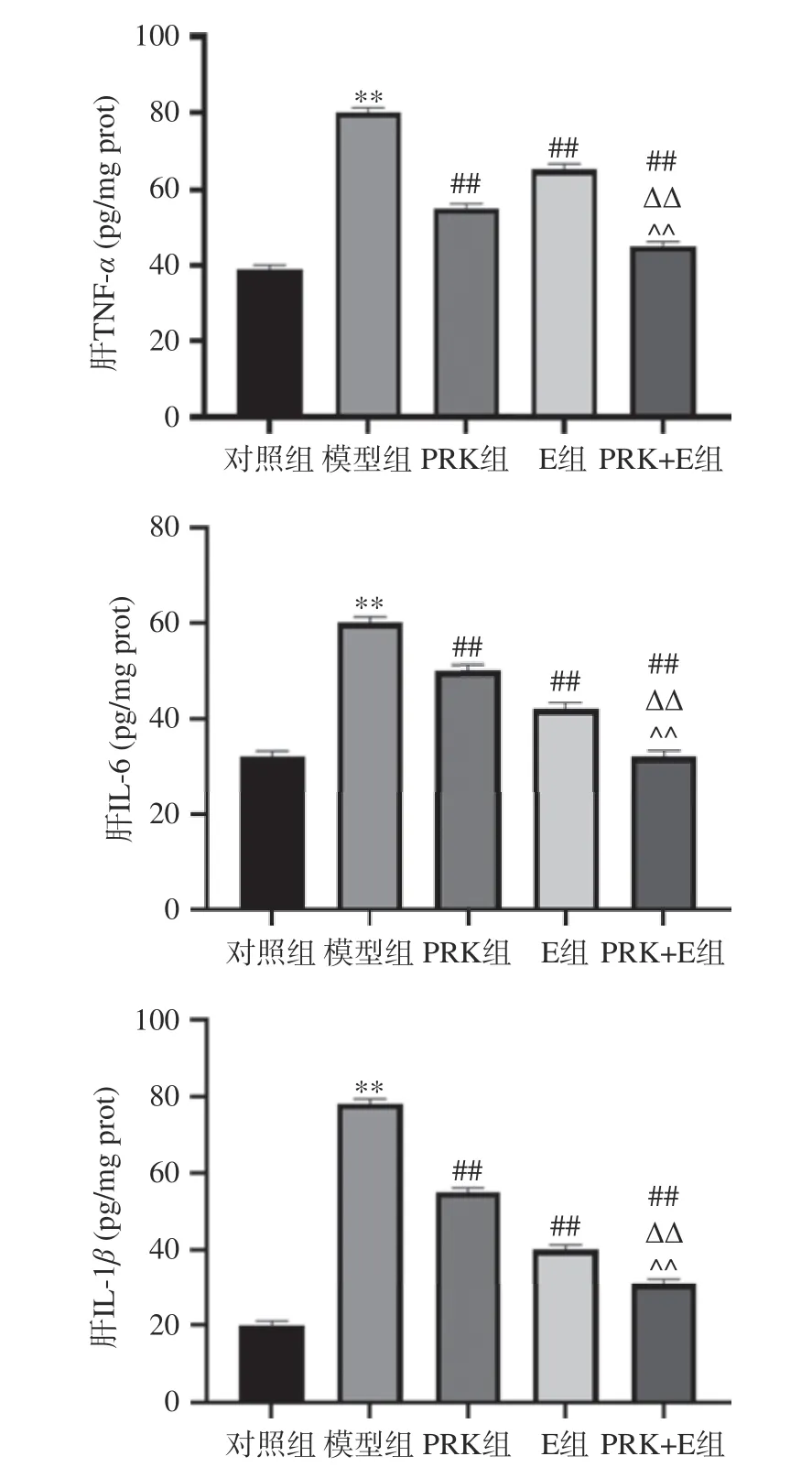
图4 红芸豆多糖联合运动对机体肝脏炎症因子的影响Fig.4 Effects of polysaccharide from red kidney bean combined with exercise on liver inflammatory factors
2.5 红芸豆多糖联合运动对机体肝脏TG、TC 的影响
TG、TC 均为脂类成分之一。研究报道,长期高热量进食可加速TG 的合成,导致TG 在血液和肝脏中大量积累。如图5 所示,与对照组比较,模型组小鼠肝脏TG、TC 极显著上调(P<0.01),说明长期喂食高脂会出现小鼠肝脏异常,导致脂肪的积累。经PRK联合运动干预12 周后,与PRK 组、E 组比较,PRK+E组肝脏中TG、TC 含量均极显著降低(P<0.01)。图6肝脏组织学染色进一步证实了这一点,与对照组比较,模型组肝细胞内出现大量脂滴,这说明动物模型已经成功建立。与模型组比较,PRK、E 或PRK+E 组肝脏脂质沉积物明显减少,中央静脉和小叶结构清晰。参与脂肪酸合成的基因FASN 是脂质生物合成的主要贡献因子,脂肪酸氧化基因PPARα可抑制脂肪酸合成[22]。本研究中,与对照组比较,模型组肥胖小鼠中FASN 的表达量极显著增加(P<0.01),PPARα的表达量极显著减低(P<0.01),这与上述完全一致。而经过PRK、E 或PRK+E 处理后,与模型组比较,PRK、E 或PRK+E 组FASN的表达量极显著降低(P<0.01),PPARα的表达量极显著增加(P<0.01),说明处理组均能有效抑制脂类异常变化,有助于降低肝脏脂质积累,并首次证明了PRK 联合E 通过下调脂肪酸通路表现出较好的协同效应,从而改善肥胖所导致的异常。

图5 红芸豆多糖联合运动对机体肝脏TG、TC 的影响Fig.5 Effects of polysaccharide from red kidney bean combined with exercise on liver TG and TC
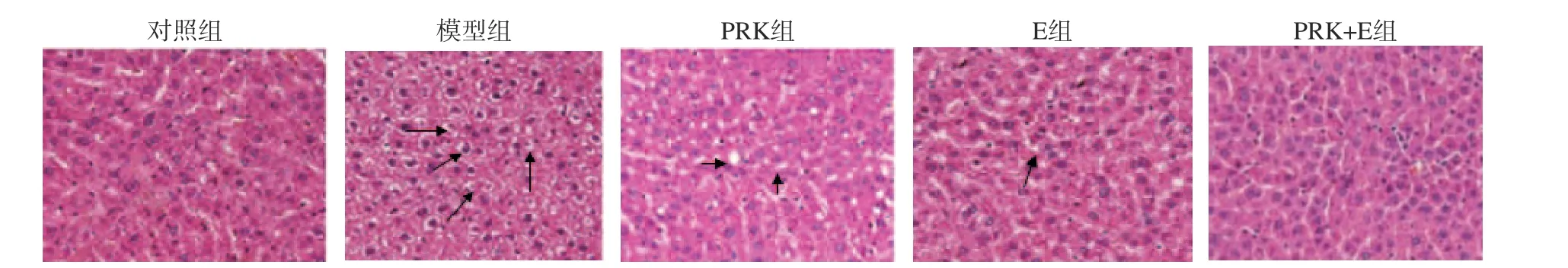
图6 肝切片H&E 染色(200×)Fig.6 H&E staining of liver sections (200×)
2.6 红芸豆多糖联合运动对机体氧化应激的影响
由图7 可知,与对照组比较,模型组MDA 水平极显著升高(P<0.01),GSH-Px 和SOD 活性极显著降低(P<0.01),说明高脂饮食喂养小鼠会导致肝脏组织中氧化应激发生,而且氧化应激被认为是胰岛素抵抗、肥胖的主要执行因子之一,氧化应激的升高被认为先于高脂饮食引起的胰岛素抵抗和肥胖的发生和发展[23]。本研究中,与模型组比较,PRK、E 或PRK+E 联合干预后,GSH-Px 和SOD 极显著增加(P<0.01),MDA 含量极显著降低(P<0.01),说明PRK、E 或PRK+E 均能显著改善饮食诱导的氧化应激(P<0.05),其中PRK+E 干预效果更加明显,这些结果清楚地表明,联合干预能显著保护肝脏免受肥胖诱导的氧化损伤,表现出比PRK 或E 组更充分的作用。另外,与PRK 和(或)E 处理比较,PRK 和E 联合使用能极显著增加Nrf2、NQO1 和HO-1 表达水平(P<0.01),说明PRK 和E 联合使用能显著增强Nrf2 介导的II 相酶系统,特别是其下游基因NQO1 和HO-1,其可调节氧化应激发挥保护作用,减少炎症激活,降低炎症的发生与发展[24]。
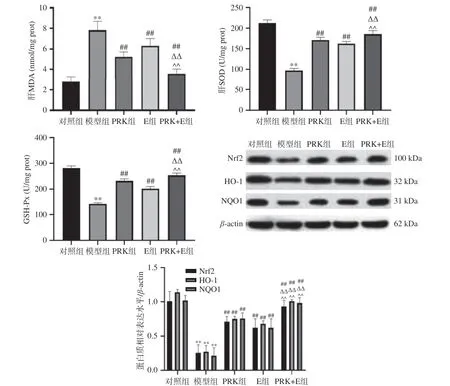
图7 红芸豆多糖联合运动对机体氧化应激的影响Fig.7 Effects of polysaccharide from red kidney bean combined with exercise on oxidative stress
3 结论
目前的研究表明,PRK、E 和PRK+E 可以改善高脂饮食引起小鼠的体重和脂肪堆积,降低高脂饮食引起的肝脏炎症,说明 PRK 和E 对高脂饮食所致糖脂代谢紊乱具有一定的调节作用。此外,本研究表明,与单独使用PRK 或E 干预的小鼠相比,PRK+E干预对血脂、血糖和肝脏炎症具有额外的益处。更重要的是,PRK+E 组的体重下降幅度大于PRK 或 E组,表明PRK 和 E 的组合对体重产生更有效的影响。本研究中,与对照组相比,PRK 和 E 可提高GSH-Px和SOD 的抗氧化酶活性,降低MDA 含量,同时激活Nrf2 信号通路。此外,TNF-α、IL-6 和IL-1β在 PRK+E 组中极显著降低(P<0.01),说明PRK+E 对Nrf2 信号通路具有一定的影响,PRK 联合E 干预可以通过上调Nrf2、NQO1 和HO-1 有效减轻肥胖诱导的炎症和氧化应激来保护肝脏,以应对肥胖诱导的代谢障碍,保护机体能量代谢,改善肝脏炎症。与PRK 或E干预相比,该组合通过减少脂质积累、抑制炎症和氧化应激,并表现出更大的有效协同效益,红芸豆多糖和运动的结合可能是一种可行的非药物干预,以改善肥胖引起的代谢障碍。其调控作用与降低FASN 的表达,增加PPARα水平有关,并通过上调Nrf2、NQO1和HO-1 水平,降低氧化应激,减轻肝脏炎症。因此PRK+E 的组合可能是干预高脂饮食所致的糖脂代谢紊乱的一种有前途的方法。

