草菇栽培过程中培养料养分和微生物群落结构的动态特征
李辉平 骆昕 马林 姜雅 王琳 杨华平 曲绍轩


摘要:为研究草菇生产过程中不同阶段培养料中的养分和微生物群落结构组成的变化特征,以二次发酵结束后、发菌期和出菇期等3个不同栽培阶段培养料为研究对象,测定培养料中有机质、全氮、全磷、全钾、有效磷、速效钾、水解性氮含量和pH值。同时,基于16S和18S rDNA序列研究同批次的培养料在3个不同栽培阶段的细菌和真菌等生物群落的组成时空动态特征。在此基础上,还对比了同批次和非同批次未正常结实培养料与正常结实培养料的生物群落差异特征,以揭示培养料养分含量和生物群落中优势种群组成与草菇结实之间的关系。结果表明,二次发酵后的培养料中有机质、全氮、水解性氮、全钾和速效钾养分含量以及pH值在发菌期和出菇期均明显上升,而全磷和有效磷含量在发菌期显著上升后在出菇期下降。与正常结实的培养料相比,同批次未正常結实草菇培养料的全氮、水解性氮、全磷、全钾和速效钾养分含量均存在显著性差异;生物群落α多样性指数表明,培养料中真核生物群落的Chao1、Ace指数随着草菇的定植、生长和子实体形成而下降,细菌群落的Chao1、Ace、香农指数呈现一直增加的趋势;发酵料随着草菇生长发育其生物群落在门水平上优势菌群组成和相对丰度差异较大,厚壁菌门、放线菌门、子囊菌门、毛霉菌门是二次发酵后培养料的优势菌群,草菇菌丝定植后变形菌门、担子菌门和褐藻门的相对丰度提高;不能结实培养料与正常结实培养料的生物菌落结构存在显著差异,其优势菌群的相对丰度下降以及可能缺少出菇期特有的微生物菌群是造成出菇异常的重要因素。本研究结果对揭示草菇出菇异常的形成机制具有一定的参考价值。
关键词:发酵料;出菇异常;群落结构;聚类分析;多样性分析
中图分类号:S646.1+30.4 文献标志码:A
文章编号:1002-1302(2023)13-0149-09
草菇(Volvariella volvacea)是世界重要的可栽培草腐食用菌之一,以作物秸秆(如稻草、麦秆、玉米秸秆等)发酵后的腐殖质作为主要营养来源[1]。自然分布于热带、亚热带地区,是一种高温型食用菌,其人工栽培最早起源于我国,因此又被称为“中国蘑菇”,在我国和东南亚地区栽培广泛,我国是全球最大的草菇生产国[2-3]。
草菇的栽培方式以培养料经一次发酵或二次发酵处理后的大棚栽培和室内栽培为主,栽培周期在20~23 d。发酵料中的有益微生物能促进培养料的大分子降解、转化和利用生物热能以及抑制病虫和杂菌的滋生。在已报道的以稻草、废棉或菌渣为主要培养料栽培草菇的研究中发现,发酵料中的微生物优势种群在发酵不同时期会发生变化,同时微生物的群落结构和优势种群因培养料组成的不同而存在显著性差异[4]。目前已初步明确了草菇培养料发酵中的优势微生物类群及变化情况,即以废棉为主要培养料,在二次发酵中细菌是以变形菌门、拟杆菌门和厚壁菌门为优势种群,真菌是以非培养散子囊菌目为优势种群[5-6];以工厂化杏鲍菇或鹿茸菇栽培后的菌渣为主要培养料栽培草菇时,一次发酵后是变形菌门和拟杆菌门为细菌优势种群,二次发酵后以变形菌门、拟杆菌门和厚壁菌门为优势种群[7]。然而,培养料发酵完成后栽培过程中生物群落组成结构与草菇生长发育之间相关分析的研究还未有报道,是否还有其他生物群落在草菇栽培中起关键作用尚不清楚。本研究运用高通量测序技术对草菇栽培过程中培养料内生物群落的动态变化特征进行解析,并比较分析其养分组成的动态变化过程,以期明确不同阶段培养料养分和生物群落动态特征,为解析其与草菇生长结实互作关系奠定基础。
1 材料与方法
1.1 试验材料
本研究于2022年夏季在江苏江南生物科技有限公司进行。草菇菌种为V06,由江苏江南生物科技有限公司提供。草菇的培养料配方为鹿茸菇菌渣90%,稻草10%,石灰调 pH值到7.9~8.0,含水量为65%。
分别采集二次发酵后(CK)、草菇发菌期(F)、草菇出菇期(V)的培养料以及同批次不出菇(T)和不同批次不出菇(TJ)的培养料(不出菇的培养料发菌正常,无杂菌污染和病虫害发生)。采用随机取样法,每个时期的样品取5点混合,重复3次,每个重复分成2份样品,一份用于培养料理化性质测定,一份用于高通量测序[7-8]。样品于-80 ℃保存备用。
1.2 试验方法
1.2.1 培养料DNA提取及高通量测序 利用土壤DNA提取试剂盒(Omega Bio-Tek,Norcross,GA,美国)提取培养料微生物DNA。分别利用细菌16S rRNA 基因的V4~V5 区域特异性引物[515F (5′-GTGCCAGCMGCCGCGGTAA-3′)和907R (5′-CCGTCAATTCMTTTRAGTTT-3′)],真核 18S rRNA基因的 V4 区特异性引物[1380F (5′-CCCTGCCHTTTGTACACAC-3′)和1510R (5′-CCTTCYGCAGGTTCACCTAC-3′)]进行PCR扩增[9-10]。反应程序:95 ℃预变性5 min,30个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s)扩增,最后72 ℃延伸 5 min。PCR反应体系为30 μL,其中Phanta Max Master Mix(南京诺唯赞生物科技股份有限公司)为15 μL,F/R引物(10 μmol/L)各1 μL,模板DNA为20 ng。扩增子在 2% 的琼脂糖凝胶中电泳分离,用AxyPrep DNA凝胶回收试剂盒(Axygen Biosciences,Union City,CA,美国)进行纯化回收,产物送至南京瑞源生物技术有限公司经 Qubit3.0 (Life Invitrogen,美国)定量后构建测序文库,在Illumina Novaseq 6000平台进行高通量测序[7]。
1.2.2 培养料中养分含量和pH值测定 培养料中有机质含量采用重铬酸钾法测定;全氮含量的测定采用凯氏定氮法;水解性氮含量的测定采用碱解扩散法;全磷和有效磷含量的测定采用比色法;全钾和速效钾含量的测定采用火焰光度法;pH值的测定采用电位测定法[11]。
1.3 数据统计
1.3.1 序列分析 采用DADA2方法对得到的原始数据(raw data)进行拼接、去噪过滤[12],得到有效数据(clean data)。然后基于有效数据进行ASVs(amplicon sequence variants)聚类和物种分类分析[13]。使用QIIME2软件对ASVs进行丰度和Alpha多样性计算等分析,获得样本内物种丰富度和均匀度信息、不同样本或分组间的共有和特有ASVs信息(https://github.com/QIIME2/q2-feature-classifier)[13];为进一步挖掘分组样本间的群落结构差异,选用T-test、MetaStat、LEfSe、Anosim和MRPP等统计分析方法对分组样本的物种组成和群落结构进行差异显著性检验[7];PICRUST2軟件对生态样本中的微生物群落进行功能预测分析(https://github.com/picrust /picrust2/wiki)。
1.3.2 统计分析 采用Microsoft Excel 2016 软件对数据进行处理和作图;SPSS 21.0软件采用最小显著差异法(LSD)进行单因素方差分析(One-Way ANOVA)[7]。
2 结果与分析
2.1 培养料在草菇不同发育阶段的养分组成和pH值
对4组草菇发育不同阶段的培养料理化性质进行分析(表1),培养料pH值在8.14~8.96之间,均为碱性,无显著性差异。水解性氮和速效钾含量随着草菇的生长发育不断的提高,各阶段呈极显著差异;全氮和有机质含量在二次发酵后(CK)和发菌期(F)之间差异不显著,但出菇期(V)与CK和F处理差异极显著,全氮含量在V阶段提高了10%左右,有机质含量提高了2.4%;全磷、有效磷含量和全钾含量在F阶段显著提高,在V阶段显著下降,与F阶段相比,全磷含量下降了12.3%,有效磷含量下降了21.3%,全钾含量下降了2.9%。
与正常结实的培养料V相比,同批次不出菇的培养料T在全氮、水解性氮、全磷、全钾、速效钾和有机质含量等理化性质方面均有极显著差异。相较于F阶段,全氮和有机质含量表现出相似的上升趋势,但有效磷和全钾含量呈现出下降趋势,水解性氮和速效钾含量在T阶段没有显著变化但在V阶段显著提高,全磷含量在T阶段中继续上升而非如V阶段下降。
2.2 培养料在草菇不同发育阶段的细菌多样性指数与群落组成
经高通量测序分析,15个样品共得到有效reads数832 802条,平均每个样品55 520条,共检测到25门、56纲、135目、200科和323属。每个样品随机抽取28 980条reads数据进行抽平处理,所得的有效数据进行ASVs聚类和物种分类分析。通过培养料中细菌群落的多样性分析指数,对草菇不同发育阶段以及不能正常结实的培养料细菌群落物种的丰富度和均匀度进行了评估。由表2所示,培养料在F和V期的细菌丰富度指数(Chao1指数)和群落多样性(Ace指数和香农指数)与二次发酵(CK)相比,呈现出增加的趋势;T和TJ不出菇的培养料细菌群落的Chao1指数、Ace指数和香农指数低于V期的培养料,其细菌多样性和物种丰富度下降。
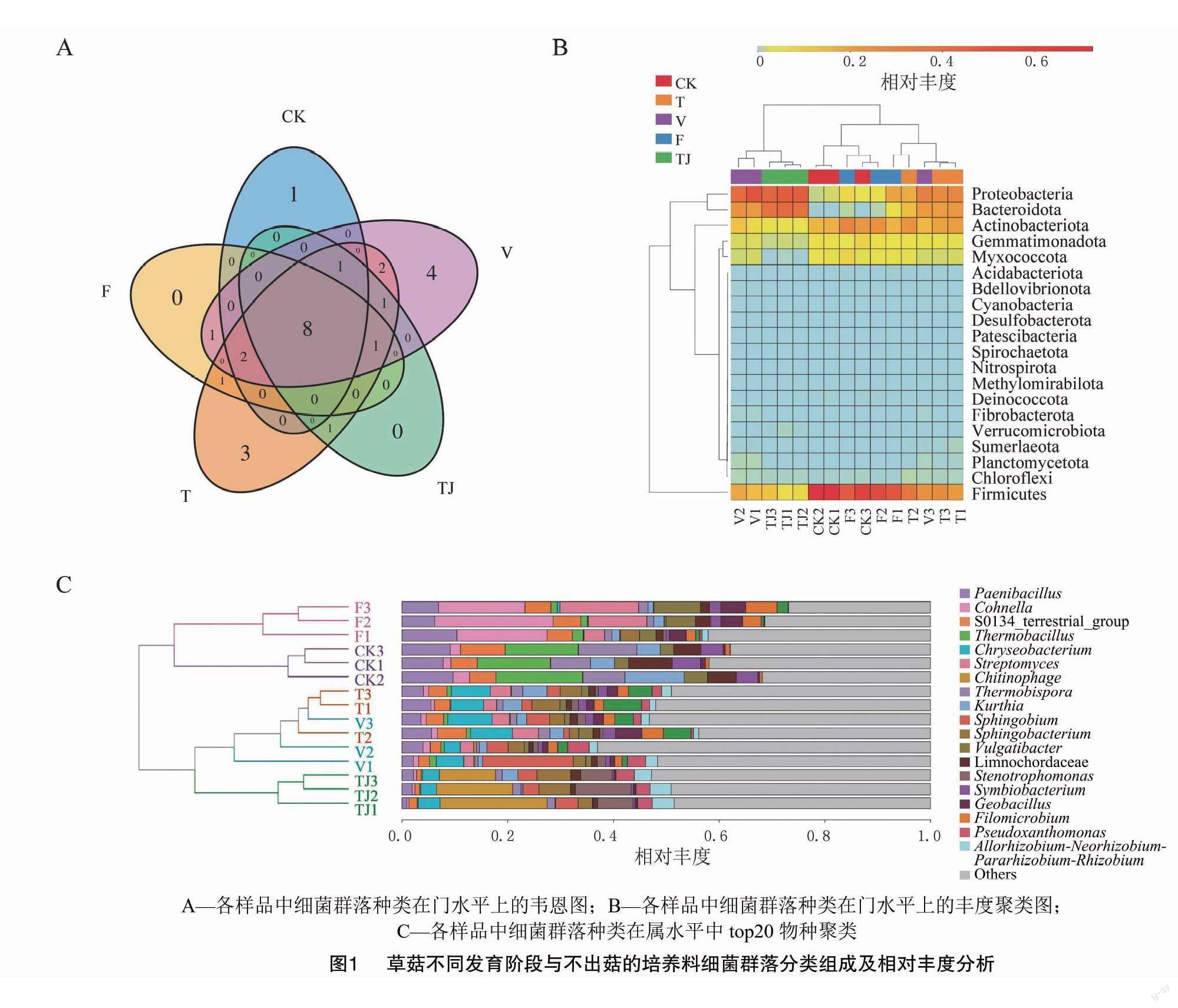
培养料中的细菌群落种类在门水平上有8个门的细菌在15个样品中共有(图1-A)。CK中相对丰度大于1%的细菌菌群从高到低依次为厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)、芽单胞菌门(Gemmatimonadota)、黏球菌门(Myxococcota)和变形菌门(Proteobacteria),5个优势菌门约占所有细菌总数的99%左右(图1-B);F阶段的培养料厚壁菌门相对丰度由CK时的68.3%降低至51.2%,放线菌门相对丰度从17.7%提高到23.4%,拟杆菌门(Bacteroidota)由CK时的0.04%提高到2.6%,6个优势菌门占到所有细菌总数的99%以上(图1-B);V阶段的培养料中厚壁菌门的相对丰度继续降低到18.9%,放线菌门的相对丰度开始下降到11.6%,而变形菌门和拟杆菌门的相对丰度达到最高(分别为41.3%、22.3%),6个优势菌门约占到所有细菌总数的98.4%(图1-B)。各优势菌门在草菇不同发育阶段的分布均有明显差异,但变形菌门和拟杆菌门的相对丰度随着草菇的生长发育呈上升趋势说明二者在其中发挥着重要作用。排在前2位的优势种群的代谢通路均为氨基酸代谢和碳水化合物代谢。
从属水平(图1-C),对获得的323属中前20个优势属进行多样性分析。丰富度大于1%的优势属有19个,分布在草菇不同的发育阶段。CK阶段主要属有厚壁菌门耐热芽孢杆菌属(Thermobacillus)、类芽孢杆菌属(Paenibacillus)、库特氏菌属(Kurthia)、Limnochordaceae科未知属、嗜热共生菌属(Symbiobacterium)和科恩氏菌属(Cohnella)(耐热),放线菌门热孢菌属(Thermobispora)、芽单胞菌门S0134_terrestrial_group以及黏球菌门流行杆菌属(Vulgatibacter),约占所有优势属的62.8%;草菇在定植培养料后,在F阶段和V阶段新出现了放线菌门野野村氏菌属(Nonomuraea)和异样根瘤菌属-新根瘤菌属-副根瘤菌属-根瘤菌属(Allorhizobium-Neorhizobium-Pararhizobium-Rhizobiu)、变形菌门鞘脂菌属(Sphingobium)和寡养单胞菌属(Stenotrophomonas)以及拟杆菌门的噬几丁质菌属(Chitinophaga)5个优势属;同时,变形菌门的丝状微球菌属(Filomicrobium)和厚壁菌门的芽孢杆菌属(Geobacillus)、放线菌门的链霉菌属(Streptomyces)、拟杆菌门的鞘氨醇杆菌属(Sphingobacterium)在草菇定植后相对丰度提高到1.3%~9.9%(图1-C);CK阶段和F阶段(相对丰度大于5%)的优势属以高温的厚壁菌门为主,V阶段的细菌多样性最高,以变形菌门鞘脂菌属和拟杆菌门的金黄杆菌属(Chryseobacterium)为主;有4个门7个纲20个目27个科共51个属的细菌仅在V阶段出现,其相对丰度均低于1%,其中大于0.5%相对丰度的有拉氏噬冷菌属(Algoriphagus)、黄杆菌属(Flavobacterium)和印度副土地杆菌(Parapedobacter)。
2.3 培养料在草菇不同发育阶段的真核生物多样性指数与群落组成
利用18S rRNA基因序列高通量测序获得了15个样品的所有真核生物种类,反映了样本间生物种类的差异。15个样品共得到有效reads数1 121 536条,平均每个样品74 769条,共检测到24门、39纲、55目、70科和76属。每个样品随机抽取35 705条reads数据进行抽平处理,所得的有效数据进行ASVs聚类和物种分类分析。由表3可知,培养料在F和V阶段的真核生物Chao1指数和Ace指数与二次发酵(CK)相比呈现出下降的趋势,而香浓指数和辛普森指数呈上升趋势。同批次T不出菇的培养料群落的Chao1指数、Ace指数、辛普森指数低于正常出菇的培养料(V),其生物多样性和物种丰富度下降;不同批次的TJ不出菇培养料的香农指数是最低。
15个样品的真核生物群落种类在门水平上有11个门共有和5个门特有(图2-A)。由图2-B可知,CK中相对丰度大于1%的生物群落从高到低依次为真菌中的子囊菌门(Ascomycota)、毛霉菌门(Mucoromycota)和担子菌门(Basidiomycota)以及原生动物中的丝足虫门(Cercozo),其中子囊菌门为优势群落,占所有生物总数的83.7%;F阶段子囊菌门相对丰度降低到12.6%,毛霉菌门相对丰度也下降了4.7%,担子菌门相对丰度从3.3%提高到37.1%, 褐藻门(Ochrophyta)由CK阶段的0.4%上升到了26.2%;V阶段的子囊菌门和毛霉菌门的相对丰度继续下降,特别是毛霉菌门降低到0.8%,担子菌门占所有生物总数的69.0%,褐藻门虽由F阶段的26.2%降到17.6%,但其仍是在担子菌门之后的优势群落。此外,在V阶段,原生生物双并鞭虫(Bicosoecida)的相对丰度从F阶段的0.01%提高到2.2%。真菌优势种群的代谢通路排在前2位的均为核苷酸代谢和遗传基因信息处理的复制和修复。
在目水平上(图2-C),对获得的所有目中前20个优势目进行多样性分析。丰富度大于1%的优势目有7个,分布在草菇不同的发育阶段。CK阶段主要有子囊菌门的酵母目(Saccharomycetales)、毛霉菌目(Mucorales)和散囊菌目(Eurotiales),以及担子菌门的伞菌目(Agaricales),约占所有目的94.7%;F阶段随着草菇的定植,伞菌目的相对丰度很快提高到37.0%,子囊菌门的酵母目和粪壳菌目(Sordariales)以及原生动物门的分类地位未定的(Incertae_Sedis)相对丰度提高,毛霉菌目和散囊菌目的相对丰对降低;V阶段伞菌目的相对丰度提高到69.0%,超过1%的丰富度的优势目还有酵母目(6.2%)、粪壳菌目(1.3%)和Incertae_Sedis(7.4%),约占所有目的83.9%;草菇定植后,培养料的生物多样性和丰富度都有所下降。
2.4 生物群落的多样性对草菇结实的影响
为研究生物群落的结构及其多样性对草菇结实的影响,分别比较分析T和TJ与V阶段的细菌菌落(图3)、真核生物(图4)在门和属水平上的丰富度和组成的差异。细菌菌落差异分析结果(图3)表明, T与V阶段有65个属共有、 27个属特有,TJ与V阶段有51个属共有、13个属特有,T和TJ都有博斯氏菌属(Bosea)和短杆菌属(Brevibacterium)2个属,二者相对丰度约占0.1%;T中变形菌门的博德特氏菌属(Bordetella)的相对丰度较低,而放线菌门的野野村氏菌属相对丰度显著提高,与V阶段呈现出相反趋势(图3-A、图3-C);TJ中放线菌门野野村氏菌属和芽单胞菌门S0134_terrestrial_group的相对丰度低于V阶段,而拟杆菌门的噬几丁质菌属的相对丰度高于V阶段(图3-B、图3-D);在所有的样品中,V阶段特有的4个门为纤维杆菌门(Fibrobacterota)的纤维杆菌属(Fibrobacter)、蛭弧菌门(Bdellovibrionota)、蓝藻菌门(Cyanobacteria)和脱硫杆菌门(Desulfobacterota),除纤维杆菌的相对丰度为0.18%外,后3个的相对丰度均低于0.01%。
真核生物群落差异分析結果表明,T与V阶段有18个属共有,无特有属,TJ与V阶段有20个属共有、2个属特有,T和TJ之间无特有的属;从门水平看,T中原生动物中丝足虫门的相对丰度显著低于V阶段;V阶段的优势群落褐藻门(26.2%)在TJ样品中相对丰度仅为1.7%,而真菌群落中子囊菌门的毛壳菌属(Chaetomium)和毕赤酵母菌属(Pichia)相对丰度显著高于V阶段,子囊菌门嗜热真菌属(Thermomyces)相对丰度下降(图4)。
3 讨论
本研究发现,培养料经二次发酵腐食后随着草菇生长发育其养分组成和生物群落在相对丰度和组成上表现出较大的时空变化。利用高通量测序,笔者在草菇培养料中共检测到细菌25门、56纲、135目、200科、323属,真核生物24门、39纲、55目、70科、76属,物种多样性差异反映了草菇栽培的微生态群落的功能和动态变化。二次发酵后的培养料是以高温的厚壁菌门和放线菌门为细菌优势种群,子囊菌门和毛霉菌门为真菌优势种群,这一结果与已报道的有关食用菌菌渣为发酵料的微生物菌群研究较为一致[7]。草菇定植后,细菌多样性不断提高,有4个目7个纲共51个属的细菌仅在草菇出菇阶段出现,厚壁菌门、放线菌门、子囊菌门和毛霉菌门的相对丰度逐渐降低,而变形菌门、拟杆菌门、担子菌门和褐藻门上升为优势种群。可见,培养料生物群落的多样性和物种丰富度受草菇生长发育的影响。
培养料的发酵腐熟过程是由多种微生物共同作用而实现的,在这个过程中培养料的营养成分得到充分降解以利于草腐菌的吸收,理化性质是微生物群落的重要推动因素[14]。此外,培养料的组成也影响草菇呈味物质的组成,以棉籽壳为基质栽培草菇,其粗蛋白及水解氨基酸含量及组成最高,以稻草为基质栽培草菇,其可溶性糖醇、有机酸含量最高[15]。在对双孢蘑菇培养料的细菌菌群结构及其功能研究中发现,培养料中50%以上的纤维素和60%左右的半纤维素是通过微生物降解得到的,在二次发酵中纤维素降解的细菌优势种群为假黄单胞菌属(Pseudoxanthomona)、高温单胞菌属(Thermomonospor)和高温双歧杆菌属(Thermobifida),这个过程会使木质纤维素降解为食用菌生长所需的单糖,影响培养料中氮含量、木质素含量和灰分含量,为食用菌生长提供营养,因此也成为影响产量的必然因素[16-19]。Kabel等研究发现,培养料种类不同,特别是木质纤维素组成和结构不同其相关降解所需的酶系存在较大差异,导致培养料中微生物群落的差异性以及食用菌利用的偏好性和选择性,从而影响子实体发生的早晚、多少和质地,最终影响食用菌的产量和品质[20]。草菇培养料在发酵过程中,中温型的细菌和真菌主要分布在发酵料的最外层,高温固氮菌位于内层,放线菌、固氮菌、微嗜氮菌在外层和中层差异不大,其群落的组成和分布随着发酵进程而不同。但培养料中微生物组成与草菇产量的相关性还未明确,有报道显示固氮类微生物的多样性可能与高产性状相关[21]。本研究发现,以鹿茸菇菌渣为主要基质的发酵料二次发酵后的培养料中,嗜热细菌优势种群以耐热芽孢杆菌属、类芽孢杆菌属和热孢菌属为主,其预测的功能是在氨基酸代谢和碳水化合物代谢途径上;嗜热真菌是以酵母目、毛霉菌目和散囊菌目为主,其预测的功能是在核苷酸代谢、复制和修复途径上;随着草菇的生长发育,培养料的生物优势种群和种群结构发生显著性变化,细菌种群新出现了放线菌门野野村氏菌属和异样根瘤菌属-新根瘤菌属-副根瘤菌属-根瘤菌属、变形菌门鞘脂菌属和寡养单胞菌属以及拟杆菌门的噬几丁质菌属等5个优势属,真核生物种群褐藻门真菌相对丰度从0.4%上升到26.2%。同时,培养料中的氮和钾养分含量以及pH值在发菌期和出菇期均显著上升,而磷在发菌期显著上升在出菇期下降,这说明培养料生物群落结构影响基质的养分组成。从细菌和真菌群落优势种群结构来看,二次发酵料中微生物在培养料的分解代谢和改善培养料理化性质中发挥重要作用,在草菇生长发育中,放线菌对草菇并无负面影响,而是进一步使木质素内部结构发生变化,形成腐殖质为草菇提供营养,并且可产生抗生素抑制致病菌,有改善草菇生长的培养料微生态环境的作用[22]。在不结实的培养料中,水解性氮、速效钾的含量没有显著提高,同时全磷的含量继续增加,表现出与出菇培养料相反的变化规律,进而使生物群落的丰富度和结构组成出现显著差异,特别是不出菇的培养料中缺少正常出菇培养料特有的纤维杆菌门的纤维杆菌属、蛭弧菌门、蓝藻菌门和脱硫杆菌门等。
本研究进一步揭示了培养料出菇异常问题可能是培养料微生物群落结构失衡导致的,缺乏特异的菌落来分解成水解性氮、全磷、有效磷和速效钾养分,而使草菇的出菇能力下降,这可能是导致出菇异常的潜在因素。研究草菇生长发育中的有益微生物组成和功能,将其提取出来作为生物菌剂或生物表面活性剂添加到培养料中可以显著改变培养料的微生物群落结构,增加基质的养分吸收、改善培养料的微生态环境,对提高食用菌品质和产量具有重要意义[16,18]。
4 结论
本研究表明,草菇的生长发育影响培养料中生物的多样性,表现为细菌多样性呈增加趋势而真菌多样性呈下降趋势。草菇正常出菇与出菇异常的培养料细菌群落在属水平上差异较大,正常出菇培养料的优势菌有野野村氏菌属、异样根瘤菌属-新根瘤菌属-副根瘤菌属-根瘤菌属、鞘脂菌属、寡养单胞菌属和噬几丁质菌属,而出菇异常的培养料细菌群落α多样性下降。培养料中营养成分包括有机质、全氮、水解性氮、全钾和速效钾养分含量以及pH值随着草菇的生长发育均上升,这与培养料中生物群落结构改变相关。是否因缺乏某种特异的菌落来分解成水解性氮、全磷、有效磷和速效钾养分,而使草菇的出菇能力下降,其相关性需要进一步研究证实。
参考文献:
[1]何焕清,肖自添,彭洋洋,等. 草菇栽培技术发展历程与创新研究进展[J]. 广东农业科学,2020,47(12):53-61.
[2]Chiu S W,Law S C,Ching M L,et al. Themes for mushroom exploitation in the 21st century:sustainability,waste management,and conservation[J]. The Journal of General and Applied Microbiology,2000,46(6):269-282.
[3]李正鹏,余昌霞,李巧珍,等. 草菇工厂化栽培原材料研究进展[J]. 农业工程技术,2017,37(19):67-70.
[4]赵 妍,刘顺杰,张亚茹,等. 微生物多样性分析技术应用于食用菌发酵培养料分析的进展[J]. 食用菌学报,2019,26(3):148-156.
[5]陈长卿,李 桐,姜 云,等. 草菇培养料二次发酵过程中真菌的群落结构[J]. 微生物学报,2014,54(12):1507-1514.
[6]陈长卿,姜 云,孟 丽,等. 变性梯度凝胶电泳分析草菇培养料二次发酵过程中细菌群落演替[J]. 微生物学报,2012,52(8):977-984.
[7]蔣 宁,李辉平,林金盛,等. 草菇培养料发酵过程中细菌菌群的变化研究[J]. 湖北民族大学学报(自然科学版),2021,39(3):261-265.
[8]Chen B Z,Gui F,Xie B G,et al. Composition and expression of genes encoding carbohydrate-active enzymes in the straw-degrading mushroom Volvariella volvacea[J]. PLoS One,2013,8(3):e58780.
[9]Caporaso J G,Lauber C L,Walters W A,et al. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108(S1):4516-4522.
[10]Youssef N,Sheik C S,Krumholz L R,et al. Comparison of species richness estimates obtained using nearly complete fragments and simulated pyrosequencing-generated fragments in 16S rRNA gene-based environmental surveys[J]. Applied and Environmental Microbiology,2009,75(16):5227-5236.
[11]鲍士旦. 土壤农化分析[M]. 3版.北京:中国农业出版社,2000.
[12]Schmieder R,Edwards R. Quality control and preprocessing of metagenomic datasets[J]. Bioinformatics,2011,27(6):863-864.
[13]Edgar R C. UPARSE:highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods,2013,10(10):996-998.
[14]王 杰,何铭烽,李碧瑶,等. 基质成分对草菇生物学特性及其营养利用动态的影响[J]. 广东农业科学,2015,42(2):32-36,48.
[15]余昌霞,陈明杰,李传华,等. 不同培养基质对草菇营养成分及呈味物质的影响[J]. 菌物学报,2018,37(12):1731-1740.
[16]隽加香,肖婷婷,王 倩,等. 双孢蘑菇发酵培养料细菌菌群结构及其功能预测[J]. 食用菌学报,2019,26(4):50-56,159-160.
[17]Jurak E,Punt A M,Arts W,et al. Fate of carbohydrates and lignin during composting and Mycelium growth of Agaricus bisporus on wheat straw based compost[J]. PLoS One,2015,10(10):e0138909.
[18]李云福,李正风,董高峰,等. 双孢蘑菇培养料发酵过程中细菌群落动态变化[J]. 菌物研究,2019,17(2):94-102.
[19]Li Y F,Li Z F,Dong G F,et al. Dynamics of bacterial communities of Agaricus bisporus compost[J]. Mycosystema,2019,17(2):94-102.
[20]Kabel M A,Jurak E,Mkel M R,et al. Occurrence and function of enzymes for lignocellulose degradation in commercial Agaricus bisporus cultivation[J]. Applied Microbiology and Biotechnology,2017,101(11):4363-4369.
[21]肖 熙. 草菇主要产量性状研究及与微生物的关系初探[D]. 福州:福建农林大学,2013:46-47.
[22]Xiang Q J,Luo L H,Liang Y H,et al. The diversity,growth promoting abilities and anti-microbial activities of bacteria isolated from the fruiting body of Agaricus bisporus[J]. Polish Journal of Microbiology,2017,66(2):201-207.

