商品疫苗对我国h9.4.2.5分支H9N2亚型禽流感分离株的免疫保护
麻琦,和新文,王燕,刘艳晶,潘舒心,3,侯玉杰,施建忠,3,邓国华,3,包红梅,3,刘景利,郭兴福,毛胜刚,胡井雷,路通,杨帆,田国彬,3,曾显营,3,陈化兰,3
商品疫苗对我国h9.4.2.5分支H9N2亚型禽流感分离株的免疫保护
麻琦1,和新文1,王燕1,刘艳晶1,潘舒心1,3,侯玉杰1,施建忠1,3,邓国华1,3,包红梅1,3,刘景利2,郭兴福2,毛胜刚2,胡井雷2,路通2,杨帆2,田国彬1,3,曾显营1,3,陈化兰1,3
1中国农业科学院哈尔滨兽医研究所/动物疫病防控全国重点实验室/国家禽类实验动物资源库,哈尔滨 150069;2哈尔滨维科生物技术有限公司,哈尔滨 150069;3农业农村部禽流感等家禽重大疾病防控重点实验室,哈尔滨 150069
【目的】我国批准使用的H9亚型禽流感(avian influenza,AI)商品化灭活疫苗种类繁多,其免疫效果和选用受到养殖者的广泛关注。通过评估不同商品疫苗对我国近期H9N2亚型AIV的免疫保护效果,以期为H9亚型AIV的免疫防控提供科学参考。【方法】依据国家兽药基础数据库疫苗批签发数据,从在售的40种H9亚型AI商品疫苗中选择批签发数量较多的4种疫苗(A—D疫苗),进行免疫攻毒试验。4株h9.4.2.5分支的H9N2亚型分离株CK/XJ/S1204/ 2015、DK/JX/S4512/2017、CK/YN/S1666/2020和CK/NX/S4590/2020为攻毒毒株,分别测定4株病毒的鸡胚半数感染量(EID50)、鸡半数感染量(CID50)和细胞半数感染量(TCID50),以确定动物试验的攻毒剂量和细胞试验的感染剂量。每种疫苗以产品推荐剂量免疫3周龄SPF鸡各40只,同时设同日龄SPF鸡40只接种PBS作为对照组;免疫3周时,采集所有试验鸡血清,测定血凝抑制抗体(HI)和中和抗体(NT)滴度;同时将每种商品疫苗接种40只SPF鸡进行随机分组,每组10只,连同10只对照组鸡,以10 CID50的剂量鼻腔感染H9N2亚型分离株,分别进行商品疫苗对4株病毒的攻毒保护试验。采集攻毒后3、5 d喉头及泄殖腔棉拭子样品,接种10日龄鸡胚检测排毒情况,统计疫苗保护率,比较疫苗对H9N2亚型分离株的免疫保护效果。【结果】4株H9N2亚型分离株的CID50依次为103.5、102.5、102.5和103.5EID50/0.1 mL。商品疫苗接种后3周,各免疫组SPF鸡血清中针对商品化H9亚型HI试验抗原(CK/SH/10/2001)的HI抗体均在9.4 log2—11 log2之间,但针对攻毒株的HI抗体平均效价在4.6 log2—10.8 log2之间,不同疫苗免疫组间存在较大差异,最大差异为64倍,各免疫组NT抗体平均效价在6.7 log2—12.2 log2之间,最大差异为32倍,对照组鸡的HI抗体和NT抗体均为阴性。以滴鼻方式感染不同H9病毒后,4种疫苗的免疫保护效果存在较大差别,在攻击CK/XJ/S1204/2015毒株的试验中,3种疫苗(B—D疫苗)能为免疫鸡提供80%以上保护;在攻击DK/JX/S4512/ 2017毒株试验中,仅1种疫苗(B疫苗)能为免疫鸡提供80%以上保护;在攻击CK/YN/S1666/2020毒株的试验中,2种疫苗(A和B疫苗)能为免疫鸡提供80%以上免疫保护;而攻击CK/NX/S4590/2020毒株,4种疫苗免疫鸡的保护率均低于80%,而同期各对照组鸡均排毒,排毒率均高于80%。【结论】不同商品疫苗预防近期H9亚型分离株感染的免疫保护效果存在较大差异,疫苗抗原与分离株之间的抗原性差异是免疫保护率降低的主要原因;使用H9N2亚型流行毒株测定免疫后的HI抗体和NT抗体可作为评价商品疫苗免疫保护效果的重要依据。本研究为商品H9疫苗的科学选用提供重要参考。
H9N2亚型;AIV;商品疫苗;免疫效果;禽流感
0 引言
【研究意义】H9N2亚型禽流感(avian influenza,AI)是由H9N2亚型禽流感病毒(avian influenza virus, AIV)引起的低致病性禽流感(low pathogenic avian influenza,LPAI)[1-2]。1966年,美国威斯康星州在全球范围内首次报道火鸡群发生H9N2亚型AI感染事件[3],随后该疫病向全球传播。我国于1994年在广东省的鸡群中首次分离到H9N2亚型AIV[4],目前,H9N2亚型AI已经成为我国家禽中最为流行的AI亚型[5]。H9N2亚型AIV单独感染家禽后临床症状不明显[6],但其极易与其他病原造成混合感染[7-11],导致感染家禽表现出较为明显的临床症状,严重者会导致死亡,持续困扰养禽业的发展[12-13]。同时,H9病毒不仅可以感染人,也作为AIV内部基因供体,促进了H5N6、H5N8、H7N9以及H10N8等新型AIV的出现。我国自1998年开始实施疫苗接种策略[2,14-15],在控制H9亚型AI中发挥了重要作用。国家兽药基础数据库数据显示,自2010年至2021年我国已累计有43种H9亚型禽流感相关疫苗批准获得新兽药证书,形成了众多疫苗产品同时生产和应用的局面。近年来,尽管疫苗在我国广泛使用,但H9N2亚型AIV是所有亚型AIV中分离率最高的亚型[2,16],引起人们对当前我国家禽中应用的商品化H9亚型AI疫苗免疫保护效果的担忧,同时我国种类繁多的商品化H9疫苗也给养殖者选用带来困难。因此评估现有商品疫苗对指导H9N2亚型AI的免疫防控具有重要临床意义。【前人研究进展】1998—2006年间流行毒株的抗原变化差异不明显,疫苗的保护率为100%,但2006年以后,H9N2亚型AIV抗原性发生了较大变化,疫苗的保护率也在逐渐下降,家禽感染H9亚型AIV的数量逐渐增多[17]。LI等进行的家禽活禽市场暴露试验中也发现,接种过H9亚型疫苗的鸡依然能够感染活禽市场中的H9N2病毒[18]。我国使用的H9N2亚型AI商品疫苗对近期H9流行毒株的免疫保护效果还没有相关系统的报道。【本研究切入点】本研究基于国家兽药基础数据库中疫苗的种类和批签发数量,筛选出批签发数量较多的H9亚型AI疫苗,使用2015—2020年分离的4株H9N2亚型病毒作为攻毒毒株,进行疫苗免疫保护效果评估。【拟解决的关键问题】评估市场上主要H9亚型AI商品化疫苗对近期H9流行毒株的免疫保护效果,为我国H9N2亚型AIV的疫苗临床应用提供科学数据。
1 材料与方法
1.1 试验时间与地点
本研究于2019—2022年在中国农业科学院哈尔滨兽医研究所完成。
1.2 病毒株
A/chicken/XinJiang/S1204/2015(H9N2)(简称CK/XJ/S1204/2015)、A/duck/JiangXi/S4512/2017(H9N2)(简称DK/JX/S4512/2017)、A/chicken/ YunNan/S1666/2020(H9N2)(简称CK/YN/S1666/ 2020)以及A/chicken/NingXia/S4590/2020(H9N2)(简称CK/NX/S4590/2020)等4株病毒用于主要商品化疫苗对H9N2亚型现地分离株的免疫保护效果研究,以上病毒株均属于h9.4.2.5分支,由国家禽流感参考实验室分离、鉴定和保存。
1.3 疫苗
在国家兽药基础数据库中查询H9亚型AI疫苗相关信息,以2019年H9亚型AI相关疫苗产品的批签发数为依据,筛选出批签发数量较多的4种H9N2亚型AI疫苗作为本研究的评估疫苗。相关疫苗均为市场销售疫苗,编号为A—D。
1.4 抗原
以H9N2亚型AIV A/chicken/Shanghai/10/2001 (CK/SH/10/2001)株为种毒制备的商品化H9亚型AI血凝抑制试验(HI)抗原由哈尔滨维科生物技术有限公司提供。4株H9攻毒毒株抗原(CK/XJ/S1204/2015、DK/JX/S4512/2017、CK/YN/S1666/2020和CK/NX/ S4590/2020)均为接种鸡胚收获尿囊液经β-丙内酯灭活后备用。
1.5 实验动物、鸡胚
3周龄SPF鸡和9—11日龄鸡胚均由依托中国农业科学院哈尔滨兽医研究所的国家禽类实验动物资源库提供。所有试验鸡均饲养在负压隔离器内,所有H9亚型AIV的相关试验均在生物安全2级实验室内进行。
1.6 攻毒毒株EID50、CID50和TCID50测定
鸡胚半数感染量(EID50)测定 根据《中华人民共和国药典》(2015年版附录)规定的方法,将CK/ XJ/S1204/2015、DK/JX/S4512/2017、CK/YN/S1666/2020和CK/NX/S4590/2020,4株H9N2亚型代表毒株病毒原液分别用无菌PBS进行10倍倍比稀释(10-6— 10-10),每个稀释度接种5枚鸡胚,0.1 mL/枚,37℃培养箱孵育,每日照胚,死亡鸡胚随时取出,置于4℃。孵育至72 h后,检测所有鸡胚尿囊液血凝价(HA),HA≥4 log2判为感染。按照Reed-Muench法计算病毒EID50。
鸡半数感染量(CID50)测定 将CK/XJ/S1204/ 2015、DK/JX/S4512/2017、CK/YN/S1666/2020和CK/ NX/S4590/2020,4株H9N2亚型代表毒株病毒液分别用无菌PBS以102EID50—105EID50稀释,每个稀释度分别经鼻腔感染5只3周龄SPF鸡,0.1 mL/只,感染后5 d采集喉头和泄殖腔拭子,接种鸡胚病毒滴定,判定感染鸡排毒阳性数(每只鸡喉头或泄殖腔拭子样品病毒分离阳性,均判定为该只鸡排毒),计算病毒的CID50。
细胞半数感染量(TCID50)测定 取病毒液用无血清DMEM连续进行10倍倍比稀释(10-1—10-10)。取24 h左右长满单层MDCK细胞的96孔细胞培养板,弃去原培养基,各稀释度分别接种8孔,每孔加入100 μL稀释好的病毒液,同时设置细胞对照孔。37℃,5% CO2培养箱中培养72 h,72 h后用1%鸡红细胞悬液滴定结果,根据Reed-Muench法计算病毒的TCID50。
1.7 4种商品化疫苗对我国H9N2亚型流行毒株的免疫保护
1.7.1 分组免疫 A—D每种疫苗分别以说明书推荐剂量(分别为0.3 mL/只、0.5 mL/只)各接种3周龄SPF鸡40只,接种途径为肌肉注射,另外40只接种同剂量的PBS,作为对照组。40只接种相同疫苗的SPF鸡随机分组,10只/组,4种疫苗共40只免疫鸡,连同10只对照组鸡,用于对1株病毒的测试,包括相应HI抗体和中和抗体测定及病毒攻击试验。
1.7.2 HI抗体检测 在免疫3周时,翅下静脉采集所有试验鸡血清,分别用商品H9抗原和攻毒毒株抗原进行HI抗体测定。参照高致病性禽流感诊断技术(GB-T18936-2020)附录中微量血凝抑制试验(HI)方法进行。
1.7.3 中和抗体(NT)检测 参照国家流感中心标准操作规程(修订版)中的禽流感微量中和抗体检测方法[19],分别检测4种疫苗免疫SPF鸡血清针对H9N2攻毒毒株的中和抗体效价。将2倍连续稀释的鸡血清与100 TCID50测试病毒1﹕1混合,37℃,5% CO2培养箱中互作1 h,将100 μL互作液转移至长满单层MDCK细胞的96孔细胞培养板,同时设置细胞对照孔。37℃,5% CO2培养箱中培养72 h,72 h后用1%鸡红细胞悬液滴定结果。
1.7.4 病毒攻击试验 疫苗接种后3周时,将4种疫苗免疫的鸡40只,连同对照鸡10只,以鼻腔感染方式进行攻毒,攻毒剂量为10 CID50。攻毒后3、5 d采集所有攻毒试验鸡喉头和泄殖腔棉拭子样品,接种鸡胚进行病毒滴定,检测排毒情况(病毒分离阳性即表明该只鸡排毒),计算疫苗免疫保护率(组内未排毒鸡数/组内总鸡数×100%)。所有试验鸡观察14 d,记录试验鸡发病和死亡情况。
1.8 H9N2亚型代表毒株抗原性分析
为进一步了解4株H9N2亚型分离株间的抗原性关系,攻毒试验对照组鸡感染14 d后,心脏采血收集血清,另用我国早期H9N2分离毒株A/chicken/ Shanghai/10/2001/(H9N2)(简称CK/SH/10/2001)(h9.4.2.4分支),进行4株H9N2亚型AIV代表株抗原性分析。参考高致病性禽流感诊断技术(GB- T18936-2020)附录中微量血凝抑制试验(HI)方法进行检测。
2 结果
2.1 试验商品疫苗的筛选
国家兽药基础数据库中H9疫苗产品批签发数据显示,2019年共有40种H9疫苗在批准销售,均为灭活疫苗,批签发总计为2 549批次,其中来自不同厂家、批签发数量较多的4种疫苗(编号为A—D)累计1 001批次,占年度批签发总量的39.2%。为避免商业利益纠纷,未公开相关被评估疫苗的名称和生产企业。
2.2 病毒EID50、CID50、TCID50测定
4株病毒的EID50、CID50和TCID50测定结果如表1所示。4株病毒的EID50、CID50和TCID50差异较小。病毒的EID50在10-8.5/0.1 mL和10-8.94/0.1 mL之间;CID50在102.5EID50/0.1 mL和103.5EID50/0.1 mL之间;TCID50在10-6.5/0.1 mL和10-7.5/0.1 mL之间。
2.3 4种商品疫苗免疫SPF鸡血清的HI抗体测定
HI抗体是评价禽流感疫苗免疫效果的最常用方法。SPF鸡接种A—D疫苗3周时,采用微量HI试验检测各免疫组鸡血清针对商品化H9抗原和攻毒毒株的HI抗体。结果显示,用于4株H9分离株攻毒的A—D疫苗免疫鸡血清针对商品化H9抗原(CK/SH/10/2001)的HI平均抗体效价分别在9.4 log2—11 log2之间(图1);用CK/XJ/S1204/2015分离株同时测定对应攻毒免疫鸡血清的HI平均抗体滴度在9.2 log2—10.7 log2(图1-a),表明A—D疫苗中的疫苗抗原与来源于早期毒株的H9商品化HI试验抗原和CK/XJ/S1204/2015分离株具有较近的抗原性;而用DK/JX/S4512/2017和CK/YN/S1666/2020分离株分别测定对应攻毒免疫鸡(A—D疫苗)血清的HI抗体时,A、C和D疫苗免疫鸡血清HI抗体平均滴度均在4.8 log2—7.8 log2之间,只有B疫苗免疫鸡血清针对2株分离株的HI抗体平均滴度分别为10.0 log2和10.8 log2(图1-b和c);用CK/NX/S4590/2020分离株同时测定对应攻毒免疫鸡血清的HI平均抗体滴度在4.7 log2—8.4 log2之间(图1-d);对照组鸡血清对代表毒株抗原的HI抗体均低于2 log2,判定其为抗体阴性。结果表明,4种商品疫苗接种SPF鸡后的血清与早期H9毒株(CK/SH/10/2001)均具有较好HI交互反应,而与近期H9分离株的HI交互反应存在不同程度的差异。

表1 4株H9N2亚型AIV的EID50、CID50和TCID50
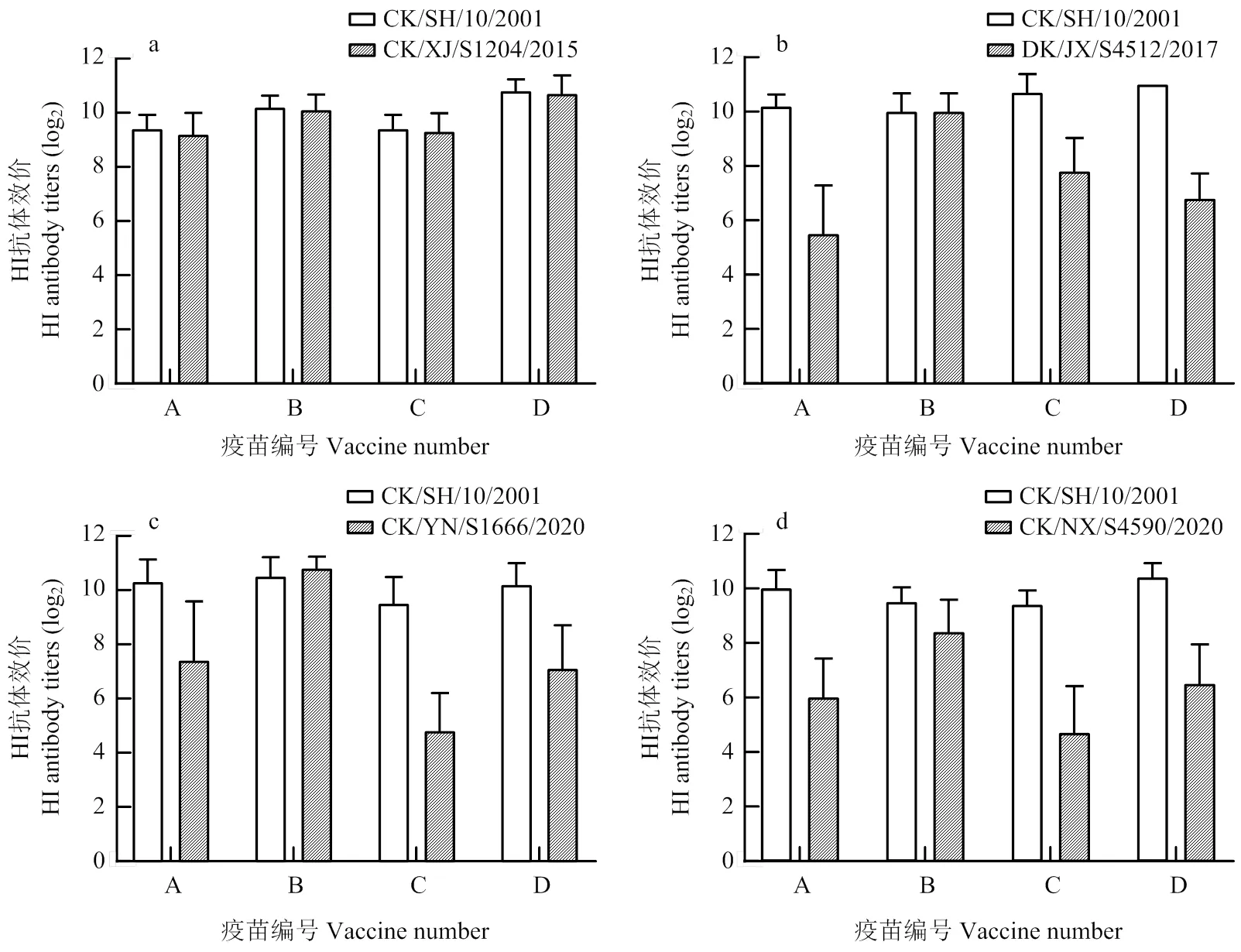
图1 不同疫苗接种组SPF鸡3周的HI抗体平均效价
2.4 4种商品疫苗免疫SPF鸡血清的中和抗体测定
中和抗体水平是评价疫苗免疫效果的重要依据。在SPF鸡接种A—D疫苗3周时,以4株分离株作为检验毒株,采取微量中和试验的方法检测用于攻毒测试的各对应免疫组鸡血清的中和抗体。由于部分血清余量较少,每组10份血清中随机选择6份足量血清,进行中和抗体效价检测。结果显示,在用CK/XJ/S1204/ 2015分离株测定相应各免疫组的平均中和抗体中,A疫苗组为8.9 log2,B、C和D疫苗组均在10.1 log2— 11.1 log2之间(图2-a)。在用DK/JX/S4512/2017分离株测定相应各免疫组的平均中和抗体效价中,仅B疫苗组较高(10.1 log2),其余组均在6.8 log2—8.8 log2之间(图2-b)。在用CK/YN/S1666/2020分离株测定相应各免疫组的平均中和抗体中,A和B疫苗组达到10 log2,分别为10.9 log2、12.2 log2,而C和D疫苗组分别仅为7.6 log2和8.4 log2(图2-c)。在用CK/NX/S4590/2020分离株测定相应各免疫组的平均中和抗体中,4个疫苗组均低于9.0 log2,在7 log2—8.6 log2之间(图2-d)。结果表明,4种商品疫苗诱导针对不同分离株的中和抗体存在较大差异,与疫苗株和攻毒毒株的抗原性差异趋势基本一致。

图2 不同疫苗组免疫SPF鸡攻毒前针对攻毒毒株的NT抗体效价
2.5 4种商品疫苗对我国H9N2亚型分离株的攻毒试验结果
攻毒测试是评价疫苗免疫保护效果的标准方法。本研究使用4株分离株,模拟自然感染方式,以鼻腔感染途径,以10 CID50的攻毒剂量,对各组试验鸡进行攻毒评估。攻毒结果显示,攻毒后14 d的观察期内,所有对照组和免疫组鸡均无死亡,没有明显的临床症状表现;对照组鸡3和5 d喉头拭子样品病毒分离阳性数均在9/10以上,泄殖腔排毒因毒株而异;4种疫苗免疫鸡3和5 d拭子样品病毒分离阳性数和病毒滴度大都低于对照组鸡,但不同疫苗免疫组保护率存在差异。其中,攻击CK/XJ/S1204/2015分离株后,4种疫苗免疫组的保护率依次为10%、80%、80%、90%;攻击DK/JX/S4512/2017分离株后,A、C和D疫苗组免疫鸡5 d拭子样品分别10/10、8/10和10/10排毒阳性,接近于对照组鸡排毒率,B疫苗则在3和5 d拭子样品中均未检测到排毒,4种疫苗免疫组的保护率依次为0、100%、10%、0;攻击CK/YN/ S1666/2020分离株后,4种疫苗免疫组的保护率依次为100%、100%、0和40%;攻击CK/NX/S4590/2020分离株后,不同免疫组的保护率均不高于10%。详情见表2。
2.6 疫苗免疫鸡血清平均抗体效价与攻毒保护效果之间的关系
综合HI抗体、中和抗体及攻毒保护试验结果发现,不同疫苗免疫后,诱导的针对H9亚型分离株的抗体因毒株而异,当抗体滴度越高时则免疫鸡获得的保护率越高。A疫苗免疫鸡血清针对CK/XJ/ S1204/ 2015和CK/YN/S1666/2020分离株的免疫鸡的HI抗体平均效价分别为9.3 log2和8 log2,NT抗体平均效价分别为8.9 log2和10.9 log2,HI抗体前者大于后者,然而NT抗体后者大于前者,此时A疫苗为攻击CK/YN/ S1666/2020毒株的免疫鸡提供100%保护。B疫苗诱导的针对近期H9N2分离株的HI抗体和NT抗体平均效价分别在8.6 log2—10.8 log2、8.4 log2—12.2 log2之间,当HI抗体平均效价>9.8 log2,NT抗体平均效价>10 log2时,能给免疫鸡提供80%以上保护;C疫苗诱导的HI抗体和NT抗体平均效价分别在4.7 log2—9.5 log2、7 log2—10 log2之间,当HI抗体平均效价>9.5 log2,NT抗体平均效价>10 log2时,能为免疫鸡提供80%以上保护。D疫苗诱导的HI抗体和NT抗体平均效价分别在6.8 log2—10.8 log2、8.4 log2—10.9 log2之间,当HI抗体平均效价>10 log2,NT抗体平均效价>10 log2时,能为免疫鸡提供80%以上保护。总体而言,使用本研究中的4株分离株攻毒后,4种商品疫苗诱导的HI抗体平均效价>10 log2,NT抗体平均效价>10 log2时,则能给SPF免疫鸡提供较好的保护(表3)。
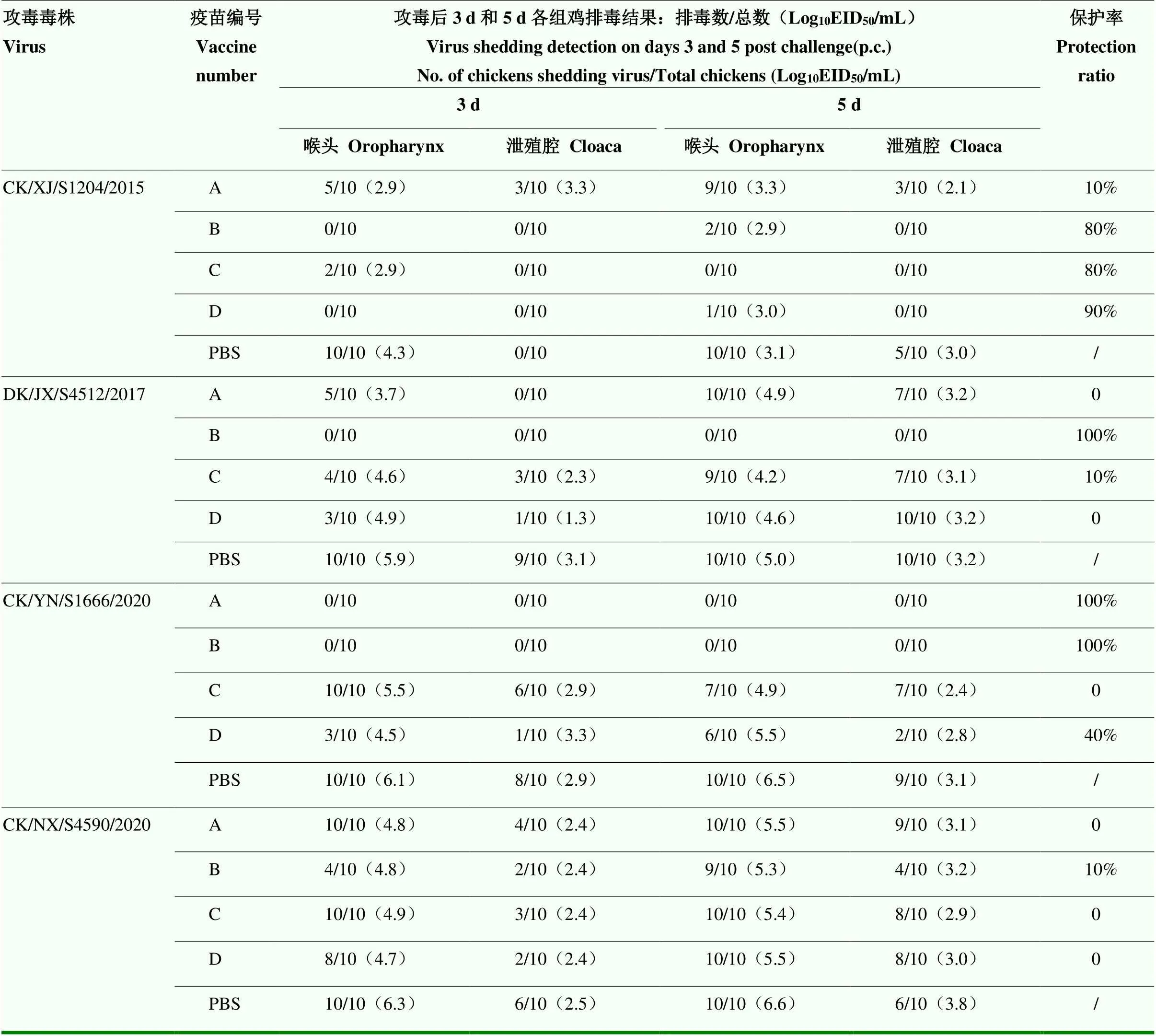
表2 不同疫苗免疫后的排毒检测
2.7 H9N2亚型代表毒株抗原性分析
抗原性分析结果显示,H9N2早期分离毒株CK/SH/10/01抗血清与4株H9N2亚型代表毒株,有较大HI抗体差异,与2017年和2020年的毒株最高有32倍和16倍差异。CK/XJ/S1204/2015抗血清与4株H9N2病毒HI抗体差异较小,在4倍以内。而DK/JX/S4512/ 2017抗血清与CK/XJ/S1204/2015毒株的HI抗体差异最大有64倍。CK/YN/S1666/2020抗血清与CK/XJ/S1204/ 2015毒株的HI抗体差异为32倍。CK/NX/S4590/2020抗血清与CK/XJ/S1204/2015毒株的HI抗体为16倍(表4)。结果表明,早期毒株与近期H9N2分离株有较大抗原变异,疫苗株应根据抗原性变化进行更新。

表3 商品化H9亚型AI疫苗免疫攻毒保护效果与平均抗体滴度间的关系

表4 4株H9N2亚型AIV与不同血清的交叉血凝抑制反应
3 讨论
3.1 商品化疫苗对我国H9N2亚型分离株的免疫保护效果呈下降趋势
H9N2亚型AIV不断进化,形成多个进化分支,并频繁发生抗原变异,引起疫苗的免疫保护效果下降[20-21]。H9N2病毒一般分为两大谱系分别是北美谱系和欧亚谱系[22],基于分离株HA与经典毒株间的进化关系,可划分为h9.1—h9.4四个进化分支,h9.4包括h9.4.1和h9.4.2两个亚分支[23],2007年之前的H9N2亚型AIV一般属于分支h9.4.2.1—h9.4.2.4[24],此后,以A/chicken/Guangxi/55/2005(H9N2)为代表的h9.4.2.5分支逐渐成为主流[23, 25]。Sun等研究表明H9禽流感商品疫苗对早期H9毒株(1999年)攻击可以完全阻止排毒,提供良好免疫保护作用,但对2007年分离株攻击不能完全阻止排毒[20]。本研究选用4种商品疫苗攻击h9.4.2.5分支分离毒株后,A—D疫苗中有3种疫苗对2015年分离株攻击可以提供80%以上的保护作用,但对2017年分离株和1株2020年分离株攻击后分别只有B疫苗和A、B疫苗提供80%以上免疫保护,攻击另一株2020年分离株后,疫苗的保护率则均低于80%,表明当前商品疫苗对近期不同时间H9分离株的免疫保护效果呈明显下降趋势。由于本研究没能收集到商品疫苗的配套检测抗原,因此没有通过比较针对疫苗株抗原和针对攻毒毒株抗体进行抗原性比较,但发现所有疫苗免疫鸡血清中针对H9标准抗原(2001年分离株)的HI抗体水平较高,而与2015—2020年分离株抗原的HI抗体水平则参差不齐,充分表明4种疫苗株呈现与早期H9毒株良好的抗原匹配性,而与近期分离株之间存在不同程度的抗原性差异,可能是造成市售商品疫苗对我国近期H9N2病毒的免疫保护下降的主要原因。
3.2 针对H9亚型分离株的HI抗体和中和抗体测定结果可作为H9亚型AI灭活疫苗的评价和选用依据
疫苗接种是预防传染病的重要举措,评估疫苗免疫保护效果最佳的方式是进行攻毒保护试验。根据兽用生物制品质量标准汇编规定,H9亚型AI灭活疫苗效力检验的攻毒途径有两种,一是鼻腔感染,二是静脉注射[26-27]。本文模拟自然感染方式以鼻腔感染途径攻毒,客观评价疫苗的免疫保护效果。本研究4株攻毒毒株的EID50均在10-8.5/0.1 mL和10-8.94/0.1 mL之间,差异较小,最大差异为2.7倍,但其对应CID50差异较大,最大差异为27倍。攻毒剂量的选择会一定程度上影响攻毒保护试验的最终结果。EID50可以作为攻毒剂量的参考依据,106EID50/0.1 mL为常用的攻毒剂量,但研究表明,在H9N2亚型免疫攻毒保护试验中,CID50数据更为可靠,且以10 CID50为H9亚型AI疫苗评估的最佳攻毒剂量[28]。但采用攻毒试验评估疫苗免疫效果的方法耗时长,结果反馈慢,在实际应用中有一定局限性。因此,建立血清学评价方法对于快速评估疫苗免疫效果具有重要意义。HI抗体检测常用于疫苗接种后效果的监测。我国H5、H7亚型AI疫苗的HI抗体质量标准为免疫后3周不低于6 log2,免疫抗体监测的合格抗体滴度为4 log2,针对H9亚型AI疫苗具有相似的HI抗体合格标准。但本研究中,4种疫苗免疫后H9亚型HI抗体超过6 log2,但攻毒后不能获得80%以上的免疫保护数据,这可能与采用鼻腔感染而不是静脉注射的攻毒方式有关。另外,HI试验不能完全准确检测出血清中对病毒具有中和作用的抗体,需要采用中和试验的方法检测中和抗体[29]。本研究结果显示,结合HI抗体和中和抗体水平可预测疫苗的免疫保护率。尤其是检测针对现地分离株的HI抗体和中和抗体可以作为疫苗选用的重要参考依据。就现有疫苗的临床应用而言,由于各商品疫苗毒种的抗原性不同,对于不能进行检测的研制者,可以选用不同厂家和毒种来源的疫苗交替免疫,可有望提高免疫保护的广谱性。同时加强饲养管理、做好生物安全措施,有利于提高H9亚型禽流感免疫防控成效。
4 结论
4种商品化疫苗对我国近期的H9N2亚型流行毒株的免疫保护效果有较大差异,整体免疫保护效果下降。疫苗的免疫保护效果与免疫后测定的HI抗体平均效价总体呈正相关趋势,但不同时期、不同地域分离的H9N2亚型AIV抗原性存在不同差异,以现地分离毒株为检测抗原,检测的HI抗体和中和抗体效价能够更科学反映疫苗的保护效果。本研究为我国商品化H9疫苗的科学选用提供重要参考。
[1] GU M, XU L J, WANG X Q, LIU X F. Current situation of H9N2 subtype avian influenza in China. Veterinary Research, 2017, 48(1): 49.
[2] SUN Y P, LIU J H. H9N2 influenza virus in China: a cause of concern. Protein & Cell, 2015, 6(1): 18-25.
[3] HOMME P J, EASTERDAY B C. Avian influenza virus infections. I. Characteristics of influenza A-Turkey-Wisconsin-1966 virus. Avian Diseases, 1970, 14(1): 66-74.
[4] 陈伯伦, 张泽纪, 陈伟斌. 鸡A型禽流感病毒的分离与血清学初步鉴定. 中国家禽, 1997, 19(11): 3-5.
CHEN B L, ZHANG Z J, CHEN W B. Isolation and preliminary serological identification of avian influenza virus-type A from chickens. China Poultry, 1997, 19(11): 3-5. (in Chinese)
[5] XIN L, BAI T, ZHOU J F, CHEN Y K, LI X D, ZHU W F, LI Y, TANG J, GUO J F, CHEN T, GAO R B, WANG D Y, SHU Y L. A comprehensive retrospective study of the seroprevalence of H9N2 avian influenza viruses in occupationally exposed populations in China. PLoS One, 2017, 12(6): e0178328.
[6] LI C J, YU K Z, TIAN G B, YU D D, LIU L L, JING B, PING J H, CHEN H L. Evolution of H9N2 influenza viruses from domestic poultry in Mainland China. Virology, 2005, 340(1): 70-83.
[7] KONG L C, YOU R R, ZHANG D C, YUAN Q L, XIANG B, LIANG J P, LIN Q Y, DING C, LIAO M, CHEN L B, REN T. Infectious bronchitis virus infection increases pathogenicity of H9N2 avian influenza virus by inducing severe inflammatory response. Frontiers in Veterinary Science, 2022, 8: 824179.
[8] AMANOLLAHI R, ASASI K, ABDI-HACHESOO B. Effect of Newcastle disease and infectious bronchitis live vaccines on the immune system and production parameters of experimentally infected broiler chickens with H9N2 avian influenza. Comparative Immunology, Microbiology and Infectious Diseases, 2020, 71: 101492.
[9] AWUNI J A, BIANCO A, DOGBEY O J, FUSARO A, YINGAR D T, SALVIATO A, ABABIO P T, MILANI A, BONFANTE F, MONNE I. Avian influenza H9N2 subtype in Ghana: Virus characterization and evidence of co-infection. Avian Pathology, 2019, 48(5): 470-476.
[10] ARAFAT N, ABD EL RAHMAN S, NAGUIB D, EL-SHAFEI R A, ABDO W, ELADL A H. Co-infection ofwith H9N2 avian influenza virus in chickens. Avian Pathology, 2020, 49(5): 496-506.
[11] LI X Y, LIU B T, MA S J, CUI P F, LIU W Q, LI Y B, GUO J, CHEN H L. High frequency of reassortment after co-infection of chickens with the H4N6 and H9N2 influenza A viruses and the biological characteristics of the reassortants. Veterinary Microbiology, 2018, 222: 11-17.
[12] LAHARIYA C, SHARMA A K, PRADHAN S K. Avian flu and possible human pandemic. Indian Pediatrics, 2006, 43(4): 317-325.
[13] GERHARD W, MOZDZANOWSKA K, ZHARIKOVA D. Prospects for universal influenza virus vaccine. Emerging Infectious Diseases, 2006, 12(4): 569-574.
[14] ZHANG P H, TANG Y H, LIU X W, PENG D X, LIU W B, LIU H Q, LU S, LIU X F. Characterization of H9N2 influenza viruses isolated from vaccinated flocks in an integrated broiler chicken operation in Eastern China during a 5 year period (1998–2002). Journal of General Virology, 2008, 89(12): 3102-3112.
[15] WU Z Q, JI J, ZUO K J, XIE Q M, LI H M, LIU J, CHEN F, XUE C Y, MA J Y, BI Y Z. Cloning and phylogenetic analysis of hemagglutinin gene of H9N2 subtype avian influenza virus from different isolates in China during 2002 to 2009. Poultry Science, 2010, 89(6): 1136-1143.
[16] SHI J Z, DENG G H, MA S J, ZENG X Y, YIN X, LI M, ZHANG B, CUI P F, CHEN Y, YANG H L, WAN X P, LIU L L, CHEN P C, JIANG Y P, GUAN Y T, LIU J X, GU W L, HAN S Y, CHEN H L. Rapid evolution of H7N9 highly pathogenic viruses that emerged in China in 2017. Cell Host & Microbe, 2018, 24(4): 558-568.e7.
[17] 申伟霞. H9N2亚型禽流感病毒遗传演化分析及细胞灭活苗初步研制[D]. 太谷: 山西农业大学, 2014.
SHEN W X. The phylogenic analysis of H9N2 Subtype avian influenza virus and preliminary research of cellular inactivated vaccine[D]. Taigu: Shanxi Agricultural University, 2014. (in Chinese)
[18] LI M, YIN X, GUAN L Z, ZHANG X, DENG G H, LI T, CUI P F, MA Y, HOU Y J, SHI J Z, CHEN H L. Insights from avian influenza surveillance of chickens and ducks before and after exposure to live poultry markets. Science China Life Sciences, 2019, 62(6): 854-857.
[19] CUI P F, ZENG X Y, LI X Y, LI Y B, SHI J Z, ZHAO C H, QU Z Y, WANG Y W, GUO J, GU W L, MA Q, ZHANG Y C, LIN W P, LI M H, TIAN J M, WANG D X, XING X, LIU Y J, PAN S X, ZHANG Y P, BAO H M, LIU L L, TIAN G B, LI C J, DENG G H, CHEN H L. Genetic and biological characteristics of the globally circulating H5N8 avian influenza viruses and the protective efficacy offered by the poultry vaccine currently used in China. Science China Life Sciences, 2022, 65(4): 795-808.
[20] SUN Y P, PU J, FAN L H, SUN H L, WANG J J, ZHANG Y, LIU L Q, LIU J H. Evaluation of the protective efficacy of a commercial vaccine against different antigenic groups of H9N2 influenza viruses in chickens. Veterinary Microbiology, 2012, 156(1/2): 193-199.
[21] ZHENG Y Q, GUO Y N, LI Y F, LIANG B, SUN X Y, LI S J, XIA H Z, PING J H. The molecular determinants of antigenic drift in a novel avian influenza A (H9N2) variant virus. Virology Journal, 2022, 19(1): 26.
[22] PEACOCK T H P, JAMES J, SEALY J E, IQBAL M. A global perspective on H9N2 avian influenza virus. Viruses, 2019, 11(7): 620.
[23] JIANG W M, LIU S, HOU G Y, LI J P, ZHUANG Q Y, WANG S C, ZHANG P, CHEN J M. Chinese and global distribution of H9 subtype avian influenza viruses. PLoS One, 2012, 7(12): e52671.
[24] SUN Y P, PU J, JIANG Z L, GUAN T, XIA Y J, XU Q, LIU L Q, MA B, TIAN F L, BROWN E G, LIU J H. Genotypic evolution and antigenic drift of H9N2 influenza viruses in China from 1994 to 2008. Veterinary Microbiology, 2010, 146(3/4): 215-225.
[25] ZHANG Y, YIN Y B, BI Y H, WANG S C, XU S Z, WANG J L, ZHOU S, SUN T T, YOON K J. Molecular and antigenic characterization of H9N2 avian influenza virus isolates from chicken flocks between 1998 and 2007 in China. Veterinary Microbiology, 2012, 156(3/4): 285-293.
[26] 中华人民共和国农业部. 兽用生物制品质量标准汇编(2006-2008)上册, 2009, 3: 107-112.
Ministry of Agriculture of the People’s Republic of China. Quality Standards of Veterinary Biological Products(2006-2008) Booklet, 2009, 3: 107-112. (in Chinese)
[27] YANG J M, CUI H R, TENG Q Y, MA W J, LI X S, WANG B B, YAN D W, CHEN H J, LIU Q F, LI Z J. Ducks induce rapid and robust antibody responses than chickens at early time after intravenous infection with H9N2 avian influenza virus. Virology Journal, 2019, 16(1): 46.
[28] 石文军, 曾显营, 臧金凯, 吴姣姣, 白洁, 陈化兰, 田国彬. 不同攻毒剂量对评估H9亚型禽流感疫苗免疫效果的影响. 中国预防兽医学报, 2017, 39(4): 301-305.
SHI W J, ZENG X Y, ZANG J K, WU J J, BAI J, CHEN H L, TIAN G B. Different challenge doses influence the immunity efficacy evaluation of H9 subtype avian influenza virus. Chinese Journal of Preventive Veterinary Medicine, 2017, 39(4): 301-305. (in Chinese)
[29] GAUGER P C, VINCENT A L. Serum virus neutralization assay for detection and quantitation of serum neutralizing antibodies to influenza A virus in swine. Methods in Molecular Biology (Clifton, N J), 2020, 2123: 321-333.
The Protective Efficacy of Commercial Vaccines Against H9N2 Avian Influenza Virus of Branch h9.4.2.5 Isolated in China
MA Qi1, HE XinWen1, WANG Yan1, LIU YanJing1, PAN ShuXin1, HOU YuJie1, SHI JianZhong1,3, DENG GuoHua1,3,BAO HongMei1,3, LIU JingLi2, GUO XingFu2, MAO ShengGang2, HU JingLei2, LU Tong2, YANG Fan2, TIAN GuoBin1,3, ZENG XianYing1,3, CHEN HuaLan1,3
1National Poultry Laboratory Animal Resource Center/State Key Lab for Animal Disease Control and Prevention/Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Harbin 150069;2Harbin Weike Biotechnology Company Limited, Harbin 150069;3Key Laboratory for Prevention and Control of Avian Influenza and Other Major Poultry Diseases, Ministry of Agriculture and Rural Affairs, Harbin 150069
【Objective】There are many commercial inactivated vaccines against the H9 subtype avian influenza approved for use in China, and their protection efficacy and selection have been widely concerned by farmers. In this study, the protection efficacy of main commercial vaccines against H9N2 viruses recently isolated in the field were evaluated, so as to provide the research reference for guiding the prevention and control of H9 subtype AI by immunization in China.【Method】According to the vaccine batch release of the National Veterinary Drug Basic Information Database in China, 4 commercial vaccines (labeled as A-D) with large batches were selected from 40 kinds of sold H9 commercial vaccines. The four H9N2 subtype AIV, including CK/XJ/S1204/2015, DK/JX/S4512/2017, CK/YN/S1666/2020 and CK/NX/S4590/2020, belonging to h9.4.2.5 branch and isolated at different times and places, were used to evaluate the protection efficacy of selected commercial H9 subtype AI vaccines. The 50% chicken embryo infection (EID50), 50% chicken infection (CID50), and 50% cell infection (TCID50) of the four viruses were tested to determine the challenge dose of the animal experiment and the infection dose of the cell test. 40 3-week-old SPF chickens were injected intramuscularly with 4 kinds of inactivated vaccine, and the groups of 10 similar SPF chickens were inoculated with PBS as control group. 3 weeks post vaccination (p.v.), the serum of all experimental chickens were collected before challenge, the hemagglutination inhibition (HI) and neutralization (NT) antibody titers were detected by HI test and neutralization test; the 40 immunized chickens of each vaccine were randomly divided into four groups, and 10 chickens of each vaccine and 10 control chickens were infected intranasally with the 10 CID50of each H9N2 virus. Oropharyngeal and cloacal swabs were collected on days 3 and 5 post challenge (p.c.) for virus shedding detection and calculation of the protective rate of each vaccine.【Result】The CID50of the four strains were 103.5EID50/0.1 mL, 102.5EID50/0.1 mL, 102.5EID50/0.1 mL and 103.5EID50/0.1 mL, respectively. At three weeks p.v., the mean HI antibodies titers against the commercial H9 subtype HI test antigen (CK/SH/10/2001) in 4 groups of vaccinated chickens ranged from 9.4 log2to 11 log2, while the mean HI antibodies titers against challenge virus in 4 groups of vaccinated chickens ranged from 4.6 log2to 10.8 log2, and the significant differences of HI antibodies titers were observed among different vaccine groups, for the maximum difference of mean HI antibodies titers were 64-fold among them. The mean NT antibodies titers against challenge virus in 4 groups of vaccinated chickens ranged from 6.7 log2to 12.2 log2, while the maximum difference of mean HI antibodies titers were 32-fold among them, and the HI antibody and NT antibody of the control group were negative. After intranasal infection with different H9 viruses, the immune effects of the four vaccines were quite different. In CK/XJ/S1204/2015 challenged groups, 3 vaccines (B-D) could provide more than 80% protection. In DK/JX/S4512/2017 challenged groups, 1 vaccine (B) could provide more than 80% protection. In CK/YN/S1666/2020 challenged groups, 2 vaccines (A and B) could provide more than 80% protection. In CK/NX/S4590/2020 challenged groups, the protection efficacy of the four vaccines (A-D) were all less than 80%. In the same period, the virus shedding rate of chickens under the control group was more than 8/10. 【Conclusion】There was a great difference in the immune protection efficacy of the four kinds of commercial vaccines after challenge with recently isolated H9 strains, and the difference of antigenicity between vaccine antigens and isolates was the main reason for the decrease of immune protection efficacy of the commercial vaccines. The titers of HI antibody and NT antibody against H9N2 prevalent strains could be as important data for evaluation of the commercial H9N2 AI vaccines. This study provided the scientific references for selection and usage of the commercial vaccines against H9N2 AI.
H9N2 subtype; AIV; commercial vaccine; protective efficacy; avian influenza

10.3864/j.issn.0578-1752.2023.15.017
2022-07-04;
2022-09-15
国家重点研发计划(2021YFD1800200)、现代农业产业技术体系(CARS-41)
麻琦,Tel:0451-51051678;E-mail:13592583529@163.com。通信作者陈化兰,Tel:0451-51997168;E-mail:chenhualan@caas.cn。通信作者曾显营,Tel:0451-51051678;E-mail:zengxianying@caas.cn
(责任编辑 林鉴非)

