牦牛Fas相关因子1多克隆抗体制备及初步应用
王静瑜,潘阳阳,徐庚全,张 瑞,张文兰,王筱珊,乌仁套迪,照日格图,崔 燕,余四九*
(1.甘肃农业大学动物医学院/甘肃省牛羊胚胎工程技术研究中心,兰州 730070;2.阿拉善盟畜牧研究所,阿拉善 750300)
FAF1是1995年由Chu等[1]以酵母双杂交方法筛选得到,FAF1蛋白是死亡诱导信号复合物(death inducing signaling complex,DISC)的组成部分。FAF1蛋白为胞内蛋白[2],主要表达于不同细胞类型的细胞核及核周胞质,其在进化上较为保守,由650个氨基酸构成,大小约为 74 ku,含有多个功能性结构域,主要包括N末端泛素相关域(ubiquitin-associating,UBA)、C端泛素调节X域(ubiquitin regulatory X,UBX)、死亡效应结构域(death effector domain interacting domain,DEDID)、Fas相互作用域(FAS-interacting domain,FID)[3]。FAF1 mRNA及蛋白质在人和小鼠的睾丸及卵巢中均有表达[4]。但是FAF1在牦牛睾丸和卵巢中的生物学作用还尚不清楚。
牦牛(Bosgrunniens)为青藏高原一带独有的原始牛种之一,一般分布于海拔3 000~5 000米的高原上,它不但能够适应高原寒冷、空气稀薄、强辐射的地理环境,也可用于农牧业和交通运输。除此之外,还能为当地牧民提供肉、奶、毛、皮革、燃料等生产和生活资料,被誉为藏区“牧民之宝”。素有“高原之舟”和“冰河之车”的美称[5]。FAF1广泛存在于多种组织和细胞中,含有多种功能结构域,参与不同信号通路的调节,具有多种重要的生殖生理功能。由于敲除FAF1基因的纯合子会在胚胎早期发育死亡[6],限制了通过基因敲除技术探索FAF1基因的生物学功能,因此通过制备牦牛FAF1多克隆抗体来探索FAF1基因生物学功能具有重要的意义。高品质的精液是保证受精和早期胚胎发育的重要条件,较好的卵巢机能对于受精具有重要意义[7]。细胞凋亡是生殖调节的机制之一,生殖细胞(精子和卵母细胞)的周期性变化与其凋亡过程密切相关[8],Fas-FasL系统被认为是生殖细胞(精子和卵子)凋亡的关键生理调节因子[9]。FAF1是Fas-FasL凋亡通路重要调控元件[10],FAF1通过多种方式作用于细胞凋亡[10],并且其在生殖系统中表达量较高。本研究以牦牛睾丸组织cDNA为模板,扩增FAF1基因全序列,构建全长 pET-28a-FAF1原核表达载体,优化诱导表达条件,经镍柱纯化并鉴定后免疫试验动物,获得兔源FAF1多克隆抗体,以牦牛不同年龄睾丸组织及处于不同繁殖周期的卵巢为研究对象,采用实时荧光定量检测不同年龄睾丸组织及处于不同繁殖周期的卵巢FAF1 mRNA相对表达水平,采用Western blot检测不同年龄睾丸组织及处于不同繁殖周期的卵巢FAF1蛋白相对表达水平,采用免疫组织化学技术定位FAF1蛋白表达部位,以期为进一步研究FAF1在牦牛生殖方面的功能提供依据。
1 材料与方法
1.1 试验材料
本研究所使用的试剂主要有:TransZol(北京,全式金);GoScript Reverse Transcription System (美国,Promega);Goat anti-rabbit IgG-HRP(北京,博奥森);DNA纯化回收试剂盒、质粒小提试剂盒、DH5a 感受态细胞、BL21(DE3)/Rosetta感受态细胞(北京,天根);IPTG、卡那(北京,索莱宝);PVDF膜(美国,Millipore);酵母、氯化粉钠、琼脂、胰蛋白胨(英国,Oxoid);pET-28a为实验室保存;限制性核酸内切酶XhoⅠ、限制性核酸内切酶EcoR I、T4连接酶(大连,TaKaRa);Ni-NTA-Sefinose Column(上海,生工);预混型 qPCR 试剂盒(湖南,艾科瑞生物);FAF1兔抗牦牛多克隆抗体为甘肃省牛羊胚胎工程中心制备保存。
本研究所使用的仪器主要有:PCR仪(美国,Bio-Rad);SDS-PAGE电泳槽(美国,Rio-Rad公司);超声波破碎仪(宁波,新芝);恒温培养箱(日本,松下);恒温振荡摇床(上海,恒字);超灵敏多功能成像仪(美国,GE Healthcare)。
1.2 样品的采集
试验样品于2021年10月采集于青海省西宁市屠宰场。挑选不同年龄的健康雄性牦牛各3头,挑选年龄相仿且处于不同繁殖周期(卵泡期卵巢上具有成熟卵泡、黄体期卵巢有明显黄体和妊娠期卵巢在子宫内有发育的胎儿的卵巢)的健康雌性牦牛各3头,经颈动脉放血致死后,迅速采集睾丸组织和卵巢组织,用0.9%的生理盐水冲洗3次,将组织修剪为约1 cm3的组织块并浸泡于4%的中性多聚甲醛溶液中固定,以便于开展后期的免疫组织化学试验。剩余组织用锡箔纸包裹后放入冻存袋内,然后放入液氮罐中,过程中尽可能的快速,以防止组织降解变质,运回实验室后转存于-80 ℃超低温冰箱中,以便于开展后期的分子试验。
1.3 目的基因的获取
利用GoScriptTMReverse Transcription System试剂盒将总RNA反转录为cDNA。以β-actin(肌动蛋白)为内参基因,β-actin及FAF1基因引物序列如表1。Taq PCR Master Mix 10 μL,ddH2O 8 μL,模板cDNA 1 μL,β-actin-F、β-actin-R各0.5 μL,共20 μL体系置于PCR仪中,95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸8 s,72 ℃条件下10 min,循环40次。反应结束后琼脂糖凝胶电泳进行验证。模板cDNA验证成功后,扩增FAF1基因,体系共20 μL:Taq PCR Master Mix 10 μL,ddH2O 8 μL,模板cDNA 1 μL,FAF1-F、FAF1-R各 0.5 μL,退火时间变为2 min,其它条件不变。琼脂糖凝胶电泳后,利用DNA纯化回收试剂盒纯化目的基因。
1.4 原核载体pET-28a-FAF1的构建
纯化的DNA及空载体pET-28a使用限制性内切酶XhoⅠ和EcoR Ⅰ进行双酶切。将酶切好的目的基因与酶切好的载体使用T4 DNA连接酶16 ℃条件过夜连接。将重组质粒转化至DH5a 感受态细胞中,涂布至含卡那的LB培养基上,37 ℃过夜培养。挑取阳性克隆菌,提取质粒,分别进行PCR及双酶切验证,验证成功后送至上海生工测序。将连接成功的重组质粒转化至BL21(DE3)/Rosetta感受态细胞。
1.5 重组蛋白优化诱导
挑取含有于pET-28a重组子的BL21(DE3)/Rosetta菌落接种于5 mL含卡那的LB培养基中,37 ℃振荡培养过夜。取150 μL培养液于5 mL含卡那的LB培养基中,37 ℃条件下200 r·min-1振荡培养3 h。取1 mL作为IPTG诱导前的样品,12 000 r·min-1离心1 min,弃上清液,菌体沉淀用40 μL PBS悬浮,-20 ℃保存。其余样品加入IPTG,使IPTG终浓度为0.5 mmol·L-1,分别在20 ℃、25 ℃、28 ℃、32 ℃、37 ℃条件下180 r·min-1振荡培养。分别在各温度诱导后2、3、4、5 h取1 mL样品的菌液,12 000 r·min-1离心1 min,收集菌体,用30 μL PBS悬浮,-20 ℃保存。在诱导前以及诱导后各时间的样品中各加入10 μL 4×SDS上样缓冲液,涡旋振荡1 min,使菌体完全溶菌,沸水浴10 min。在4 ℃条件下12 000 r·min-1离心1 min后取上清到新的离心管中。分别取20 μL诱导前以及10 μL诱导后的样品进行SDS-PAGE分析。为提高FAF1重组蛋白的表达量,对诱导剂IPTG浓度(0.1、0.3、0.5、0.7、1.0 mmol·L-1)进行优化,同时以未诱导样品作为对照,取不同浓度的样品经SDS-PAGE分离并用考马斯亮蓝染色后进行分析。
1.6 重组蛋白大量诱导表达及纯化
根据最佳诱导条件进行阳性克隆菌的大量培养,收集菌体,加入PBS缓冲液重悬,冰浴条件下,超声波破碎,功率40 W,工作3 s,间隔3 s,总时间约30 min,以菌体由浑浊变透明且不黏稠为准。将破碎的菌液于4 ℃条件下5 000 r·min-1离心10 min,收集上清和沉淀,将所得上清和沉淀变性,SDS-PAGE电泳考马斯亮蓝染色。按照Ni-NTA-Sefinose Column说明书对重组蛋白纯化。
1.7 试验动物免疫
选取2只健康雄性新西兰大白兔,饲养1周观察是否有应激等不良反应,若无不良反应,则分别取耳缘静脉血1 mL,留作阴性对照。以1.2 mg纯化的FAF1重组蛋白与弗氏完全佐剂等量混匀并充分乳化,分多点背部皮下注射免疫2只新西兰大白兔;第一次免疫两周后进行第二次免疫,以1.2 mg纯化的FAF1重组蛋白与弗氏不完全佐剂等量混匀并充分乳化,分多点肩胛部及腘淋巴结注射免疫2只新西兰大白兔;第二次免疫3周后进行第三次免疫,以0.4 mg纯化的FAF1重组蛋白与弗氏不完全佐剂等量混匀并充分乳化,分多点肩胛部及腘淋巴结注射免疫2只新西兰大白兔;第三次免疫两周后进行耳缘采血检测效价,效价良好则可进行心脏采血收集血液,37 ℃恒温箱静置1 h,再于4 ℃冰箱静置过夜,分离血清,至于-80 ℃超低温冰箱保存备用。
1.8 牦牛FAF1多克隆抗体效价检测
将FAF1重组蛋白用包被液稀释至1 μg·mL-1,96孔酶标板每孔加入100 μL,设置阴性对照和空白对照,前者加入含重组蛋白的包被液,后者只加入包被液,4 ℃过夜;使用1×PBST洗涤3次,拍干;加入5%脱脂奶粉封闭液37 ℃,3 h进行封闭;使用1×PBST洗涤3次,拍干;加入等比稀释的兔多抗血清100 μL,阴性对照孔加入阴性血清,37 ℃孵育2 h;洗涤3次,拍干;每孔加入100 μL 以1∶10 000稀释的HRP标记山羊抗兔二抗,37 ℃孵育2 h;洗涤3次,拍干;每孔加入100 μL TMB,37 ℃显色15 min;每孔加入50 μL浓度为 2 mol·L-1的H2SO4终止显色反应,放入酶标仪检测450 nm处OD值。
1.9 多克隆抗体特异性检测
将纯化后的重组蛋白上样进行SDS-PAGE电泳,65 V条件35 min,调至110 V 1 h。110V条件下转膜70 min,5%脱脂奶粉封闭过夜,加制备的兔源多克隆抗体室温孵育3 h,PBST洗涤5次,每次10 min,加二抗(Goat anti-rabbit IgG-HRP)室温孵育40 min,PBST洗涤6次,每次10 min。在PVDF膜上滴加ELC超敏发光液,置于超灵敏多功能成像仪曝光成像。
1.10 实时荧光定量PCR
制备不同组织cDNA工作液,使终浓度为100 ng·μL-1。加入2X SYBR®Green Pro Taq HS Premix 10 μL,不同组织cDNA工作液1 μL,FAF1-F1、FAF1-R1各0.4 μL,RNase free water 8.2 μL,反应体系共20 μL。反应条件:95 ℃预变性300 s,95 ℃变性10 s,58 ℃退火30 s,72 ℃延伸16 s,共进行40个循环。每个模板,设4个重复组,使用 2-ΔΔCt法计算不同年龄睾丸组织及不同繁殖周期卵巢组织FAF1 mRNA的相对表达量。
1.11 Western blot
根据SDS-PAGE 分离胶和浓缩胶配制体系分别配制浓度为8%的分离胶和5%的浓缩胶。将变性好的蛋白样品进行上样电泳,待电泳结束后,使用湿转的方式将蛋白转印至0.45 μm的PVDF膜上,转膜完成后用PBST 洗去膜上的残留转膜液,使用5%脱脂奶粉摇床上孵育过夜,PBST洗涤2次,每次30 min,一抗(兔抗牦牛FAF1多克隆抗体)按1∶1 000稀释,室温孵育2.5 h,PBST 洗涤 5 min,共洗涤6次,二抗(Goat Anti-Rabbit IgG-HRP)1∶8 000稀释摇床上孵育 40 min,PBST 洗涤3次,每次20 min。将超敏化学发光 A 液与超敏化学发光B液按1∶1混匀配置成工作液,将工作液滴加至PVDF膜上并避光作用5 s,使用Amersham Imager 600 System进行化学发光检测。根据成像结果,利用目的灰度值/内参灰度值分析FAF1蛋白相对表达量。
1.12 免疫组织化学
将固定于4%中性多聚甲醛的组织在自来水中冲洗24 h,再经梯度酒精脱水后使用酒苯透明,然后浸蜡,最后进行石蜡包埋。利用切片机将组织切为4 μm的连续性切片。在烘片机上60 ℃烘烤6 h,下行脱蜡水化,采用柠檬酸盐进行抗原修复,将载玻片放入0.01 mol·L-1的柠檬酸盐中,高火加热直至煮沸,再使用中火维持10 min,待冷却至室温后,PBS洗涤3 次,每次3 min;使用3% H2O2溶液于37 ℃条件下孵育10 min进行阻断,PBS洗涤3次,每次3 min;山羊血清工作液室温封闭(SPA 试剂盒A液)15 min,试验组一抗(兔抗牦牛FAF1多克隆抗体)按1∶400稀释后置于湿盒4 ℃孵育过夜,阴性对照组使用PBS作为一抗孵育过夜,PBS洗涤3 次,每次3 min;生物素标记山羊抗兔IgG(SPA试剂盒B液)37 ℃条件下孵育15 min,PBS洗涤3 次,每次3 min;辣根酶标记链霉卵白素工作液(SPA试剂盒C液)室温孵育15 min,PBS洗涤3次,每次3 min;使用DAB显色液进行显色,经苏木精复染后盐酸酒精分化,在自来水中返蓝10 min。脱水透明后封片。待晾干后置于显微镜下拍照。
1.13 数据分析
使用 SPSS 25.0 对 FAF1 mRNA相对表达量和蛋白相对表达量进行单因素方差分析,每组3次重复,计算结果均以“平均值±标准误”来表示,P<0.05表示二者差异显著,使用Graphpad prism 8 进行绘图。
2 结 果
2.1 目的基因的获取
以牦牛cDNA为模板,以FAF1-F、FAF1-R进行PCR扩增,其结果如图1所示,在1 953 bp处有清晰单一的条带,与预期大小一致。

M.2000bp ladder; 1.牦牛睾丸组织cDNA为模板
2.2 重组质粒pET-28a-FAF1的鉴定
以重组质粒pET-28a-FAF1为模板,FAF1-F、FAF1-R为引物进行PCR,结果如图2A所示,在1 953 bp处有清晰明亮的条带,产物大小与预期相符。将重组质粒pET-28a-FAF1双酶切后,结果如图2B所示,在5 335bp和1 953bp处有较清晰的条带,且与预期大小一致。重组质粒pET-28a-FAF1经上海生工测序确认pET-28a-FAF1原核表达载体构建成功。
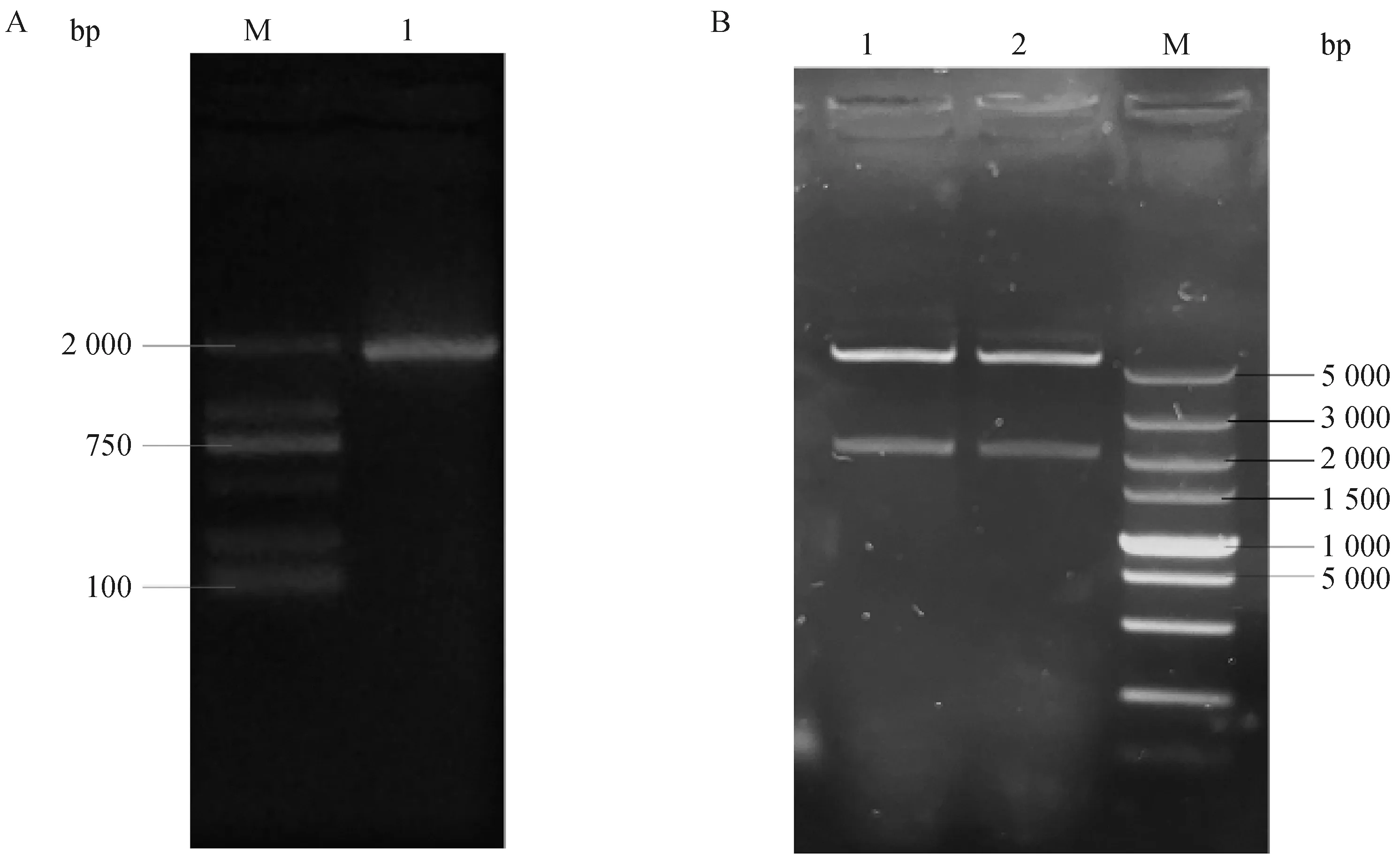
A.重组质粒pET-28a-FAF1 PCR:M.2000 bp ladder;1.构建重组质粒。B.重组质粒pET-28a-FAF1双酶切:M.5000 bp ladder;1~2.不同菌落重组质粒
2.3 重组蛋白的优化诱导
重组蛋白pET-28a-FAF1在20 ℃(图3A)、25 ℃(图3B)、28 ℃(图3C)、32 ℃(图3D)条件下,随诱导时间增加,表达量呈现增加的趋势,37 ℃(图3E)条件下温度过高,导致该重组蛋白表达量降低。该重组蛋白大小与预期一致,为74 ku,其在25 ℃表达量最大,该温度为该重组蛋白的最优诱导温度;25 ℃下诱导5 h表达量最高,认为5 h为最佳诱导时间。不同浓度IPTG对FAF1重组蛋白诱导表达(图4)并无太大影响,因此选择0.5 mmol·L-1作为IPTG最佳诱导浓度。

A.20 ℃不同诱导时间;B.25 ℃不同诱导时间;C.28 ℃不同诱导时间;D.32 ℃不同诱导时间;E.37 ℃不同诱导时间。M.蛋白预染Marker;1.未诱导;2.诱导2 h;3.诱导3 h;4.诱导4 h;5.诱导5 h

M.蛋白预染Marker;1~6.IPTG浓度分别为0.1、0.3、0.5、0.7、1.0和0 mmol·L-1
2.4 重组蛋白的表达和纯化
将破碎后的上清和沉淀变性,经SDS-PAGE电泳,考马斯亮蓝染色后,如图5A所示,经破碎后重组蛋白pET-28a-FAF1基本全部存在于沉淀中,该重组蛋白为不可溶性蛋白。重组蛋白pET-28a-FAF1经镍柱纯化后结果如图5B所示,其大小为74 ku,与预期一致,成功获得较高纯度的重组蛋白pET-28a-FAF1。
2.5 牦牛FAF1多克隆抗体效价检测
ELISA法检测多抗血清抗体效价结果(图6)分析显示,稀释度为1∶1 024 000时的阳性血清OD450 nm>2.1倍阴性血清OD450 nm阴性血清,因此,兔源FAF1多克隆抗体效价为1∶1 024 000。
2.6 牦牛FAF1多克隆抗特异性检验
以重组FAF1蛋白为抗原,1∶2 000稀释兔抗血清作为一抗,Goat anti-rabbit IgG-HRP 以1∶8 000稀释,进行Western blot检测,结果(图7)显示在74 ku处出现特异性条带。结果表明,本研究制备的兔抗FAF1多克隆抗体可与牦牛重组FAF1蛋白能够发生特异性反应。
2.7 FAF1 mRNA在不同年龄睾丸组织相对表达量
qRT-PCR 结果统计分析(图8)表明FAF1 mRNA的表达普遍存在于不同年龄睾丸组织中。其中3、4、7周岁雄性牦牛睾丸组织中FAF1mRNA相对表达量显著高于其他年龄段。FAF1 mRNA的相对表达水平在牦牛不同年龄睾丸组织中存在差异性表达。

柱上所标字母相异表示差异显著(P<0.05),所标字母相同表示差异不显著(P>0.05)。下同
2.8 FAF1 蛋白在不同年龄睾丸组织相对表达量
Western blot结果(图9)显示,FAF1蛋白普遍存在于雄性牦牛不同年龄睾丸组织。统计分析后结果显示(图 10),11周岁时FAF1相对蛋白表达量显著高于其他年龄,6、7周岁次之,3、4周岁FAF1相对蛋白表达量最低,FAF1 蛋白在牦牛不同年龄的相对表达量存在差异性。
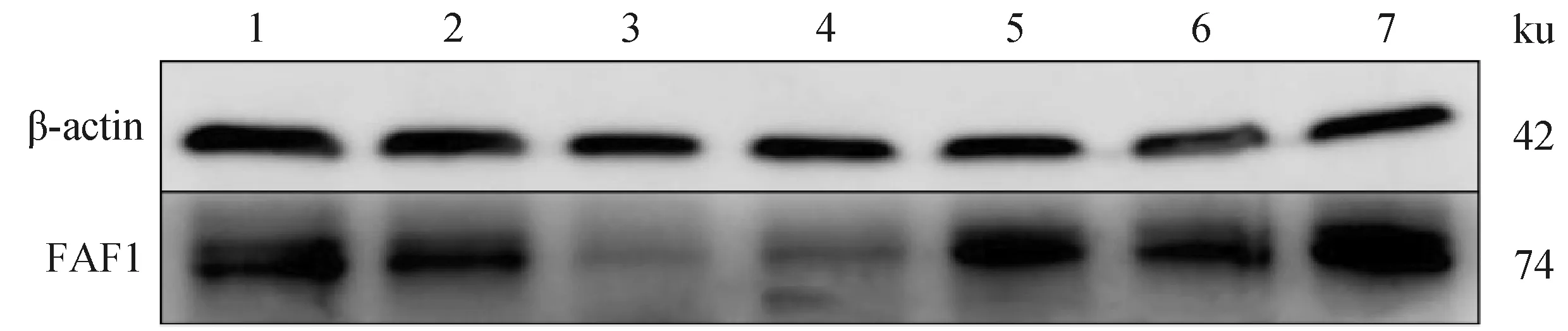
1~7.1、2、3、4、6、7、11周岁牦牛睾丸样品
2.9 FAF1 蛋白在不同年龄睾丸组织的表达定位
免疫组织化学染色结果(图11)显示,FAF1蛋白在不同年龄段牦牛睾丸中均有棕褐色阳性表达,不同年龄睾丸FAF1蛋白分布表达部位基本一致,主要表达于精子、精子细胞、精原细胞、初级精母细胞、支持细胞、睾丸间质细胞和管周肌样细胞。
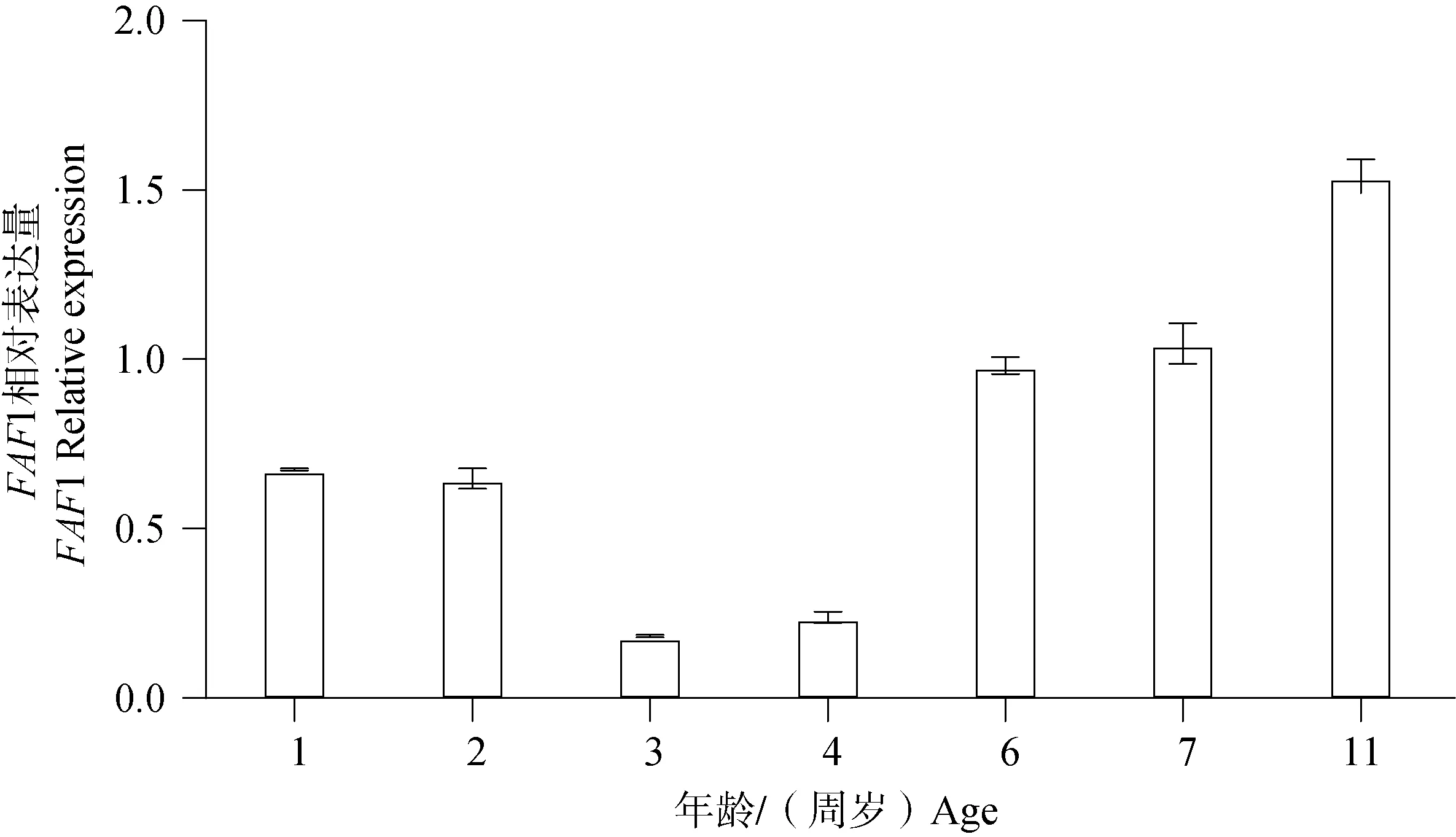
图10 FAF1蛋白在不同年龄雄性牦牛睾丸组织中的相对表达水平
2.10 FAF1 基因在不同繁殖周期卵巢的相对表达水平
qRT-PCR结果(图12)统计分析表明FAF1 mRNA普遍表达存于不同时期的卵巢。黄体期卵巢FAF1 mRNA相对表达量显著高于卵泡期和妊娠期,妊娠期卵巢次之,卵泡期卵巢FAF1 mRNA相对表达量最低。FAF1 mRNA的相对表达量在牦牛不同繁殖周期卵巢组织存在差异化表达。
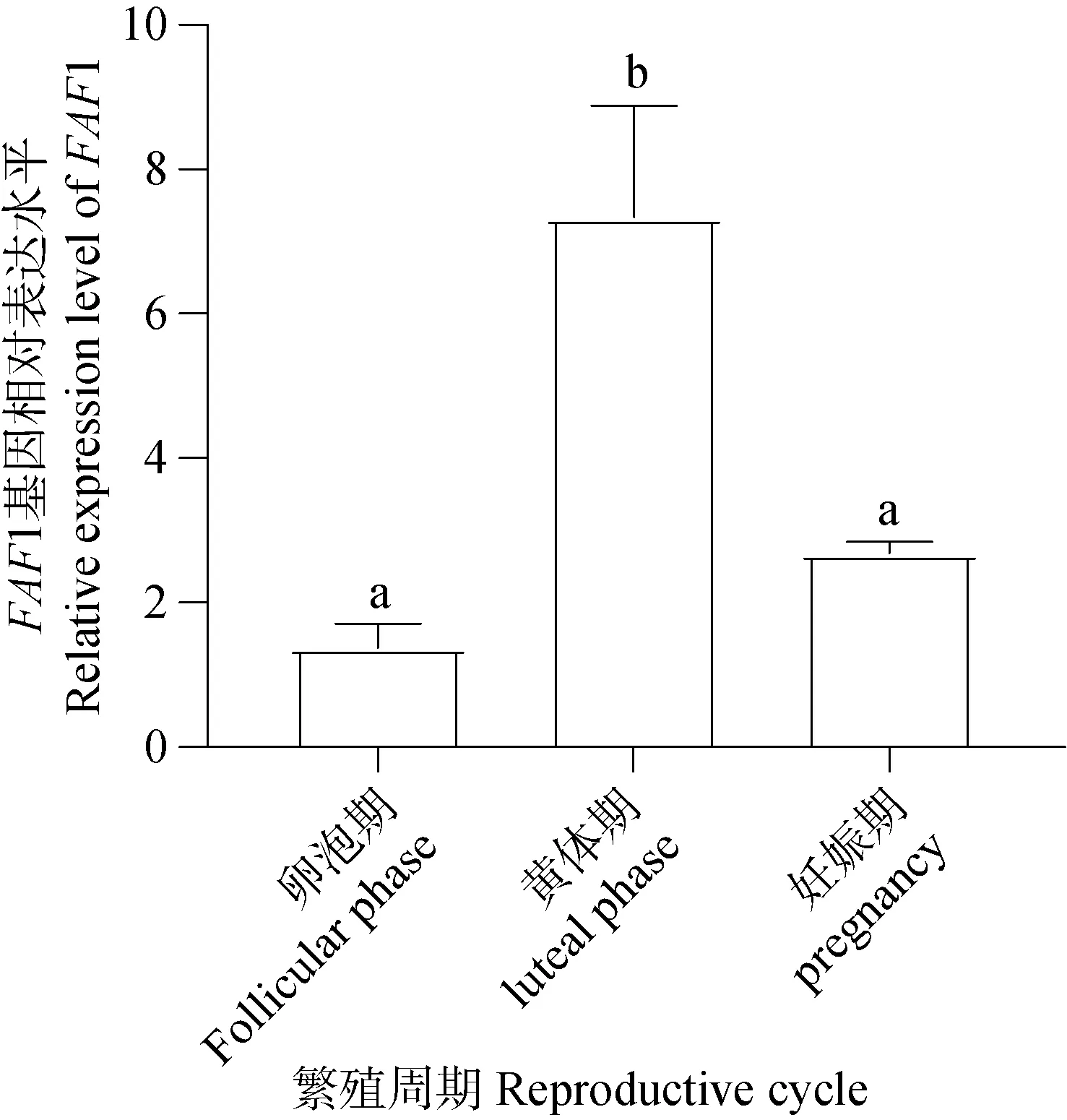
图12 FAF1 mRNA在不同繁殖周期卵巢的表达定位
2.11 FAF1 蛋白在不同繁殖周期卵巢的相对表达水平
Western blot检测结果(图13)显示,FAF1蛋白普遍存在于牦牛不同繁殖周期的卵巢组织中。经统计分析结果(图14)显示,卵泡期和妊娠期卵巢FAF1蛋白相对表达量显著高于黄体期,卵泡期卵巢表达量最高,妊娠期卵巢次之,黄体期卵巢中的FAF1相对表达量最低,FAF1蛋白在牦牛不同繁殖周期卵巢组织中相对表达存在差异性。

1.卵泡期卵巢;2.黄体期卵巢;3.妊娠期卵巢
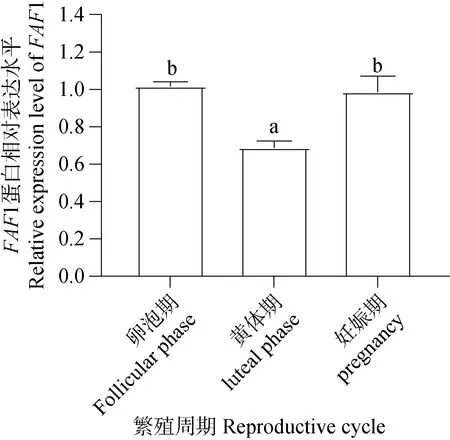
图14 FAF1蛋白在不同繁殖周期卵巢相对表达水平
2.12 FAF1 蛋白在不同繁殖周期卵巢的表达定位
免疫组织化学染色结果(图15)显示,FAF1蛋白在不同繁殖周期卵巢均存在棕褐色阳性表达。在不同繁殖周期卵巢中表达部位并无明显的差异,主要表达于卵巢生殖上皮细胞、颗粒细胞、卵丘细胞(图15A)卵泡膜细胞和黄体细胞(图15B、15C)。
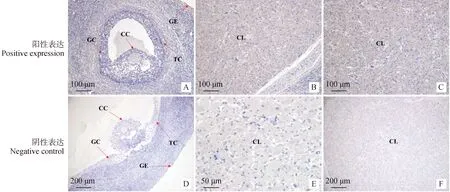
A、D为卵泡期卵巢;B、E为黄体期卵巢;C、F为妊娠期卵巢;GC.颗粒细胞;GE.生殖上皮细胞;TC.卵泡膜细胞;CL.黄体细胞;CC.卵丘细胞
3 讨 论
FAF1含有多个功能结构域,主要包括N末端UBA、C端UBX、DEDID、FID[11]。UBA能够募集对FAF1介导的细胞凋亡和应激反应至关重要的多泛素化蛋白[12],从而介导细胞凋亡和应激反应[13-14]。UBX与泛素-蛋白酶体系统中的分子伴侣含valosin的蛋白(valosin-containing protein,VCP)相结合[15],VCP是酵母中多功能Cdc48p和爪蟾中多功能p97的哺乳动物同源物[16],它是与多种细胞活动相关的ATP酶家族的成员,在细胞周期调节、凋亡、转录激活、细胞器生物发生、囊泡转运、内质网降解等多种生理过程中起分子伴侣的作用[17]。
DEDID可与Fas相关死亡域(Fas-associated protein with death domain,FADD)蛋白及caspase-8相互作用增强或者启动Fas介导的凋亡[18])。FID 与IKKβ直接相互作用来阻止IKKα、IKKβ和IKKγ/NEMO复合物形成,从而抑制NF-κB信号传导,FAF1也被称为IκB激酶(IκB kinase,IKK)激活的抑制剂[14]。除此之外FAF1还可以通过干扰NF-κB的RelA亚基(p65)的核易位而抑制NF-κB的活性[19]。近年来,相关的研究报道还表明FAF1是一种抑癌基因,在多种肿瘤组织和细胞中的表达都是降低的,例如胃癌[20]、肺癌[21]、乳腺癌[22]等,FAF1表达下调可能导致肿瘤的发生。FAF1还通过抑制MAVS来调节抗病毒免疫过程[21]。
睾丸是雄性动物的生殖腺,是精子形成和睾酮分泌的主要器官[23]。哺乳动物睾丸内精子发生是一个复杂而又十分精细的生理过程,其中包括凋亡的调节机制,正常的精子在发生的过程中就存在自发性的生殖细胞凋亡现象[24-25],睾丸生殖细胞凋亡这一过程排除了受到损伤或具有畸形染色体的生殖细胞,既保证了遗传信息传递的准确性,又使得生殖细胞从支持细胞获得充足的营养和支持[26],而过度的凋亡又会使得生殖细胞数量过少,形成的精子数量减少,从而导致雄性个体生育能力下降。Fas信号通路与生精细胞的敏感性密切相关,可能主导生精细胞凋亡[27],FAF1为Fas通路的重要调控元件,对于Fas通路活化具有重要的调控作用[28]。本研究表明随着牦牛年龄的增长,从幼年到青年,再至老年,FAF1 mRNA及FAF1蛋白普遍表达于各个年龄阶段,但在不同年龄又有存在差异性,这与Adham等[6]在小鼠睾丸上的研究结果一致。FAF1 mRNA相对表达量在3、4周岁时升高,6周岁下降,7周岁再次升高,后又下降,差异化表达表明FAF1在睾丸发育及精子发生等生理过程发挥重要生物学作用。FAF1 mRNA相对表达量随着雄性牦牛达到性成熟而增加,可能是由于性成熟睾酮分泌量的改变,生殖细胞数量增加,造成睾丸生殖细胞凋亡增加[29],从而FAF1 mRNA相对表达量增加,老年时表达量下降则可能是由于睾酮分泌量减少,性功能降低,精子发生减少,相应凋亡也减少;FAF1蛋白相对表达量在青年初期(3、4周岁)时下降,后逐步升高,与FAF1 mRNA相对表达量不尽相同,可能因为 FAF1蛋白不能单独启动细胞凋亡程序,除了在人类BOSC23细胞中可直接启动细胞凋亡[30],FAF1蛋白需与其他蛋白结合形成死亡效应丝(death effector filament,DEF)或DISC发挥凋亡作用[31],因此,FAF1蛋白相对表达量降低可能是形成了蛋白复合体来发挥凋亡作用而导致。FAF1蛋白主要表达于不同年龄的精子、精子细胞、精原细胞、初级精母细胞、支持细胞、睾丸间质细胞和管周肌样细胞中。支持细胞是为生殖细胞增殖分化提供营养和支持;睾丸间质细胞是分泌睾酮及影响支持细胞分化;管周肌样细胞主要是协同支持细胞,为精原细胞提供基质,产生不同阶段的生精细胞[32];提示FAF1可能参与睾丸发育、精子发生及睾酮分泌等重要生理过程。
卵巢在动物生殖中占有极其重要的地位,因为它不仅能产生卵细胞,还能分泌数种性激素。FAF1 mRNA相对表达量在黄体期卵巢显著高于卵泡期和妊娠期,妊娠期卵巢次之,卵泡期卵巢表达量最低。在卵巢组织中,闭锁卵泡、排卵时的卵巢上皮和黄体发生时都会发生细胞凋亡[33]。黄体期卵巢时由于形成黄体,孕激素分泌增加,FAF1 mRNA表达量显著上升,Taniguchi等[34]发现牛的黄体期卵巢Fas mRNA表达水平显著高于其他阶段,FAF1是Fas家族成员,为Fas通路重要调控原件,本研究结果与Taniguchi等[34]研究结果相似,推测FAF1 mRNA表达量受孕激素调控,可能参与黄体溶解的生理过程。FAF1蛋白相对表达量在卵泡期卵巢显著高于黄体期和妊娠期,妊娠期卵巢次之,黄体期相对表达量最低。FAF1蛋白表达情况与FAF1 mRNA表达情况相反,这可能是因为一般情况下FAF1蛋白需要与其他蛋白形成复合蛋白才能发挥其生物学作用,与上述FAF1蛋白在睾丸中表达情况相似,因此导致黄体期卵巢中FAF1蛋白表达量较低,用以形成复合物溶解黄体。FAF1表达于不同繁殖周期卵巢生殖上皮细胞、颗粒细胞、卵丘细胞和黄体细胞。生殖上皮在卵细胞形成中是不可或缺的因素[35];颗粒细胞的增殖分化与卵泡的发育密切相关[36],卵泡闭锁其实质就是颗粒细胞凋亡而产生的结果[37];卵丘细胞通过缝隙连接调节卵母细胞中激素蛋白质和相关调节因子的表达,从而影响卵母细胞成熟[38];卵泡膜细胞可以和颗粒细胞,卵母细胞发生相互作用,在卵泡发育过程中提供结构支持,还可以合成雄激素[39];黄体细胞在妊娠建立及黄体维持、发育和退化中具有重要作用[40]。而FAF1在雌性牦牛不同繁殖周期差异性表达,因此推测FAF1蛋白可能参与卵泡闭锁、发育、成熟和黄体溶解等生理过程。
4 结 论
本研究成功构建pET-28a-FAF1原核表达载体,并优化其诱导温度,诱导表达后的融合蛋白为不可溶性蛋白,经镍柱纯化后,利用Western blot鉴定,成功获得纯度较高的FAF1重组蛋白,免疫试验动物后获得兔源FAF1多克隆抗体,效价为1∶1 024 000,具有良好特异性。FAF1在不同年龄睾丸及不同繁殖周期卵巢组织中均有表达,且不同年龄睾丸及不同繁殖周期卵巢表达水平存在显著差异,揭示FAF1在牦牛不同阶段中具有重要生物学作用,推测FAF1可能与雄性牦牛的睾丸发育、精子发生及睾酮分泌密切相关,与雌性牦牛的卵泡闭锁、发育、成熟和黄体溶解生理过程相关,但相关机制有待进一步深入研究。

