基于RNA-Seq技术研究枸杞多糖对环磷酰胺致雏鸡免疫抑制的拮抗机制
王建东,唐玉林,王 敏,张宝锁,杨富强,高海慧,于 洋,郭延生*
(1.宁夏农林科学院动物科学研究所,银川 750002;2.宁夏大学农学院,银川 750021;3.宁夏银川市妇幼保健院,银川 750001;4.宁夏顺宝现代农业股份有限公司,青铜峡 751600)
免疫抑制是免疫系统的一种暂时性或永久性紊乱,易由病毒、化学药物、应激等多种因素引起,其中病毒引起的免疫抑制在畜禽中非常普遍[1]。近年来,单一或混合感染性免疫抑制病毒,如马立克氏病病毒(MDV)、网状内皮细胞增多症病毒(REV)、禽白血病病毒(ALV)、传染性法氏囊病病毒(IBDV)、鸡传染性贫血病毒(CIAV)等广泛存在于鸡群中[2]。这些免疫抑制病毒往往会降低机体对疫苗免疫反应的敏感性,增加鸡群传染病的发病率和死亡率,给养鸡业造成巨大的经济损失[3]。当前控制免疫抑制病和预防继发性感染的方法主要还是通过长期的疫苗接种和高剂量的药物治疗,然而灭活疫苗不能产生足够的抗体,高剂量的药物治疗也面临着动物产品中药残问题[4-5]。因此,寻找防治免疫抑制疾病的新方法迫在眉睫,而使用免疫增强剂来增强宿主的防御能力被认为是最有前途的替代方法[6]。近年来,一些传统中药制剂被证明具有免疫增强的作用,而进一步研究表明,其发挥免疫调节作用与其所含的活性成分植物多糖有着密切联系。多糖是由糖苷键连接的单糖聚合物,在植物中广泛存在,并被广泛用作免疫调节剂[7]。枸杞多糖(Lyciumbarbarumpolysaccharides,LBP)是从枸杞成熟果实中分离出的有效活性成分之一,主要由阿拉伯糖、甘露糖、木糖、鼠李糖、半乳糖和葡萄糖6种单糖组成[8],且以半乳糖为主链结构组成[9]。据报道,LBP具有抗氧化、抗肿瘤、抗炎、增强免疫、生殖保护及神经保护等作用[10-14]。Long等[15]研究发现,在肉鸡日粮中添加LBP能显著提高肉鸡生长性能,增强机体抗氧化应激能力,并增加血清中IgG、IgA、IL-4、IL-6、TNF-α和IFN-γ水平。王思月[16]研究表明,LBP能够显著改善肉鸡肠道菌群结构,提高血中IgA和IgG水平,并增加IL-2和IL-6基因的表达水平,从而达到增强免疫的作用,但目前关于枸杞多糖对雏鸡免疫抑制调节的分子机制尚未见报道。
环磷酰胺(cyclophosphamide,CY)是一种常被用于肿瘤化疗的药物,但其靶向性不强,在杀伤肿瘤细胞的同时会杀伤如淋巴细胞在内的大量免疫细胞,导致机体出现免疫抑制等严重副作用,可用来构建免疫抑制模型。因此,本试验采用RNA-Seq技术研究LBP对环磷酰胺所致免疫抑制雏鸡脾组织基因的调节作用,旨在揭示LBP干预雏鸡免疫抑制的分子机制。
1 材料与方法
1.1 主要动物与药品
1日龄雏鸡购自北京华都峪口禽业有限公司;枸杞多糖购自宁夏天仁枸杞生物科技股份有限公司;环磷酰胺购自大连美仑生物技术有限公司。
1.2 试验动物分组与处理
将120羽1日龄海兰褐蛋鸡,适应性饲养至7日龄后随机分成3组,每组40羽,即空白组(NC组)、环磷酰胺组(CY组)及枸杞多糖组(CYLbGp组),NC组连续3 d肌注生理盐水,其余2组连续3 d每日肌注80 mg·kg-1环磷酰胺进行造模,造模后CYLbGp组通过饮水的方式每日给予5 mg·kg-1枸杞多糖,连续30 d。在CYLbGp组给药结束后第1天,每组随机选取6只鸡处死后取脾组织于冻存管中,-80 ℃超低温冰箱保存。
1.3 测序试验流程
使用TRIzol试剂(Invitrogen)从雏鸡脾组织样品中提取总RNA,随后利用Nanodrop2000、琼脂糖凝胶电泳检测RNA的浓度、纯度及完整性,再使用Agilent 2100测定RNA完整值(RNA integrity number,RIN)。加入buffer后,利用带有Oligo(dT)磁珠分离出300 bp左右mRNA的小片段,加入随机引物合成一链cDNA,随后进行二链合成。将得到的双链cDNA进行PCR扩增(15个cycles),最后在cBot系统上进行桥式PCR扩增,完成整个文库的制备工作。将构建好的文库用Illumina NovaSeq6000平台进行测序(PE文库,读长2×150 bp)。
1.4 RNA-Seq质量评估和序列比对
对原始测序数据进行过滤,得到高质量测序数据(Clean data)。使用SeqPrep、Sickle等在线平台修剪、剔除测序数据中的问题片段,再对过滤所得到的高质量测序数据进行质量评估,计算Q20、Q30(Q20、Q30分别指测序质量在99%和99.9%以上的碱基占总碱基的百分比)和GC含量,同时选择对应的测序碱基平均错误率(Error rate)小于0.1%的用于后续的转录组分析。将得到的高质量测序数据与参考基因组进行比对,获得用于后续分析的比对率(Mapped data),同时对本次测序的比对结果进行质量评估,并使用TopHat2软件进行序列比对分析。
1.5 转录组数据分析
获得基因的Read Counts数后,使用RSEM软件对其进行TPM(Transcripts per million)转换,进而得到标准化的基因表达水平。利用软件DESeq2筛选出各组样本间差异表达基因(|log2(Fold change)|≥0,P-adjust<0.05)。利用Blast2go 2.5对基因集进行GO注释分析,采用软件Goatools对基因集内的基因进行GO富集分析,使用KOBAS对基因集内的基因进行KEGG通路富集分析,筛选差异表达基因显著富集的途径。
1.6 蛋白质互作网络分析
使用String 11.5(http:∥string-db.org/)平台构建枸杞多糖回调差异基因的蛋白质-蛋白质相互作用网络分析图(PPI),选择多种蛋白模式(Multiple proteins),将所筛选的差异基因名导入模块(List Of Names),从物种类别里选择鸡(Gallusgallus)进行搜索,将所得图片数据下载后导入Cytoscape3.8.2软件进行调整,使用Analysis Network进行分析获得Degree值,根据Degree值的大小进行相关基因节点的绘制,进一步挖掘枸杞多糖在拮抗免疫抑制网络中的重要基因。
1.7 RT-qPCR验证
从差异表达基因中随机挑选5个差异基因CD83、CCL4、PSPH、LPIN2和ULK2,以β-actin为内参基因,采用RT-qPCR法验证转录组测序结果的准确性。所用引物经上海美吉生物医药科技有限公司合成,见表1。RT-qPCR反应体系为20 μL,2×ChamQ SYBR Color qPCR Master Mix 10 μL,上、下游引物各0.8 μL,50×ROX Reference Dye 1 0.4 μL,cDNA 2 μL,ddH2O 6 μL。反应条件为:95 ℃变性5 s,55 ℃退火30 s,72 ℃延伸40 s,40个循环。采用2-ΔΔCT法测定与对照组相比试验各组基因的相对表达量。

表1 RT-qPCR引物序列
2 结 果
2.1 免疫抑制雏鸡模型判断
CY组和CYLbGp组雏鸡在肌注3 d环磷酰胺后,外观明显可见精神状态萎靡不振、喜卧、闭目呆立、羽毛凌乱、少食,出现体重减轻,表明免疫抑制雏鸡模型建立成功。前期研究中也发现,环磷酰胺所致免疫抑制雏鸡可出现脾脏指数、淋巴细胞转化率显著降低,脾组织结构较正常组生发中心减少[17-18]。
2.2 测序数据质量评估与序列比对
3个试验组的脾组织样本转录组测序后数据质量评估和序列比对详细结果见表2。结果显示,对各组样本进行转录组测序后,NC组、CY组和CYLbGp组分别共获得363 058 878、330 263 170和355 979 838条原始测序数据条目数,对原始数据进行质控、过滤后分别共获得了357 135 798、324 728 438和350 233 042个测序条目数。测序所得数据的各样本Q20、Q30的最小含量分别为97.39%、93.05%(一般Q20在85%以上,Q30在80%以上被认为测序质量可靠),GC含量在50.16%~52.40%之间,且所有样品的唯一比对率均达到83.76%以上。质量评估结果表明,本次转录组测序数据质量较高、结果可靠,可用于后续分析。

表2 测序数据质量处理与序列比对
2.3 转录组样本关系分析
利用比对至基因组的结果以及基因组注释文件,获得每个样本基因的Read Counts。然后使用RSEM对其进行TPM转换,进而得到标准化的基因表达水平。依据得到的TPM数据进行小提琴图绘制,如图1所示。

图1 3组样本基因表达量小提琴图
PCA分析基于基因表达量对样本进行聚类,图中样本间的距离远近,表明样本间相似性的高低,距离越近相似性越高。为了解各样本间和组间差异基因的表达情况,采用DESeq软件进行PCA分析,见图2。结果表明,3组雏鸡脾样本表达结果均处于95%置信区间内,表明各组组内脾样本基因表达情况相似,数据稳定性好,样本可信度高。CYLbGp组和NC组基因表达轮廓重合,表示两组基因表达水平无明显差异,而CY组较NC和CYLbGp两组样本的组间差异大,基因表达水平发生明显改变,提示CY显著改变了雏鸡脾的基因表达情况,而LBP对CY刺激产生的影响有明显改善作用。

图2 3组样本间PCA得分图
2.4 差异表达基因筛选
NC和CY组、CY和CYLbGp组之间以P-adjust<0.05和|log2FC|≥0为标准筛选差异表达基因,结果见图3。如图所示,与NC组相比,CY组筛选出差异表达基因有408个,其中上调193个,下调215个。与CY组相比,CYLbGp组共筛选出差异表达基因896个,其中上调了408个,下调488个。为明确LBP拮抗CY免疫抑制作用的主要靶基因,筛选CY组较NC组上调的差异表达基因与CYLbGp组较CY组下调差异表达基因的交集,得到108个差异表达基因;将CY组较NC组下调的差异表达基因与CYLbGp组较CY组上调差异表达基因的交集,得到70个差异表达基因(图4)。

图3 差异表达基因火山图

A.与NC组相比,CY组上调的差异表达基因数目,以及与CY组相比,CYLbGp组下调的基因数目;B.与NC组相比,CY组下调的差异表达基因数目,以及与CY组相比,CYLbGp组上调的基因数目
2.5 差异表达基因的GO功能注释分析
对枸杞多糖干预后上、下调差异基因集进行GO功能注释分析,结果主要分为三个模块:生物过程主要涉及到细胞过程、生物调节等,细胞成分主要涉及细胞部分、膜部分、膜、细胞器部分、细胞器等,分子功能主要涉及结合、催化活性等。结果如图5、6所示。

cell part:细胞部分;membrane:膜;organelle:细胞器;organelle part:细胞器部分;membrane part:膜部分;protein-containing complex:蛋白复合体;synapse:突触;cellular process:细胞过程;biological regulation:生物调节;metabolic process:代谢过程;response to stimulus:对刺激的反应;localization:本地化;developmental process:发展过程;cellular component organization or biogenesis:细胞组成组织或生物发生;multicellular organismal process:多细胞生物过程;multi-organism process:多组织过程;binding:结合;catalytic activity:催化活性;molecular transducer activity:分子换能器活性;transcription regulator activity:转录调控因子活性
2.6 差异表达基因的GO功能富集分析
为研究枸杞多糖干预免疫抑制雏鸡后差异表达基因的生物学功能,对给予枸杞多糖后发生显著改变的差异基因进行GO功能富集分析。其中在CY刺激后上调,给予枸杞多糖干预后下调的108个基因显著富集到6个属于生物过程模块的GO条目(P-adjust<0.05)上,如图7所示,生物质量调节、细胞对化学刺激的反应、生物调节、多细胞生物过程的调节、稳态过程、化学反应。在CY刺激后下调,给予枸杞多糖干预后上调的70个基因也显著富集于23条GO BP条目上(Padjust<0.05),见图8。其中许多条目与免疫调节相关,包括免疫系统过程的正向调节、淋巴细胞活化、免疫系统过程、免疫系统过程的调节、白细胞活化、白细胞分化、白细胞-细胞黏附的调节等生物学过程。

cell part:细胞部分;membrane:膜;organelle:细胞器;membrane part:膜部分;organelle part:细胞器部分;protein-containing complex:蛋白复合体;binding:结合;catalytic activity:催化活性;transcription regulator activity:转录调控因子活性;transporter activity:运输活动;biological regulation:生物调节;cellular process:细胞过程;localization:本地化;metabolic process:代谢过程;developmental process:发展过程;cellular component organization or biogenesis:细胞组成组织或生物发生;response to stimulus:对刺激的反应;immune system process:免疫系统过程;locomotion:运动;multicellular organismal process:多细胞生物过程
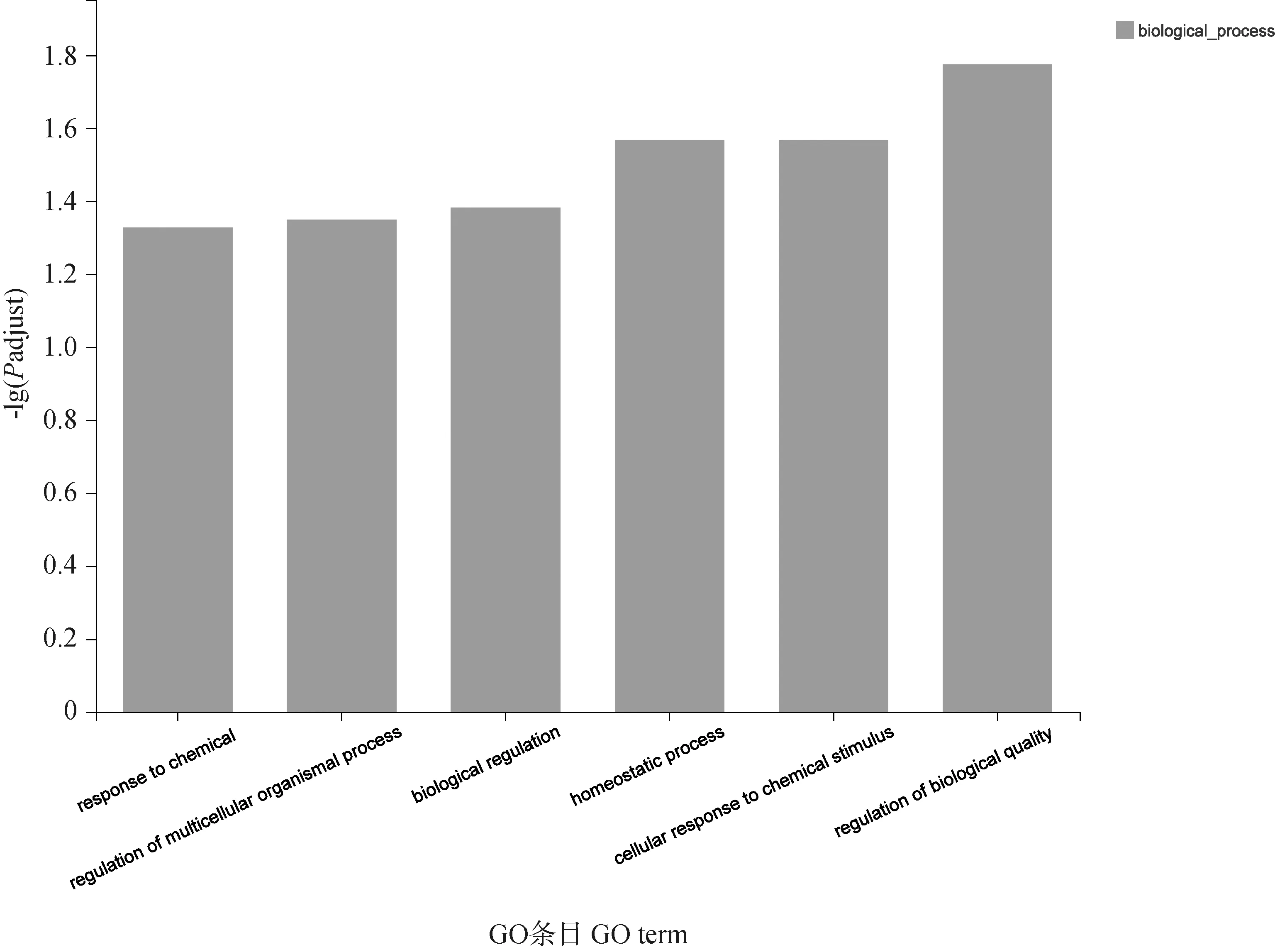
response to chemical:对化学物质的反应;homeostatic process:稳态过程;regulation of multicellular organismal process:多细胞生物过程的调节;biological regulation:生物调节;cellular response to chemical stimulus:细胞对化学刺激的反应;regulation of biological quality:生物质量调节

caicium ion transport:钙离子迁移;cell activation:细胞活化;regulation of leukocyte cell-cell adhesion:白细胞-细胞黏附的调节;regulation of cellular component movement:调节细胞成分的运动;cell motility:细胞活性;regulation of cell-cell adhesiorr:细胞-细胞黏附的调节;regulation of locomotion:运动调节;leukocyte differentiation:白细胞分化;movemenf of cell or subcellular component:细胞或亚细胞成分的运动;leukocyte activation:白细胞活化;intracelular signal transductior:细胞内信号转导器;regulation of cell motility:细胞运动的调节;regulation of immune system process:免疫系统过程的调节;locomotion:运动;regulation of cell migration:细胞迁移的调节;immune system process:免疫系统过程;positive reguiation of locomotiorr:积极调节运动能力;positive regulation of celluiar component movemet:细胞成分运动的正向调节;positive regulation of cell motility:细胞运动的正向调节;metal ion transport:金属离子运输;positive regulation of cell migratiorr:正向调节细胞迁移;lymphocyte activation:淋巴细胞活化;positive regulation of immune system process:免疫系统过程的正向调节
2.7 差异表达基因的KEGG通路富集分析
对178个枸杞多糖干预后发生显著回调的差异表达基因进行KEGG通路富集分析。结果显示,CY刺激后发生上调,在给予枸杞多糖干预后发生下调的108个差异基因显著富集通路有13条,主要涉及到线粒体自噬-动物、mTOR信号通路和AMPK信号通路等与细胞自噬相关通路上(图9)。在CY刺激后发生下调,给予枸杞多糖干预后发生上调的70个差异基因显著富集通路有79条,主要涉及到趋化因子信号通路、C型凝集素受体信号通路、B细胞受体信号通路、血小板活化、自然杀伤细胞介导的细胞毒性、Th1和Th2细胞分化等免疫相关信号通路上(图10)。去除掉未知基因后共有17个差异表达基因被富集到上述通路中(表3)。

Mitophagy-animal:线粒体自噬-动物;cGMP-PKG signaling pathway:cGMP-PKG信号通路;Pathways in cancer:癌症通路;Thyroid hormone signaling pathway:甲状腺激素信号通路;Adipocytokine signaling pathway:脂肪细胞因子信号通路;Longevity regulating pathway-worm:寿命调节通路-虫;PPAR signaling pathway:PPAR信号通路;mTOR signaling pathway:mTOR信号通路;Salivary secretion:唾液分泌;Fatty acid degradation:脂肪酸降解;Mineral absorption:矿物质的吸收;AMPK signaling pathway:AMPK信号通路;Longevity regulating pathway-multiple species:长寿调节途径-多物种

Chemokine signaling pathway:趋化因子信号通路;Ras signaling pathway:Ras信号通路;C-type lectin receptor signaling pathway:C型凝集素受体信号通路;Phosphatidylinositol signaling system:磷脂酰肌醇信号系统;Spinocerebellar ataxia:脊髓小脑的共济失调;Non-small cell lung cancer:非小细胞肺癌;Platelet activation:血小板活化;Human immunodeficiency virus 1 infection:人类免疫缺陷病毒1型感染;cAMP signaling pathway:cAMP信号通路;Shigellosis:志贺菌病;Proteoglycans in cancer:蛋白质多糖在癌症中的作用;B cell receptor signaling pathway:B细胞受体信号通路;AGE-RAGE signaling pathway in diabetic complications:糖尿病并发症中的AGE-RAGE信号通路;Natural killer cell mediated cytotoxicity:自然杀伤细胞介导的细胞毒性;PD-L1 expression and PD-1 checkpoint pathway in cancer:PD-L1在癌症中的表达和PD-1检查点通路;Kaposi sarcoma-associated herpesvirus infection:卡波济肉瘤相关疱疹病毒感染;Cholinergic synapse:胆碱能突触;Parathyroid hormone synthesis,secretion and action:甲状旁腺激素的合成、分泌和作用;Th1 and Th2 cell differentiation:Th1和Th2细胞分化;Inflammatory mediator regulation of TRP channels TRP:通道的炎性介质调节

表3 枸杞多糖干预免疫抑制雏鸡KEGG筛选的通路及富集基因
2.8 差异表达基因PPI网络分析
枸杞多糖干预后回调差异表达基因PPI网络图,如图11所示。结果表明,PIK3CD、JAK3、GATA3、HIF1A、NKX2-5和INPPL1为其中的关键基因,除NKX2-5外均为上述筛选差异通路中的富集基因,可能作为枸杞多糖拮抗雏鸡免疫抑制的药效靶点。

图11 枸杞多糖干预回调差异表达基因PPI网络图
2.9 RT-qPCR验证结果
RT-qPCR验证结果表明,CD83、CCL4在枸杞多糖干预后表现出上调的趋势,PSPH、LPIN2、ULK2呈现为下调趋势,并且与转录组学数据变化趋势基本一致(图12),表明转录组数据的有较高的可靠性。

A.RNA-seq所检测5个基因的相对表达水平;B.qRT-PCR所检测5个基因的相对表达水平。*表示与NC组差异显著(P<0.05),**表示与NC组差异极显著(P<0.01);#表示与CY组差异显著(P<0.05),##表示与CY组差异极显著(P<0.01)
3 讨 论
CY因其良好的免疫抑制效果,常被用于免疫抑制模型的建立。研究表明,CY通过抑制机体免疫器官的发育、降低免疫细胞数量和减少免疫相关细胞因子产生达到免疫抑制的效果,而LBP可通过调节各种免疫细胞活化、分化,及促进免疫分子的分泌达到免疫增强的作用[19-20]。
3.1 枸杞多糖对细胞凋亡的影响
本研究发现,LBP干预后,下调的108个共表达基因最主要显著富集在线粒体自噬信号通路上,下调的关键基因为缺氧诱导因子-1a(HIF1A)。HIF-1a是一种PAS家族转录因子,可调节代谢对组织氧环境变化的适应。在常氧条件下,HIF-1a被脯氨酰羟化酶迅速降解。在缺氧条件下,HIF-1a稳定并与组成型表达的HIF-1b形成异二聚体,并与调节不同生物过程的基因中的缺氧反应元件结合[21]。HIF1A在缺氧适应性反应中特异性表达,可能参与脊髓损伤后继发性缺血缺氧过程,并可能介导损伤性细胞凋亡[22]。在快速生长的肿瘤中,细胞通常会遇到缺氧应激,从而导致HIF表达的诱导,诱导细胞凋亡[23]。研究表明,CY也可造成再生障碍性贫血,常被用于动物贫血模型的建立[24],并使血清中HIF-1a表达水平升高[25]。本试验中CY组脾组织中HIF1A表达上升,提示CY可造成机体贫血引起HIF1A表达上调,诱导细胞凋亡,给予LBP干预后HIF1A表达水平显著降低,表明LBP能够改善脾免疫细胞凋亡情况,进而缓解雏鸡免疫抑制作用。
3.2 枸杞多糖对免疫功能的影响
转录组分析发现,许多差异表达基因与免疫反应相关,所涉及到的关键基因包括PIK3CD、GATA3和JAK3。PIK3CD是磷脂酰肌醇3-激酶(PI3K)家族的成员,是细胞代谢、增殖、分化和凋亡等细胞功能中的关键信号调控枢纽[26]。PIK3CD主要在白细胞中表达,可能占B淋巴细胞中PI3K活性的60%,是B细胞发育和存活所必需的[27]。细胞中PIK3CD含量降低会阻止B细胞分化并减少循环中成熟B细胞的数量,这表明其在B细胞滤泡成熟和存活中不可或缺的作用[28]。本试验中,给予LBP后PIK3CD表达水平较CY组出现显著上调。
T细胞转录因子基因GATA3分别是Th1和Th2细胞的关键转录因子,可促进T细胞活化与分化,并且在多种炎症反应中具有重要作用[29]。JAK3是酪氨酸激酶家族的重要成员之一,在转导来自IL-2、IL-4、IL-7、IL-9和IL-15受体的信号中起关键作用,对T细胞和B细胞的增殖分化以及在维持机体的免疫系统稳态中发挥重要作用[30]。本试验中,给予LBP后GATA3、JAK3表达水平较CY组出现显著上调。
INPPL1(又称SHIP2)是一种抑制性磷酸酶,对肌醇磷脂磷脂肌醇-3,4,5-三磷酸(PIP3)具有特异性[31]。SHIP通过水解PIP3作为免疫反应的负调节因子,而PIP3作为脂质第二信使,对机体各免疫细胞的发育和功能起到调控作用[32]。本试验中,给予LBP后INPPL1表达水平较CY组出现显著上调。
综上可见,LBP具有缓解雏鸡免疫抑制的作用。
4 结 论
本试验采用转录组学方法探究枸杞多糖拮抗雏鸡免疫抑制的作用机制,与NC组/CY组鉴定出的差异表达基因比较,发现LBP回调的差异表达基因有178个,其中上调基因70个,下调基因108个,显著逆转调节富集通路有92条。结果表明,LBP可通过调节线粒体自噬、趋化因子信号通路、C型凝集素受体信号通路、B细胞受体信号通路、血小板活化、自然杀伤细胞介导的细胞毒性、Th1和Th2细胞分化等通路,起到抑制细胞凋亡,提高免疫功能的作用。

