宁夏小麦茎基腐病病原鉴定
胡耀龙 申昊 高龙 苟金红 李文强 贾龙 任斌

摘要 为确定宁夏地区小麦茎基腐病病原,于2020年小麦灌浆期在宁夏引黄灌区小麦产区采集小麦茎基腐病发病植株,进行组织分离纯化。根据培养性状、菌落颜色、分生孢子等形态学和分子生物学对其进行病原鉴定及致病性测定。结果表明,共分离获得87株菌株,根据病原形态学鉴定及分子生物学鉴定结果,其中有59株菌株鉴定为假禾谷镰刀菌(Fusarium pseudograminearum),28株菌株鉴定为尖孢镰刀菌(Fusarium oxysporum),其中假禾谷镰刀菌占总分离菌株的67.8%,是宁夏地区小麦茎基腐病的优势病原。
关键词 小麦茎基腐病;病原鉴定;假禾谷镰刀菌;尖孢镰刀菌;致病性
中图分类号 S 432.4+4文献标识码 A文章编号 0517-6611(2023)15-0131-04
doi:10.3969/j.issn.0517-6611.2023.15.032
Identification of Pathogen of Wheat Crown Rot Disease in Ningxia
HU Yao-long,SHEN Hao,GAO Long et al
(College of Agriculture, Ningxia University, Yinchuan, Ningxia 750000)
Abstract In order to determine the pathogen of wheat crown rot in Ningxia area, plants with wheat crown rot disease were collected in the wheat production area of Ningxia irrigation area in 2020 for tissue separation and purification. Pathogen identification and pathogenicity determination were based on morphology and molecular biology such as culture traits, colony color, conidia, etc. The results showed that a total of 87 strains were isolated, and according to the pathogen morphological identification and molecular biology identification results, 59 strains were identified as F. pseudograminearum and 28 strains were identified as F. oxysporum, of which F. pseudograminearum accounted for 67.8% of the total isolated strains, which was the dominant pathogen of wheat crown rot in Ningxia.
Key words Wheat crown rot;Pathogen identification;Fusarium pseudograces;Fusarium oxysporum;Pathogenicity
小麥茎基腐病是影响小麦产量和品质的真菌性病害,该病害在发病初期导致小麦茎基部变褐及腐烂,影响小麦生长,发病后期致使小麦穗部干瘪甚至变为白穗,严重影响小麦的品质和产量[1-2]。小麦茎基腐病的病原组成较为复杂,且在各地不同环境条件下的优势致病菌也不同。在塞尔维亚地区,从小麦茎基腐病的发病部位分离出的病原包括假禾谷镰刀菌(F.pseudograminearum)和尖孢镰刀菌(F.oxysporum)[3]。在伊拉克地区,研究表明黄色镰刀菌(F.culmorum)是引起该地区病害发生的重要病原菌[4]。在智利南部地区,小麦茎基腐病的病原组成主要为镰刀菌属(Fusarium.sp.),包括禾谷镰刀菌(F.graminearum)、燕麦镰刀菌(F.avenaceum)等[5]。我国研究者同样发现镰刀菌属(Fusarium sp.)是引起小麦茎基腐病发生的主要病原菌。研究者从小麦茎基腐病病株上分离出的病原菌主要包括燕麦镰刀菌(F.avenaceum)[6]、木贼镰刀菌(F.equiseti)、假禾谷镰刀菌(F.pseudograminearum)[7]、轮枝镰孢菌(F.verticillioides)、禾谷镰孢菌(F.graminearum)[8]、三线镰刀菌(F.tricinctum)[9]等。镰刀菌属(Fusarium.sp.)分布范围大,寄生或腐生于寄主植物维管束中。在一定的气候条件下,对小麦的茎基部及根部进行侵染,导致小麦株系萎蔫,对小麦产量造成极大影响[10]。
近年来,因为秸秆还田的实行,宁夏引黄灌区银川平原永宁县、灵武市、吴忠市等地土地中的菌原累积的越来越多,加之其他因素导致小麦茎基腐病在全国多省大面积发生,且不断加剧[11-13]。宁夏引黄灌区地势平坦,小麦作为银川平原的主要农作物,而小麦茎基腐病在宁夏的病原组成一直缺乏系统研究。笔者通过对宁夏引黄灌区小麦产区采到的小麦茎基腐病病株进行病原分离纯化,根据培养性状、菌落、分生孢子等形态学特征和分子生物学方法对小麦茎基腐病株中所含有的镰刀菌种类进行鉴定,为进一步研究和防治小麦茎基腐病提供科学依据。
1 材料与方法
1.1 材料
于2020年5月在宁夏引黄灌区小麦种植区采集小麦茎基腐病发病植株,装在自封袋中,记录采样地点、病株编号、采样日期等信息。将采集的病株带回实验室之后于4 ℃保存以待后续分离使用。
供试小麦品种:宁春50。
培养基:PDA培养基,用于病原菌的分离纯化;水琼脂,用于病原菌分生孢子的纯化。培养基配方:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 L。121 ℃灭菌25 min,待培养基冷却至室温时加入氯霉素。水琼脂培养基:2 g琼脂,100 mL蒸馏水,121 ℃灭菌25 min。
1.2 方法
1.2.1 病原菌分离纯化。
采用植物组织分离法。取样品病株发病部位,剪成5 mm×5 mm左右的碎片,用75%乙醇消毒15 s、无菌水漂洗、5%的次氯酸钠消毒4 min,最后用无菌水冲洗干净后用滤纸片对组织表面水分干燥后置于PDA培养基中,每个培养皿上均匀分布4块植物组织。于26 ℃恒温培养3 d,长出菌落后对边缘菌落继续纯化培养,生长5 d左右后对其进行镜检,对确认是致病的病原菌进行单孢分离,以获得纯培养物,并将纯化后菌种置于斜面PDA上,冷藏保存备用。
1.2.2 病原菌的形态学鉴定。
将获得纯化后的病原菌置于PDA培养基上生长5 d左右,观察菌落生长情况和菌丝生长情况,包括孢子形态、色素产生及菌丝形状与疏密程度并拍照记录。对病原菌进行形态学观察鉴定,初步明确目标病原的类型。
1.2.3 病原菌致病性测定。
对分离获得的病原菌在小麦合适生长条件下进行致病性的测定。挑取宁春50春小麦种子,播种至花盆当中,于温室培养。当小麦生长至三叶期时,将不同致病菌株分别接种至小麦幼苗上,后每经过2 d观察一次发病情况并浇水。接种方法采用针刺法,15 d后观察盆栽小麦发病情况。
1.2.4 病原菌的分子生物学鉴定。
采用Biospin真菌基因组DNA提取试剂盒对代表性菌株DNA进行提取,方法步骤见试剂盒说明书。将提取到不同菌株的DNA样品送至上海生工生物工程有限责任公司进行PCR扩增及基因序列测序,所有产物均采用双向测序。选取EF-1α序列上的一对基因位点对代表性菌株的DNA样品进行分子生物学鉴定。用于分子生物学鉴定的引物信息:
EF-1T 5′-ATGGGTAAGGAAGACAAGAC-3′,EF-2T 5′-GGAAGTACCAGTGATCATGTT-3′。
根据上海生工生物工程有限责任公司所反馈的测序拼接结果,并进行人工校对,然后于NCBI上进行BLAST比对,根据比对结果从GenBank数据库中下载同源性较高的序列,将在基因库中所下载的镰刀菌序列和试验中所测的镰刀菌序列,采用MEGA.7分析软件的邻接法构建基于EF-1α基因序列的系统发育树。
2 结果与分析
2.1 病原菌分离结果及形态学鉴定
通过对宁夏引黄灌区采集到的小麦茎基腐病病株进行分离,共获得87株菌株,对所获得菌株在PDA培养基上的培养形状的观察及分生孢子和厚垣孢子的显微观察,将其鉴定为两类镰刀菌,包括59株假禾谷镰刀菌和28株尖孢镰刀菌。
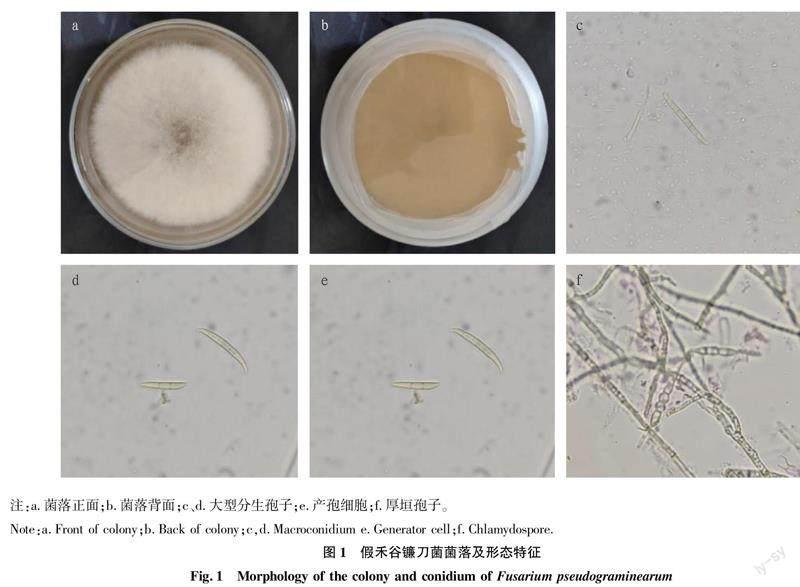
2.1.1 假禾谷镰刀菌(Fusarium pseudograminearum)。
PDA培养基上26 ℃培养5 d菌落直径为4.4~5.7 cm。气生菌丝为粉红色或者白色,绒状,可以产生深红色的色素、黄色色素或不产色素(图1a、b)。大型分生孢子较直。隔膜数为1~11个,大多数为5~6个,孢子大小为(45~91) μm×(2.8~5.5) μm,有明显足细胞,顶细胞弯曲(图1c、d)。随着培养时间的增加有厚垣孢子产生(图1f)。
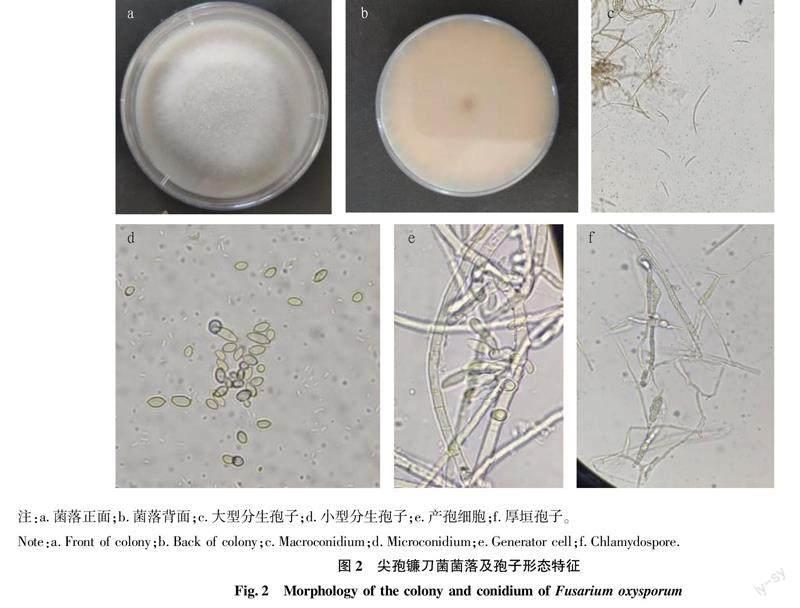
2.1.2 尖孢镰刀菌(Fusarium oxysporum)。
PDA培养基上25 ℃暗培养5 d,菌落直径为2.7~5.2 cm。气生菌丝呈棉絮状,初期为粉色,后期为白色与淡青莲色相间。移植次数增多,有退化现象,菌丝成束生紧贴管壁(图2a、b)。小型分生孢子数量较多,卵形,假头状着生,孢子大小为(5.0~12.6) μm×(2.5~3.6) μm(图2d)。大型分生孢子,美丽型,镰刀状,稍弯,向两端比较均匀地逐渐变尖,基孢足跟明显。隔膜数为1~6隔,孢子大小具体为1~2隔,(10~34)μm×(2.5~4.0) μm;3~4隔,(23.0~56.6) μm×5 μm;5~7隔,(31~60) μm×(3~6) μm(图2c)。容易形成厚垣孢子,多为球形,直径为6~8 μm,单生或顶生(图2f)。产孢细胞较短,单瓶梗。大小为(4.4~10.0) μm×(2.5~4.4) μm,在菌丝上直接长出或分生孢子座上成丛生状(图2e)。
2.2 致病性测定
以宁春50春小麦为试验材料,在室温条件下通过针刺茎基部的接种方法对不同镰刀菌菌株进行盆栽苗的致病性测定。结果表明,2种镰刀菌对小麦均具有致病力,可以引起小麦苗期发病,且对照组不发病(图3)。后依据柯赫氏法则,对接种发病的小麦苗进行分离纯化,通过形态学观察,同样将分离物鉴定为假禾谷镰刀菌(Fusarium pseudograminearum)和尖孢镰刀菌(Fusarium oxysporum)。符合柯赫氏法则,并选取4株代表性菌株进行分子生物学鉴定。
2.3 镰刀菌的分子生物学鉴定
选用镰刀菌特异性引物EF1/EF2对代表性的4种菌株(YNWH-A/B/C/E)进行PCR扩增后双向测通,将测序结果在NCBI上进行BLAST比对,根据比对结果从GenBank数据库中下载同源性在99%以上的序列,数据库中的EF-1α基因序列信息见表1。将下载的镰刀菌序列和试验所得序列采用比邻法构建基于EF-1α基因序列的系统发育树(图4)。结果表明,菌株编号为YNWH-B和YNWH-E的2种菌株与GenBank中登录号为MG670541.1的假禾谷镰刀菌聚在一起,支持率高达100%,所以将YNWH-B和YNWH-E这2株菌株鉴定为假禾谷镰刀菌,菌株编号为YNWH-A和YNWH-C的2种菌株与登录号为MH819256.1的尖孢鐮刀菌属于同一分支,将其鉴定为尖孢镰刀菌。结合形态学和分子生物学鉴定结果,确定宁夏地区小麦茎基腐病病原为假禾谷镰刀菌F.pseudograminearum和尖孢镰刀菌F.oxysporum。
3 讨论
小麦茎基腐病随着不同地区气候的不同,对小麦的生长表现出不同的影响程度,不同经纬度海拔地区小麦茎基腐病的病原组成也具有一定差异[14]。该试验的分子生物学鉴定采用镰刀菌特异性EF-1α基因序列构建系统发育树的分析方法,同时也证明形态学鉴定的准确性。结果从分离出的87株菌株中共鉴定出2类镰刀菌,尖孢镰刀菌(F.oxysporum)占其中32.2%,是致小麦茎基腐病发生的新兴菌种[3]。假禾谷镰刀菌(F.pseudograminearum)占其中67.8%,是小麦茎基腐病在宁夏地区发生的优势病原菌,这与塞尔维亚地区对该病害的鉴定结果一致,相关学者从该地区小麦茎基腐病上分离到这2种镰刀菌[3]。国内大部分相关学者同样印证了假禾谷镰刀菌作为小麦茎基腐病优势病原菌这一结论[6-9]。张向向[14]研究发现禾谷镰刀菌是南方地区寄生在小麦上的优势病原菌,这与该试验结果存在一定的差异,这可能与不同地区的海拔、经纬度及环境条件的差异相关[15-16]。
该试结果确定了假禾谷镰刀菌和尖孢镰刀菌是致使宁夏引黄灌区小麦茎基腐病发生的病原,丰富了宁夏地区对小麦茎基腐病的研究,为小麦茎基腐病的进一步研究和防治提供参考。
参考文献
[1] SHRESTHA S,POUDEL R S,ZHONG S B.Identification of fungal species associated with crown and root rots of wheat and evaluation of plant reactions to the pathogens in North Dakota[J].Plant disease,2021,105(11):3564-3572.
[2] 栾冬冬,贾吉玉,王光州,等.中国小麥茎基腐病的发生现状及防治策略[J].麦类作物学报,2022,42(4):512-520.
[3] JEVTIC′ R,STOSIC′ N,ZUPUNSKI V,et al.Variability of stem-base infestation and coexistence of Fusarium spp.causing crown rot of winter wheat in Serbia[J].The plant pathology journal,2019,35(6):553-563.
[4] MATNY O,SHAMSALLAH S,AL FAHAD M,et al.Genetic diversity study of Fusarium culmorum:Causal agent of wheat crown rot in Iraq[J].Journal of plant protection research,2019,59(2):206-213.
[5] MOYA-ELIZONDO E,ARISMENDI N,CASTRO M P,et al.Distribution and prevalence of crown rot pathogens affecting wheat crops in southern Chile[J].Chilean journal of agricultural research,2015,75(1):78-84.
[6] 李月娇,孙淑琴,霍建飞,等.小麦茎基腐病病原鉴定及其对杀菌剂的敏感性测定[J].山东农业科学,2022,54(3):112-118.
[7] 周锋,胡海燕,范玉闯,等.河南省小麦茎基腐病病原的鉴定及其对13种杀菌剂的敏感性测定[J].河南科技学院学报(自然科学版),2021,49(1):1-5,13.
[8] 孟程程,孙晓凤,张莉,等.山东省小麦茎基腐病的病原鉴定[J].山东农业大学学报(自然科学版),2019,50(5):753-757.
[9] 朱运启,靳鹏飞,王峭,等.陕西省小麦茎基腐病病原菌鉴定及其致病力分析[J].植物保护学报,2022,49(3):824-831.
[10] NARKIEWICZ-JODKO M,GIL Z,URBAN M.Stem base rot of winter wheat by Fusarium spp.-causes and effects[J].Acta agrobotanica,2012,58(2):319-328.
[11] 王宁堂,王军利.小麦茎基腐病的研究进展[J].贵州农业科学,2021,49(5):52-57.
[12] 周海峰,杨云,牛亚娟,等.小麦茎基腐病的发生动态与防治技术[J].河南农业科学,2014,43(5):114-117.
[13] 范学锋.中国小麦茎基腐病病原菌群体组成及遗传结构分析[D].北京:中国农业科学院,2021.
[14] 张向向.我国冬小麦主产省小麦茎基腐镰孢菌组成、地理分布及致病基因研究[D].南京:南京农业大学,2014:27-28.
[15] 吴斌,郭霞,张眉,等.鲁西南地区小麦茎基腐病病原菌鉴定及其致病力分析[J].麦类作物学报,2018,38(3):358-365.
[16] 赵利民,吕国强,何洋,等.河南省小麦茎基腐病发生现状及综合防控措施[J].中国植保导刊,2022,42(5):49-51.
基金项目 国家自然科学基金项目(31860352)。
作者简介 胡耀龙(1999—),男,宁夏银川人,硕士研究生,研究方向:植物病理学。
*通信作者,副教授,从事植物病理学研究。
收稿日期 2022-08-17;修回日期 2022-09-23

