河南省一例番鸭源小鹅瘟病毒株的鉴定及VP1基因序列分析
于静 张明宇 肖娜 辛长勋 马振乾



摘 要:为确定河南某鸭场发病番鸭的致病原因,采集该鸭场患病鸭的小肠组织病料作为检测样品,采用PCR的方法对病原进行检测分析,同时进行VP1 基因序列的测序比对。结果表明,该病原VP1基因与小鹅瘟病毒同源性最高,最高为99.8%,且位于进化树同一分支,而与经典番鸭细小病毒的同源性为81.4%~87.8%。因此,确定该病由小鹅瘟病毒引起。
关键词:番鸭;小鹅瘟;序列分析
中图分类号:S858.32 文献标识码:B 文章编号:1673-1085(2023)08-0054-05
小鹅瘟(Gosling plague)是由小鹅瘟病毒(Gosling plague virus,GPV)引起的一种急性或亚急性的败血性传染病。该病具有传播快、发病率高及致死率高等特点,给水禽生产造成巨大的经济损失。小鹅瘟病毒主要侵害30日龄以内的雏鹅或雏番鸭,而随着雏鹅或雏番鸭日龄的增大,其发病率及致死率会显著下降[1-3]。
GPV属于细小病毒科,在电镜下观察可见空壳和实心两种病毒粒子,无囊膜,二十面体对称,大小为20~22 nm。GPV有3种结构蛋白,分别是VP1、VP2、VP3,分子量分别是85 000、61 000、57 500 Da,其中VP3为主要结构蛋白[4-5]。1956年,方定一先生首次在我國扬州地区发现该病毒,1958年确定为小鹅瘟病毒[6]。本文通过对河南省某疑似发生小鹅瘟鸭场采集到的病料进行病毒分离鉴定,确诊为小鹅瘟病毒,随后对VP1基因序列进行分析,以期为小鹅瘟疫苗的研发提供进一步的信息支持。
1 材料与方法
1.1 病料来源
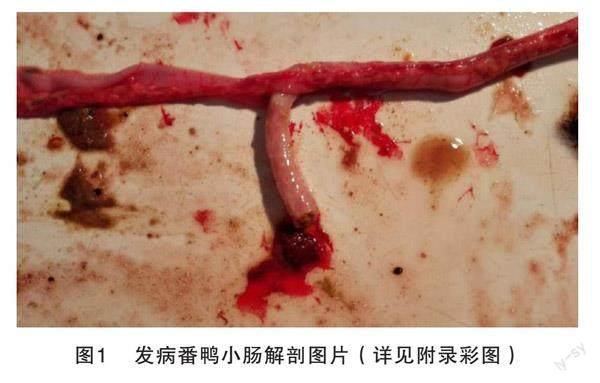
河南某鸭场病鸭出现拉稀现象,伴有墨绿色粪便和灰白色水样粪便,饮水量增加,有明显的呼吸道症状,精神沉郁,解剖发现该番鸭出现小肠栓塞及肝脏包膜等典型临床症状,见图1。采集疑似感染小鹅瘟番鸭的小肠样品作为待检病料。
1.2 试剂
DNA提取试剂盒购自杭州博日科技股份有限公司;Taq DNA聚合酶、dNTP、琼脂糖购自生工生物工程(上海)股份有限公司。
1.3 引物设计合成
根据GenBank上已发表的GPV SYG61v(登录号: KC996729)、VG32/1(登录号:EU583392)等病毒株的基因序列,应用Primer premier 5软件在VP1基因内部设计并合成一对引物(表1),该引物可同时扩增出经典小鹅瘟、新型小鹅瘟、经典番鸭细小病毒及新型番鸭细小病毒的VP1基因片段,引物由生工生物工程(上海)股份有限公司合成。
1.4 病料处理
将番鸭小肠组织样品加入PBS缓冲液充分研磨成悬浊液,反复冻融3次,10 000 r/min离心4min,取上清,经0.22 μm滤器过滤。使用NDA提取试剂盒按说明书中的步骤从样品中提取总DNA。
1.5 PCR检测
采用表1中的引物进行PCR扩增反应,反应体系按照说明书制备,即:10×PCR缓冲液 5 μL,Mg2+(25 mM)3 μL,dNTP(10 mM)1 μL,Taq DNA聚合酶(5 U/μL)1 μL,cDNA模板 1 μL,上下游引物各2 μL,用ddH2O补齐至50 μL。PCR运行程序为:95 ℃ 5 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,共30个循环,72 ℃延伸10 min。ddH2O作为阴性对照,同时用实验室其他水禽常见病毒检测引物对待检样品进行PCR扩增鉴定,将PCR产物进行1%琼脂糖凝胶电泳。
1.6 PCR产物测序及序列分析
将PCR产物由生工生物工程(上海)股份有限公司测序,序列与GenBank下载的GPV参考毒株(表2)进行序列比对和分析。
2 结果
2.1 分离毒的PCR检测结果
以疑似感染病料上清液为模板,GPV VP1-F/ GPV VP1-R为引物进行PCR扩增,同时用实验室其他水禽常见病毒检测引物进行PCR检测,将产物经过凝胶电泳检测后,结果显示,检测样品扩增产物的电泳条带与小鹅瘟病毒阳性对照一致,约为1 000 bp,阴性对照未见任何非特异扩增(图2),表明分离的病毒为GPV。
2.2 分离毒VP1序列分析
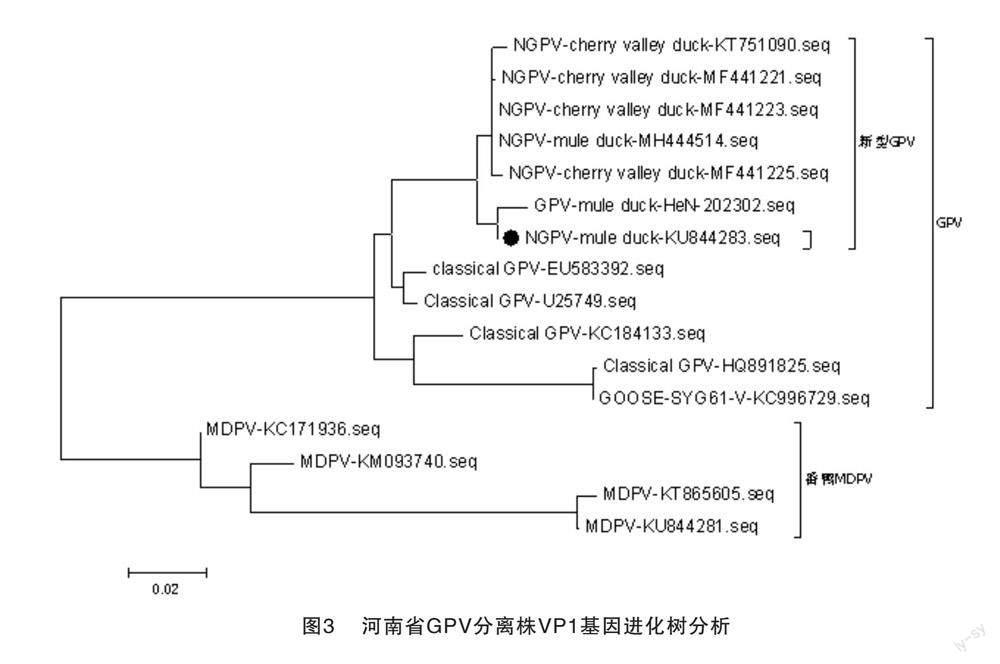
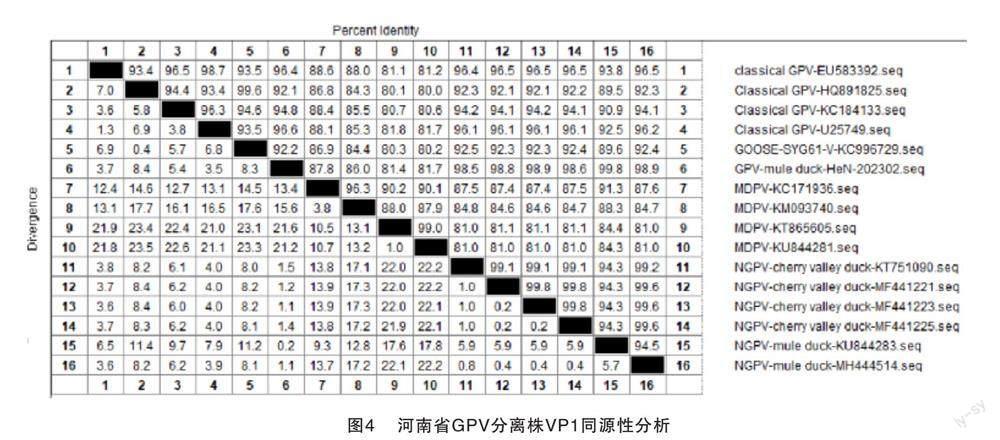
将从病料中分离毒株的VP1基因与从GenBank上下载的小鹅瘟及经典番鸭细小病毒毒VP1进行基因比对。结果显示,该测序序列与新型小鹅瘟同源性最高,为98.5%~99.8%,位于同一分支,而与经典番鸭细小病毒的同源性为81.4%~87.8%,结果见图3和图4。
3 讨论
实验室检测对于小鹅瘟的临床诊断及病原研究非常重要。近些年,分子生物学技术在兽用疾病临床诊断方面发挥重要作用,PCR快速检测方法省时省力,已经成为小鹅瘟临床诊断常用的检测方式。童艳梅等[7]为了提高小鹅瘟病毒PCR检测的检出率,根据已有的小鹅瘟病毒基因序列,设计合成了一对特异性引物,并进行了优化,其优化后的PCR方法特异性强、敏感性高,反应时间明显缩短。
近些年小鹅瘟时有发生,在福建、广东、江苏、山东、吉林等地区[8-14]均有报道。该病毒基因组变异较小,20世纪分离的毒株SYG61与今年分离的毒株间同源性很高,与本实验室分离的毒株同源性为92.2%。无论是在国内不同区域分离到的毒株,还是国内与国外分离到的毒株间同源性均较高,无论非结构蛋白还是结构蛋白编码基因核苷酸序列一致性均达到90.0%以上。
本实验室从河南省某鸭场分离得到的一株细小病毒,结果显示该病毒为小鹅瘟。对其进行VP1基因序列测定显示,该毒株与新型小鹅瘟同源性为98.5%~99.8%,而与经典鸭细小病毒的同源性为81.4%~87.8%。因此该毒株为番鸭源鹅细小病毒,即新型小鹅瘟,并证实了GPV对鸭场的污染。临床上使用我国最早分离毒株SYG61研发的疫苗对小鹅瘟仍有良好的免疫保护效果。
参考文献:
[1] 王劭,肖世峰,程晓霞,等.番鸭小鹅瘟病毒感染诱导细胞自噬[J].中国兽医学报,2022, 42(9):1790-1797.
[2] Chen Z Y, Li C F, Zhu Y Q, et al. Immunogenicity of virus-like particles containing modified goose parvovirus VP2 protein[J]. Virus Research, 2012, 169(1):306-309.
[3] 孟繁兴,董浩,胡桂学.鹅细小病毒分子生物学的研究新进展[J].黑龙江畜牧兽医, 2015(23):65-67.
[4] 江丹丹,林锋强,程晓霞,等.小鹅瘟病毒的分离鉴定及遗传变异分析[J].中国兽医杂志,2021, 57(09):27-31.
[5] 李书光,张伟,程立坤,等. 我国鹅细小病毒研究进展[J].中国家禽, 2017, 39(18):50-54.
[6] 刘佳佳,苏晓娜,王占新,等. 广东地区小鹅瘟病毒分离鉴定及全基因序列的测定分析[J].中国兽医杂志, 2018, 54(08):21-24.
[7] 童艳梅,李娴妍,陈义旺,等.小鹅瘟病毒PCR检测条件的优化[J].黑龙江畜牧兽医, 2018(15):139-141.
[8] 王劭,程晓霞,陈少莺,等.番鸭小鹅瘟病毒PT分离株全长DNA克隆的构建[J].中国兽医学报,2015, 35(07):1064-1068.
[9] 范娟,钱钟,刘秀梵.一株小鹅瘟病毒的生物学特性分析[J].中国家禽, 2017, 39(07):67-70.
[10]卢松岩,邢程,阮洪玲,等.一株小鹅瘟病毒的分离鉴定、全基因测序及复方中草药抗病毒效果研究[J]黑龍江畜牧兽医,2021(14):64-68+152.
[11]金光秋,宫福军,常帅,等.小鹅瘟的流行与净化[J].吉林畜牧兽医,2020, 41(12):64+66.
[12]李书光,王艳,刘吉山,等.山东省小鹅瘟病毒BZ株的分离鉴定及VP3基因的序列分析[J].黑龙江畜牧兽医, 2010, 21(23):114-115.
[13]邵周伍林,李晨曦,刘明,等.鹅细小病毒YG株的鉴定及在器官中的分布[J].中国兽医科学, 2015, 45(09):912-917.
[14]刘伟, 程晓霞, 陈少莺. 番鸭源小鹅瘟病毒和番鸭细小病毒的结构蛋白及其抗原性[J].福建农林大学学报(自然科学版), 2015, 44(01):64-68.
Identification of a Muscovy Goose Plague Virus Strain and Sequence Analysis of VP1 Gene from Muscovy Duck in Henan Province
YU Jing1, ZHANG Mingyu1,XIAO Na1,XIN Changxun1, MA Zhenqian2*
(1.Qingdao Ruier Weite Biotechnology Co., Ltd., Qingdao 266000, China;
2.Qingdao Yebio Biotechnology Co., Ltd., Qingdao 266000, China)
Abstract: In order to determine the pathogenesis of sick Muscovy ducks in a muscovy duck farm in Henan Province, the samples of small intestine tissues of sick ducks were collected and the pathogen was detected by PCR. Then the VP1 gene sequence was sequenced and compared. The results showed that the VP1 gene had the highest homology (99.8%) with Gosling plague virus and located in the same branch of the phylogenetic tree. The homology of VP1 gene with classical Muscovy duck parvovirus was 81.4% ~ 87.8% . Therefore, it was confirmed that the disease was caused by Gosling plague virus.
Keywords: Muscovy duck; Goose plague; Sequence analysis