铜胁迫下吊兰的生理响应及对铜的吸收特性*
谢晓霄,徐 劼,方学雷,温豪骏
(嘉兴学院生物与化学工程学院,浙江 嘉兴 314001)
由人类生产、生活所引发的环境重金属污染问题,已成为全球关注的热点环境问题之一[1]。重金属作为一类有害物质,能借助在环境中的迁移、转化及在生物圈的蓄积对动植物产生毒害作用并最终通过食物链对人体健康构成潜在威胁[2]。植物修复技术是借助植物的吸收作用来去除环境中污染物的一种环境友好型的原位处理技术[3]。在相关实验研究中,通常会选用水培法来评价植物对重金属的耐性及吸收累积特性。
观赏植物应用于重金属污染环境的修复,一方面不会对环境造成二次污染,另一方面也不会因食物链而危及人体健康,因此在近年来得到了人们的广泛关注。吊兰属于百合科吊兰属,为常见观赏植物,具有环境适应生存能力强、易栽培等特点。本研究以吊兰为实验对象,通过水培实验探究铜胁迫下吊兰的生理响应及对铜的吸收特性。研究结论能为重金属铜污染地区的环境治理与修复提供参考依据。
1 实 验
1.1 试剂与仪器
试剂:硫酸铜、硝酸、盐酸、高氯酸、三氯乙酸、2-硫代巴比妥酸、无水乙醇、丙酮。以上试剂均为分析纯,购置于上海国药集团化学试剂有限公司。
仪器:FA1204B型电子天平,上海精科天美科学仪器有限公司;TU-1810型紫外可见分光光度计,北京普析通用仪器有限责任公司;TDZ5-WS台式低速离心机,湘仪离心机仪器有限公司;JC-FW-100植物粉碎机,青岛聚创嘉恒分析仪器有限公司;DHG-9140A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;iCE 3500型原子吸收分光光度计,赛默飞世尔科技公司。
1.2 实验方法
采用实验室水培开展,新购买的吊兰幼苗于空白营养液中预培养3周(营养液配方参照文献配制[4]),当根系达到一定长度后开始Cu2+胁迫(CuSO4)处理。选取长势一致的吊兰幼苗作为后续实验对象,Cu2+胁迫实验共设置4个处理组,水培营养液中Cu2+的浓度分别为0 mg/L、15 mg/L、30 mg/L和60 mg/L。每5 d更换1次营养液,培养周期为25 d。每个实验处理均设三组平行,所有实验结果均为三组平行实验结果的平均值。
1.3 测定指标与方法
1.3.1 生理特性指标
吊兰叶片中叶绿素含量的测定参照乙醇-丙酮提取法测定[5]:称取各实验处理组经洗净、剪碎的新鲜吊兰叶片0.1 g于比色管中,随后加入10 mL丙酮∶乙醇(1∶1体积)混合液于暗处放置24 h后,最后提取液在波长663 nm、645 nm下利用分光光度计测定吸光度,以1∶1丙酮-乙醇混合液为空白,最后计算叶片中叶绿素的含量。
吊兰根和叶片组织中丙二醛含量的测定采用硫代巴比妥酸比色法[6]:称取实验各处理组吊兰根或叶片组织样品1 g于研钵中。随后加入2 mL 10%三氯乙酸和少量石英砂,研磨至匀浆后再加8 mL三氯乙酸进一步研磨后进行离心(4000 r/min 10 min)处理。取离心上清液2 mL(对照为2 mL去离子水),加入2 mL 0.6% 硫代巴比妥酸溶液,混匀物于沸水浴上加热反应15 min,迅速冷却后再离心。最后取上清液,分别于532 nm、600 nm和450 nm波长下的吸光度,根据公式计算吊兰根和叶片组织中丙二醛的含量。
1.3.2 吊兰根和叶片组织中铜含量的测定
Cu2+胁迫处理实验结束后,将不同Cu2+胁迫处理组吊兰根和叶分别洗净并烘干处理。称取烘干的吊兰根或叶片组织样品0.1 g于150 mL三角瓶中,利用HNO3-HCl-HClO4法消解完全[7];1% HNO3定容后利用原子吸收光谱仪测定并根据公式计算吊兰根和叶片组织中的铜含量水平。
2 结果与讨论
2.1 铜胁迫对吊兰叶片叶绿素含量变化的影响
叶绿素是植物进行光合作用的物质基础,其在对光能的吸收及转化过程中作用巨大,因而其含量变化是反映植物光合作用正常与否的关键指标[8]。在不同Cu2+浓度胁迫处理的第5 d、10 d、15 d、20 d和25 d,对吊兰叶片叶绿素含量水平进行了测定,实验结果如图1所示。
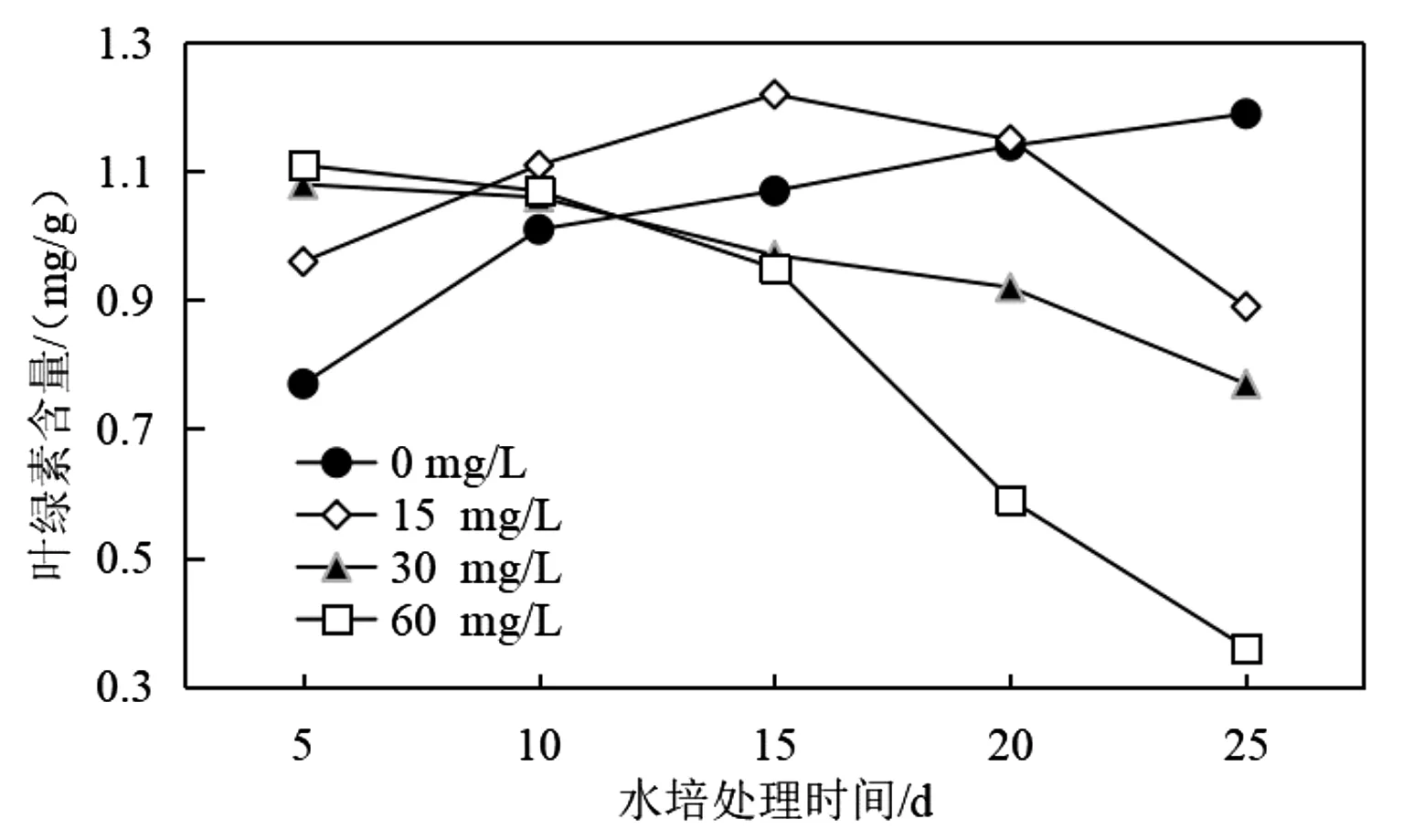
图1 铜胁迫对吊兰叶片叶绿素含量变化的影响Fig.1 Effects of copper stress on chlorophyll content in Chlorophytum leaves
从图1可以看出不同Cu2+浓度胁迫对吊兰叶片叶绿素含量随培养时间的变化存在不同的影响。当水培液中不含Cu2+时,随着培养时间的延长吊兰叶片中叶绿素的含量增加明显,与培养第5 d的数据相比,在培养的第25 d吊兰叶片叶绿素的含量水平增加了54.54%。当水培液中Cu2+的浓度为15 mg/L时,随着培养时间的延长吊兰叶片叶绿素含量呈现先增大后降低的变化趋势,在水培的第15 d叶绿素含量水平最高(1.22 mg/g),这说明在短期内低浓度的Cu2+胁迫对吊兰的光合过程存在促进作用。铜是植物生长的必需元素之一,因而体系中适量铜的存在对吊兰的生长起到了一定的促进作用。但相关研究也表明体系中过量铜的存在会造成植物叶色色失绿,并最终影响植物生长[9]。本实验研究也观察到类似结果,当水培液中Cu2+浓度进一步增大(30 mg/L和60 mg/L),随着培养时间的延长Cu2+胁迫导致叶片叶绿素含量呈明显下降趋势;与培养第5 d的数据相比,在培养的第25 d吊兰叶片叶绿素的含量水平分别降低了36.70%(30 mg/L)和67.57%(60 mg/L);这说明高浓度的Cu2+胁迫对吊兰光合过程存在明显的抑制作用。研究认为这主要是源于体系中过量存在的Cu2+会与诸如8-氨基乙酰丙酸合成酶、原叶绿素酸酯还原酶和胆色素原脱氨酶的-SH结合,使得这些在叶绿素合成过程中起关键作用的酶因结构发生改变而失效[10]。也有研究表明体系中过量存在的Cu2+会对叶片细胞中的叶绿体结构直接产生破坏作用,从而导致叶绿素含量的降低[9]。
2.2 铜胁迫对吊兰根和叶组织中丙二醛含量变化的影响
本实验在不同Cu2+浓度胁迫处理的第5 d、10 d、第15 d、第20 d和第25 d,对吊兰根和叶组织中丙二醛的含量水平进行了测定,实验结果如图2和图3所示。
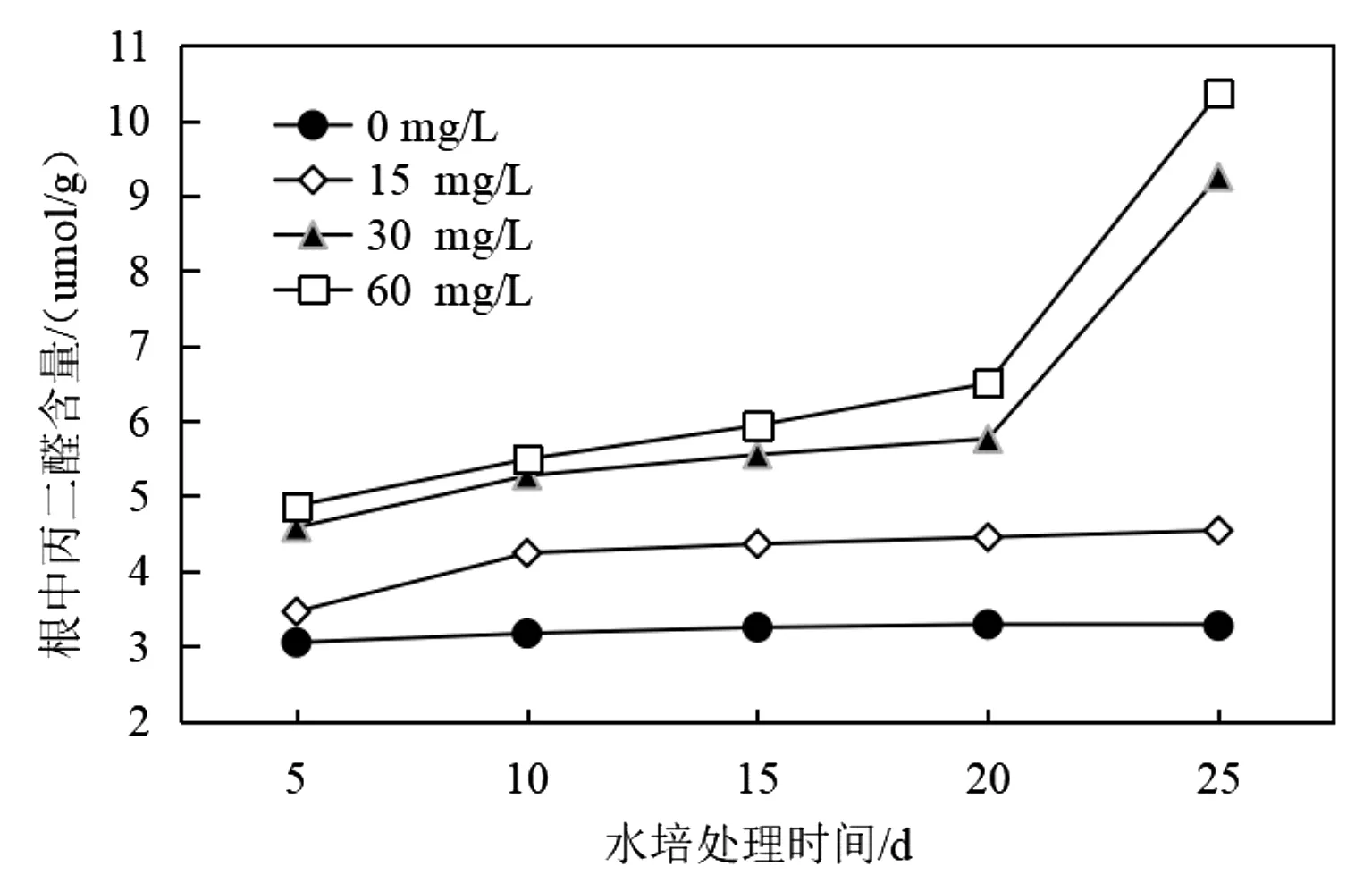
图2 铜胁迫对吊兰根组织中丙二醛含量变化的影响Fig.2 Effect of copper stress on malondialdehyde content in Chlorophytum root
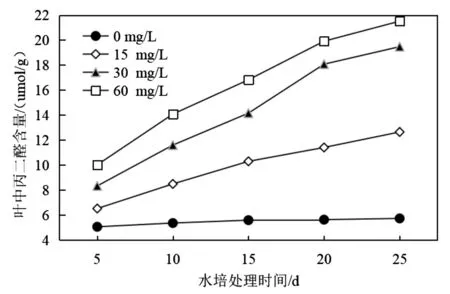
图3 铜胁迫对吊兰叶片组织中丙二醛含量变化的影响Fig.3 Effects of copper stress on malondialdehyde content in Chlorophytum leaves
在污染环境下,存在于植物器官组织细胞膜中的不饱和脂肪酸会在氧自由基的氧化作用下反应生成丙二醛,其结果是由于细胞质膜的氧化损伤而导致其选择性功能弱化及丧失[11]。因此在逆境胁迫环境下,植物器官组织细胞膜的氧化及变性程度强弱可用其组织细胞中丙二醛含量的多寡来评判[12]。由图2数据可以看出,空白对照处理组(Cu2+浓度为0 mg/L)中随着水培时间的延长,吊兰根组织中的丙二醛含量变化不明显(3.05~3.29 μmol/g),说明在正常水培条件下吊兰根系组织能正常生长。当水培液体系中添加了Cu2+后,由于Cu2+的胁迫作用使得根系组织中丙二醛的含量增加,并且表现为60 mg/L>30 mg/L>15 mg/L。水培前期(<20 d),在各Cu2+添加水平条件下,吊兰根系组织中丙二醛含量增加不明显;但培养后期(>20 d),在高Cu2+添加水平条件下(30 mg/L和60 mg/L),吊兰根系组织中丙二醛含量增加明显。这说明随着培养时间的延长,高浓度Cu2+胁迫对吊兰根系组织的毒性作用更加明显。
由图3数据可以看出,当Cu2+浓度为0 mg/L时,吊兰处于正常生长状态因而叶片组织中丙二醛含量波动不大(5.05~5.72 μmol/g)。当水培液体系中添加了Cu2+后,随着水培过程的进行,吊兰根系吸收的Cu2+会转运至叶部。可以很明显的看出,由于Cu2+的胁迫作用使得吊兰叶片组织中丙二醛的含量显著增加,同样表现为60 mg/L>30 mg/L>15 mg/L。而且在各Cu2+添加水平条件下,一方面叶片组织中的丙二醛含量水平均高于根组织中的含量(图2);另一方面,在整个水培实验阶段吊兰叶片组织中丙二醛的含量均随着培养时间的延长而不断增大。这说明在相同浓度Cu2+水培条件下,吊兰叶片组织对Cu2+胁迫作用的响应敏感性高于根系组织。
2.3 不同铜浓度处理对吊兰根和叶Cu含量的影响
Cu2+胁迫处理实验结束后,将不同胁迫处理组吊兰根和叶组织中的铜含量水平进行了测定,实验结果如图4所示。从图4可以看出,在同一Cu2+浓度胁迫条件下,吊兰根组织中的铜含量水平均明显高于叶片组织。随着Cu2+浓度的增大,根组织中铜的含量水平也显著增高;而三个Cu2+浓度胁迫水平下,吊兰叶片组织中的含量水平则变化不明显。这说明对于吊兰而言,根系是外界铜蓄积的主要器官组织,吊兰根系吸收的铜向地上部的转运有限,从而尽可能的减少对植株地上部的毒害作用。
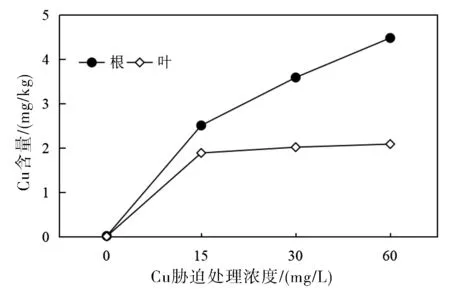
图4 不同Cu2+浓度处理条件下吊兰根和叶部铜含量的变化Fig.4 Changes of copper content in roots and leaves of Chlorophytum under copper stress
植物种类不同,根系吸收的铜向地上部转移的能力也存在较大差异。如研究发现对大多数植物物种而言铜富集能力最强的是根系组织,而叶片对铜的富集能力最弱,这是植物对铜胁迫的一种适应性表现[13-16]。这与本实验研究结论相一致。当然某些植物因体内存在一些特殊的转运蛋白或特定的可溶性Cu伴侣,因而可将根系吸收的铜向植株地上部转运并输送至叶片组织[17]。如研究发现铜胁迫环境下,向日葵幼苗地上部的最高铜含量水平可以是根系组织含量水平的4倍[18]。
3 结 论
以吊兰为实验对象,采用水培法研究了不同浓度Cu2+胁迫对吊兰光合作用、根和叶组织中丙二醛含量变化的影响及吊兰对铜的吸收特性。实验结果表明:短期内低浓度Cu2+胁迫(15 mg/L)对吊兰的光合过程存在促进作用,高浓度Cu2+胁迫(30 mg/L和60 mg/L)对吊兰光合过程存在明显抑制作用;由于Cu2+的胁迫作用使得吊兰根、叶片组织中丙二醛的含量显著增加,并且随着培养时间的延长高浓度Cu2+胁迫作用对吊兰根系组织的毒性作用更加明显;在相同浓度Cu2+水培条件下,吊兰叶片组织对Cu2+胁迫作用的响应敏感性高于根系组织;不同浓度Cu2+胁迫条件下,吊兰根组织中的铜含量水平均明显高于叶片组织,并且随着Cu2+浓度的增大,根组织中铜的含量水平也显著增高,而叶片组织中的铜含量水平则变化不明显。

