基于AMPK/SREBP-1c分子通路的山楂原花青素调控脂质代谢机制
宓 伟,于 敏,李 宁,石塔拉,陈彩云,*
(1.滨州医学院公共卫生与管理学院,山东 烟台 264003;2.滨州医学院药学院,山东 烟台 264003)
血脂异常俗称高脂血症,是一种以血清甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平升高,或伴有高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平降低的代谢性疾病,是诱发心脑血管疾病的主要因素[1]。2020年中国居民营养与慢性病状况报告指出,我国成年人血脂异常的总患病率为40.40%,其中低密度脂蛋白血症患病率最高,为33.90%,这将导致2010—2030年间我国心血管疾病患者增加约920万 人[2]。他汀类、贝特类、烟酸类药物等是治疗高脂血症疗效确切的西药,但肝功能异常、横纹肌溶解症等副作用较多[3-5]。山楂原花青素(hawthorn procyanidins,HPC)是由表儿茶素和儿茶素缩合而成的一种来源于山楂的低聚体多酚化合物,山楂鲜果中原花青素的含量高达4 mg/g,其抗氧化活性远高于来源于葡萄籽、松树皮等的高聚体原花青素,HPC可用乙醇溶剂萃取法、大孔吸附树脂层析法等提取和纯化,已被充分开发应用于食品、药品和化妆品工业[6]。本课题组前期研究表明,HPC具有良好的抗肿瘤[7]、抗氧化[8]等生物活性,经体内外质量评价已明确其有效的药效浓度范围。
作为脂质代谢的调控中枢,经活化的AMP激活蛋白激酶(AMP-activiated protein kinase,AMPK)直接磷酸化固醇调节元件结合蛋白(sterol regulatory element binding protein-1c,SREBP-1c),促使甘油-3-磷酸酰基转移酶(glycerol-3-phosphate acyltransferase,GPAT)磷酸化失活,使其下游的乙酰辅酶羧化酶(acetyl CoA carboxylase,ACC)和脂肪酸合成酶(fatty acid synthese,FAS)表达量降低,肉毒碱棕榈酰基转移酶(carnitine palmitoyltransterase-1,CPT-1)和过氧化物酶体增殖物激活受体γ辅助激活因子1α(peroxisome proliferator activated receptor γ coactivator-1α,PGC-1α)活性增强,从而加速脂肪酸氧化分解,抑制脂质合成[9-13]。本研究采用高脂膳食诱导动物模型,以非诺贝特为阳性对照,探讨HPC靶向作用于AMPK/SREBP-1c分子信号通路调控脂质代谢的机制,为高脂血症防治、寻找靶向天然植物药提供实验依据。
1 材料与方法
1.1 动物、材料与试剂
S P F 级S D 雄性大鼠6 0 只,8 周龄,体质量240~290 g,购自山东弘立医学动物实验研究有限公司,生产许可证号SCKX(鲁)2021-0005。在无特定病原的条件下基础饲料适应性喂养1 周后用于实验。本研究得到滨州医学院动物伦理学委员会的批准(202108-005)。
基础饲料、高脂饲料(MCD002)均由江苏美迪森生物医药有限公司提供,总热量比为23.0 kJ/g,脂肪、碳水化合物和蛋白质供能比分别为45.7%、35.8%、18.5%。
HPC(聚合度≥99%,批号:20200420) 杭州绿盛生物技术有限公司;非诺贝特胶囊(规格100 mg/粒,批号H44021454) 广东华南药业集团有限公司;TG、TC、LDL-C和HDL-C试剂盒(货号分别为20200201、20200104、20200308、20200509) 南京建成生物工程研究所;高效化学发光(efficient chemiluminescence,ECL)显色试剂盒、聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、RNA提取试剂盒(货号分别为36208ES60、20201ES76、19221ES08)翌圣生物科技(上海)股份有限公司;高效RIPA裂解液、苏木精-伊红(hematoxylin eosin,HE)染色试剂盒(货号分别为R0010、G1120) 北京索莱宝科技有限公司;AMPK抗体、SREBP-1c抗体、GPAT1抗体、ACC抗体、FAS抗体、CPT1抗体和PGC-1α抗体(货号分别为ab32047、ab133125、ab0059、ab185901、ab133619、ab189181、ab145641) 英国Abcam公司;phospho-AMPK(Thr172)抗体、GAPDH抗体、二抗羊抗兔IgG(货号分别为AA393、AF006、AS118) 上海碧云天生物技术有限公司。
1.2 仪器与设备
RG2000荧光实时定量聚合酶链式反应(polymerase chain reaction,PCR) 澳大利亚Corbett公司;电泳转膜仪 美国Bio-Rad公司;Alphalmager HP凝胶成像分析系统 美国Alpha Innotech公司;BX-26荧光显微镜日本Olympus公司;Varioskan LUX多功能酶标仪美国Thermo Fisher Scientific公司;TDL-40B台式离心机、DYY-12型凝胶电泳仪 北京六一仪器厂。
1.3 方法
1.3.1 实验分组和给药
采用随机数字表法将大鼠分为空白对照组(blank control group,BCG),高脂血症模型组(hyperlipidemia m o d e l g r o u p,H M G),H P C 低、中、高剂量组(HPC-low-, medium- and high-dose groups,HPCLDG、HPC-MDG、HPC-HDG)、非诺贝特阳性对照组(fenofibrate positive group,FPG),每组10 只。非诺贝特胶囊临用前配制成4 mg/mL药液。根据本课题组前期研究,称取适量HPC以无水乙醇溶解,加入0.5%(质量分数,下同)生理盐水(normal saline,NS)分别配制成质量浓度为14、28、56 μg/mL的低、中、高剂量HPC溶液[14]。
BCG大鼠用基础饲料(玉米73.5%(质量分数,下同)、麦麸20%、鱼粉5%、谷粉1%、食盐0.5%)喂养,其余各组用高脂饲料(普通饲料78.8%、胆固醇1%、牛胆盐0.2%、蛋黄粉10%、猪油10%)喂养。BCG和HMG大鼠以0.5% NS 0.02 g/(kgmb·d)灌胃。根据人体和大鼠体表面积换算,HPC低、中、高剂量组大鼠分别以HPC溶液0.14、0.28、0.56 g/(kgmb·d)灌胃。FPG大鼠以非诺贝特药液0.04 g/(kgmb·d)灌胃。各给药组高脂饲料喂养的同时每天上午9∶00—9∶30灌胃给药1 次,BCG和HMG同时间以0.5% NS灌胃1 次,连续给药7 周。实验期间观察大鼠的一般情况、饮食情况和精神状态,每周称量大鼠体质量并记录。给药结束后大鼠眼眶取静脉血分离血清,通过TG、TC、LDL-C和HDL-C水平判断高脂血症模型是否制备成功。
1.3.2 肝脏指数、血清及肝脏脂质浓度检测
实验结束后,肌肉注射3 mL/kgmb20%氨基甲酸乙酯麻醉大鼠,用分析天平秤量大鼠体质量,分离肝脏并称量肝质量,取大鼠部分肝脏,称质量后按下式计算肝脏指数。然后于大鼠腹主动脉取血,室温静置30 min,离心机4 000 r/min离心10 min取上层血清;摘取大鼠肝脏,选择距肝边缘0.5 cm处相同部位的肝右叶组织,4 ℃下加入0.5% NS制成肝匀浆,按照试剂盒方法检测大鼠血清和肝匀浆中TG、TC、LDL-C和HDL-C的浓度。
1.3.3 肝脏组织病理观察
取部分肝组织,采用体积分数10%的中性甲醛溶液固定标本,常规脱水、石蜡包埋,切片机连续切3 μm切片,HE染色,光学显微镜下观察肝脏组织病理学变化。大鼠肝脏组织病理变化由脂肪细胞空泡所占面积与总细胞所占面积之比计算。
1.3.4 大鼠肝脏组织相关指标mRNA相对表达量检测
取部分肝脏组织,分别装于不同冷冻管,置于液氮中速冻后于超低温冰箱冷冻备用。按试剂盒说明书提取肝脏组织总RNA并合成cDNA,并选择GAPDH作为内参,通过熔解曲线分析产物的特异性。本研究自行设计的AMPK、SREBP-1c、GPAT1、ACC、FAS、CPT-1和PGC-1α引物序列见表1。
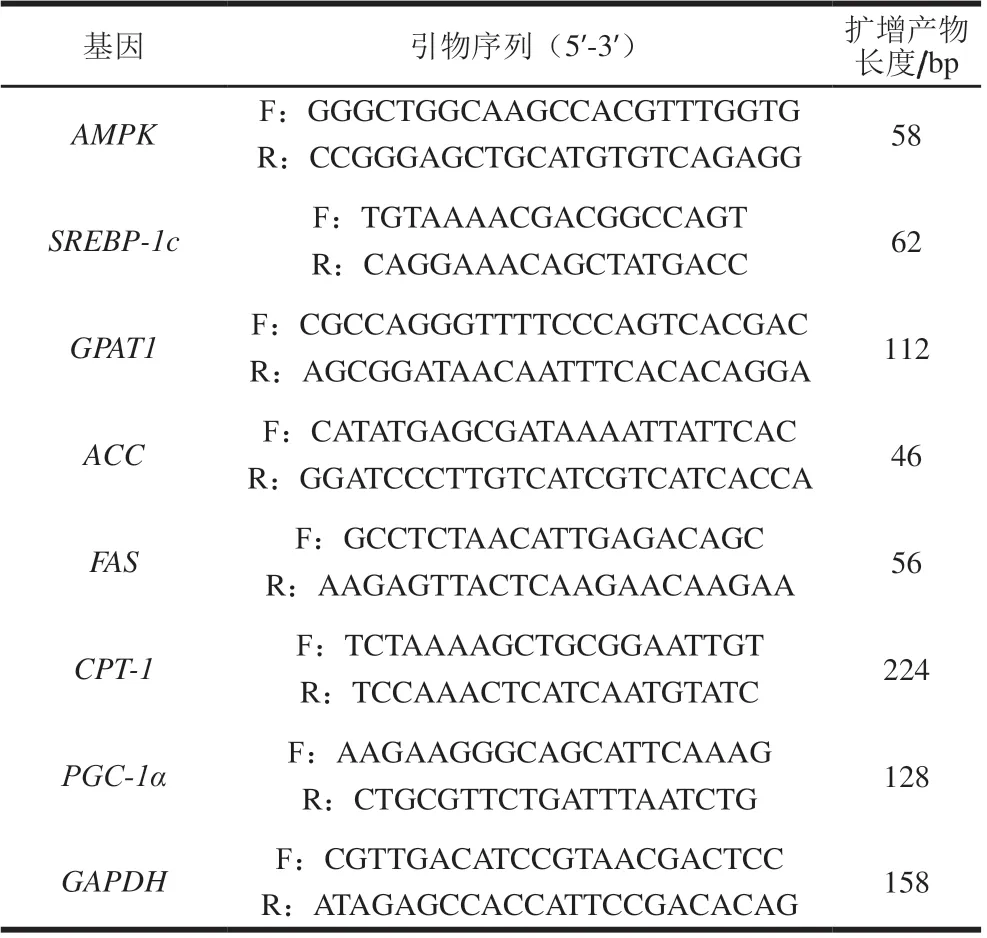
表1 引物序列表Table 1 Primer sequences used in this study
1.3.5 大鼠肝脏相关指标蛋白相对表达量检测(Western blot法)
取各组大鼠肝组织,用BCA法检测RIPA裂解液提取的蛋白浓度。在提取蛋白液中加入6%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)缓冲液,沸水变性5 min,SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gelelectrophoresis,PAGE)后湿移至聚偏二氟乙烯膜上,37 ℃封闭2 h,依次加入AMPK、p-AMPK、SREBP-1c、GPAT1、ACC、FAS、CPT1和PGC-1α 4 ℃过夜,漂洗后加辣根过氧化物酶标记的二抗,室温反应2 h,滴加ECL试剂进行检测,并选择GAPDH作为内参,采用Quantity One软件扫描各条带,获取目的蛋白灰度值。
1.4 数据处理与分析
采用SPSS 23.0软件进行数据的统计分析,用±s表示;摄食量的变化采用重复测量方差分析;两组间比较采用t检验,多组间采用单因素方差分析,有统计学意义的再采用两两比较的q检验,以P<0.05表示差异显著。
2 结果与分析
2.1 HPC对高脂血症大鼠脂质代谢的影响
2.1.1 各组大鼠的一般情况
实验中大鼠无死亡,BCG大鼠皮肤光洁,一般状况和精神状态良好。HMG大鼠毛色暗淡,不爱动,饮食饮水量增加,大便小便增多,体质量明显增加。HPCMDG、HPC-HDG和FPG大鼠一般情况和精神状态均有所改善,HPC-HDG的效果接近FPG。
如图1所示,BCG大鼠摄食量总体趋于平稳,与BCG比较,HMG大鼠摄食量极显著增高(P<0.01);与HMG比较,HPC各剂量组和FPG大鼠摄食量有所下降,且HPC-HDG和FPG大鼠摄食量极显著下降(P<0.01),表明高剂量HPC能有效改善高脂血症大鼠的摄食量。
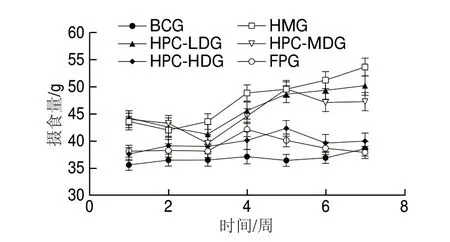
图1 各组大鼠摄食量的变化(n=10)Fig.1 Changes in food intake of rats from all groups (n = 10)
2.1.2 各组大鼠的体质量、肝质量和肝指数变化
如表2所示,造模7 周后,与BCG比较,HMG大鼠体质量、肝质量和肝脏指数均显著升高(P<0.05)。与HMG比较,HPC-MDG、HPC-HDG和FPG大鼠体质量、肝质量和肝脏指数均有不同程度降低(P<0.05)。说明HPC能够降低高脂血症大鼠的体质量、肝质量和肝脏指数,高剂量HPC效果更明显。
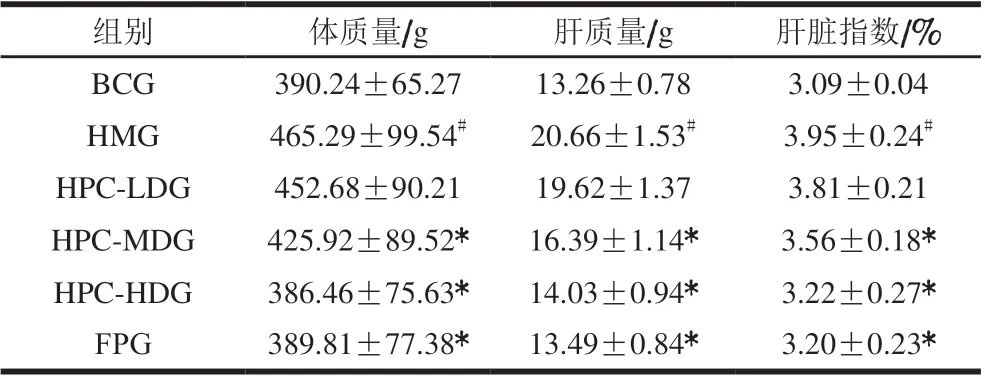
表2 各组大鼠体质量、肝质量和肝脏指数的比较(n=10)Table 2 Comparison of body mass, liver mass and liver index of rats from all groups (n = 10)
2.1.3 各组大鼠血清脂质浓度的变化
如表3所示,与BCG比较,HMG大鼠血清TG、TC和LDL-C浓度均极显著升高,HDL-C浓度极显著下降(P<0.01)。与HMG比较,HPC-HDG和FPG大鼠血清TG、TC和LDL-C浓度极显著下降,HDL-C浓度极显著升高(P<0.01),且HPC对大鼠血清中脂质浓度的影响有一定的剂量依赖性,说明HPC能降低高脂血症大鼠血清中的TG、TC、和LDL-C浓度,提高HDL-C浓度,使其各项异常指标恢复正常,改善大鼠血脂紊乱。
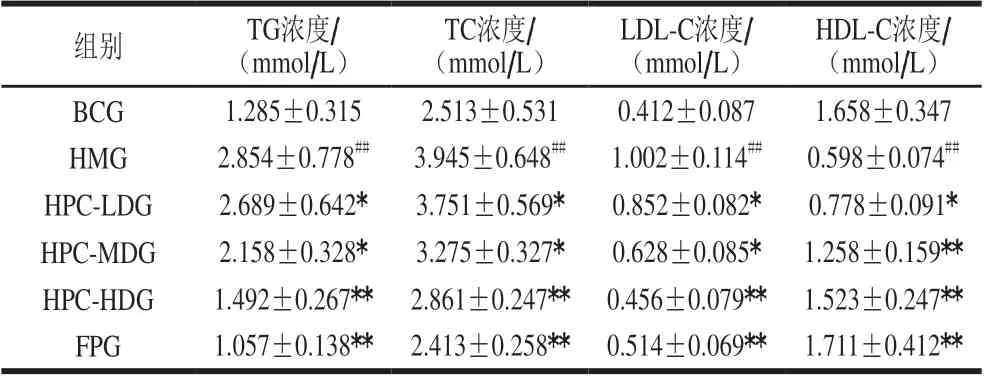
表3 各组大鼠血清脂质浓度的比较Table 3 Comparison of serum lipid contents of rats from all groups
2.1.4 各组大鼠肝脏匀浆脂质浓度的变化
如表4所示,与BCG比较,HMG大鼠肝脏TG、TC和LDL-C浓度均极显著升高,HDL-C浓度极显著下降(P<0.01)。与HMG比较,HPC-HDG和FPG大鼠肝脏TG、TC和LDL-C浓度极显著下降,HDL-C浓度极显著升高(P<0.01),且HPC对大鼠肝脏中脂质浓度的影响有一定的剂量依赖性,表明HPC能改善大鼠肝匀浆中异常的脂质水平,且高剂量HPC效果更明显。
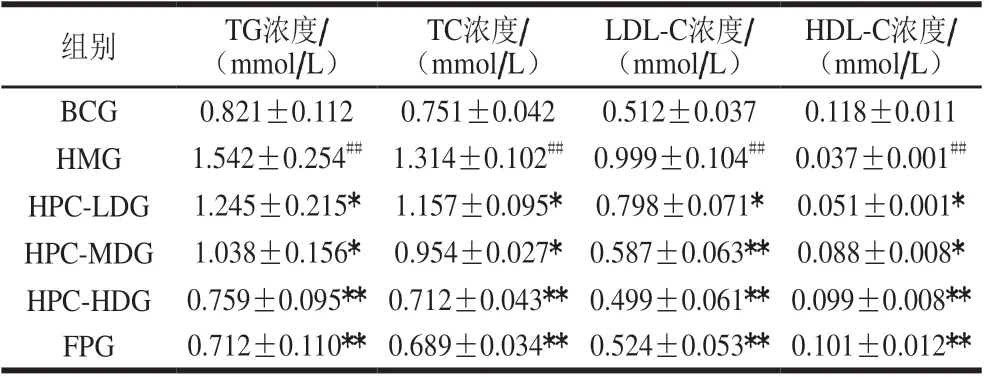
表4 各组大鼠肝脏脂质浓度的比较Table 4 Comparison of liver lipid contents of rats from all groups
2.2 各组大鼠肝脏病理学组织变化观察
如图2所示,BCG大鼠肝组织结构完整,肝小叶结构无异常。HMG大鼠肝脏出现重度弥漫性肝组织变性,肝小叶结构紊乱,肝细胞体积增大,胞浆疏松,出现数量、大小不一的脂肪空泡,有一定的脂肪堆积。与HMG大鼠相比,HPC各剂量组预防性干预后,随HPC剂量增加大鼠肝细胞脂肪变性逐渐改善。FPG大鼠肝细胞脂肪变性基本恢复正常,高剂量HPC与非诺贝特干预效果接近。

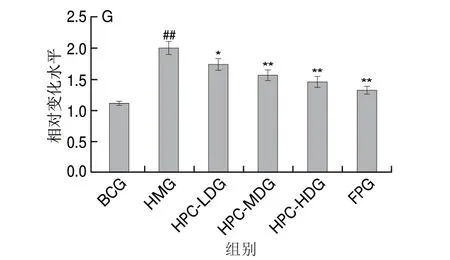
图2 各组大鼠肝脏病理组织变化Fig.2 Histopathological examination of liver tissues of rats from all groups
2.3 各组大鼠肝脏AMPK mRNA和p-AMPK蛋白的相对表达量
如图3所示,与BCG相比,HMG大鼠肝脏AMPKm R N A 和p-A M P K 蛋白相对表达量均极显著下降(P<0.01)。与HMG比较,HPC-MDG、HPC-HDG和FPG大鼠肝脏AMPKmRNA和p-AMPK蛋白相对表达量均极显著上升(P<0.01),高剂量HPC与非诺贝特效果相当,表明HPC能使AMPK转录增加,并使AMPK发生磷酸化。

图3 各组大鼠肝脏AMPK mRNA和p-AMPK蛋白的相对表达量Fig.3 Relative expression of AMPK mRNA and relative expression of p-AMPK protein in liver tissues of rats from all groups
2.4 各组大鼠肝脏SREBP-1c、GPAT1、ACC、FAS mRNA和蛋白相对表达量
如图4所示,与BCG相比,HMG大鼠肝脏SREBP-1c、GPAT1、ACC、FAS mRNA和蛋白相对表达量均极显著升高(P<0.01)。与HMG比较,HPC-HDG和FPG大鼠肝脏SREBP-1c、GPAT1、ACC、FAS mRNA和蛋白相对表达量均极显著下降(P<0.01),HPC-HDG效果与FPG相当。结果表明经HPC作用活化的AMPK进一步通过分子通路使参与脂肪分解代谢的负调控因子SREBP-1c、GPAT1、ACC、FAS的转录和翻译水平降低,促进脂肪氧化分解代谢,抑制脂质合成。
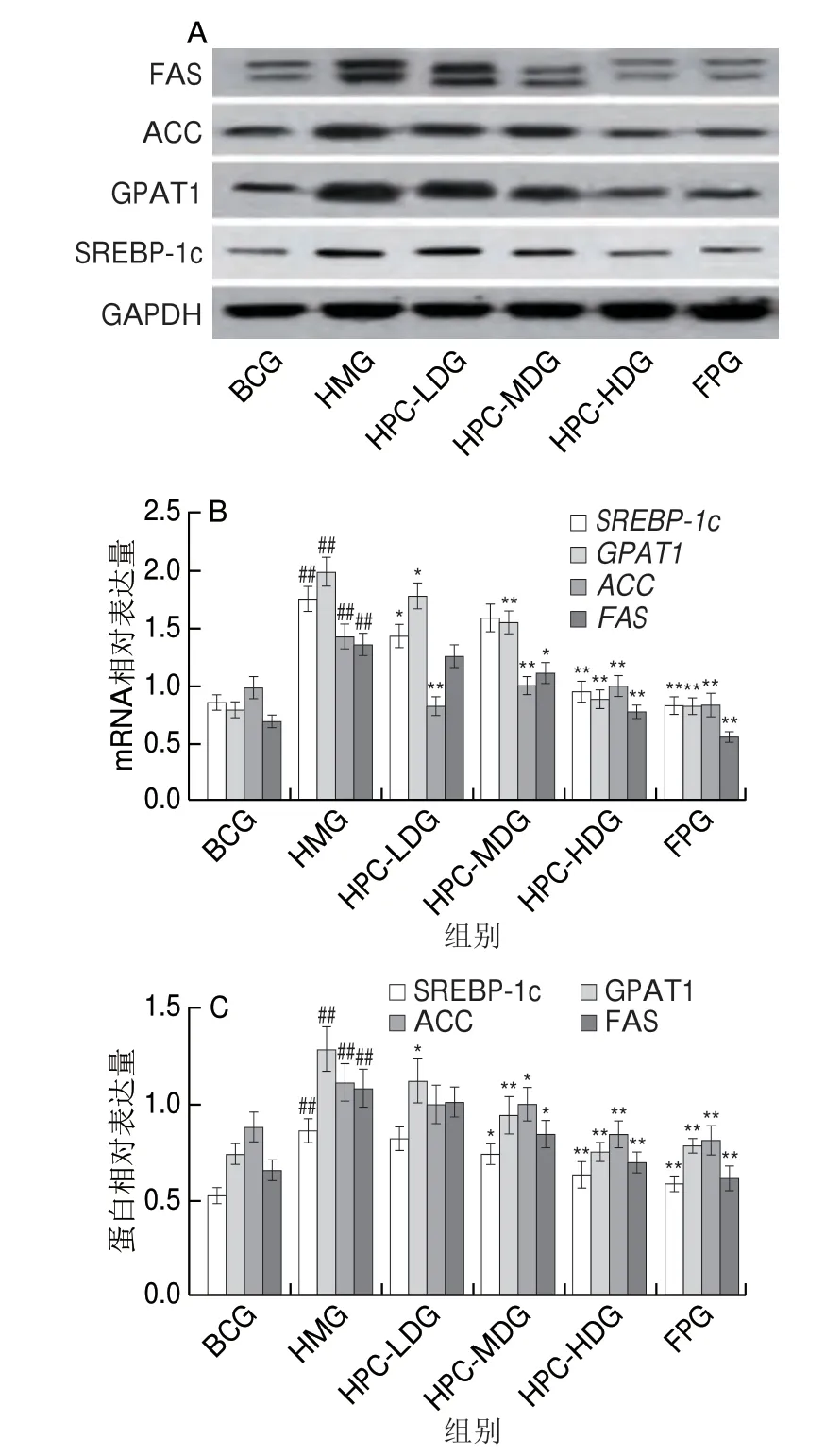
图4 各组大鼠肝脏SREBP-1c、GPAT1、ACC、FAS mRNA和蛋白相对表达量Fig.4 Relative expression of SREBP-1c, GPAT1, ACC and FAS mRNA and protein in liver tissues of rats from all groups
2.5 各组大鼠肝脏CPT1、PGC-1α mRNA和蛋白相对表达量
如图5所示,与BCG相比,HMG大鼠肝脏CPT1、P G C-1 α m R N A 和蛋白相对表达量均极显著降低(P<0.01)。与HMG比较,HPC-HDG和FPG大鼠肝脏CPT1、PGC-1α mRNA和蛋白相对表达量均极显著升高(P<0.01),高剂量HPC和非诺贝特效果相当。结果表明经HPC活化的AMPK能促进脂质分解代谢正调控因子CPT1、PGC-1α的转录和翻译,加速脂肪氧化分解,且具有剂量依赖性。
3 讨 论
血脂异常是动脉粥样硬化性心脏病发病的危险因素[15]。在我国血脂异常的人群中,进行降脂治疗患者的仅占14.1%,其中能达到《2021 ESC心血管疾病预防指南》要求有效控制血脂的比例为26.6%[16]。临床实践中,使用他汀类、贝特类等降脂药存在不耐受情况,并会加重肝脏负担,因此寻找并研发作用于AMPK多靶点的天然植物药是目前研究的热点之一。
本研究采用高脂饲料喂养大鼠建立高脂血症动物模型,实验结束后,HMG大鼠摄食量、体质量、肝质量和肝脏指数均显著或极显著高于BCG大鼠(P<0.05、P<0.01),HMG大鼠血脂各项指标均出现异常,造模结果与Li Hui等[17]研究结果一致;与HMG大鼠比较,HPC-HDG大鼠体质量、肝质量和肝脏指数均有不同程度的下降(P<0.05),大鼠血清和肝脏匀浆的TG、TC、LDL-C浓度极显著下降,而HDL-C浓度极显著升高(P<0.01),说明高剂量HPC可以明显改善高脂血症大鼠血脂代谢紊乱。肝脏病理学组织HE染色结果显示,与BCG大鼠比较,HMG大鼠肝脏出现重度弥漫性肝组织变性,与HMG大鼠相比,HPC-HDG大鼠肝细胞脂肪变性基本恢复正常。
在脂质代谢过程中,AMPK对多种代谢酶及转录因子起关键调控作用。AMPK广泛存在于真核细胞中,是由α-、β-和γ-亚基构成异源三聚体的一种高度保守的丝氨酸/苏氨酸蛋白激酶[18-21]。激活的AMPK转变成p-AMPK,直接磷酸化SREBP-1c的Ser372的识别位点使其转录能力下降,抑制下游FAS和TC合成酶的表达,减少脂质合成[22-24]。GPAT1是催化TG合成的一种关键限速酶,AMPK能促进线粒体外膜上的GPAT1磷酸化,降低其生物活性,导致脂肪酸氧化增加,减少脂质在肝细胞内的累积[25-27]。ACC有ACC1和ACC2两种异构体,由于活化的AMPK可以使其磷酸化而失活,而失活的ACC1可抑制脂肪酸的从头合成途径,失活的ACC2可以提高CPT1的活性而促进线粒体中脂肪酸的β-氧化分解[28-29]。
本研究结果显示,与HMG比较,HPC-HDG和FPG大鼠肝脏AMPKmRNA和p-AMPK蛋白相对表达量均极显著上升(P<0.01),SREBP-1c、GPAT1、ACC、FAS mRNA和蛋白相对表达量均极显著下降(P<0.01),CPT1、PGC-1α mRNA和蛋白相对表达量均极显著升高(P<0.01)。结果表明HPC可抑制SREBP-1c基因的转录和蛋白表达,从而抑制下游脂肪酸和胆固醇合成酶的表达,减少脂质合成;同时,通过下调GPAT1表达以降低GPAT1活性,减少肝细胞内脂质的积累。p-AMPK磷酸化ACC和FAS使两者失活,而失活的ACC和FAS可阻止乙酰辅酶A(coenzyme A,CoA)羧化成丙二酰CoA,同时活化CPT1和PGC-1α,促进脂肪酸β-氧化,抑制脂质合成,减少肝脏脂质生成,从而达到改善脂质代谢紊乱的效果,与Zhang Zhiqin等[30]研究结果相符。
综上所述,HPC能有效干预大鼠高脂血症,并能在一定程度上逆转脂质代谢紊乱的发展,其作用机制可能与通过AMPK/SREBP-1c信号通路调控脂质代谢、改善线粒体功能,从而减轻肝脏损伤密切相关。

