余甘子冻干粉对急、慢性高尿酸血症小鼠的降尿酸及肝肾保护作用
李瑞婷,何 维,宋 贺,谢小亭,吴 杰,姜 燕,*
(1.大理大学公共卫生学院,云南 大理 671000;2.川北医学院,四川 南充 637000;3.川北医学院第二附属医院口腔科,四川 南充 637100;4.宾川佳泓园艺有限责任公司,云南 宾川 671600)
高尿酸血症(hyperuricemia,HUA)是一种由嘌呤代谢异常引起的以血清尿酸水平异常升高为特征的常见代谢性疾病[1],被列为继高血压、高脂血症和高血糖之后的“第四高”疾病[2-3]。研究表明,HUA作为疾病独立危险因素,与痛风[4]、心血管疾病[5]、糖尿病[6]、高血压[7]和肾损伤[8]等疾病的发生发展密切相关。目前,HUA的治疗以饮食调节和药物治疗为主,西药治疗主要为黄嘌呤氧化酶(xanthine oxidase,XOD)抑制剂、尿酸盐转运体抑制剂和尿酸酶等[9]。然而西药治疗存在较多的不良反应和显著的副作用,如肾功能障碍、肝损伤、胃肠道刺激、皮疹和过敏等[10-11]。因此,通过膳食调节或寻找安全有效的天然降尿酸物质对于预防和治疗HUA及其相关疾病具有重要的临床意义。
余甘子(Phyllanthus emblicaL.)又称滇橄榄,属大戟科叶下珠属[12],是一种药食同源植物[13]。现代药理学分析表明,余甘子果实具有抗菌[14]、抗氧化[15]、抗炎[16]、抗糖尿病[17]、抗衰老[18]、保肝[19]、降血压[20]、降血脂[21]等作用。余甘子主要化学成分为鞣质类、酚酸类、黄酮类、萜类、甾醇类、维生素类、挥发油类[22]。研究证明黄酮类、酚酸类、萜类、生物碱类等化合物具有良好的降尿酸作用[23]。李楠等[24]研究发现余甘子叶提取物羟基酪醇具有较强的抗氧化活性可缓解CS2致小鼠睾丸组织损伤。张炳森等[25]研究发现橄榄果汁冻干粉中胡椒碱与木犀草素可能具有一定的降尿酸作用。Tao Haolin等[26]研究表明余甘子醇提物可以用于治疗大鼠的急性痛风性关节炎。符晓晖[27]研究发现余甘子总酚可能通过抑制XOD活性而发挥降尿酸作用。余甘子可能具有抗HUA的功效,但对于其能否在体内发挥抑制XOD和腺苷脱氨酶(adenosine deaminase,ADA)活性及其降尿酸作用潜在机制的研究尚有限。
课题组前期研究发现,‘ 盈玉’‘热农1号’和野生余甘子品种中,野生余甘子药用价值最高[28]。故本实验以野生余甘子为研究对象,将其冷冻干燥、低温研磨得到冻干粉,探讨野生余甘子冻干粉(freeze-dried powder ofPhyllanthus emblicaL.,PEFP)对次黄嘌呤引起的急性HUA和氧嗪酸钾诱导的慢性HUA小鼠的降尿酸及肝肾保护作用,以期为食药物质、功能食品及天然降尿酸药物的开发提供实验基础和理论依据。
1 材料与方法
1.1 材料与试剂
成熟野生余甘子鲜果由云南佳泓园艺有限责任公司提供。
KM雄性SPF级小鼠(体质量18~22 g) 湖南斯莱克景达实验动物有限公司,生产许可证号:SCXK(湘)2019-0004。经大理大学伦理委员会批准,批号:2021-P2-054。
别嘌醇(allopurinol,ALLO)(批号:315-30-0)、氧嗪酸钾(批号:2207-75-2)、次黄嘌呤(批号:68-94-0)上海麦克林生化科技有限公司;羧甲基纤维素钠(sodium carboxymethyl cellulose,CMC-Na)(批号:428U021)、4%组织细胞固定液 北京索莱宝科技有限公司;尿酸、血清尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,CRE)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、谷氨酸氨基转移酶(alanine aminotransferase,ALT)、XOD和ADA检测试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
SP-Max3500FL多功能荧光酶标仪 上海闪谱生物科技有限公司;TGL-16C高速台式离心机 上海安亭科学仪器厂;SC-3610低速离心机 科大创新股份有限公司中佳分公司;A11 B S25分析用研磨机 德国IKA公司;18ND冷冻干燥机 宁波新芝生物科技股份有限公司;BX46生物显微镜 日本Olympus公司。
1.3 方法
1.3.1 余甘子冻干粉的制备
野生余甘子鲜果清洗、去核,切成薄片,-25 ℃冷冻12 h后冷冻干燥15 h,用研磨机粉碎得PEFP,1 500 g野生余甘子鲜果约制备冻干粉100 g,将制备的PEFP密封,4 ℃冰箱保存备用。
1.3.2 次黄嘌呤致急性HUA小鼠模型的建立、分组与给药
参考文献[29-30],取KM雄性小鼠48 只,适应性喂养1 周后随机分为6 组:正常对照组(NC),模型对照组(MC),余甘子冻干粉低(75 mg/kgmb,PEFP-L)、中(150 mg/kgmb,PEFP-M)、高剂量组(300 mg/kgmb,PEFP-H),以及ALLO组(20 mg/kgmb),每组8 只。按2020年版《中国药典》余甘子人体用量9 g/d推算余甘子冻干粉使用中等剂量,然后分别确定低、高剂量。每天按照10 mL/kgmb灌胃给药1 次,连续7 d,PEFP组小鼠分别灌胃不同剂量PEFP(溶于质量分数0.9%生理盐水),ALLO和次黄嘌呤均混悬于质量分数0.5% CMC-Na溶液中,正常组与模型组给予等体积质量分数0.5% CMC-Na溶液。灌胃第7天末次给药后1 h,除正常组腹腔注射等体积生理盐水外,模型组与各给药组小鼠腹腔注射次黄嘌呤溶液(1 000 mg/kgmb)诱导急性HUA。造模后0.5 h,摘眼球采血,4 ℃静置2 h,3 500 r/min离心15 min,取上层清液待测。取肾脏与肝脏组织待测。
1.3.3 氧嗪酸钾致慢性HUA小鼠模型的建立、分组与给药
参照文献[31-32],取KM雄性小鼠48 只,分组情况同1.3.2节。ALLO和氧嗪酸钾均混悬于0.5% CMC-Na溶液中,除正常组外,各组小鼠均每天腹腔注射给予氧嗪酸钾(500 mg/kgmb,10 mL/kgmb)以建立慢性HUA模型,并于注射后1 h,各组小鼠灌胃相应的药物治疗,正常组与模型组给予等量0.5% CMC-Na溶液,每天1 次,连续给药14 d。第14天末次给药后1 h,眼球采血后处死小鼠,血样4 ℃静置2 h后,离心(3 500 r/min离心15 min)分离出血清待测。取肾脏与肝脏组织待测。
1.3.4 指标检测
1.3.4.1 小鼠肝/肾系数
小鼠颈脱臼处死后取肝脏和肾脏,称质量,按下式计算各组小鼠的肝/肾系数。
1.3.4.2 血清及肝脏生化指标检测
按照试剂盒说明分别测定小鼠血清尿酸、BUN、CRE、AST、ALT、XOD、AOD水平。肝脏匀浆后,按试剂盒说明书测定XOD和ADA活力。
1.3.4.3 肾脏和肝脏病理学检查
用质量分数4%多聚甲醛溶液固定肾脏与肝脏组织,石蜡包埋,苏木素-伊红染色,观察组织病理学变化。
1.4 数据处理与分析
采用SPSS 26.0软件对数据进行统计学处理,GraphPad Prime 8软件进行图表绘制。结果以平均值±标准差表示,组间比较采用单因素方差分析,两两比较采用Tukey检验,P<0.05表示有统计学差异。
2 结果与分析
2.1 PEFP对次黄嘌呤致急性HUA小鼠的影响
2.1.1 PEFP对急性HUA小鼠肝/肾系数的影响
脏器的肿大或萎缩可以反映其损伤情况,肝/肾系数降低表明肝脏和肾脏可能存在一定程度的萎缩,升高则表明肝脏和肾脏可能出现增生和水肿[33]。如表1所示,MC组小鼠相较于NC组的肝/肾系数均极显著升高(P<0.01),说明腹腔注射次黄嘌呤可引起小鼠肝脏和肾脏肿大,急性HUA造模成功。PEFP组小鼠相比MC组肝/肾系数均显著降低(P<0.05、P<0.01),PEFP-H小鼠肝/肾系数最低,且PEFP-M和PEFP-H组的肝/肾系数均与NC组无显著差异(P>0.05),PEFP对降低小鼠肝/肾系数的效果呈剂量依赖性。初步判断PEFP可缓解次黄嘌呤诱导的急性HUA小鼠的肝肾损伤。

表1 PEFP对急性HUA小鼠肝/肾系数的影响(n=8)Table 1 Effect of PEFP on liver and kidney indexes of mice with acute hyperuricemia (n = 8)
2.1.2 PEFP对急性HUA小鼠血清尿酸、CRE和BUN水平的影响
血清尿酸浓度是检测小鼠HUA模型是否成功的关键,HUA的主要评价指标就是血清尿酸浓度升高。如图1A显示,KM小鼠给予次黄嘌呤后,血清尿酸浓度较NC组极显著增加了28.04%(P<0.01),表明急性HUA小鼠造模成功;相较于MC组,PEFP低、中、高剂量组小鼠血清尿酸浓度分别降低了10.22%、19.71%(P<0.01)、14.64%(P<0.05),即PEFP-M组尿酸水平最低,且与N C 组水平最为接近,表明150 mg/kgmbPEFP是下调次黄嘌呤所致急性HUA小鼠血清尿酸水平的最优剂量。
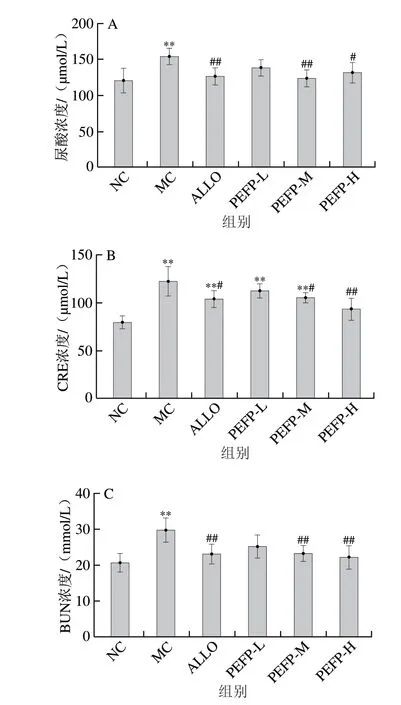
图1 PEFP对急性HUA小鼠血清尿酸(A)、CRE(B)和BUN(C)浓度的影响(n=8)Fig.1 Effect of PEFP on serum UA (A), CRE (B) and BUN (C) levels in mice with acute hyperuricemia (n = 8)
临床上常用血清CRE和BUN水平评估肾脏损伤程度。由图1B、C可知,MC组小鼠血清CRE和BUN浓度较NC组均极显著升高(P<0.01),即次黄嘌呤诱导的HUA小鼠肾功能受到损伤。而灌胃不同剂量PEFP的HUA小鼠相比MC组血清CRE和BUN浓度均不同程度降低,且灌胃300 mg/kgmbPEFP(PEFP-H组)降低血清CRE和BUN浓度效果最好(P<0.01),提示小鼠血清CRE和BUN水平与给药剂量相关,呈剂量依赖性。推测PEFP可改善次黄嘌呤所致急性HUA小鼠的肾脏损伤。
2.1.3 PEFP对急性HUA小鼠血清AST和ALT活力的影响血清AST和ALT水平是临床评价肝功能的重要指标。由图2可知,MC组小鼠血清AST和ALT活力均极显著高于NC组(P<0.01),即腹腔注射次黄嘌呤可导致小鼠肝脏功能损伤。灌胃PEFP的HUA小鼠血清AST和ALT活力均较MC组不同程度降低,提示PEFP能抑制血清AST和ALT活力,从而缓解由次黄嘌呤所致急性HUA小鼠的肝脏损伤。
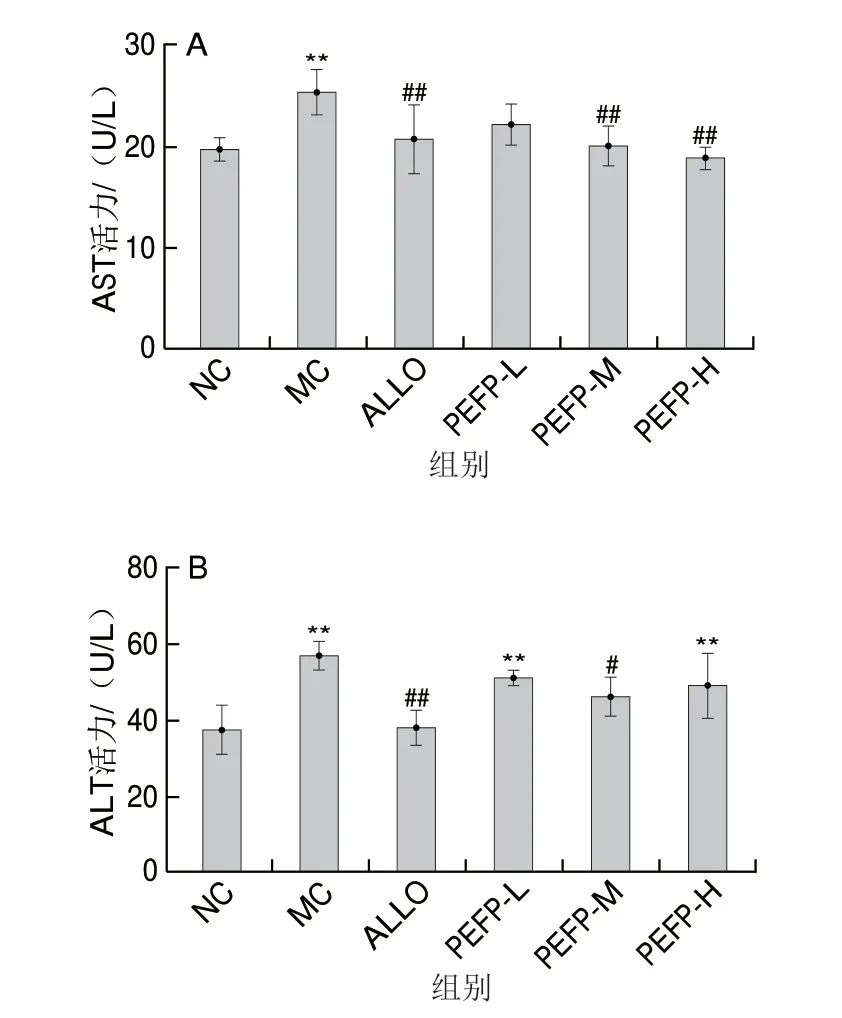
图2 PEFP对急性HUA小鼠血清AST(A)和ALT(B)活力的影响(n=8)Fig.2 Effect of PEFP on serum AST (A) and ALT (B) levels in mice with acute hyperuricemia (n = 8)
2.1.4 PEFP对急性HUA小鼠血清及肝脏XOD和ADA活力的影响
ADA和XOD是嘌呤核苷酸分解代谢的关键酶,在体内尿酸生成的过程中发挥着重要作用[34]。如图3所示,MC组小鼠血清和肝脏的XOD和ADA活力均较于NC组极显著升高(P<0.01)。与MC组相比,各给药组均可极显著降低血清和肝脏XOD和ADA活力(P<0.01),提示PEFP能显著抑制由次黄嘌呤引起的急性HUA小鼠血清及肝脏XOD和ADA活力的升高,PEFP可能通过抑制XOD和ADA活力发挥降尿酸作用。
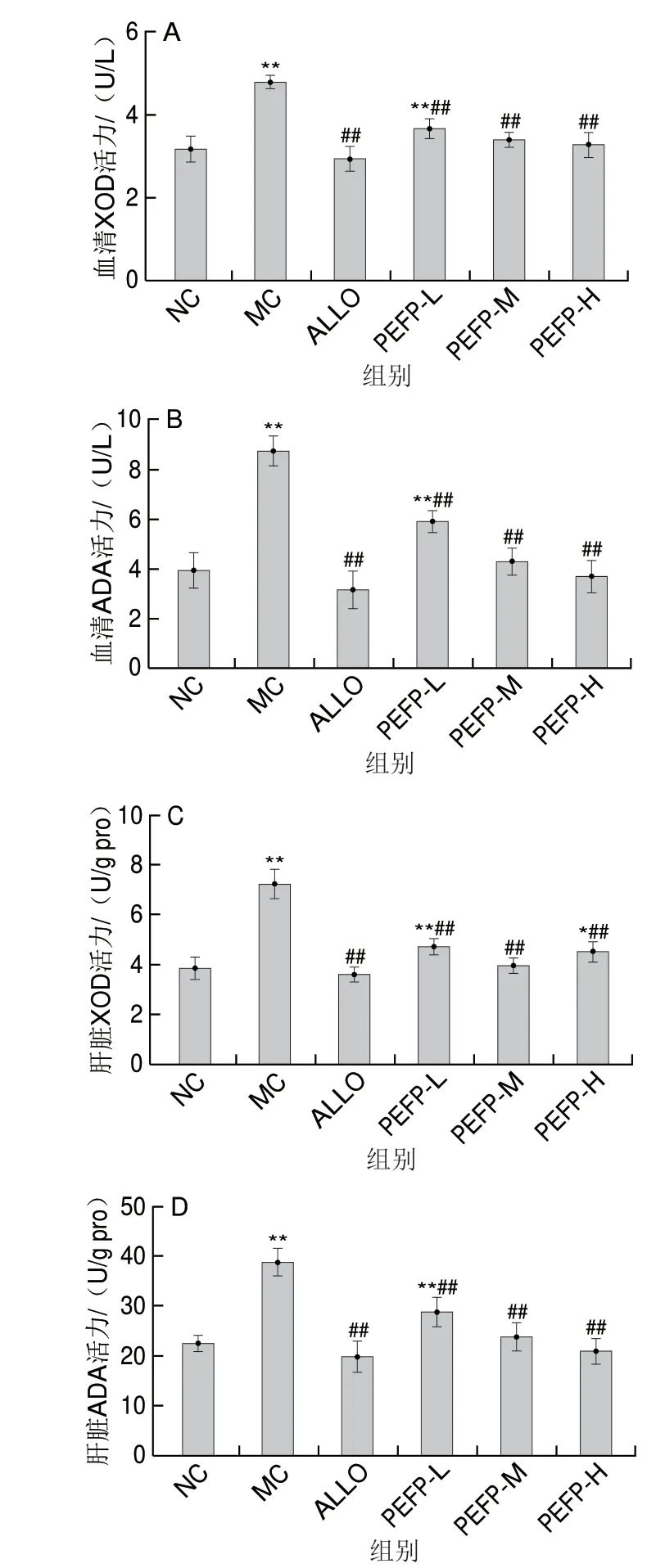
图3 PEFP对急性HUA小鼠血清和肝脏XOD和ADA活力的影响(n=8)Fig.3 Effect of PEFP on XOD and ADA activities in serum and liver of mice with acute hyperuricemia (n = 8)
2.1.5 急性HUA小鼠的肾脏组织病理变化
如图4所示,NC组小鼠肾组织形态结构正常,肾小球大小正常,结构清楚,未见炎细胞浸润等明显病理改变。MC组相比于NC组,肾小球明显萎缩,肾间质水肿,肾小管明显扩张伴上皮细胞水肿,可见炎细胞浸润。ALLO组和PEFP各剂量组相比于MC组肾脏组织病理改变均得到不同程度改善,ALLO组肾小管明显扩张,但肾小球萎缩减轻;PEFP各剂量组肾小球萎缩和肾小管上皮细胞水肿明显减轻。表明腹腔注射次黄嘌呤可诱导小鼠肾损伤,而灌胃PEFP可明显改善小鼠肾损伤。
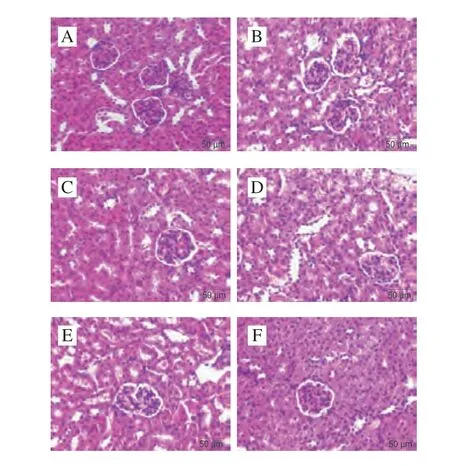
图4 PEFP对急性HUA小鼠肾脏病理变化的影响(400×)Fig.4 Effect of PEFP on renal pathological changes in mice with acute hyperuricemia (400 ×)
2.1.6 急性HUA小鼠的肝脏组织病理变化
如图5所示,NC组小鼠肝脏组织结构清晰,肝细胞大小正常,排列整齐,未见明显病理学改变。MC组相较于NC组,中央静脉周围肝细胞明显水肿,可见脂肪变性。与MC组相比较,ALLO组肝细胞轻度水肿,脂肪变性减轻;PEFP-L组肝细胞轻度脂肪变性,少许淋巴细胞浸润,偶见点状坏死;PEFP-M和PEFP-H组肝细胞轻度水肿,可见脂肪变性。提示次黄嘌呤可致HUA小鼠轻微肝损伤,灌胃PEFP可一定程度缓解肝损伤。
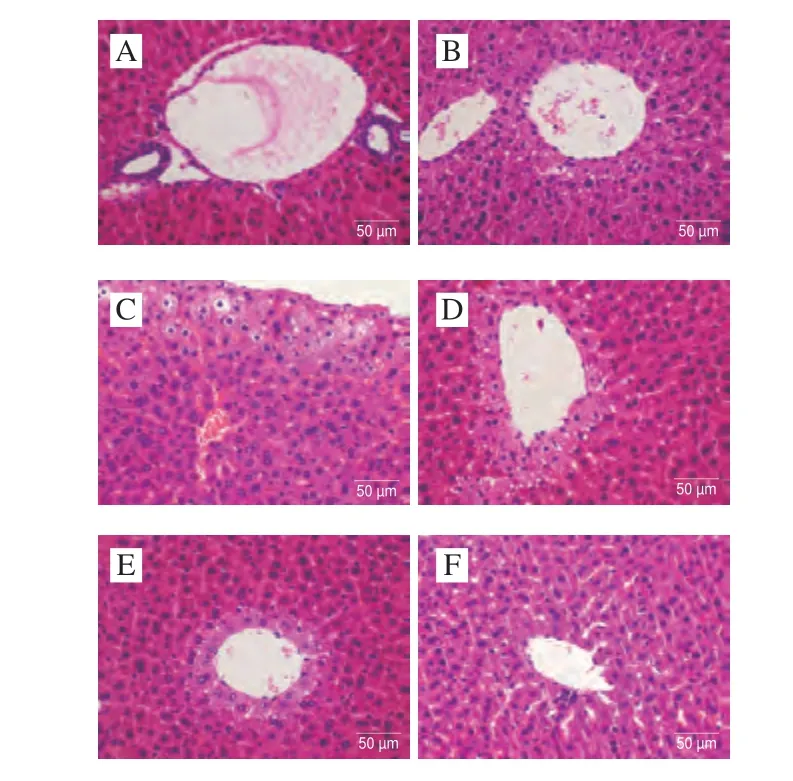
图5 PEFP对急性HUA小鼠肝脏病理变化的影响(400×)Fig.5 Effect of PEFP on hepatic pathological changes in hypoxanthine-mice with acute hyperuricemia (400 ×)
2.2 PEFP对氧嗪酸钾致慢性HUA小鼠的影响
2.2.1 PEFP对慢性HUA小鼠肝/肾系数的影响
由表2可知,MC组较NC组小鼠肝/肾系数极显著升高(P<0.01),表明腹腔注射氧嗪酸钾可能导致小鼠肝脏和肾脏损伤。灌胃PEFP的HUA小鼠较MC组肝肾/系数均显著降低(P<0.05、P<0.01),PEFP-H小鼠肝/肾系数最低,且PEFP-M和PEFP-H小鼠肝肾系数接近NC组(P>0.05)。表明灌胃不同剂量的PEFP均可下调小鼠的肝/肾系数,且效果与给药剂量呈正相关,实验结果与PEFP对急性HUA小鼠的干预效果一致。

表2 PEFP对慢性HUA小鼠肝/肾系数的影响(n=8)Table 2 Effect of PEFP on liver and kidney indexes of mice with chronic hyperuricemia (n = 8)
2.2.2 PEFP对慢性HUA小鼠血清尿酸、CRE和BUN水平的影响
如图6A显示,腹腔注射氧嗪酸钾14 d后,MC组小鼠血清尿酸浓度较NC组显著增加了81.79%(P<0.01),说明造模成功;与MC组相比,PEFP低、中、高剂量组小鼠血清尿酸浓度分别降低32.97%、38.99%、43.60%,表明PEFP可极显著降低由氧嗪酸钾诱导的慢性HUA小鼠血清尿酸水平(P<0.01),从而缓解小鼠的HUA。PEFP对慢性HUA小鼠降尿酸效果优于其对急性HUA小鼠的干预效果,且对慢性HUA小鼠的降尿酸效果表现出剂量依赖性。
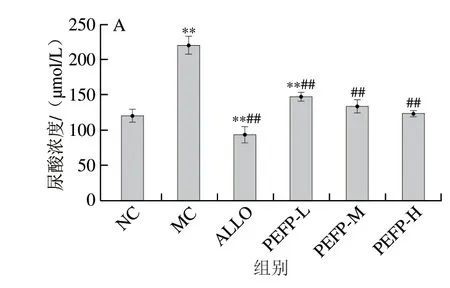
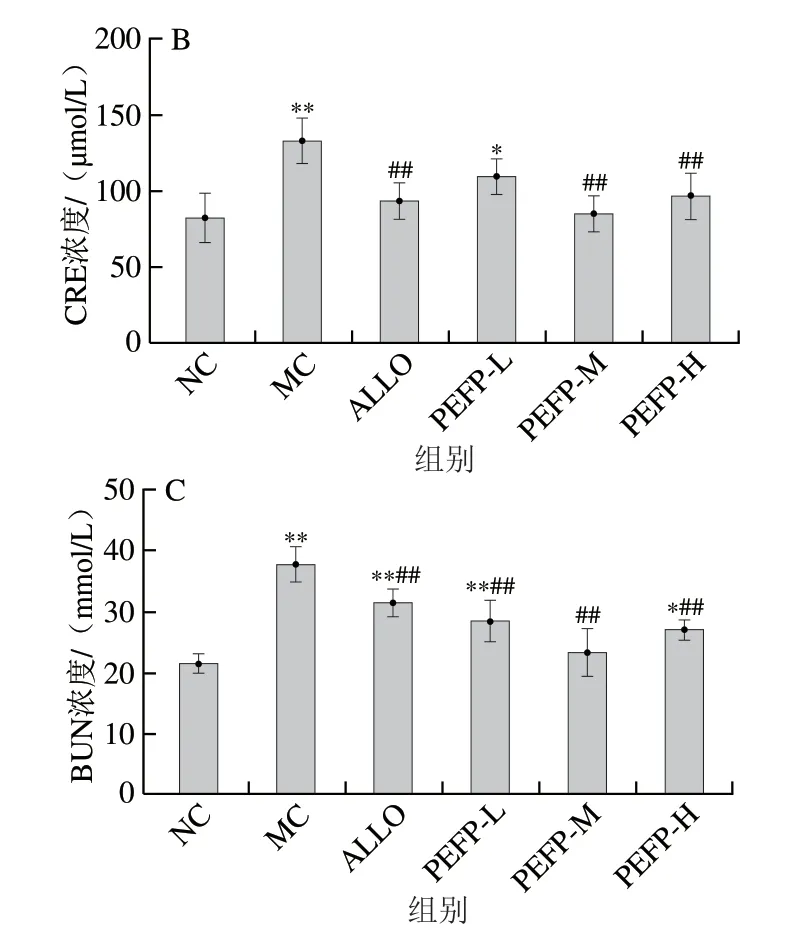
图6 PEFP对慢性HUA小鼠血清尿酸(A)、CRE(B)和BUN(C)浓度的影响(n=8)Fig.6 Effect of PEFP on serum UA (A), CRE (B) and BUN (C) levels in mice with chronic hyperuricemia (n = 8)
如图6B、C所示,MC组小鼠血清CRE和BUN浓度均较NC组极显著增加(P<0.01),表明氧嗪酸钾导致慢性HUA小鼠肾脏损伤。灌胃不同剂量的PEFP可有效降低慢性HUA小鼠血清CRE和BUN浓度,从而改善慢性HUA导致的肾损伤。与对急性HUA小鼠干预效果不同的是,PEFP对慢性HUA小鼠血清CRE和BUN水平干预效果无剂量依赖性,这与长时间灌胃高剂量PEFP可能会造成小鼠肾功能一定程度的损伤有关。
2.2.3 PEFP对慢性HUA小鼠血清AST和ALT活力的影响
由图7可知,MC组小鼠血清AST和ALT活力相比NC组极显著增高(P<0.01),提示由氧嗪酸钾诱导的慢性HUA小鼠肝功能损伤。灌胃不同剂量的PEFP均可显著降低慢性HUA小鼠血清AST和ALT活力,且呈剂量依赖性,表明PEFP可有效抑制小鼠血清AST和ALT活力,从而改善慢性HUA小鼠的肝损伤。PEFP虽可有效下调急性HUA小鼠血清AST和ALT活力,AST活力的降低呈剂量依赖性,但ALT活力的下降并无剂量依赖性。
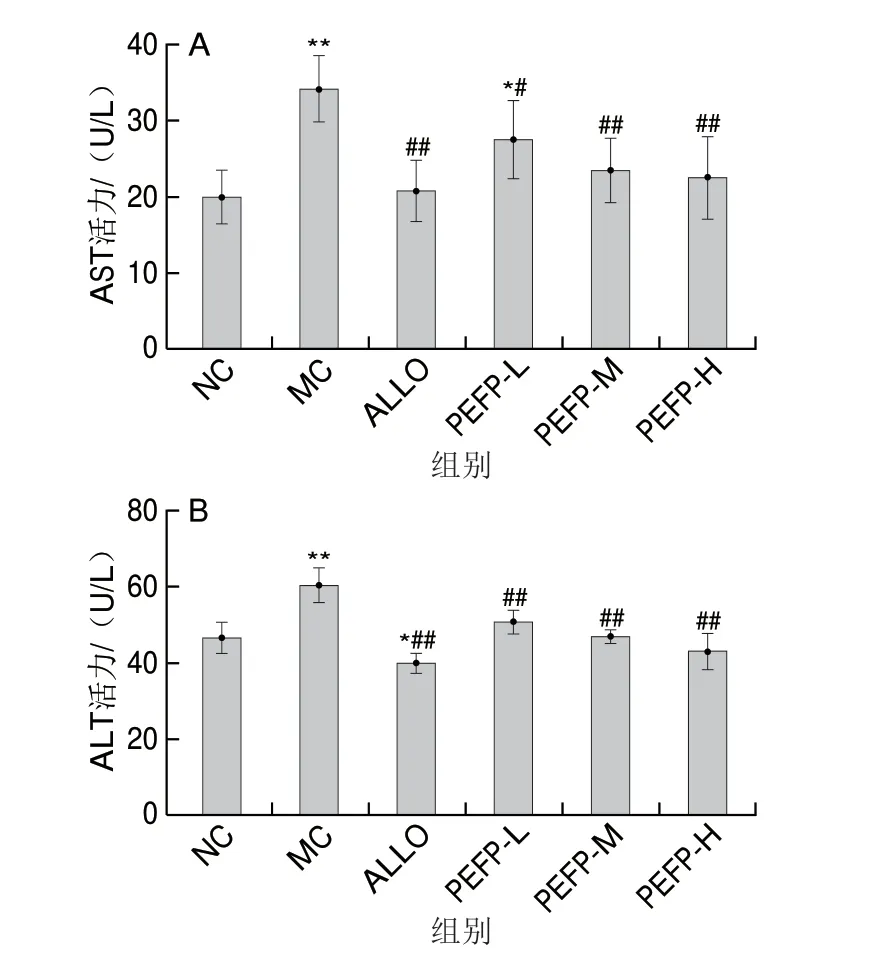
图7 PEFP对慢性HUA小鼠血清AST(A)和ALT(B)活力的影响(n=8)Fig.7 Effect of PEFP on serum AST (A) and ALT (B) levels in mice with chronic hyperuricemia (n = 8)
2.2.4 PEFP对慢性HUA小鼠血清及肝脏XOD和ADA活力的影响
如图8所示,MC组小鼠血清和肝脏组织中XOD和ADA活力均较NC组极显著升高(P<0.01),说明腹腔注射氧嗪酸钾可增加小鼠体内XOD和ADA活力,从而促进尿酸的生成。灌胃不同剂量的PEFP小鼠血清和肝脏组织中XOD和ADA活力均呈剂量依赖性降低,表明PEFP可有效抑制慢性HUA小鼠血清和肝脏组织中XOD和ADA活力。推测PEFP可能通过抑制慢性HUA小鼠的XOD和ADA活力发挥降尿酸作用,且与给药剂量呈正相关。而对于急性HUA小鼠,PEFP对ADA活力的降低作用存在剂量依赖性,对XOD活力的影响无剂量依赖性。

图8 PEFP对慢性HUA小鼠血清和肝脏中XOD和ADA活力的影响(n=8)Fig.8 Effect of PEFP on XOD and ADA activities in serum and liver of mice with chronic hyperuricemia (n = 8)
2.2.5 慢性HUA小鼠的肾脏组织病理变化
如图9所示,NC组小鼠肾脏组织学无明显异常,细胞排列整齐,肾小管和肾小球大小正常,未见明显病理变化。MC组相较于NC组肾小管严重扩张,肾小管上皮细胞水肿,部分肾小球明显萎缩。与MC组相比较,ALLO组和PEFP各剂量组病理变化情况得到不同程度的改善,ALLO组肾小管明显扩张,肾小管上皮细胞水肿减轻,肾小球萎缩减轻,可见炎细胞浸润;PEFP各剂量组肾小管扩张和肾小球萎缩均明显减轻,未见炎细胞浸润。提示腹腔注射氧嗪酸钾可诱导慢性HUA小鼠明显肾损伤,灌胃PEFP可明显缓解小鼠肾损伤。
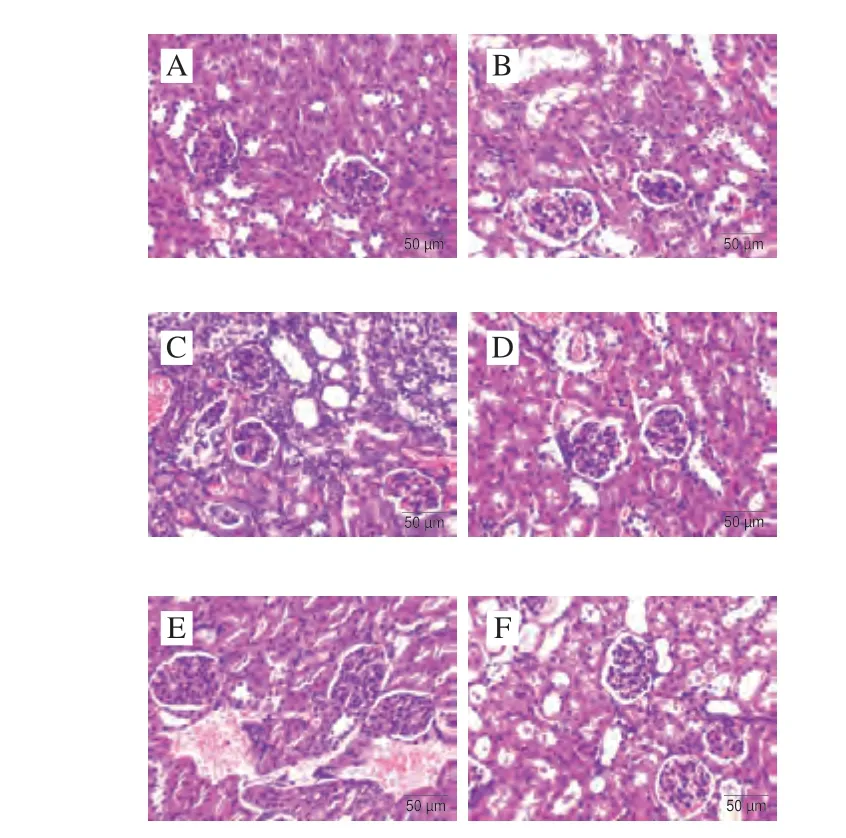
图9 PEFP对慢性HUA小鼠肾脏病理变化的影响(400×)Fig.9 Effect of PEFP on renal pathological changes in mice with chronic hyperuricemia (400 ×)
2.2.6 慢性HUA小鼠的肝脏组织病理变化
如图10所示,NC组小鼠肝细胞形态结构正常,肝细胞大小正常,结构清晰,未见明显病理改变。MC组小鼠相比于NC组肝细胞明显水肿伴脂肪变性,可见点状坏死,大量淋巴细胞浸润。与模型组相比,ALLO组小鼠肝细胞水肿明显伴脂肪变性;PEFP-L和PEFP-M组小鼠肝细胞未见明显异常;PEFP-H小鼠肝细胞明显水肿。表明氧嗪酸钾可诱导慢性HUA小鼠明显肝损伤,灌胃PEFP可明显改善小鼠肝损伤。
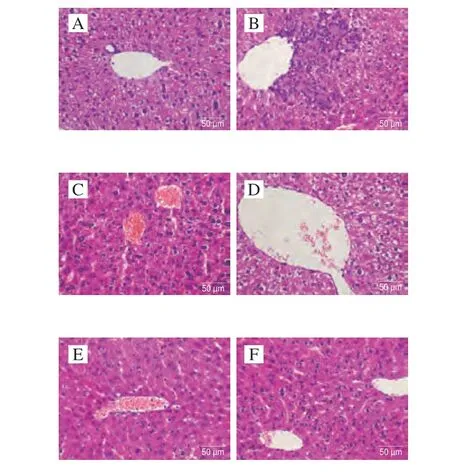
图10 PEFP对慢性HUA小鼠肝脏病理变化的影响(400×)Fig.10 Effect of PEFP on hepatic pathological changes in mice with chronic hyperuricemia (400 ×)
3 讨 论
尿酸是嘌呤碱代谢终产物,尿酸生成过多或尿酸排泄障碍是导致HUA的直接原因[35-36]。次黄嘌呤是尿酸生成的直接前体物质,XOD催化次黄嘌呤氧化为黄嘌呤,并进一步催化黄嘌呤氧化为尿酸[37],即注射次黄嘌呤可增加尿酸来源。氧嗪酸钾为尿酸酶抑制剂,结构与尿酸的嘌呤环相似,可竞争性抑制尿酸酶活性[38],即注射氧嗪酸钾可减少尿酸去路。本研究采用次黄嘌呤建立急性HUA模型,以氧嗪酸钾诱导慢性HUA模型,采用化学诱导剂建立HUA模型具有稳定、简便和可重复的特点。两种模型小鼠的MC组血清尿酸浓度均极显著升高,表明造模成功,而灌胃不同剂量的PEFP可有效降低两种模型的血清尿酸浓度,提示PEFP具有改善HUA作用。
余甘子富含没食子酸、槲皮素、芦丁、黄酮、多酚、鞣质和VC等活性成分[39],研究表明槲皮素可能通过抑制肝脏中XOD和ADA活力减少尿酸的生成[40],从而降低血尿酸;藤茶总黄酮具有较好的抗HUA及肾功能保护作用[41];牡丹花总黄酮对高尿酸血症大鼠肾脏具有一定的保护作用[9],其作用与促进尿酸排泄、抑制氧化反应、抑制尿酸合成关键酶活性、调节尿酸转运蛋白表达有关;山楂叶总黄酮能调节XOD的活性,从而调节血清尿酸浓度[42];余甘子总黄酮对大鼠佐剂性关节炎有一定的干预作用[43]。故推测余甘子总黄酮及槲皮素可能为其抗HUA的活性成分,其具体作用机制有待进一步研究。
XOD和ADA是尿酸生成的关键酶,ADA催化腺嘌呤核苷分解为次黄嘌呤核苷,而后经核苷磷酸化酶催化生成次黄嘌呤,再经XOD氧化作用最终生成尿酸[44]。朱春胜等[45]研究发现菊苣发挥降尿酸的功效可能与抑制XOD、ADA活力有关。本实验结果也表明,各剂量PEFP可显著降低急性和慢性HUA小鼠血清和肝脏组织XOD和ADA活力。由此可推测各剂量PEFP在体内可能通过抑制XOD和ADA活力,阻碍尿酸的合成途径,减少尿酸的生成,从而发挥降尿酸作用。
肾是尿酸主要的排泄器官,HUA可造成不同程度的肾功能损伤,同时HUA与脂肪肝关系密切[46]。血清CRE、BUN浓度是检测肾功能的灵敏指标,血清AST和ALT活力则常用于反映肝功能情况,本研究两种模型中MC组较NC组血清CRE、BUN、AST和ALT水平及肝/肾系数均极显著升高(P<0.01),表明急性和慢性HUA对小鼠的肝肾功能产生损伤;PEFP各剂量组相比于MC组血清CRE、BUN、AST、ALT水平及肝/肾系数均不同程度地降低,说明PEFP对急性和慢性HUA小鼠的肝肾功能有保护作用。同时病理组织学观察发现,PEFP可明显减轻急性HUA小鼠的肾小球萎缩和肾小管上皮细胞水肿,可一定程度缓解肝细胞水肿和脂肪变性;明显减轻慢性HUA小鼠的肾小管扩张和肾小球萎缩以及炎细胞浸润,较好改善肝细胞水肿和脂肪变性。因此推测PEFP可能通过缓解小鼠肾损伤,从而促进尿酸的排泄,发挥降尿酸功效,且对HUA所致的肝肾损伤有一定保护作用。
综上所述,PEFP可能通过抑制XOD和ADA活力降低急性和慢性HUA小鼠血清尿酸浓度,也可能因改善小鼠肾功能从而促进尿酸排泄,发挥降尿酸作用,同时对肝肾损伤有保护作用,其具体作用机制及有效作用成分还需进一步研究。余甘子有望成为改善HUA的功能食品和治疗药物,本研究结果为野生余甘子的开发利用提供了新的思路。

