牛支原体TrxR胞内抑制EBL细胞凋亡的研究
张 立,何肖肖,马海云,赵云海,王 青,蔡 伟,邢小勇,武小椿,权国梅,温峰琴,包世俊
(甘肃农业大学动物医学院,甘肃兰州 730070)
牛支原体(Mycoplasmabovis,Mb)是造成牛呼吸道疾病的病原之一,可对养殖业造成严重经济损失[1-2]。Mb感染是通过其自身表面的蛋白对宿主细胞的黏附,逐步侵袭感染细胞造成机体功能的损伤,目前已知的Mb表面黏附因子有α-烯醇酶、NADH氧化酶和亚甲基四氢叶酸tRNA-甲基转移酶等[3-5],这些Mb膜表面蛋白通过其自身与宿主细胞的黏附完成了牛支原体侵染宿主细胞的第一步。Mb P48蛋白也是一种具有黏附作用的膜表面蛋白,通过黏附宿主细胞进而侵入诱导凋亡因子的表达致使细胞凋亡,Mb P48蛋白在Mb感染宿主细胞并表现出临床症状过程中发挥了重要作用[6]。因此,探讨牛支原体在感染宿主细胞的过程中其相关蛋白与宿主细胞的相互作用,对认识Mb发病机制及制备完善的防控方案具有重要意义。
硫氧还蛋白还原酶(thioredoxin reductase,TrxR)广泛存在于原核生物及各种细胞中,在细胞各种生理功能的发挥中起着关键作用[7]。TrxR在参与细胞分化、生长和死亡、细胞抗氧化损伤、还原抗坏血酸自由基、细胞各种氧化还原信号传导等过程中发挥关键作用[8-9]。TrxR与硫氧还蛋白(Trx)和辅酶NADPH共同构成的硫氧还蛋白系统维持着细胞氧化还原状态的平衡[10]。研究Mb TrxR在胎牛肺细胞(EBL)中表达,了解其对EBL增殖与凋亡的影响及细胞中过氧化氢(H2O2)含量的变化,有助于解析其与宿主细胞的互作机制,进一步阐述Mb感染和逃避免疫的机制[11],为防控Mb感染引起的疾病积累理论基础,也可更深地阐述Mb TrxR相关的生物学功能。
1 材料与方法
1.1 材料
1.1.1 菌种、细胞及载体 牛支原体武威分离株、EBL细胞及pVAX1和pEGFP-N1载体由甘肃农业大学动物医学院传染病实验室保存。
1.1.2 主要试剂 支原体基础培养基(HB7025),青岛海博生物技术有限公司产品;DNA Marker、T4 DNA Ligase(2011A)、限制性内切酶BamHⅠ(1010S)和XhoⅠ(1094S),宝日医生物技术(大连)有限公司产品;过氧化氢(H2O2)含量检测试剂盒(M1020),北京索莱宝科技有限公司产品; MTT细胞增殖及细胞毒性检测试剂盒(C0009S)、Annexin V-FITC细胞凋亡检测试剂盒(C1062M),上海碧云天生物技术有限公司产品;2×Hieff Canace®PCR Master Mix高保真酶预混液(10149ES03)、Hieff®qPCR SYBR Green Master Mix(Q311-02/03),翌圣生物科技(上海)股份有限公司产品;无内毒素质粒小提中量试剂盒(DP118-02),天根生化科技有限公司产品;PEI 40K Transfection Reagent(G1802-1ML),武汉赛维尔生物科技有限公司产品。
1.1.3 主要仪器 生物安全柜,青岛海尔生物医疗股份有限公司产品;Minispin小型高速离心机,Hermle公司产品;高压蒸汽灭菌锅,上海申安医疗器械厂产品;梯度PCR仪,德国Eppendorf公司产品;电泳仪,北京六一生物科技有限公司产品;凝胶成像仪,君意东方电泳设备有限公司产品;超微量分光光度计,Pultton公司产品;细胞培养箱,上海博迅医疗生物仪器股份有限公司产品;酶标仪,美国Molecular Devices公司产品;倒置荧光显微镜,德国ZEISS公司产品;Guava easyCyte流式细胞检测仪,Millipore公司产品;LightCycler96实时荧光定量PCR仪,瑞士Roche公司产品;细胞超声破碎仪,浙江宁波新芝生物科技股份有限公司。
1.2 方法
1.2.1 Mb基因组及pVAX1和pEGFP-N1质粒的提取 取2 mL培养至对数生长中后期的Mb菌液,12 000 r/min离心6 min收集菌体,用水浴法粗提Mb基因组。将含有质粒pVAX1和pEGFP-N1的甘油菌在具有卡那抗性的LB固体培养基划线复苏,待其培养至肉眼可见的单菌落时,挑取菌落继续扩大培养,收集相应菌体用质粒小提试剂盒提取质粒。
1.2.2 引物设计 参照GenBank中Mb Hubei-1株TrxR基因序列(CP002513.1)设计引物对Mb-TrxR-FA、Mb-TrxR-RA和Mb-TrxR-Fa、Mb-TrxR-Ra,在上、下游引物5′端引入酶切位点XhoⅠ和BamHⅠ,其顺序依载体而言,pVAX1载体上游引物5′端需引入一段Kozak翻译起始序列和密码子ATG,方能正确启动翻译(表1);实时荧光定量PCR引物参照文献[6]进行(表2)。所有引物由北京擎科生物科技有限公司(西安)合成。

表1 Mb TrxR基因PCR扩增引物信息

表2 实时荧光定量PCR引物信息
1.2.3 MbTrxR基因的扩增 以Mb粗提基因组为模板,用引物对Mb-TrxR-FA、Mb-TrxR-RA和Mb-TrxR-Fa、Mb-TrxR-Ra分别扩增片段MbTrxRA和MbTrxRa,反应体系(50 μL):2×Hieff canace®PCR Master Mix高保真酶预混液25 μL,上、下游引物(10 μmol/mL)各2 μL,模板DNA 3 μL,ddH2O补足50 μL。扩增条件为:98℃ 3 min;98℃ 10 s,退火20 s(MbTrxRA和MbTrxRa片段退火温度分别为57℃和56℃),72℃延伸20 s,32个循环;72℃终延伸 5 min,扩增产物经10 g/L的琼脂糖凝胶电泳分离,回收后置-20℃保存备用。
1.2.4 真核表达载体pVAX-TrxR和pEGFP-TrxR的构建及鉴定 分别取20 μL MbTrxRA和MbTrxRa基因片段,20 μL pVAX1质粒和20 μL pEGFP-N1质粒于4个1.5 mL离心管中,加入以下组分后用限制性内切酶XhoⅠ和BamHⅠ进行双酶切(表3)。

表3 酶切体系
分别将以上组分混合后的离心管置于37℃水浴锅酶切反应7 h,酶切产物用通用型DNA纯化回收试剂盒回收,对酶切后的基因片段与线性载体进行连接、转化。在转化后的固体培养基挑取单菌落经PCR验证和重组质粒酶切验证后测序,正确的质粒分别命名为pVAX-TrxR和pEGFP-TrxR。
1.2.5 重组质粒转染EBL细胞 扩大培养含有质粒pVAX1、pEGFP-N1、pVAX-TrxR、pEGFP-TrxR的大肠杆菌Trans 5α,各取15 mL菌液用无内毒素质粒小提中量试剂盒按说明书提取质粒,重组质粒用超微量分光光度计测取浓度(表4)。将培养至生长状态良好的EBL细胞以每孔4×105个接种至6孔细胞培养板,待其生长至融合度达到85%左右时开始转染。转染前各孔弃原培养液,用0.01 mol/L 磷酸盐缓冲液(PBS)缓慢清洗1次后换成1.8 mL不含胎牛血清(FBS)和抗生素的培养液。
转染时先在洁净无菌的离心管中分别加入100 μL不含FBS与抗生素的高糖DMEM培养基和3 μg的质粒DNA(pVAX1、pEGFP-N1和pVAX-TrxR、pEGFP-TrxR),轻轻吹吸混匀配制成A液,再取无菌离心管加入100 μL不含FBS及抗生素的高糖DMEM培养基和10 μL转染试剂PEI 40 K Transfection Reagent,轻轻吹吸混匀配制成B液,将A液和B液轻微混合后室温孵育15 min,最后将配置好的转染复合物(DNA-PEI)加入到含1.8 mL细胞培养液的6孔细胞培养板中,将细胞放入细胞培养箱进行培养,6 h之后向培养液中加入终浓度3%的FBS,然后每隔24 h换完全培养基(FBS终浓度10%)一次。
1.2.6 MTT法检测细胞增殖 将生长状态良好的EBL细胞以每孔1.5×104个传至96孔细胞培养板,待其融合度达到85%左右时用PBS洗涤细胞一次后换成无血清无抗生素培养基,按1.2.5方法转染细胞,在96孔细胞培养板中依次加入含pVAX1、pVAX-TrxR、pEGFP-N1、pEGFP-TrxR质粒的DNA-PEI 10 μL(96孔细胞培养板DNA和PEI用量分别为0.1 μg/孔和0.35 μL/孔),同时设置加入0.35 μL的PEI和等体积PBS的细胞孔做阴性对照组和空白对照组,每组设3个重复孔,各组细胞依次培养24 h、48 h、72 h,每间隔12 h换一半培养液。各时间段结束后用MTT试剂盒检测分析EBL细胞的增殖情况。
1.2.7 Annexin V-FITC试剂盒检测细胞凋亡 取EBL细胞以每孔3×105个接种至6孔细胞板,待细胞融合度达85%左右时转染,将含pVAX1、pVAX-TrxR、pEGFP-N1、pEGFP-TrxR质粒的细胞及PEI阴性对照组和PBS空白对照组细胞分别培养24 h、48 h、72 h,培养结束后胰酶消化并细胞计数,各组取5×104~1×105个细胞参照Annexin V-FITC细胞凋亡检测试剂盒说明书处理后用流式细胞仪检测Mb TrxR表达对EBL细胞凋亡的影响。
1.2.8 实时荧光定量PCR法检测凋亡因子表达 按1.2.7方法处理细胞,收集细胞后用Trizol法提取总RNA,将RNA逆转录为cDNA,以cDNA为模板,采用实时荧光定量PCR法(GAPDH为内参基因),用2-ΔΔCt方法分析EBL细胞中Bax、Beclin-1、caspase3、caspase4、P53凋亡因子在各时间段受细胞中TrxR蛋白影响的mRNA表达情况。
1.2.9 细胞内过氧化氢(H2O2)含量检测 按1.2.7方法处理后的细胞,PBS洗涤计数后各取5×106个1 500 r/min室温离心8 min,弃去PBS,每个离心管中加入1 mL丙酮后冰浴,用超声破碎仪破碎细胞(功率为20%,工作3 s,间隔3 s,工作3 min),破碎后的细胞按H2O2含量检测试剂盒说明书。检测各时间段Mb TrxR在细胞内表达对细胞内H2O2含量的影响。使用以下公式计算EBL细胞内H2O2的含量。
EBL细胞内H2O2的含量(μmol/104cell)=ΔA测定÷(ΔA标准÷C标液)×V样本÷(500×V样本÷V提取)=0.004×ΔA测定÷ΔA标准。
其中,ΔA测定=A测定管-A空白管,ΔA标准=A标准管-A空白管。
2 结果
2.1 Mb TrxR基因的扩增
以Mb粗提基因组为模板,引物Mb-TrxR-FA、Mb-TrxR-RA和Mb-TrxR-Fa、Mb-TrxR-Ra经PCR分别扩增获得片段MbTrxRA和MbTrxRa,10 g/L的琼脂糖凝胶电泳分离后在凝胶成像仪下可见约952 bp和942 bp大小的目的条带,与预期大小相符(图1)。

M.DNA标准DL 2 000;1.Mb TrxRA扩增结果;3.Mb TrxRa扩增结果;2,4.阴性对照 M.DNA Marker DL 2 000; 1.Mb TrxRA amplification result; 3.Mb TrxRa amplification result; 2,4.Negative control
2.2 真核表达载体pVAX-TrxR和pEGFP-TrxR的构建及鉴定
构建的真核表达载体pVAX-TrxR和pEGFP-TrxR转化后挑取单菌落分别进行PCR鉴定,经PCR鉴定为阳性的菌扩大培养后提取质粒pVAX-TrxR和pEGFP-TrxR,对重组质粒用XhoⅠ和BamHⅠ双酶切,可切出大小约952 bp和942 bp的目的片段(图2)。经双酶切验证后的质粒送生物公司进行测序,结果显示成功获得序列正确的重组质粒。

M.DNA标准DL 2 000;1.Mb TrxRA酶切结果;2.Mb TrxRa酶切结果 M.DNA Marker DL 2 000; 1.Results of Mb TrxRA enzyme digestion; 2.Results of Mb TrxRa enzyme digestion
2.3 pEGFP-TrxR在细胞内的表达情况
由于pEGFP-N1载体带有绿色荧光蛋白(GFP)基因,表达后的GFP在荧光显微镜下有绿色荧光。为了验证质粒的转染效率及重组质粒在EBL细胞中的表达情况,分别将转染质粒pEGFP-N1和pEGFP-TrxR后培养24 h和48 h的EBL细胞用40 mL/L多聚甲醛室温固定30 min,依次用10 μmol/L DiI染色液和PBS 1∶50稀释的 DAPI 染色液对细胞膜和细胞核染色10 min,PBS充分洗涤用抗荧光淬灭剂封片后置于荧光显微镜下观察细胞形态和GFP的表达情况。结果显示,转染pEGFP-N1和pEGFP-TrxR质粒后的EBL细胞内均有GFP蛋白表达且细胞形态正常,GFP表达量随培养时间的增加而增加;转染pEGFP-N1质粒后的EBL细胞(A、C组)GFP表达量明显高于转染pEGFP-TrxR质粒后的细胞(B、D组),B、D组细胞内GFP的表达受到细胞内TrxR表达的影响而低于A、C组(图3)。
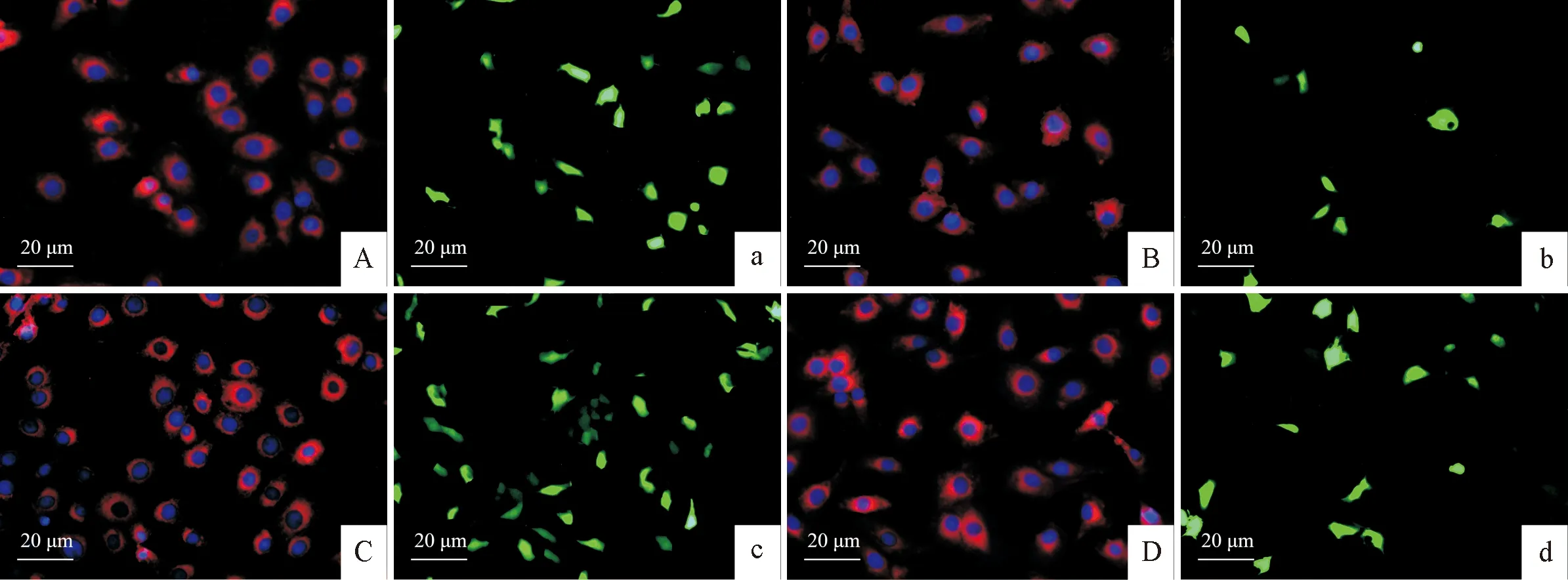
A.pEGFP-N1转染24 h;B.pEGFP-TrxR转染24 h;C.pEGFP-N1转染48 h;D.pEGFP-TrxR转染48 h A.pEGFP-N1transfection 24 h; B.pEGFP-TrxR transfection 24 h; C.pEGFP-N1 transfection 48 h; D.pEGFP-TrxR transfection 48 h
2.4 TrxR胞内表达对EBL细胞增殖的影响
转染pVAX1、pVAX-TrxR、pEGFP-N1、pEGFP-TrxR质粒的试验组及PEI阴性对照组和PBS空白对照组中各组的EBL细胞增殖随时间的增加而增加,由于转染剂及载体本身对细胞的影响,24 h、48 h和72 h三个时间段的EBL活细胞数始终少于PBS空白组(图4),说明PEI对EBL细胞的生长有一定的毒害作用,载体pEGFP-N1与pVAX1对EBL细胞的生长也有很大的影响,相比而言,载体pVAX1对细胞的影响较小,所以pVAX1更有利于外源基因的真核表达。在此试验中,pVAX-TrxR、pEGFP-TrxR实验组细胞增殖明显高于pVAX1、pEGFP-N1对照组,两者差异性极显著,表明细胞内表达的Mb TrxR蛋白促进EBL细胞的增殖。
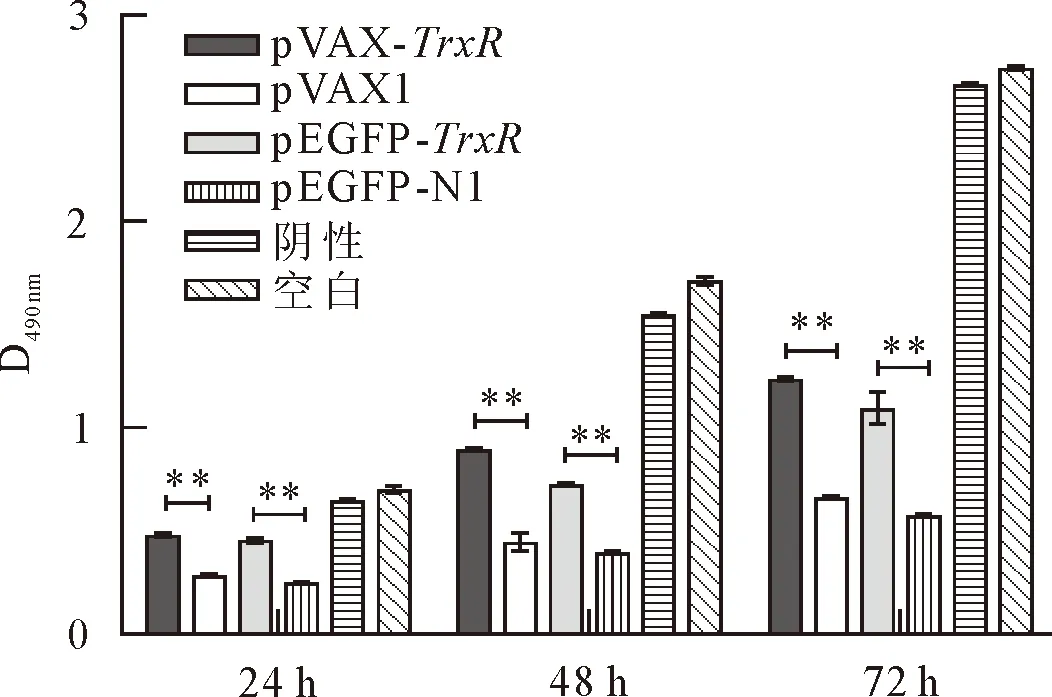
与对应空载体pVAX1、pEGFP-N1组相比,**P<0.01
2.5 TrxR胞内表达对EBL细胞凋亡的影响
将各组细胞培养48 h后用流式细胞术检测。结果显示,由于质粒本身属性对细胞生长的影响,转染pVAX1、pVAX-TrxR、pEGFP-N1、pEGFP-TrxR质粒后的细胞凋亡率高于空白对照组;转染剂对细胞生长的影响,PEI阴性对照组细胞凋亡率略高于空白对照组;空载体pVAX1、pEGFP-N1组细胞凋亡率高于pVAX-TrxR、pEGFP-TrxR试验组,两组差异性显著,载体pVAX1组细胞凋亡率低于pEGFP-N1组(图5),表明胞内表达的Mb TrxR蛋白对EBL细胞的凋亡具有抑制作用,且载体pVAX1更有利于TrxR蛋白的表达和作用的发挥。

与对应空载体pVAX1、pEGFP-N1组相比,*P<0.05Compared with the corresponding empty carriers pVAX1 and pEGFP-N1,*P<0.05
2.6 实时荧光定量PCR检测凋亡标志物mRNA的变化
分析结果表明(图6),由于凋亡因子在细胞生长各期的表达量不同,所以其mRNA表达水平也不相同,在自然凋亡情况下,凋亡因子Beclin-1 mRNA表达量随培养时间的增加呈先降后升的趋势,其他凋亡因子在72 h内与培养时间成正比;仅有PEI的阴性对照组和PBS空白对照组的试验中,凋亡因子Bax、caspase3、P53 mRNA表达水平随培养时间的延长而增加,且PEI组在各时间段略高于PBS组,说明PEI造成细胞损伤加速了其自然凋亡;当载体中TrxR基因表达时EBL细胞的凋亡率低于对应空载体组,且随着培养时间的延长两组细胞中凋亡因子mRNA表达量差异性越显著,载体pVAX1试验组细胞中各凋亡因子在3个时间段均低于pEGFP-N1组,表明pVAX1载体在真核表达中更具优势。此试验中,TrxR蛋白抑制了各凋亡因子的表达,进一步证明了Mb TrxR蛋白具有抑制EBL细胞凋亡的作用。
2.7 EBL细胞中H2O2含量的变化
H2O2含量测定试验结果显示,在未处理细胞组中,H2O2含量在48 h之前随细胞培养时间的延长而降低,由于48 h之后细胞密度增加,产生了过氧化氢酶(CAT)及细胞本身保护性机制的应激作用致使H2O2含量保持在一定的范围;基于pVAX1载体试验中(图7A),重组质粒pVAX-TrxR试验组H2O2含量低于pVAX1空载体组,两组差异性极显著,且pVAX-TrxR组48 h及之后的时间段H2O2的含量低于空白对照组;基于pEGFP-N1载体试验中(图7B),重组质粒pEGFP-TrxR试验组H2O2含量低于pEGFP-N1空载体组,两组在48 h之前具有显著性差异,48 h及之后的时间段H2O2的含量接近空白对照组。载体pVAX1试验组TrxR蛋白对EBL细胞H2O2降低效果较pEGFP-N1载体显著,充分说明了载体pVAX1更适合外源基因在细胞内的表达。此试验验证了TrxR蛋白可以降低细胞内H2O2含量,对细胞有抗氧化损伤的作用。进一步证明了Mb TrxR蛋白有利于促进EBL细胞生长,间接抑制其凋亡。

与空载体组相比,*P<0.05,**P<0.01Compared with pVAX1 empty vector group,*P<0.05,**P<0.01图7 Mb TrxR在细胞内基于载体pVAX1(A)和pEGFP-N1(B)表达后各时间段H2O2含量的变化
3 讨论
硫氧还蛋白系统是体内非常重要的抗氧化系统,该系统包括硫氧还蛋白、TrxR、NADPH、内源性硫氧还蛋白抑制剂和硫氧还蛋白相关蛋白[12]。TrxR作为硫氧还蛋白系统的最主要的蛋白之一,对体内代谢产生的氧化物调节和氧化还原稳态具有重要的作用[13],TrxR也是细胞主要的氧化还原调节因子,能够有效降低细胞产生的活性氧,从而降低对细胞的损伤[14]。研究发现,解脲支原体的硫氧还蛋白系统具有自我排毒的功能,它可以使宿主细胞免受自身代谢产生的氧化物的侵害[15]。抑制TrxR蛋白活性能够促进三阴性乳腺癌(TNBC)细胞的凋亡[16];研究Mb TrxR蛋白对EBL细胞增殖和凋亡的影响,有助于了解该蛋白在Mb感染宿主中发挥的作用,进一步揭示Mb的致病性及逃避和调节宿主反应的策略,为研发有效疫苗奠定基础。
为进一步确认Mb TrxR蛋白的效应,本研究采用真核表达载体pVAX1或pEGFP-N1在EBL细胞内表达Mb TrxR,通过MTT试验和流式细胞技术检测对细胞增殖和凋亡的影响,结果分析发现,Mb TrxR蛋白通过还原细胞内的活性氧包括降低细胞内H2O2的含量调节氧化还原的稳态,进而打造适合细胞生长的环境促进其生长;另一方面,它能够与硫氧还蛋白系统协调,通过激活调节细胞生长的转录因子,增加细胞对其他细胞因子和生长因子的敏感性,从而维持细胞内氧化还原状态的动态平衡[18]。细胞凋亡主要受细胞内死亡受体及线粒体通路的调控[16],而TrxR主要分布在细胞线粒体上,TrxR与细胞凋亡密切相关,研究发现TrxR蛋白通过抑制凋亡因子Bax、caspase3、P53 mRNA的表达量从而下调凋亡因子的表达抑制EBL细胞的凋亡,从细胞培养时间的梯度来看,Mb TrxR在细胞内营造了适合细胞生长的内环境,导致细胞自然凋亡速率减慢,在细胞培养48 h之后,出现过多积累的衰老细胞又可以激活凋亡因子caspase3的表达,使其进一步促进下游效应因子前列腺素E2的表达而刺激活细胞的生长[19]。整体来说,Mb TrxR蛋白作用EBL细胞后,一方面抑制了凋亡因子mRNA的表达,从而抑制EBL细胞的凋亡,另一方面还原Trx在细胞代谢中产生的过氧化物使其免受损伤而进一步保护宿主细胞。细胞线粒体TrxR蛋白抑制细胞凋亡的通路调控,需进一步研究探索。
本试验中基于pVAX1或pEGFP-N1两种载体表达Mb TrxR蛋白,结果显示,pVAX1载体更有利于外源蛋白的表达以及蛋白作用的发挥,而pEGFP-N1载体可以通过本身GFP的表达量来检测外源蛋白TrxR的表达。该试验中Mb TrxR蛋白对EBL细胞作用的初步研究,为进一步了解牛支原体感染机制和制定有效的抗牛支原体策略提供更多可靠的数据。

