燕窝唾液酸在大鼠体内的消化、吸收与利用
徐予浛,谢巧玲,张薇,朱梅珍,陈小旋,郭东北,李永忠,郭建荣,李红卫*
(1.厦门大学公共卫生学院,福建厦门 361102)(2.小鸟鲜燕锦溢(厦门)健康产业有限公司,福建厦门 361006)
燕窝(Edible Bird's Nest,EBN)是一种雨燕科金丝燕属鸟类分泌的唾液与其羽绒混合凝结而成的物质[1]。近年来许多研究证明燕窝具有缓解炎症[2]、降脂[3]、抗氧化[4]等多种生物活性,且对人体软骨及关节软骨细胞具有保护效果[5,6]。
燕窝中的蛋白质主要以糖蛋白的形式存在[7],唾液酸(Sialic Acid,SA)是其重要的糖基之一[8]。唾液酸是一类含有9个碳原子并具有吡喃糖结构的酸性氨基糖的总称,常以α-2,3或α-2,6键与半乳糖或N-乙酰葡糖胺连接(图1),位于酸性N-链寡糖的末端,既能作为激素、凝集素、阳离子等分子的结合配体,又能掩蔽细胞或蛋白本身的关键识别位点;其结构中C1位的羧基化使其带有很强的负电性,负电之间的排斥力影响着分子、细胞间的相互作用[9]。一般所说的唾液酸多指N-乙酰神经氨酸(Neu5Ac),其构成比占该家族所有成员的99%以上。唾液酸在自然界广泛分布,存在于唾液、胃液、血清、尿液、母乳等体液中,或燕窝、牛奶、鸡蛋、奶酪等食物中。外源性唾液酸在机体内的消化吸收与利用途径尚不明确。研究表明大鼠单次口服放射性标记的Neu5Ac后1 h内,90%以上Neu5Ac以原型从尿液中排出[10],说明绝大多数唾液酸不经裂解即以完整形态参与机体代谢,且利用率较低。因此借鉴氮平衡实验原理,通过监测食物中摄入唾液酸、粪尿中排出唾液酸,即可构建机体的“唾液酸平衡”并以此评价外源性唾液酸的消化吸收效率。
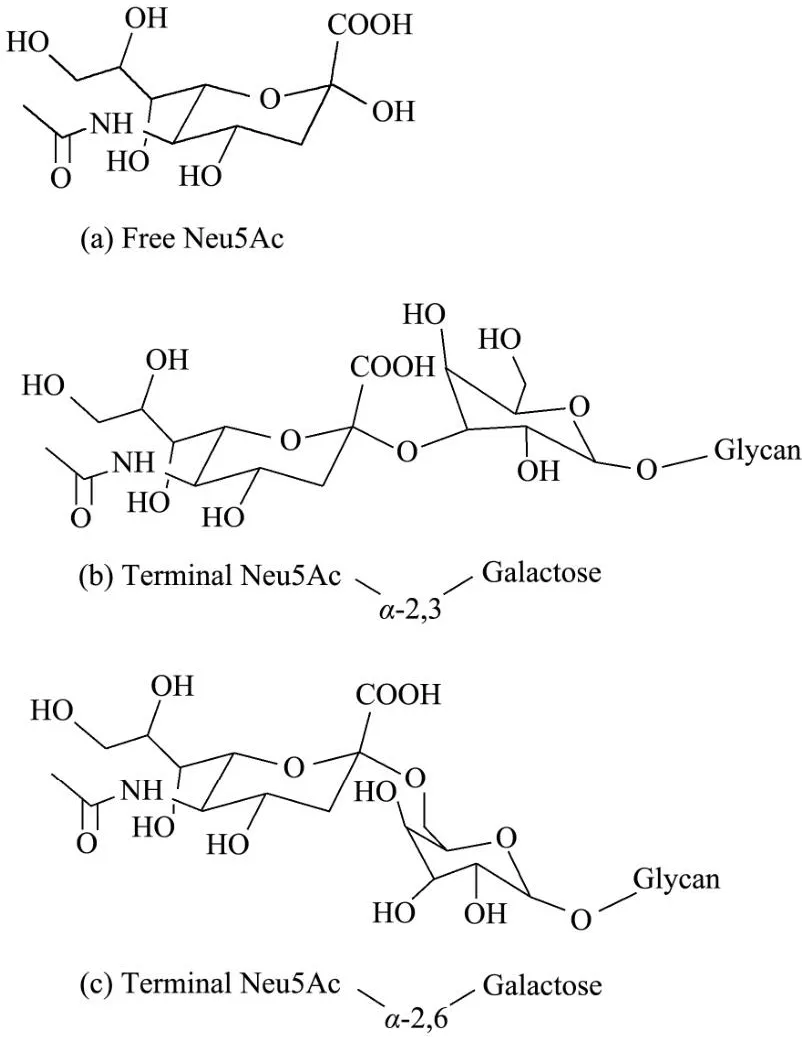
图1 游离Neu5Ac(a)及其通过α-2,3(b)、α-2,6(c)糖苷键连接半乳糖的化学结构式Fig.1 Chemical structural formula of free Neu5Ac (a) and its linkage to galactose via α-2,3 (b) or α-2,6 (c) glycosidic bond

图2 干预期间大鼠体质量变化Fig.2 Body weight alteration in rats during intervention
唾液酸修饰着细胞膜最外层的糖类部分或分泌型的糖蛋白、糖脂与低聚糖等复合糖类的糖链末端。生物大分子的唾液酸化通过掩蔽不利的特异性识别、本身作为被识别的受体、实现细胞间信息传递等来发挥不同的功能,包括对红细胞膜生化性质的改变[11]、抵抗病毒感染[12]、提升学习与记忆能力[13]、调节血脂[14]、改善骨丢失[15]等。有报道称红细胞膜的唾液酸化参与对红细胞生命周期的调控,新生红细胞膜表面唾液酸含量明显高于衰老红细胞[16]。此外,血浆脂蛋白的唾液酸化程度被认为与动脉粥样硬化发展相关[14]。唾液酸化修饰是糖复合物结构和功能多样化的物质基础,是其生物学功能发挥的前提,而食物中的营养物质被吸收后最先经过血液组织,之后才分布于全身,故推测血液唾液酸化状态具有代表性,能够较早反映机体内唾液酸的利用状况。
蛋白质是燕窝中含量最高的营养成分,达50%以上。然而,机体对燕窝蛋白质的消化与生物利用程度有限。研究显示,经胃肠消化后燕窝中蛋白质和唾液酸的溶解度仅有47.23%和44.24%[17]。蛋白质形成肽以后极具活性,可不经消化被机体直接吸收,吸收率提高2~2.5倍[18]。目前常采用体外酶解法将燕窝黏蛋白降解为小分子肽类,以期促进其蛋白质吸收。鉴于蛋白质与唾液酸的溶解性呈正相关性[17],推测肽类也能促进唾液酸等有效成分的生物利用。本研究拟通过动物实验研究含有燕窝肽的即食燕窝、常规炖煮燕窝的唾液酸消化、吸收与利用状况。
1 材料与方法
1.1 材料与试剂
1.1.1 动物
健康成年雄性SPF级SD大鼠32只,体质量200~250 g。购买并饲养于厦门大学实验动物中心SPF级动物实验室,实验动物生产许可证号为SCXK(闽)2018-0003、实验动物使用许可证号为SYXK(闽)2018-0009。动物伦理审批号XMULAC20210010。在22 ℃温度、40%~60%湿度下饲养,12 h明暗交替照明。
1.1.2 受试干预物
采用某燕窝生产加工有限公司提供的含肽款即炖燕窝(0.463±0.011 g Neu5Ac/100 g)、常规款即炖燕窝(0.447±0.019 g Neu5Ac/100 g)分别作为两种燕窝干预物;Neu5Ac标准品(纯度为98% HPLC)作为标准品对照干预物;空白组给予生理盐水。
1.1.3 试剂
Neu5Ac标准品,Sigma;乙腈、甲醇(均为色谱纯),Sigma-Aldrich;冰乙酸,罗恩试剂;磷酸,沪试;聚乙二醇,沪试;硫酸,沪试;氢氧化钠,沪试;硫酸铵,罗恩试剂;硼酸,沪试;异氟烷,深圳瑞沃德;甲基红,国药集团;溴甲酚绿,上海三爱思;PBS-EDTA,海标科技。
1.2 仪器与设备
安捷伦高效液相色谱仪,Agilent 1200;Hypersil™SAX LC色谱柱,Thermo Scientific;Varioskan Flash酶标仪,美国Thermo;VCX-150PB超声粉碎仪,美国Sonics;FRESCO17小型台氏高速冷冻离心机、JXFSTPRP-CL全自动样品冷冻研磨仪、大鼠代谢笼,厦门吉卡。
1.3 动物分组与处理
SD大鼠适应性喂养1 w后,随机分为空白对照组(Blank Control,BC)、含肽燕窝组(Peptide-Containing Edible Bird's Nest,PB)、常规燕窝组(Traditionaledible Bird's Nest,TB)、唾液酸标准品组(SA Standard Control,SC),每组8只。使用相应干预物按动物体质量1%灌胃干预(比例为质量分数)。动物干预如表1所示。动物处理分为唾液酸代谢实验和60 d连续干预实验。

表1 实验动物分组及处理Table 1 Grouping and treatment of rats
表2 干预期间大鼠体质量变化Table 2 Body weight alteration in rats during intervention (±s, n=8, g)
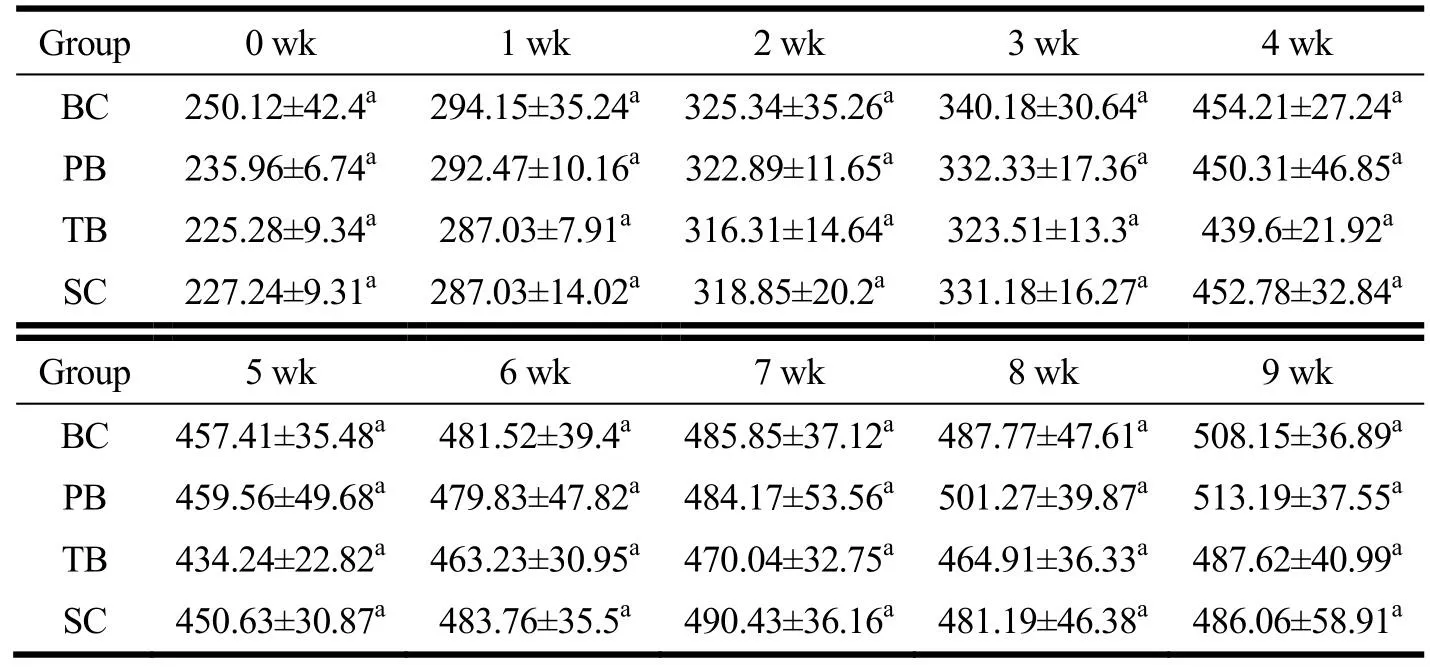
表2 干预期间大鼠体质量变化Table 2 Body weight alteration in rats during intervention (±s, n=8, g)
注:同列右肩相同上标字母表示没有显著差异(P>0.05);BC为空白对照组,PB为含肽燕窝组,TB为常规燕窝组,SC为唾液酸标准品组。
Group 0 wk 1 wk 2 wk 3 wk 4 wk BC 250.12±42.4a 294.15±35.24a325.34±35.26a340.18±30.64a454.21±27.24a PB 235.96±6.74a 292.47±10.16a322.89±11.65a332.33±17.36a450.31±46.85a TB 225.28±9.34a 287.03±7.91a 316.31±14.64a323.51±13.3a 439.6±21.92a SC 227.24±9.31a 287.03±14.02a318.85±20.2a 331.18±16.27a452.78±32.84a Group 5 wk 6 wk 7 wk 8 wk 9 wk BC 457.41±35.48a 481.52±39.4a 485.85±37.12a487.77±47.61a508.15±36.89a PB 459.56±49.68a 479.83±47.82a484.17±53.56a501.27±39.87a513.19±37.55a TB 434.24±22.82a 463.23±30.95a470.04±32.75a464.91±36.33a487.62±40.99a SC 450.63±30.87a 483.76±35.5a 490.43±36.16a481.19±46.38a486.06±58.91a
表3 大鼠唾液酸摄入、吸收与储留量Table 3 Intake, absorption, and retention of sialic acid(±s, n=8, mg/2 d)

表3 大鼠唾液酸摄入、吸收与储留量Table 3 Intake, absorption, and retention of sialic acid(±s, n=8, mg/2 d)
Group Intake Absorption Retention BC 0±0 -0.39±0.96 -0.85±2.85 PB 45.97±0.13 41.96±7.40 36.18±10.98 TB 45.18±0.19 43.72±1.34 35.92±5.41 SC 45.79±0.19 43.19±1.12 36.88±4.41
表4 唾液酸消化、吸收率Table 4 Digestion and absorption of sialic acid (±s, n=8, wt%)
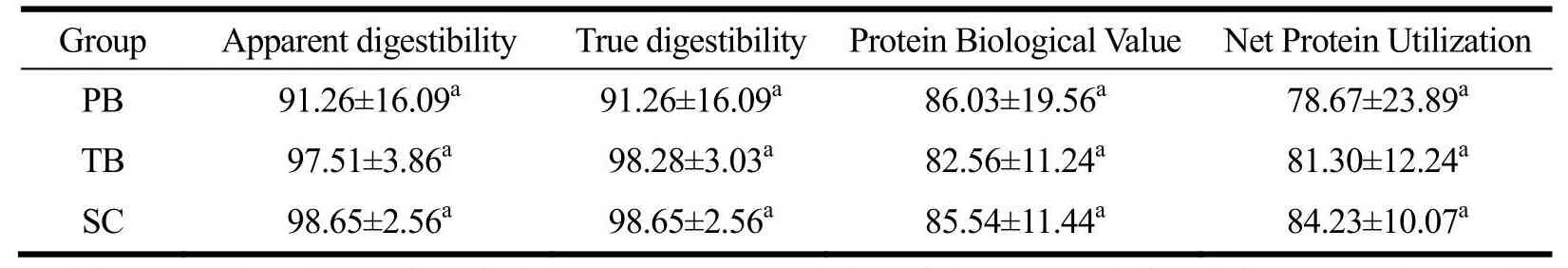
表4 唾液酸消化、吸收率Table 4 Digestion and absorption of sialic acid (±s, n=8, wt%)
注:同列右肩相同上标字母表示没有显著差异(P>0.05);PB为含肽燕窝组,TB为常规燕窝组,SC为唾液酸标准品组。
Group Apparent digestibility True digestibilityProtein Biological ValueNet Protein Utilization PB 91.26±16.09a 91.26±16.09a 86.03±19.56a 78.67±23.89a TB 97.51±3.86a 98.28±3.03a 82.56±11.24a 81.30±12.24a SC 98.65±2.56a 98.65±2.56a 85.54±11.44a 84.23±10.07a
1.3.1 唾液酸代谢实验
参照“食物蛋白质营养学评价”的氮平衡实验方法[19],将大鼠单只喂养于代谢笼中,每日记录唾液酸干预总量,收集期间的全部粪便与尿液,并检测总唾液酸量,计算大鼠唾液酸吸收与储留量,评价唾液酸的消化、吸收程度。此部分实验设计为三阶段:(I)无氮无唾液酸饲料(厦门普宁生物)+无受试物;(II)无氮无唾液酸饲料+受试物;(III)普通有氮饲料(北京维通利华)+受试物。I阶段保证动物无任何外源性唾液酸摄入,从而确定内源性粪、尿代谢唾液酸;II、III阶段唾液酸的来源为内源性与受试物来源唾液酸;III阶段氮绝大部分来源于有氮饲料,小部分来自于内源代谢氮或燕窝中蛋白质,通过阶段间物质含量差值来考察消化吸收状况[19]。每阶段安排2 d作为饮食适应期,2 d作为正式实验期;各阶段之间至少安排3 d作为洗脱期。
1.3.2 60 d连续干预实验
连续60 d使用相应干预物按动物体质量1%灌胃干预。从0 d开始每隔10 d对大鼠进行一次麻醉与颈静脉采血,直至60 d结束时最后一次采血并处死。
1.4 观察指标
1.4.1 体质量
连续干预期间,从0 d起每周记录一次体质量直至60 d结束。
1.4.2 唾液酸摄入、吸收与储存量
粪便处理:唾液酸代谢实验所收集的全部粪便烘干并记录总质量,研磨成均匀的粉末取0.5~5 g用超纯水定容至5 mL,加等体积冰乙酸于100 ℃水浴中水解10 min后取出并冷却至室温。水解液经滤纸过滤后,用流动相定容至100 mL,取上清液用0.45 μm针筒式过滤器过滤,待测。
尿液处理:全部尿液以φ=0.1%硫酸溶液稀释至50 mL,准确吸取2 mL至比色管,加等体积冰乙酸于100 ℃水浴中水解10 min并冷却至室温。将水解液经滤纸过滤后用流动相定容至100 mL,取上清液用0.45 μm针筒式过滤器过滤,待测。
式中:
A——吸收总量,mg/d;
R——储留总量,mg/d;
I——摄入唾液酸总量,mg/d;
F——粪唾液酸,mg/d;
FE——粪内源唾液酸,mg/d;
U——尿唾液酸,mg/d;
UE——尿内源唾液酸,mg/d。
1.4.3 唾液酸消化率、吸收率与净利用率
根据吸收量与储留量,计算唾液酸消化、吸收与利用率。
式中:
A——吸收总量,mg/d;
R——储留总量,mg/d;
I——摄入唾液酸总量,mg/d;
F——粪唾液酸,mg/d;
FE——粪内源唾液酸,mg/d;
AD——表观消化率,wt%;
TD——真消化率,wt%;
BV——生物价,wt%;
NUR——净利用率,wt%。
1.4.4 血浆唾液酸含量、红细胞膜唾液酸含量
血液4 000 r/min,10 min离心,上层血浆用于检测血浆游离唾液酸浓度、血浆蛋白结合唾液酸含量,下层红细胞用于检测红细胞膜结合唾液酸含量。
血浆游离唾液酸[20,21]:取100 μL血浆,加入900 μL流动相(乙腈-0.1%磷酸水溶液60:40,体积比)稀释至1 mL,用0.45 μm针筒式过滤器过滤,待测。
血浆结合唾液酸[20,21]:取100 μL血浆,加入400 μL饱和硫酸铵溶液4 ℃存放8 h沉淀蛋白。15 000 r/min离心15 min,吸取上清,并加入0.2 mol/L稀硫酸1 mL于80 ℃水浴锅中水解120 min,冷却后用0.45 μm针筒式过滤器过滤水解液,待测。
红细胞膜结合唾液酸:0.25 mol/L PBS-EDTA缓冲液(4 ℃预冷,pH值7.6)溶胀红细胞提取红细胞膜,超声粉碎机制成均匀红细胞膜液,蛋白定量试剂盒定量膜蛋白;取600 μL膜液加入1 000 μL、0.05 mol/L稀硫酸,于80 ℃水解120 min,冷却后用0.45 μm针筒式过滤器过滤水解液,待测。
1.5 唾液酸检测方法
使用高效液相色谱(HPLC)测定样品中唾液酸含量[22]。参数:色谱柱:300SCX阳离子交换色谱柱,4.6 mm×250 mm,粒径5 μm;流动相:乙腈-0.1%磷酸水溶液(60:40,体积比);柱温:30 ℃;流速:1.0 mL/min;进样量:10 μL;检测波长:205 nm;检出限:0.003 g/kg。
1.6 数据分析
2 结果与分析
2.1 体质量
干预开始前(0 wk)大鼠体质量236.02 g,各组无统计学差异(F=1.96,P>0.05)。60 d的干预期间,各组大鼠间的体质量始终保持相近(P>0.05)。重复测量方差分析中,体质量不满足球形分布假设(χ2=531.49,P<0.001)。采用Greenhouse & Geisser方法校正后的结果表明,随干预时间推移,大鼠体质量显著增长,60 d时整体水平已增长至498.83 g,干预与时间的交互作用无统计学意义(F=0.48,P>0.05),各组在0~60 d内体质量增长趋势基本一致。
2.2 唾液酸消化、吸收率
鉴于绝大多数唾液酸均以原型形态参与肠内吸收或随粪尿排出[10],参考氮平衡实验模式,本研究建立“唾液酸平衡”评价不同类型燕窝唾液酸的消化、吸收情况。结果如图3所示,在两日的代谢监测期内,由于各组动物体质量、受试物折合唾液酸含量均不同,各组唾液酸摄入量略有差异,BC组无外源性唾液酸摄入。根据粪尿中唾液酸量对吸收与储留唾液酸量进行推算,计算与分析结果显示,PB组的唾液酸摄入、吸收、储留量依次为每两日45.97、41.96、36.18 mg,TB组依次为每两日45.18、43.72、35.92 mg,SC组依次为每两日45.79、43.19、36.88 mg,不同干预组的唾液酸吸收与储留量虽数值上有所差异,但无统计学意义(P>0.05)。
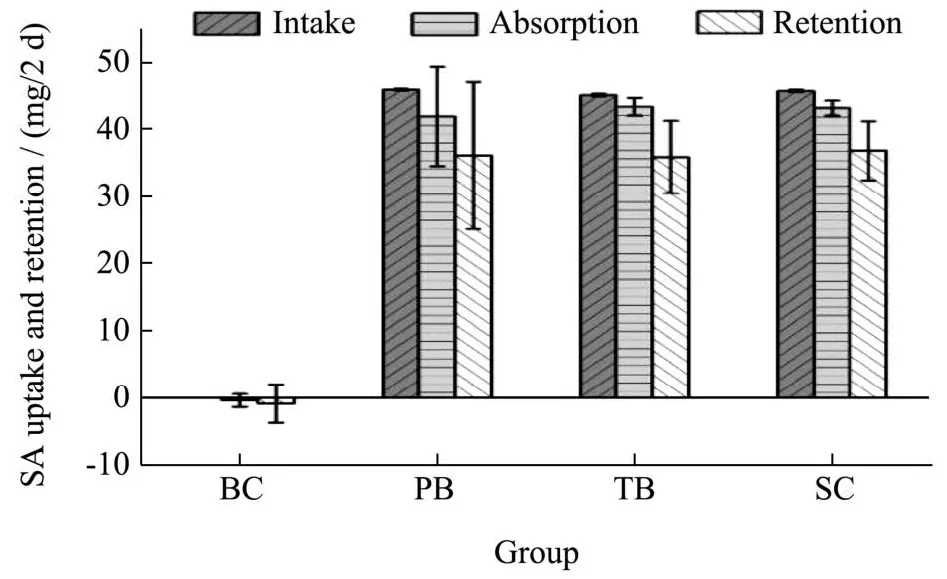
图3 大鼠唾液酸摄入、吸收与储留量Fig.3 Intake, absorption, and retention of sialic acid
图4所示为各干预组唾液酸的表观及真消化率、生物价、净利用率。由于尚未检出大鼠存在内源性的粪代谢唾液酸(TB组检出少量),故目前实验结果表明唾液酸在机体内的表观消化率与真消化率相近。各干预组表观消化率(F=1.05,P>0.05)、生物价(F=1.34,P>0.05)、净利用率(F=0.22,P>0.05)差异均无统计学意义。故尚未从本研究所构建的“唾液酸平衡”中观察到唾液酸标准品、含肽燕窝、常规燕窝中唾液酸的消化率、生物价或净利用率存在明显不同。推测原因有以下两点:一为该平衡实验为短期干预,短时间内外源唾液酸难以实现体内的驻留;二为该方法精确度低,不适用于评价唾液酸此类含量较低生物活性物质的消化吸收。
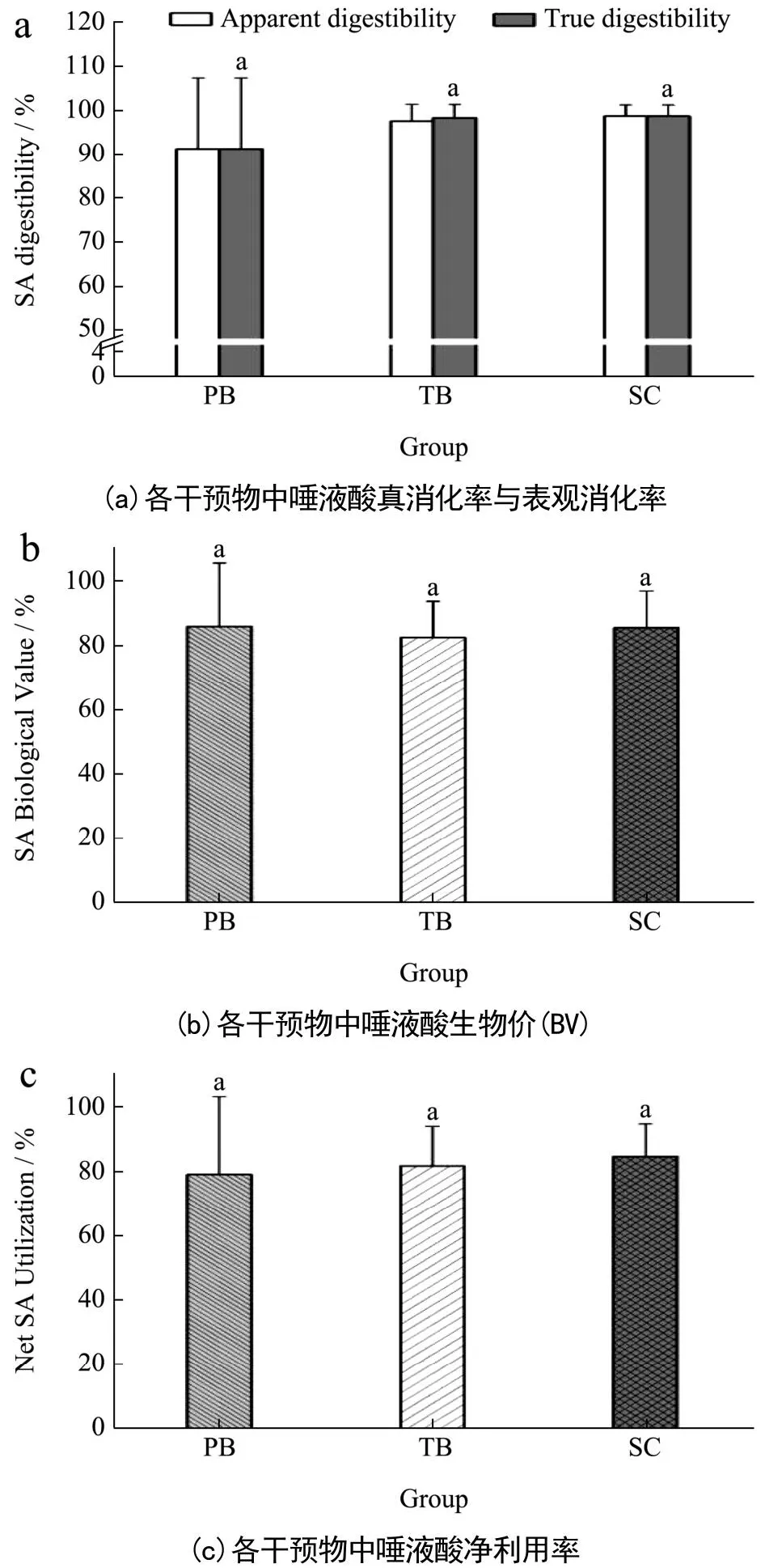
图4 不同干预物中唾液酸的消化、吸收率Fig.4 Digestibility and absorption of sialic acid in different interventions (n=8)

图5 各组血浆游离唾液酸浓度变化Fig.5 The concentration of free sialic acid in the plasma in each group
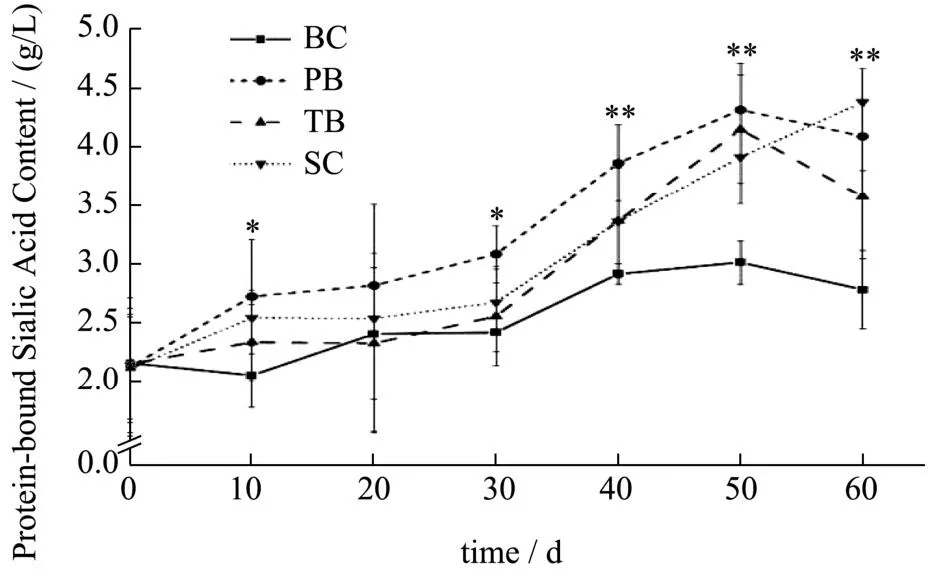
图6 各组血浆蛋白结合唾液酸含量变化Fig.6 The content of protein-bound sialic acid in the plasma in each group
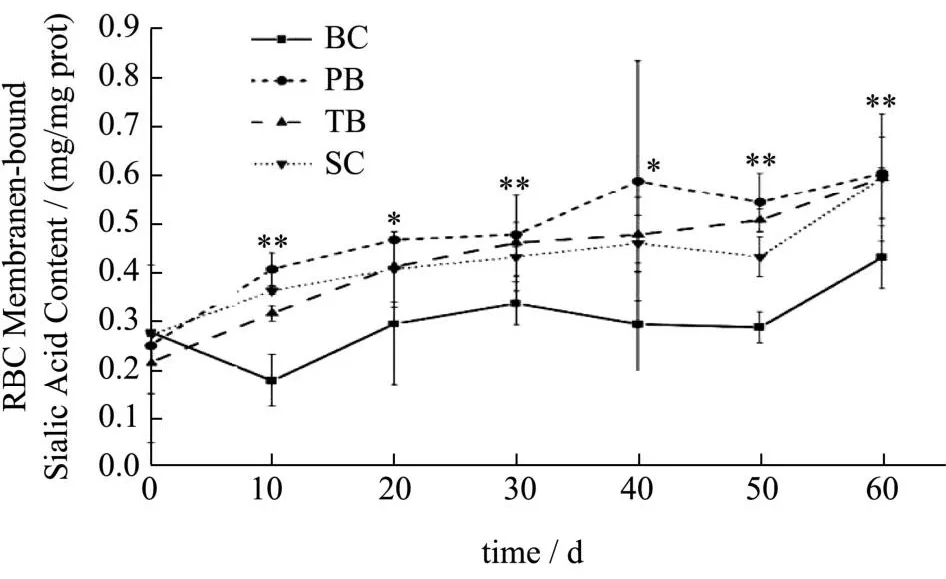
图7 各组红细胞膜结合唾液酸含量变化Fig.7 The content of erythrocyte membrane-bound sialic acid in each group
2.3 血浆游离唾液酸浓度变化
实验进一步通过血液指标考察唾液酸的利用情况。干预期间血浆游离唾液酸浓度的变化如表5所示。血液是外源性唾液酸进入人体被吸收、分布和消除的必经之路,红细胞生命周期短且更新代谢快,可更早、更直接反映外源性唾液酸对机体的影响[23-25]。在长期连续灌胃实验中,除BC组以外,各干预组的血浆游离唾液酸、蛋白结合唾液酸与红细胞结合唾液酸含量均显著升高,因此通过监测血液中唾液酸含量变化来评估外源唾液酸的利用程度是可行的。
表5 各组血浆游离唾液酸浓度变化Table 5 The change in plasma free sialic acid concentration during the intervention (±s, n=8, g/L)
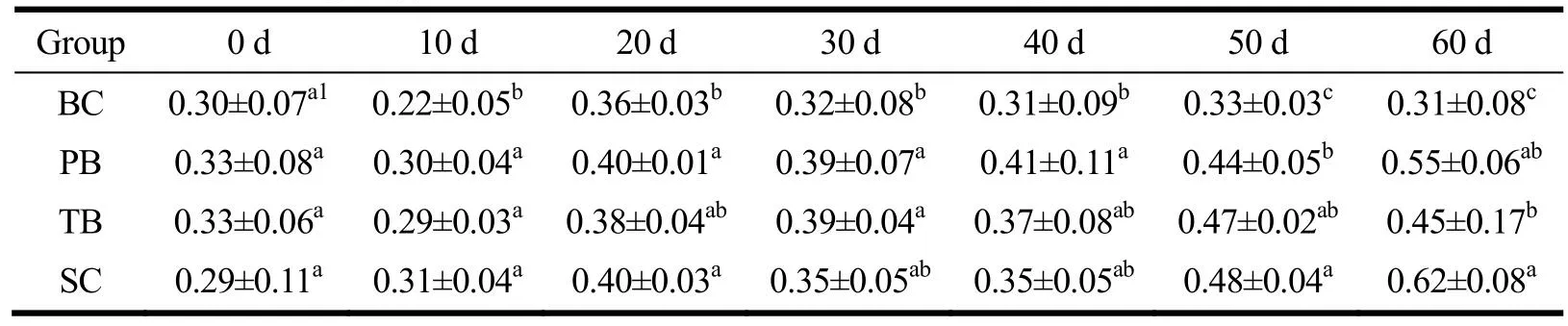
表5 各组血浆游离唾液酸浓度变化Table 5 The change in plasma free sialic acid concentration during the intervention (±s, n=8, g/L)
注:同列右肩完全不同上标字母表示具有显著差异(P<0.05),按均值大小按照a、b、c、d以此类推进行标记;BC为空白对照组,PB为含肽燕窝组,TB为常规燕窝组,SC为唾液酸标准品组。
Group 0 d 10 d 20 d 30 d 40 d 50 d 60 d BC 0.30±0.07a10.22±0.05b 0.36±0.03b0.32±0.08b0.31±0.09b0.33±0.03c 0.31±0.08c PB 0.33±0.08a0.30±0.04a 0.40±0.01a0.39±0.07a0.41±0.11a0.44±0.05b 0.55±0.06ab TB 0.33±0.06a0.29±0.03a 0.38±0.04ab0.39±0.04a0.37±0.08ab0.47±0.02ab 0.45±0.17b SC 0.29±0.11a0.31±0.04a 0.40±0.03a0.35±0.05ab0.35±0.05ab0.48±0.04a 0.62±0.08a
干预前大鼠血浆游离唾液酸浓度整体水平为0.31 g/L,经60 d干预后,干预组浓度比BC组提高了约45.16%~100.00%。对大鼠血清游离唾液酸浓度进行重复测量方差分析,数据不符合球形分布假设(χ2=94.41,P<0.001)。Greenhouse-Geisser的检验结果显示,时间与不同干预物的交互效应显著(F=10.04,P<0.001)。简单效应分析结果显示,实验初始(0 d)时,干预受试物的简单效应无统计学意义(F=1.21,P>0.05);自给予受试物干预10 d开始至60 d干预结束,绝大多数时间点的干预受试物的简单效应具有统计学意义(P<0.05),在40 d时干预物简单效应无统计学意义(P>0.05)。多重比较发现,此期间(10~60 d)PB组浓度始终高于BC组(P<0.05);SC组在50~60 d时间点的血浆游离唾液酸浓度超过两组燕窝干预组(P<0.05)。在干预10 d时PB组、TB组和SC组的血浆游离唾液酸浓度均比初始含量有所提高(P<0.05),并持续升高。时间的简单效应在各干预组都具有统计学意义(P<0.05),但并非持续升高,不同干预组均在某些时间点血浆游离唾液酸浓度达到高峰,并开始回落,可能是频繁采血造成的贫血所致。
2.4 血浆蛋白结合唾液酸含量变化
唾液酸的修饰对象包括血浆脂蛋白、血液中多种蛋白因子、细胞表面蛋白和糖脂分子等。干预期间大鼠血浆蛋白结合唾液酸含量如表6所示,干预前大鼠血浆蛋白结合唾液酸含量整体水平为2.14 g/L,经60 d干预后,干预组浓度比BC组提高了约28.32%~56.99%。结合本章2.3的结果可见,游离唾液酸浓度上升幅度小,血浆蛋白结合唾液酸则相对稳定上升。游离唾液酸在体内滞留时间短,可能被快速排出体外,或进一步被唾液酸转移酶修饰于大分子表面,从而转为结合形态间接被机体利用。血浆中蛋白结合唾液酸含量是游离唾液酸的10倍左右,是极具观测意义的指标。
表6 各组血浆蛋白结合唾液酸含量变化Table 6 The change in plasma protein-bound sialic acid content during the intervention (±s, n=8, g/L)
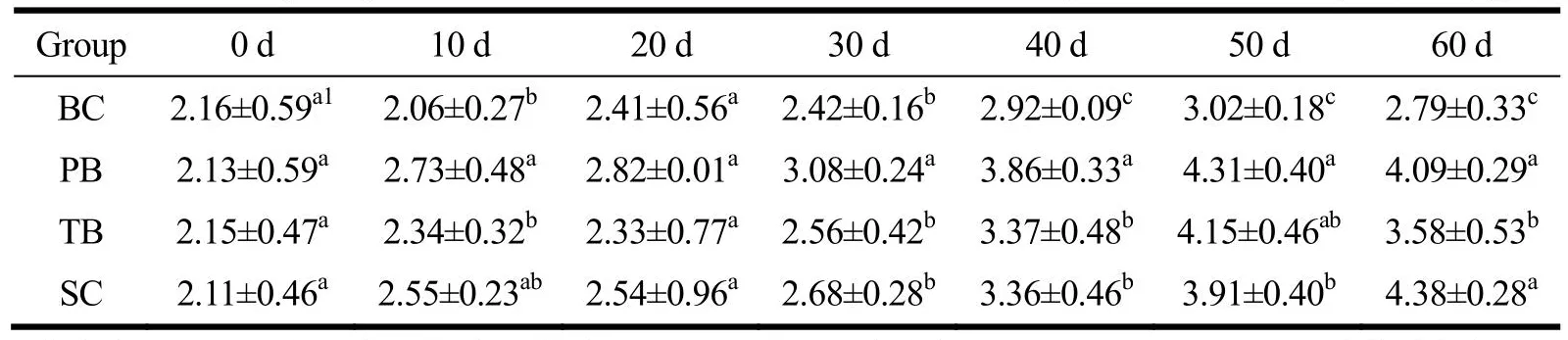
表6 各组血浆蛋白结合唾液酸含量变化Table 6 The change in plasma protein-bound sialic acid content during the intervention (±s, n=8, g/L)
注:同列右肩完全不同上标字母表示具有显著差异(P<0.05),按均值大小按照a、b、c、d以此类推进行标记;BC为空白对照组,PB为含肽燕窝组,TB为常规燕窝组,SC为唾液酸标准品组。
Group 0 d 10 d 20 d 30 d 40 d 50 d 60 d BC 2.16±0.59a1 2.06±0.27b 2.41±0.56a2.42±0.16b2.92±0.09c3.02±0.18c 2.79±0.33c PB 2.13±0.59a 2.73±0.48a 2.82±0.01a3.08±0.24a3.86±0.33a4.31±0.40a 4.09±0.29a TB 2.15±0.47a 2.34±0.32b 2.33±0.77a2.56±0.42b3.37±0.48b4.15±0.46ab 3.58±0.53b SC 2.11±0.46a 2.55±0.23ab 2.54±0.96a2.68±0.28b3.36±0.46b3.91±0.40b 4.38±0.28a
表7 干预期间各组红细胞膜结合唾液酸含量变化Table 7 The change in erythrocyte membrane-bound sialic acid content during the intervention (±s, n=8, mg/mg pro)
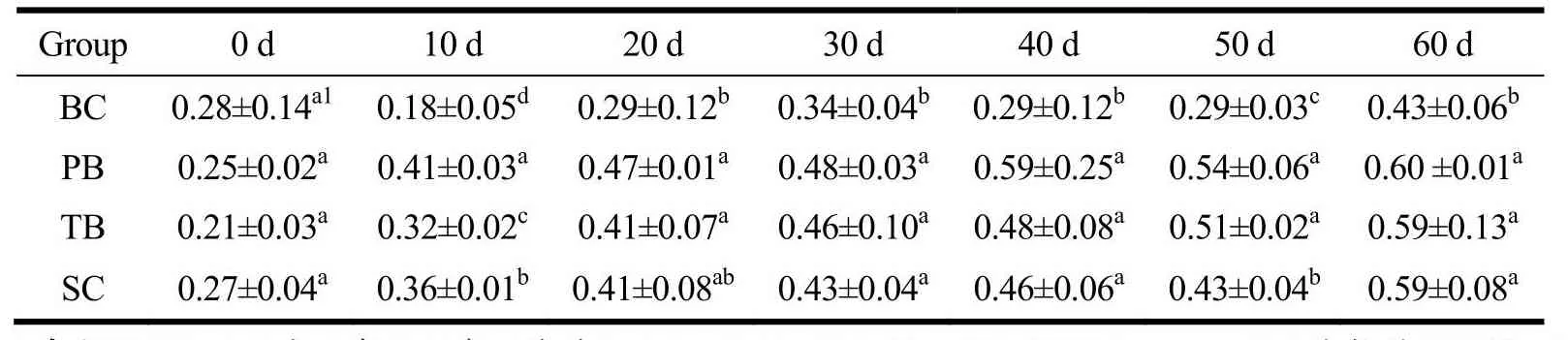
表7 干预期间各组红细胞膜结合唾液酸含量变化Table 7 The change in erythrocyte membrane-bound sialic acid content during the intervention (±s, n=8, mg/mg pro)
注:同列右肩完全不同上标字母表示具有显著差异(P<0.05),按均值大小按照a、b、c、d以此类推进行标记;BC为空白对照组,PB为含肽燕窝组,TB为常规燕窝组,SC为唾液酸标准品组。
Group 0 d 10 d 20 d 30 d 40 d 50 d 60 d BC 0.28±0.14a1 0.18±0.05d 0.29±0.12b0.34±0.04b0.29±0.12b0.29±0.03c 0.43±0.06b PB 0.25±0.02a 0.41±0.03a 0.47±0.01a0.48±0.03a0.59±0.25a0.54±0.06a 0.60 ±0.01a TB 0.21±0.03a 0.32±0.02c 0.41±0.07a0.46±0.10a0.48±0.08a0.51±0.02a 0.59±0.13a SC 0.27±0.04a 0.36±0.01b 0.41±0.08ab0.43±0.04a0.46±0.06a0.43±0.04b 0.59±0.08a
对大鼠血浆蛋白结合唾液酸含量进行重复测量方差分析,数据不符合球形分布假设(χ2=107.88,P<0.001)。Greenhouse-Geisser的检验结果显示,时间与不同干预物的交互效应显著(F=12.29,P<0.001)。简单效应分析结果显示,在干预10 d以及30 d往后的所有时间点,干预物的简单效应均存在统计学意义(P<0.005)。多重比较发现,PB、SC组大鼠的血浆蛋白结合唾液酸含量较早高于了BC组,在10 d时PB组蛋白结合唾液酸含量已较BC组提高约32.52%(P<0.05),TB组在40 d时方较BC组提高27.74%;给予干预10 d起PB组的含量最先高于TB组与SC组(P<0.05);在干预后期,各干预组的血浆蛋白结合唾液酸含量逐渐趋于一致,在60 d时干预组整体水品达到4.02 g/L,显著高于此时的BC组2.79 g/L。时间的简单效应在各干预组都具有统计学意义(P<0.05),30 d及往后时间点血浆蛋白结合唾液酸含量均高于0 d时的初始含量。目前研究已发现血浆载脂蛋白A-II、B-48、B-100、C-II、C-III、D、E、J均存在唾液酸化修饰[26-28];高密度脂蛋白和低密度脂蛋白的去唾液酸化与动脉粥样硬化、2型糖尿病的发生有显著相关性[29-31],蛋白表面唾液酸的修饰水平影响着机体的健康状况。
2.5 红细胞膜结合唾液酸含量变化
干预前大鼠红细胞膜结合唾液酸含量整体水平为0.25 mg/mg prot,经60 d干预后,干预组浓度比BC组提高了约37.21%。唾液酸被认为能够影响红细胞的形态、携氧能力、膜变形性、氧合能力,甚至血红蛋白(Hb)分子的结构和分布[32-34,16]。有报道称酶法去除红细胞膜表面部分唾液酸后,红细胞聚集程度增加,且生化特性与细胞存活时间都受到影响。红细胞的抗聚集能力主要源于其自身的电负性,而红细胞90%的负电荷均为唾液酸所提供[35]。因此,红细胞表面唾液酸的准确表达对生理和病理过程至关重要[36]。
对大鼠红细胞膜结合唾液酸含量进行重复测量方差分析,数据不符合球形分布假设(χ2=95.34,P<0.001)。Greenhouse-Geisser的检验结果显示,时间与不同干预物的交互效应显著(F=5.30,P<0.001)。简单效应分析结果显示,从给予受试物干预10 d开始至60 d干预结束,受试物的简单效应始终具有统计学意义(P<0.005)。多重比较发现,10~60 d各干预组红细胞膜结合唾液酸含量均高于BC组(P<0.05);干预组中的PB组含量均值高于其他组,在10 d时与TB组、SC组差异具有统计学意义(P<0.05);SC组的红细胞膜结合唾液酸含量在10 d、50 d这些时间点上都显著低于PB组与TB组(P<0.05)。PB组、TB组和SC组的红细胞膜结合唾液酸含量值均在干预10 d时与初始含量出现显著差异(P<0.05),并持续升高,干预结束时干预组整体水平达到0.59 mg/mg prot,显著高于BC组的0.43 mg/mg prot。
结合2.4、2.5的结果,可认为在长期唾液酸负荷下,血液中蛋白与红细胞的唾液酸化程度能够显著提高。时间效应,即受试物长期干预所提供唾液酸的累积,是最主要的效应。50~60 d血液唾液酸含量下降,可能是频繁采血致贫血的影响,而40~50 d期间血液唾液酸指标基本达到高峰,建议该方法评价实验以40~50 d为宜。
蛋白质被吸收前,需在体内消化酶的作用下依次分解为多肽、寡肽、游离氨基酸。除游离氨基酸外,寡肽也被证实能在肠道直接吸收[37],并参与机体组织蛋白的再生与合成[38,39]。寡肽被认为能够起载体作用,将食物中的营养物质运载输送到机体各细胞、组织与器官,促进其他营养成分的吸收。本次受试燕窝的蛋白质消化、吸收率未观察到明显差异,故文中不予赘述。但长期干预过程中,含肽的PB组血浆蛋白结合唾液酸、红细胞膜结合唾液酸含量较早出现升高现象,在多个时间点均高于TB、SC组。因此推测燕窝肽可能有利于唾液酸分子穿过肠道粘膜细胞,或促进燕窝中唾液酸的利用,在机体内更早实现高水平的唾液酸化。
在干预60 d时TB组的血浆蛋白结合唾液酸、红细胞膜唾液酸含量已与PB组接近,说明在保证长期摄入的前提下,各类燕窝产品均能起到提高机体唾液酸化程度的作用,无论是否加入燕窝肽类物质。且在一定时刻,机体唾液酸化水平会达到某种饱和状态,推测机体本身可能存在唾液酸的平衡机制,唾液酸化修饰存在饱和状态。因此外源性唾液酸的补充应遵循长期且适量的原则。
3 结论
燕窝的摄入提高了机体血液中唾液酸的含量,燕窝中唾液酸的体内利用程度可具体体现在血浆游离唾液酸浓度、蛋白结合唾液酸含量、红细胞膜唾液酸含量等指标上。燕窝中的肽类物质能够促进唾液酸的利用,有助于外源性唾液酸在各类蛋白、红细胞表面的修饰,可帮助机体在早期实现唾液酸化水平的突破。各类燕窝经30 d以上连续食用均能提高机体唾液酸化水平,且比摄入游离唾液酸更早出现效果。

