HIV-1感染者抗病毒治疗后耐药突变与影响因素分析
张鑫愉,刘萌,唐湘云,李维民,马峰,李岩,王莹莹,安宁,路新利,
Ⅰ型人类免疫缺陷病毒(human immunodeficiency virus type one,HIV-1)在复制过程中极易发生突变,产生耐药毒株,并成为抗逆转录病毒治疗(antiretroviral therapy,ART)成功的主要障碍。目前我国标准化的一线和二线方案分别为替诺福韦/齐多夫定+拉米夫定+依非韦伦/奈韦拉平(TDF/AZT+3TC+EFV/NVP)和替诺福韦/齐多夫定+拉米夫定+克力芝(TDF/AZT+3TC+LPV/r)[1],随着“发现即治”等抗病毒治疗策略的广泛实施,HIV-1耐药毒株不断出现,并可能在人群中传播,为艾滋病防治工作带来了新的挑战[2]。如在治疗前和治疗不佳时进行耐药检测,及早发现耐药毒株、了解因治疗引起的突变情况,就可及时调整治疗方案,抑制耐药毒株的传播。本研究采用耐药基因型检测方法对河北省HIV-1感染者抗病毒治疗后失败人群进行耐药基因突变调查,以了解该地区HIV-1获得性耐药(acquired drug resistance, ADR)的突变情况和流行特征,为制定有效的高效抗病毒治疗方案提供科学参考。
1 材料与方法
1.1研究对象 以2019年采集的136例河北省参加抗病毒治疗后治疗失败(病毒载量≥1 000 CPs/mL)的HIV-1患者的全血为研究对象,测定CD4+T淋巴细胞(以下简称“CD4细胞”)计数。分离血浆后进行病毒载量测定和耐药基因型检测。在患者知情同意情况下,通过面对面问卷调查获得研究对象的基本人口学特征、感染途径、抗病毒治疗等基本信息。本研究已获得河北省疾病预防控制中心伦理委员会批准。
1.2方法
1.2.1CD4细胞数和病毒载量测定 取50 μL抗凝全血,采用流式细胞计数方法检测CD4细胞数;应用Roche公司全自动病毒载量检测仪(COBAS AmpliPrep/COBAS TaqMan)及配套试剂盒(COBAS AmpliPrep/COBAS TaqMan HIV-1 Test v2.0,Lot:10H27383)检测,HIV-1 RNA病毒载量线性范围:20~1.0×107CPs/mL。
1.2.2病毒核酸提取 用上海罗氏制药有限公司生产的提取试剂盒(MagNA Pure LC Total Nucleic Acid Isolation Kit,Lot:49167000)及全自动核酸提取仪(MagNA Pure 96)进行HIV-1病毒核酸提取。
1.2.3病毒基因扩增和测序 采用in-house法[3]针对病毒pol区蛋白酶和逆转录酶基因编码区基因(1.3 kb,HXB2:2550-3870)进行扩增。扩增试剂使用Takara的One step RNA PCR Kit,2×Taq PCR预混试剂。最终PCR产物经1%琼脂糖凝胶电泳鉴定后,阳性样本送北京博迈德基因测序有限公司进行测序。
1.2.4序列分析 使用Sequencher5.4.5对返回的原始反应序列进行拼接,拼接后采用MEGA 6. 0. 6软件(Clustal W)进行序列的比对、剪切和清理。将获得序列上传至Stanford University的HIV Drug resistance database在线数据库(https://hivdb.stanford.edu/),使用HIV db Program在线程序分析基因型耐药突变和药物敏感性。
1.2.5基因型判定 将获得的序列与Los Alamos HIV 数据库(https://www.hiv.lanl.gov/content/sequence/HIV/mainpage.html)中的HIV-1亚型进行比对,并使用HIV Blast在线软件(https://www.hiv.lanl.gov/content/sequence/BASIC_BLAST/basic_blast.html)进行校对确认。
1.2.6统计学分析 用Excel2019整理各种突变位点的突变频数和耐药强度;应用SPSS23.0进行统计学处理分析。将基本流行特征中各变量和是否发生耐药进行单因素Logistics回归分析,将P<0.1的特征纳入多因素回归分析。
2 结果
2.1基本流行特征 成功扩增的136例HIV-1感染者中,以男性(83.82%,114/136)、25~49岁(67.65%,92/136)为主;感染者职业农民占大多数(47.79%,65/136);感染途径主要是同性传播(75.00%,102/136),其次是异性传播(13.97%,19/136);136例感染者多以一线药物为首选治疗方案(68.38%,93/136)。
2.2基因型分析 获得136条有效pol区基因序列,样本扩增成功率为100%。基因型分析显示CRF01_AE亚型、B亚型、CRF07_BC亚型、CRF55_01B亚型和其他亚型(A亚型、C亚型、CRF08_BC亚型、CRF68_01B亚型)占比分别为40.44%(55/136)、23.53%(32/136)、22.79%(31/136)、4.41%(6/136)和8.82%(12/136)。
2.3靶基因耐药情况 对获得基因序列的136例已治疗样本进行耐药位点突变分析,结果表明共106例发生耐药突变,其中2例虽然产生耐药位点突变,但并未导致对靶基因药物产生耐药性,耐药发生率为76.47%(104/136);产生耐药的104例样本中,94.23%(98/104)对NNRTIs耐药,其中80例对奈韦拉平(NVP)高度耐药,77例对依非韦伦(EFV)高度耐药;68.27%(71/104)对NRTIs 耐药,其中对拉米夫定(3TC)和恩曲他滨(FTC)高度耐药最为严重,都为56例,其次是阿巴卡韦(ABC)为41例;对蛋白酶抑制剂(protease inhibitors,PIs)药物耐药情况为1例潜在耐药。交叉耐药情况为:交叉耐药占全部耐药者的68.38%(68/104),其中65例对NRTIs和NNRTIs类药物同时耐药,3例对NNRTIs,NRTIs和PIs同时耐药。
2.4两种药物突变位点分析 结果显示,在136例样本中,106例样本存在突变位点,其中104例样本产生耐药,未产生耐药的2例分别在PIs次要编码区的Q58E和NRTIs编码区的V75I,这两个位点未导致对目前艾滋病抗病毒药物中蛋白酶抑制剂和核苷类逆转录酶抑制剂的耐药。NRTIs耐药突变位点主要是M184V/I,突变率为71.83%(51/71),此位点对FTC和3TC高度耐药,对ABC低度耐药(增加对AZT和TDF的敏感度);其次是K65R,突变率为43.66%(31/71),此位点对ABC、FTC、3TC中度耐药,对TDF高度耐药;其他常见NRTI耐药突变位点情况为:Y115F突变率19.72%(14/71)、D67N突变率14.08%(10/71)、A62V突变率12.68%(9/71)。NNRTIs耐药突变位点主要是K103N,突变率28.57%(28/98)和V106M,突变率27.55%(27/98),K103N对EFV和NVP高度耐药,V106M对EVF和NVP高度耐药,对DOR中度耐药;其他常见NNRTI耐药突变位点情况为:Y181C突变率21.43%(21/98)、V179D突变率19.39%(19/98)、G190S突变率16.33%(16/98)、F227L突变率10.20%(10/98)。具体耐药突变发生情况和耐药程度见表1~2。
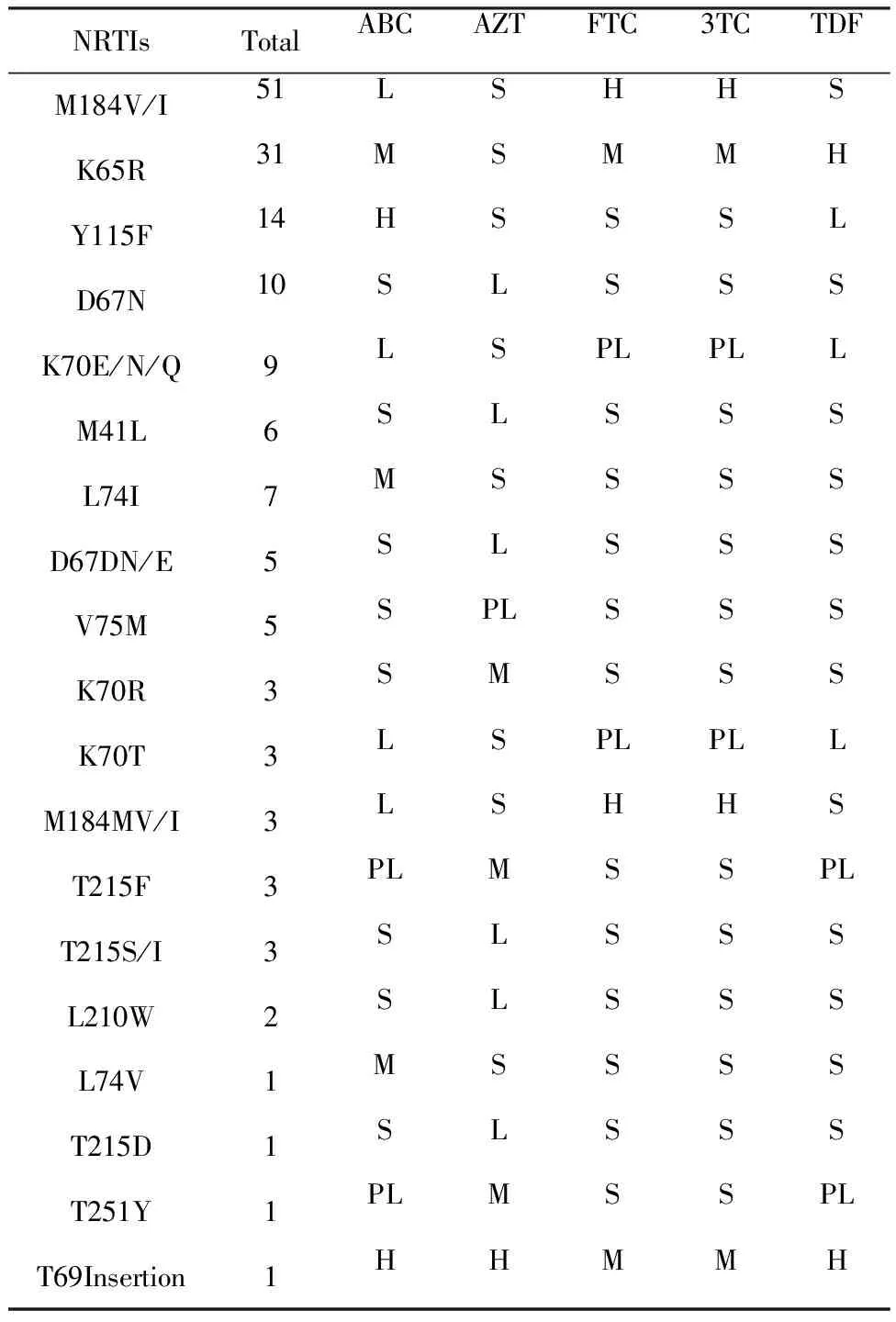
表1 NRTIs类耐药突变类型的各位点突变频数和耐药情况
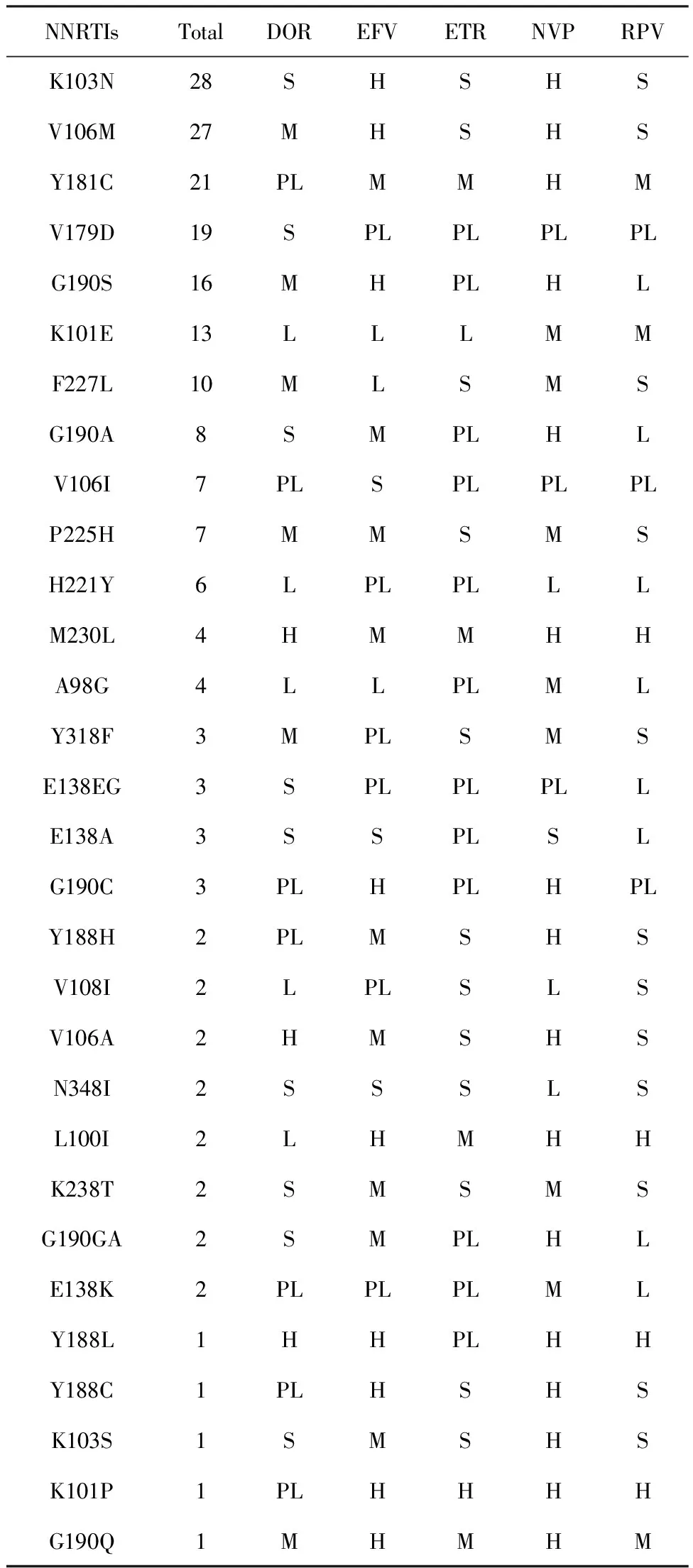
表2 NNRTIs类耐药突变的各位点突变频数和耐药情况
此外,对经过抗病毒治疗的136例患者进行亚型分析,其中55例CRF01_AE患者中46例发生耐药,占所有耐药亚型的44.23%(46/104),其次为B亚型24.04%(25/104)。分析不同亚型上几种常见突变位点的发生频率,使用χ2检验(H0:3种亚型不同位点分布有关联;H1:3种亚型不同位点分布无关联),差异无统计学意义(P>0.05),详情见表3。
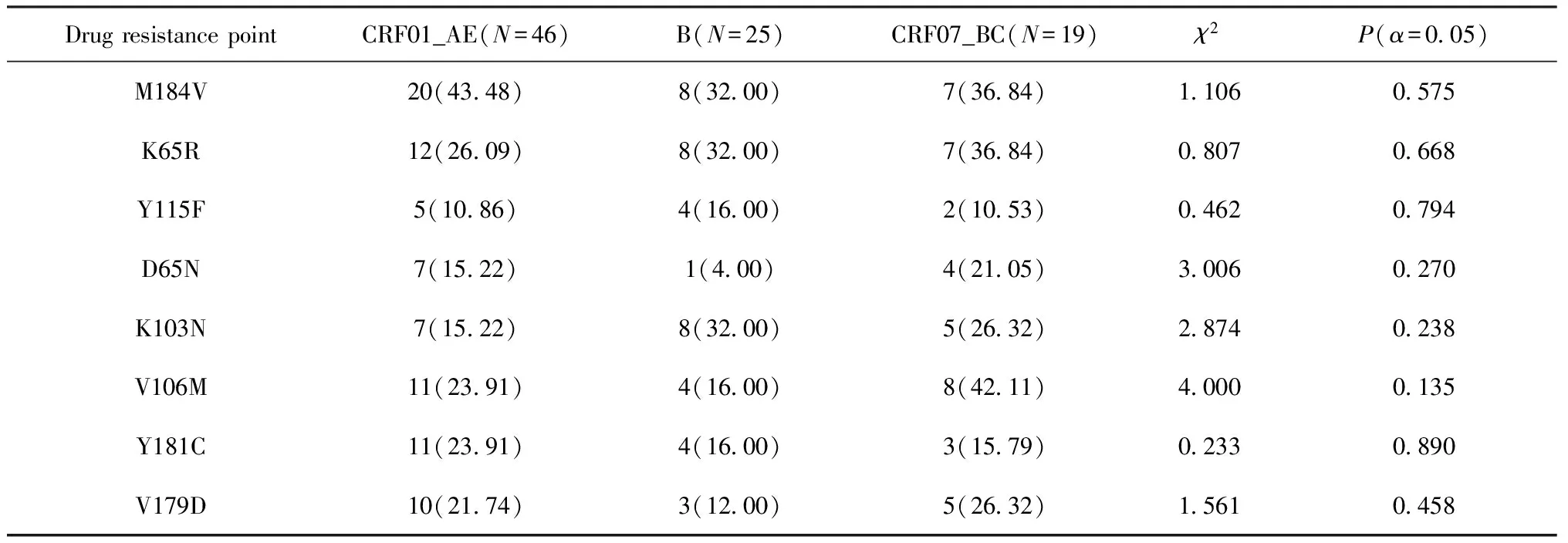
表3 耐药位点突变频率在主要亚型间的情况分析 例(%)
2.5不同治疗药物耐药差异 NNRTIs类突变和NRTIs类突变的情况比较差异有统计学意义(χ2=11.391,P=0.001)。
2.6发生HIV-1获得性耐药的影响因素 对各项人口流行病学分布特征和是否产生耐药进行单因素Logistic回归分析方法筛选危险因素,P<0.2(α=0.2)的变量纳入多因素Logistics回归分析,结果显示民族和传播途径是影响获得性耐药发生的独立危险因素。与汉族相比,少数民族是影响ADR发生的保护因素;与血液传播相比,同性传播,异性传播和母婴传播是ADR的危险因素。将民族和传播途径纳入多因素Logistics回归分析,P>0.05(α=0.05),最终无危险因素进入模型,见表4。

表4 基本流行特征和研究对象耐药影响因素分析
3 讨论
截至2019年12月底,河北省累计报告现存活HIV/AIDS患者 13 620例,报告死亡2 374例,全省人群感染率17.94/10万,属于低流行省份。但近年来传播途径发生变化,传播人群呈多样化,以及耐药基因突变给河北省AIDS防治带来新的挑战[4]。在本次研究纳入的136例有效样本中,同性传播为主要的传播途径,所占比例为75.00%(102/136)。男男性行为者(men who have sex with men, MSM)由于对自我保护的意识不强,高危性行为普遍,是AIDS感染的高危人群[5]。年龄分布多以青壮年为主(67.65%,92/136)。职业多以农民为主(47.79%,65/136),该群体文化程度有限,在艾滋病的防治工作中,应对该人群重点进行宣传教育[6]。HIV-1是一种RNA逆转录病毒,每天约复制107~108轮[7],其功能酶编码基因上药物作用靶点发生基因突变,则产生耐药性,耐药突变给抗病毒治疗带来巨大障碍。本研究中ADR耐药率为76.47%(104/136),相较于往年(2017年,51.92%)明显升高[8],这可能与近些年抗病毒药物的广泛使用密切相关[9]。ADR耐药构成比与亚洲国家类似,低于欧美发达国家[10]。耐药基因型检测耐药率表明了本省抗病毒治疗失败的人群中有23.53%(32/136)病毒学抑制失败的个案与基因型耐药无关,提示了本省艾滋病抗病毒治疗工作中应加强服药监督和依从性教育[11]。
本研究发现产生耐药突变的104例样本中,NRTIs类耐药位点中M184V/I突变频率最高(71.83%,51/71),其次为K65R(43.66%,31/71)。本次研究发现有部分研究对象具有潜在HIV耐药突变位点(PIs次要编码区Q58E,NRTIs编码区的V751),这些位点虽然并不在WHO推荐的耐药位点列表中,但这些耐药突变位点如与其他位点联合作用的话,可能会造成HIV感染者对抗病毒治疗药物的潜在耐药。
通过对三种常见亚型(CRF01_AE,B,CRF07_BC)上8种突变频率较高的位点进行χ2检验,差异均无统计学意义,但可通过每一位点在不同亚型上的突变率发现显著差异,如NNRTIs类位点V106M在CRF07_BC亚型和B亚型上的突变频率为42.11%和16.00%,该结果虽无统计学意义,但仍值得注意,造成此结果的原因有可能是样本量过小,接下来的研究可适当增加样本量。
随着发现即治疗政策的实施,ART范围进一步扩大,HIV-1耐药基因突变已成为治疗效果下降的主要原因[12]。通过单因素Logistics回归对耐药发生率和治疗方案进行分析,差异无统计学意义。对NNRTIs类耐药突变和NRTIs类耐药突变的频率进行χ2检验,差异有统计学意义,这是由于一线药物的治疗方案多为两种非核苷类逆转酶抑制剂+一种核苷类逆转录酶抑制剂[13],而目前由TDF、3TC和EFV组成的联合治疗方案是我国最常用的免费一线治疗方案[14](此次研究中占比67.2%),造成了研究对象的NNRTIs类的药物突变率更高。
对影响获得性耐药发生的危险因素进行Logistics回归分析,性别、年龄、职业、CD4细胞水平、治疗方案和亚型各组间差异均无统计学意义,民族和传播途径是影响耐药发生的独立危险因素。本研究的传播途径中,同性传播较异性传播、血液传播和母婴传播发生获得性耐药风险高,这可能与同性传播患者治疗依从性差相关[15],而血液传播大多为吸毒人群,因正在治疗的吸毒人群主要在门诊定期拿药,依从性强,长期稳定治疗有保障。最终无危险因素进入多因素Logistics回归模型。
综上所述,为了减少抗病毒治疗中耐药的发生,必须加强对患者的耐药监测,以及时发现耐药从而及时调整用药方案,尤其应谨慎使用耐药率较高的3TC、NVP和EFV,提高治疗效果[16]。此外,应对艾滋病患者特别是MSM艾滋病患者加强抗病毒治疗依从性教育[17],并随着治疗时间的延长反复强调服药依从性,以尽可能获得良好的治疗效果。

