新消渴方调控PI3K/AKT/FOXO1信号通路改善2型糖尿病大鼠肝脏胰岛素抵抗机制研究
史丽伟 孙敏 陈玉鹏 汤怡婷 吴倩 倪青
2013年我国成人糖尿病(diabetes mellitus, DM)患病率为10.4%[1]。2015年至2017年中华医学会内分泌学分会在全国31个省进行的DM流行病学调查显示,我国成人DM患病率11.2%[2]。从2000至2019年的20年间,2型糖尿病(type 2 diabetes mellitus,T2DM)的患病率每年增长超过1.5%[3]。T2DM约占成人DM发病类型的90%以上。胰岛素抵抗(insulin resistance,IR)伴随胰岛β细胞功能缺陷所致的胰岛素分泌减少是T2DM显著的病理生理学特征[4]。目前积极改善IR仍是T2DM治疗的关键策略之一[5]。新消渴方是在朱丹溪《丹溪心法》消渴方与叶天士《临证指南医案·三消》消渴方的基础上继承和创新而成,用于治疗 T2DM IR阴虚热盛证,收效颇佳。氧化应激是T2DM大鼠糖脂代谢紊乱及IR的重要机制之一[6],研究拟探讨新消渴方改善T2DM大鼠糖脂代谢、IR、氧化应激的作用以及改善T2DM大鼠肝脏IR的作用机制。
1 材料与方法
1.1 实验动物
6周龄SPF级雄性SD大鼠40只,体质量(160±20)g,购自北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2012-0001],饲养于中国中医科学院广安门医院SPF II级实验动物中心,每笼5~6只。实验前大鼠适应性饲养1周,饲喂标准大鼠合成饲料(购自江苏协同医药生物工程有限责任公司),自由饮用纯净水,环境温度、湿度适宜,12小时昼夜交替。
1.2 实验药物
新消渴方颗粒剂:由四川新绿色药业科技发展股份公司生产,每剂相当于生药:黄连10 g、地骨皮30 g、生地黄30 g、知母10 g、生石膏30 g、麦冬10 g、生白芍10 g、炙甘草6 g。大鼠给药量按照《药理实验方法学》中“标准体重动物剂量计算表”确定,即按照人—大鼠体表面积换算系数7计算大鼠等效剂量。盐酸二甲双胍片由中美上海施贵宝制药有限公司生产,500 mg/片×20片/盒,国药准字H20023370。盐酸二甲双胍成人(70 kg)每日常用剂量为1.5 g,新消渴方每日常用剂量为5.04 g,以成人(70 kg)每日每公斤体重用药量的7倍作为大鼠等效剂量。临用时用0.9%生理盐水配制成混悬液,灌胃体积10 mL/kg。
1.3 实验试剂
链脲佐菌素(streptozotocin,STZ)、戊巴比妥钠由美国SIGMA公司生产;超氧化物歧化酶(superoxide dismutase,SOD)测试盒、谷胱甘肽(glutathione,GSH)测试盒、丙二醛(malonaldehyde,MDA)测试盒均由南京建成生物工程研究所生产;大鼠胰岛素测试盒由上海睿铂赛生物科技有限公司生产。蛋白激酶B(protein kinase B, AKT)抗体、p-AKT(Ser473)抗体、叉头转录因子-1(forkhead box o1,FOXO1)抗体、p-FOXO1(Ser256)抗体、糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)抗体、p-GSK-3β(Ser9)抗体均购自CST公司;磷酸烯醇丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)抗体、β-Actin内参均购自博奥森生物技术有限公司;羊抗小鼠IgG-HRP、羊抗兔IgG-HRP均购自索莱宝生物有限公司。全自动生化分析仪(BECKMAN 公司,美国),SynergyTMH1全功能酶标仪(BioTek公司,美国),离心机(TOMOS公司,美国),电热恒温水浴箱(北京长安科学仪器厂),磁力加热搅拌器(江苏金城国胜实验仪器厂),高速恒温冷冻离心机(eppendorf公司,德国),蛋白印迹电泳系统(Bio-rad公司,美国),全自动凝胶成像系统(Bio-rad公司,美国),转移电泳仪(北京六一仪器厂),电泳槽(北京六一仪器厂),微量移液器(eppendorf公司,德国),精密电子天平(梅特勒托利多仪器有限公司,上海),冰箱(SIMENS 公司,德国)。
1.4 造模与分组
6周龄SPF雄性SD大鼠40只,适应性喂养1周,随机分为正常饮食组10只和高脂饲料组30只。正常饮食组大鼠饲喂标准普通饲料,高脂饮食组大鼠饲喂高脂饲料(购自江苏协同医药生物工程有限责任公司,配方如下:基础饲料68.1%、蔗糖10%、猪油10%、蛋黄粉10%、1.5%胆固醇、0.4%胆酸盐)。各组大鼠分别饲养4周后禁食12小时,高脂饮食组大鼠一次性予30 mg/kg STZ(0.1 mol/L pH 4.0柠檬酸缓冲液配制,现配现用)腹腔注射,正常饮食组大鼠予30 mg/kg 柠檬酸缓冲液腹腔注射。STZ注射72小时后,尾静脉采血测定空腹血糖(fasting blood glucose, FBG),若FBG>11.1 mmol/L,即认为T2DM造模成功。高脂饲料组30只大鼠共建模成功24只T2DM大鼠,将其随机分为模型组、新消渴方组、二甲双胍组各8只,正常饮食组大鼠10只作为空白对照组。空白对照组、模型组予0.9%氯化钠注射液10 mL/kg灌胃,二甲双胍组和新消渴方组分别予盐酸二甲双胍片、新消渴方混悬液10 mL/kg灌胃,干预7周。
1.5 观测指标
观察给药前后大鼠的一般情况,包括大鼠的精神状态、毛色、摄食量、尿量。采用罗氏血糖仪及血糖试纸检测各组大鼠FBG。采用空腹胰岛素(fasting blood insulin,FINS)、SOD、GSH、MDA检测试剂盒分别检测FINS、SOD、GSH、MDA水平。采用胰岛素抵抗指数(homeostatic model assessment of insulin resistance, HOMA-IR)评估IR,HOMA-IR=FBG(mmol/L)×FINS (μU/mL)/22.5。采用全自动生化分析仪检测肝功能、血脂四项[总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)]。各组大鼠进行葡萄糖耐量试验(oral glucose tolerance test, OGTT)和胰岛素耐量试验(insulin tolerance test, ITT):各组大鼠干预7周末,隔夜禁食12小时,予40%葡萄糖溶液按照5 mL/kg体积灌胃,分别于空腹及糖负荷后30分钟、60分钟、120分钟测定血糖值,绘制OGTT曲线,计算血糖曲线下面积(area under glycemic curve, AUC)。AUC=(0分钟血糖+2×30分钟血糖+3×60分钟血糖+2×120分钟血糖)/4]。ITT试验:各组大鼠干预7周末,隔夜禁食10小时,经腹部皮下按照0.75 U/kg注射胰岛素,分别于胰岛素注射后0分钟、30分钟、60分钟、120分钟测定血糖值,计算ITT试验下面积[AUC=(0.25×0分钟血糖+0.5×30分钟血糖+0.5×60分钟血糖+0.25×120分钟血糖)]。
1.6 肝脏指数、肝糖原定量及肝脏苏木精—伊红染色法(hematoxylin-eosin staining, HE)染色
各组大鼠干预7周后禁食12小时,30 mg/kg 3%戊巴比妥钠腹腔注射麻醉后处死,取下整个肝脏,称重、计算肝脾指数。脏器指数=脏器重量(g)/体重(g)。各组分别从肝脏中叶相同部位迅速剪取部分肝组织,生理盐水漂洗干净,浸泡于10%福尔马林中固定,一部分按照肝糖原定量试剂盒说明书行肝糖原定量检测,一部分行肝组织HE染色。肝脏HE染色按照标准操作流程进行:将4%多聚甲醛固定的肝组织经梯度酒精脱水、二甲苯透明、石蜡包埋,制成5 μm厚度切片。实验前80℃烤片1小时,二甲苯脱蜡,梯度酒精至水,苏木素染色,自来水洗涤,1%盐酸酒精分化,0.6%氨水返蓝,伊红染色,梯度酒精脱水后二甲苯透明,用自动灯片机封片,用光学显微镜观察并扫描图片,放大倍数为200倍。
1.7 免疫蛋白印迹法(Western blot,Wb)法检测肝脏组织蛋白表达水平
空白对照组、模型组、新消渴方组、二甲双胍组每组选取3只大鼠,采用 Wb法检测肝组织PI3K/AKT/FOXO1相关信号通路蛋白表达水平。肝脏组织预处理及细胞蛋白提取均在冰上或4℃进行。加入RIPA裂解液1 mL,冰上孵育30分钟匀浆,12 000 r/min离心20分钟,取上清,BCA法测定蛋白浓度并将各组浓度调平,蛋白样品经凝胶电泳后转移至PVDF膜,用封闭液按照1∶1 000比例稀释一抗AKT、p-AKT(Ser473)、FOXO1、p-FOXO1(Ser256)、GSK-3β、p-GSK-3β(Ser9)、PEPCK,4℃摇床过夜。一抗孵育结束,室温下TBST洗膜3次,每次10分钟。按照 1∶2 000比例稀释山羊抗兔IgGHRP抗体,室温孵育1小时,以TBST洗膜3次,每次10分钟。ECL化学发光法显影,采用ImageJ 1.52软件进行蛋白条带分析。
1.8 统计方法
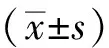
2 结果
2.1 新消渴方对T2DM大鼠FBG的影响
正常组大鼠毛发光泽,活动正常,对外界环境刺激反应灵敏;模型组大鼠毛发枯槁,多饮、多尿,行动迟缓,易惊易躁。与空白组比较,模型组大鼠FBG、FINS、HOMA-IR明显升高(P<0.05)。各组药物干预前(0周)FBG水平与模型组差异无统计学意义(P>0.05)。新消渴方组、二甲双胍片组分别干预4周、7周后FBG水平均较模型组明显下降(P<0.05),各药物干预组干预后FINS、HOMA-IR水平明显降低(P<0.05)。见表1。
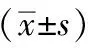
表1 新消渴方对T2DM大鼠FBG的影响
2.2 新消渴方对T2DM大鼠葡萄糖耐量的影响
模型组大鼠第7周葡萄糖耐量实验0分钟、30分钟、60分钟、120分钟血糖及AUC明显高于空白对照组(P<0.05)。新消渴方、二甲双胍组干预7周后葡萄糖耐量实验0分钟、30分钟、60分钟、120分钟血糖及AUC明显低于模型组(P<0.05)。见表2。
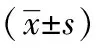
表2 新消渴方对T2DM大鼠葡萄糖耐量的影响
2.3 新消渴方对T2DM大鼠胰岛素耐量的影响
ITT实验胰岛素注射30分钟后各组大鼠血糖均降低。模型组大鼠各时点血糖及AUC均高于空白对照组(P<0.05)。与模型组比较,各药物干预组各时点血糖及AUC均明显下降(P<0.05),ITT实验注射120分钟二甲双胍组血糖明显低于新消渴方组(P<0.05)。见表3。
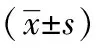
表3 新消渴方对T2DM大鼠胰岛素耐量的影响
2.4 新消渴方对T2DM大鼠血脂的影响
模型组TC、TG、LDL-C明显高于空白对照组(P<0.05),HDL-C水平各组间差异无统计学意义(P>0.05)。新消渴方组、二甲双胍组TC、TG较模型组明显下降(P<0.05),LDL-C水平均与模型组差异无统计学意义(P>0.05)。见表4。
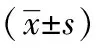
表4 新消渴方对T2DM大鼠血脂的影响
2.5 新消渴方对T2DM大鼠氧化应激指标的影响
模型组T2DM大鼠SOD、GSH水平明显低于空白对照组而MDA水平明显高于空白对照组(P<0.05)。对比模型组,新消渴方组SOD、GSH水平明显升高而MDA水平明显降低(P<0.05);二甲双胍组SOD水平明显升高而MDA水平明显降低(P<0.05),GSH水平较模型组升高但是与模型组差异无统计学意义(P>0.05)。见表5。
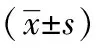
表5 新消渴方对T2DM大鼠氧化应激指标的影响
2.6 新消渴方对T2DM大鼠肝糖原定量及脏器指数的影响
T2DM模型组大鼠肝糖原含量明显低于空白对照组(P<0.05),新消渴方组、二甲双胍组T2DM大鼠肝糖原含量明显高于模型组(P<0.05)。T2DM模型组大鼠肝脏指数明显高于空白对照组(P<0.05),新消渴方、盐酸二甲双胍干预7周后肝脏指数均明显低于模型组大鼠(P<0.05)。脾脏指数各组之间差异无统计学意义(P>0.05)。见表6。
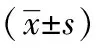
表6 新消渴方对T2DM大鼠肝糖原、肝脏指数、脾脏指数影响
2.7 新消渴方对T2DM大鼠肝脏形态的影响
空白对照组大鼠肝组织结构完整,肝小叶结构清晰,肝细胞以中央静脉为中心向四周以放射状整齐排列,肝窦规则,肝细胞索排列整齐。模型组大鼠肝细胞索排列紊乱,肝细胞多数肿胀,出现中到重度弥漫小泡性脂肪变性、空泡变性,胞浆内可见大小不等、数量不一的脂滴空泡,甚至部分肝细胞发生气球样、纤维化坏死。与模型组比较,各药物干预组大鼠肝细胞排列较模型组均匀有序,细胞水肿及脂肪变性明显减轻,见图1。

注:A为空白对照组,B为模型组,C为新消渴方组,D为二甲双胍组。
2.8 新消渴方对T2DM大鼠肝脏组织p-AKT(Ser473)、p-FOXO1(Ser256)、PEPCK、p-GSK3β(Ser9)蛋白表达的影响
模型组较空白对照组p-AKT(Ser473)、p-GSK3β(Ser9)、p-FOXO1(Ser256)蛋白表达明显下调(P<0.05),而PEPCK蛋白表达明显上调(P<0.05)。新消渴方组、二甲双胍组p-AKT(Ser473)、p-FOXO1(Ser256)、p-GSK3β(Ser9)蛋白表达明显上调(P<0.05),而PEPCK蛋白表达明显下调(P<0.05),见表7、图2。

注: A为空白对照组,B为模型组,C为新消渴方组,D为二甲双胍组。
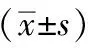
表7 新消渴方对T2DM大鼠肝组织PI3K/AKT/FOXO1信号通路相关蛋白表达的影响
3 讨论
DM属于中医消渴病范畴,消渴病病理机制为禀赋不足、饮食不节、情志失调、劳逸过度、外感邪毒致使阴虚燥热,故养阴清热是治疗消渴病的重要治法[7]。朱震亨《丹溪心法》中的消渴方,由黄连、天花粉、人乳汁、藕汁、生地黄组成,叶天士《临证指南医案·三消》的消渴方,由生地、知母、石膏、麦冬、生甘草、生白芍组成,两者皆是养阴清热治疗消渴病的重要方剂。国医名师林兰教授创立了DM阴虚热盛型→气阴两虚型→阴阳两虚型“三型辨证”理论,宏观结合微观将中医辨证分型与胰岛功能相关联发现,阴虚热盛型以IR为主,气阴两虚型以 IR 为主伴胰岛功能损伤为主,阴阳两虚型以胰岛功能衰竭为主[8]。倪青教授师从林兰教授,重视T2DM IR养阴清热法的应用,结合多年临床实践经验,对《丹溪心法》消渴方和《临证指南医案·三消》消渴方发展创新而成的新消渴方,方中黄连清热解毒、防燥热伤津,生地黄滋养肝肾,以治阴虚之本,二者合用养阴清热共为君药;知母、石膏清热润燥、养阴生津,麦冬、地骨皮滋阴清热、退热除蒸,助君药养阴清热为臣药;白芍养血敛阴、柔肝止痛,防郁火灼伤肝津,甘草益气健脾、防寒凉药物伤胃,又可调和诸药,共为佐使药。全方共奏滋养肝肾阴津、清热润燥之功,用于治疗T2DM阴虚热盛证,收效颇佳[6]。
本研究结果发现,新消渴方组、二甲双胍组大鼠精神状态、活动状况及“三多一少”症状较T2DM组大鼠明显改善,这可能与高血糖状态减轻有关。高胰岛素血症是T2DM 早期IR的重要标志,对比模型组,新消渴方组与二甲双胍组FBG、FINS水平明显降低,T2DM大鼠糖耐量明显改善,还可明显降低HOMA-IR水平、增加胰岛素敏感性。T2DM常合并血脂代谢紊乱,后者对DM患者动脉粥样硬化性心血管疾病影响最大,且与IR和胰岛β细胞衰竭相关[9]。本研究发现消渴方组、二甲双胍组TC、TG水平明显低于模型组,提示新消渴方对脂代谢改善可能有益于减轻IR。氧化应激是由于机体受到刺激细胞中的活性氧簇(Reactive oxygen species,ROS)产生过多和/或抗氧化防御机制减弱,致使ROS的生成和清除之间失衡。T2DM糖脂代谢异常、促炎因子等导致ROS产生过多造成氧化应激,同时使机体抗氧化应激能力下降,包括SOD、GSH降低而MDA升高,加重氧化应激损伤和胰岛素信号传导通路障碍,致使胰岛β细胞损伤和加重T2DM IR[10-12]。研究显示,新消渴方可明显增加SOD、GSH水平,降低MDA水平,二甲双胍组可显著增加SOD水平而降低MDA水平,提高机体抗氧化应激能力可能有助于减轻IR及胰岛β细胞损伤。T2DM常合并非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD),IR是两者共同的病理基础,IR可导致糖脂代谢紊乱、大量TG在肝脏沉积引起氧化应激及炎症反应,促使NAFLD发生发展,同时NAFLD促使糖脂代谢异常、加重IR,促使T2DM并发症发生[13]。新消渴方、二甲双胍不仅能减轻T2DM大鼠糖脂代谢,还可以明显改善肝脏组织脂肪变性,显著降低肝脏指数、增加肝糖原含量,这可能对于改善T2DM大鼠肝脏IR有益。
肝脏通过调控肝糖异生和肝糖原合成以维持血糖稳态,肝脏IR是T2DM IR 的重要机制。AKT是调控肝脏糖代谢的重要蛋白,AKT(Ser473)磷酸化激活抑制肝糖异生和促进肝糖原合成[13]。PEPCK和GSK3β分别是调控肝糖异生和肝糖原合成的关键酶类,PEPCK过表达可导致肝糖异生增加,p-GSK3β(Ser9)表达下调可致糖原合酶(Glycogen synthetase,GS)GS磷酸化增强而抑制肝糖原合成[14-15]。AKT(Ser473)磷酸化激活后,使FOXO1磷酸化从细胞核转至细胞质失活,从而抑制FOXO1在细胞核内与PEPCK DNA序列结合而启动PEPCK基因表达;同时,AKT激活可通过 AKT/GSK3β信号通路,增加GSK3β(Ser9)磷酸化而抑制GS磷酸化而促进肝糖原合成[13-16]。研究显示,模型组较空白对照组p-AKT(Ser473)、p-GSK3β(Ser9)、p-FOXO1(Ser256)蛋白表达明显下调(P<0.05),而PEPCK蛋白表达明显上调(P<0.05),提示T2DM大鼠肝脏IR与PI3K/AKT/FOXO1信号通路障碍有关。新消渴方组、二甲双胍组p-AKT(Ser473)、p-GSK3β(Ser9)、p-FOXO1(Ser256)蛋白表达明显上调(P<0.05),而PEPCK蛋白表达明显下调(P<0.05),提示新消渴方可能通过激活T2DM大鼠PI3K/AKT/FOXO1信号通路,从而改善T2DM肝脏IR。
综上所述,新消渴方可以改善T2DM大鼠糖脂代谢,减轻氧化应激,改善肝脏组织形态学,增加肝糖原含量,从而改善肝脏IR。新消渴方改善T2DM 肝脏IR的作用机制可能与其调控PI3K/AKT/FOXO1信号通路,激活相关蛋白表达有关。

