磁性纳米颗粒对牛奶黄曲霉毒素M1的检测研究
陈志坚
(厦门为正科技研究院,福建 厦门 361026)
黄曲霉毒素是食品中最常见的毒素之一,黄曲霉毒素B1(Aflatoxin B1)被认为是毒性和致癌性最强的毒素[1]。牲畜食用了受黄曲霉毒素B1污染的饲料后,在动物肝脏被代谢生成黄曲霉毒素M1(Aflatoxin M1,简称AFM1),并分泌进入乳汁中。AFM1具有强烈毒性和致癌性,各国对食品和乳制品中AFM1残留量进行了严格限制[2]。目前用于检测乳制品中AFM1的方法主要包括高效液相色谱法、酶联免疫分析法以及液相色谱-质谱法等[3-5]。高效液相色谱法需要进行衍生化反应,操作复杂,且灵敏度较低[6]。酶联免疫分析法受抗原抗体结合特异性的影响,存在一定的局限性[7]。液相色谱-质谱法灵敏度高但设备昂贵。然而该方法的前处理方法主要采用固相萃取柱,该材料成本较高且重复利用率较差[8]。因此,亟需开发一种快速、灵敏而成本低廉的检测技术用于AFM1的检测分析。
本研究采用表面修饰包覆技术改性Fe3O4磁性纳米颗粒材料,通过在其表面修饰AFM1的单克隆抗体,用于快速富集乳制品样品中的AFM1。该材料合成方法简单,成本低,分离快速,可结合液相色谱-串联质谱技术建立乳制品中AFM1的快速检测方法。该方法操作简便,灵敏度高,可为乳制品中AFM1的检测提供一种新的技术手段。
1 实 验
1.1 材料、试剂与仪器
AFM1(98%)、赭曲霉毒素A(OTA)、脱氧雪腐镰刀菌烯醇(DON)、玉米赤霉烯酮(ZEN)、O-(羧甲基)羟胺半盐酸盐(98%)、牛血清白蛋白(96%)、3-氨丙基三乙氧基硅烷(98%),阿拉丁试剂公司;AFM1单克隆抗体,北京纳百生物科技有限公司;新鲜全脂牛乳(脂肪含量3.1%)、低脂牛乳(脂肪含量1.5%)、脱脂牛乳(脂肪含量<0.5%)均购自当地超市。
本研究使用的设备主要包括荧光光谱仪(Agilent Cary Eclipse,美国)、Zetasizer Nano ZS-90激光粒度仪(Malvern,英国)、近紫外可见光谱仪(Jenway 6900,英国)、傅立叶近红外光谱(Nicolet iS50,美国)、透射电子显微镜(JOEL JEM-2100,日本)、液相色谱-串联质谱联用仪(Waters Xevo TQ-S,美国)等。
1.2 功能化磁性纳米颗粒的制备
1.2.1 磁性纳米颗粒上修饰AFM1抗体
本文采用共沉淀法制备Fe3O4纳米粒子,将2 g的3-氨丙基三乙氧基硅烷加入到3 g的Fe3O4,并加入100 mL的无水甲苯,在氮气的保护下,将反应混合物加热到100 ℃回流6 h。反应结束后,使用离心机离心并使用甲苯洗涤产物,在真空烘箱中70 ℃下真空干燥24 h,得到目标产物氨基表面改性磁性纳米颗粒(NH2-Fe3O4)。根据文献所用方法将AFM1抗体接枝到含有胺基的磁性粒子表面[2],将抗体修饰的磁性纳米颗粒(Ab-NH2-Fe3O4)收集后,分散于PBS缓冲液中(100 μg/mL)待用。
1.2.2 Ab-NH2-Fe3O4分离富集AFM1
向添加有一定量AFM1的牛乳中加入Ab-NH2-Fe3O4磁性纳米颗粒材料,充分震荡混合,在37 ℃孵育10 min,使AFM1与抗体发生免疫反应并吸附富集在磁性纳米颗粒表面。使用磁铁分离收集磁性纳米颗粒,去除上清液,采用1 mL的甘氨酸-盐酸(Gly-HCl,含5%的吐温20)缓冲液进行AFM1的洗脱分离,再次使用磁铁进行分离操作,将上清液吹氮后使用乙腈复溶,进行后续液相色谱-质谱检测分析。
2 结果与讨论
2.1 功能化磁性纳米颗粒的制备
磁性纳米颗粒可以通过磁分离技术轻松实现与示踪物结合部分和游离部分的高效分离。本研究中的磁性纳米颗粒(Fe3O4)是通过Fe2+和Fe3+的水溶液的共沉淀反应制备而成[9]。该磁性纳米颗粒的透射电子显微镜照片如图1所示,尺寸分布较为均一,粒径大约110 nm左右。在得到磁性纳米颗粒之后,进一步对使用3-氨丙基三乙氧基硅烷其进行了表面改性修饰,以引入氨基基团进行表面功能化,得到氨基修饰的磁性纳米颗粒(NH2-Fe3O4)。该功能化的磁性纳米颗粒在溶液中的分散性如图2所示,未观察到明显团聚现象,粒径分布较窄。

图1 NH2-Fe3O4磁性纳米颗粒的TEM照片

图2 NH2-Fe3O4磁性纳米颗粒的粒径分布图
在本研究中,我们在氨基表面修饰的磁性纳米颗粒表面进一步偶联AFM1单克隆抗体,制备AFM1抗体修饰的磁性纳米颗粒(Ab-NH2-Fe3O4)。如图3的Fe3O4、NH2-Fe3O4和Ab-NH2-Fe3O4的红外光谱所示,以Fe3O4纳米颗粒的红外光谱作为对照,NH2-Fe3O4样品在1028 cm-1、1096 cm-1处出现了Si-O伸缩振动峰[10],表明硅烷偶联剂已成功包覆在Fe3O4纳米颗粒表面。在Ab-NH2-Fe3O4的红外光谱中,1655 cm-1处出现抗体特有的酰胺I带,充分证实了抗体的成功偶联[11]。以上红外光谱分析清晰证明了AFM1单克隆抗体修饰磁性纳米颗粒Ab-NH2-Fe3O4的成功合成。

图3 Fe3O4、NH2-Fe3O4和Ab-NH2-Fe3O4的红外光谱图
2.2 Ab-NH2-Fe3O4对AFM1的分离富集条件优化
本研究详细研究了两大主要因素(分别为磷酸盐PBS缓冲液的pH值和Ab-NH2-Fe3O4的材料用量)对Ab-NH2-Fe3O4材料富集AFM1效果的影响。即在37 ℃的通用孵育温度条件下,使用不同pH值的PBS缓冲液和不同用量的Ab-NH2-Fe3O4,对含量为5 ng的AFM1标准品进行富集实验。使用高效液相色谱对AFM1的回收率进行精确测定。
如图4所示,随着pH的升高,回收率呈现先增大后降低的趋势,最高的回收率出现在pH为7.4处,其回收率达到92%。这是因为在中性条件下,抗体与抗原的亲和力最强,结合效率最高。因此,我们选择pH为7.4的PBS缓冲液作为后续实验的最佳PBS缓冲液pH值。

图4 Ab-NH2-Fe3O4对AFM1的回收率随PBS
如图5所示,随着Ab-NH2-Fe3O4用量的增加,AFM1的回收率持续升高,当用量达到10 mg时,回收率达到平台值,之后不再继续显著变化。这表明10 mg是Ab-NH2-Fe3O4的最佳用量。在此用量下,材料表面抗体的数量足以捕获溶液中的AFM1分子,实现最大的富集效果。综合考虑实验效果和经济性,本文选择10 mg作为后续AFM1富集实验的Ab-NH2-Fe3O4的最佳用量。
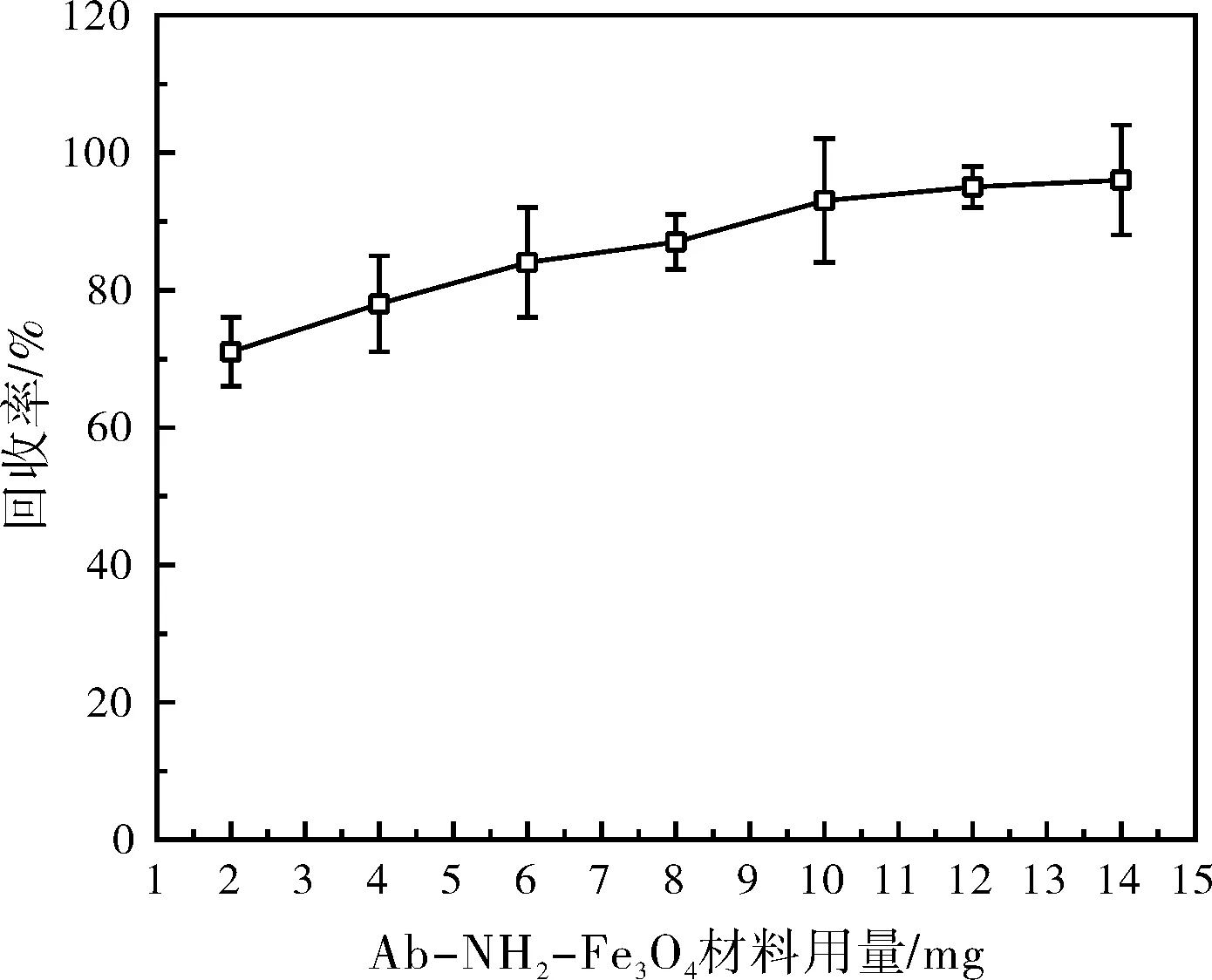
图5 Ab-NH2-Fe3O4对AFM1的回收率随Ab-NH2-Fe3O4材料用量的变化
2.3 Ab-NH2-Fe3O4分离富集能力特异性验证
本研究继续测试了Ab-NH2-Fe3O4对AFM1的特异性分离富集能力,如图6所示,随着富集时间的持续增加,Ab-NH2-Fe3O4对于AFM1的回收率也持续增加,并且在10 min达到峰值后不在显著变化,峰值为95%。经过计算可得,Ab-NH2-Fe3O4对于AFM1的分离富集能力为72.33 mg/g。与此同时,本研究同时进行了OTA、DON、ZEN这三个真菌毒素作为对比样来进行Ab-NH2-Fe3O4的特异性分离富集研究。如图6所示,Ab-NH2-Fe3O4对于AFM1的回收率显著大于其他3个对照样品的真菌毒素。该抗体修饰的磁性纳米材料Ab-NH2-Fe3O4对AFM1具有非常出色的选择性富集效果,这证明利用抗原抗体特异性免疫反应原理进行磁性分离富集,可以有效减少来自其它毒素的检测干扰,实现对目标AFM1的高选择性检测。

表1 在三种乳制品中AFM1的加标回收实验结果

图6 Ab-NH2-Fe3O4的富集能力与材料富集特异性测试结果
2.4 基于Ab-NH2-Fe3O4磁分离富集检测多种乳制品中的AFM1
为评估本研究在各种乳制品中的应用准确性和可靠性,本文选择了3类常见乳制品,分别为全脂牛奶、低脂牛奶和脱脂牛奶,进行了AFM1的加标回收实验。在这些样品中分别加入1 ng、2 ng、5 ng的AFM1标准品,经Ab-NH2-Fe3O4磁性纳米材料富集后,采用液相色谱-串联质谱进行检测。结果显示,3种不同脂肪含量的乳制品在不同浓度下的平均回收率在90%以上,表明该方法具有良好的稳定性和可靠性。
3 结 论
本研究首先成功合成了AFM1单克隆抗体修饰的Fe3O4磁性纳米粒子Ab-NH2-Fe3O4,所得功能化磁性纳米颗粒的粒径约110 nm,且具有良好的分散性。该磁性纳米颗粒材料具有非常优异的富集AFM1的能力,在PBS缓冲液的pH值为7.4和Ab-NH2-Fe3O4的材料用量为10 mg时,可实现AFM1的最高回收率。且在复杂的含有不同脂肪含量的乳制品中也能实现高选择性和快速的免疫分离富集,回收率在90%以上。

