pH值偏移对麦谷蛋白结构的修饰及溶解性的提升
荣玉娟,侯雨薇,曹晓倩,张佳佳,周 彬,2,*
(1.湖北工业大学生物工程与食品学院,湖北 武汉 430068;2.发酵工程教育部重点实验室,湖北 武汉 430068)
麦谷蛋白(glutenin,Glu)是一种天然植物蛋白,具有营养丰富、来源广泛、低致敏性、良好的生物学价值等优点。Glu由10%的高分子质量Glu和90%的低分子质量Glu组成[1]。低分子质量Glu不仅与自身结合,而且还通过分子内和分子间二硫键与高分子质量Glu亚基(glutenin subunits,GS)结合形成Glu聚集体[2],此结构特性大大降低了Glu的柔韧性。而且Glu富含脯氨酸和谷氨酰胺,带电氨基酸比较少,使其在中性条件下溶解度较低,大大限制了其在食品工业中的应用[3-5]。因此采用简单易行的处理手段提升Glu在中性条件下的溶解性对于拓宽其应用范围具有较强的产业价值。
对蛋白修饰的研究大多集中于物理处理、化学处理和生物酶修饰等方面[6]。物理方法包括超声波处理、热处理、脉冲电场、高压破碎、挤压、冷冻等[7-9]。例如,Zhang Lei等[7]利用超声波提高蛋白质的发泡能力和乳化能力。Buhler等[8]利用干热改性蚕豆浓缩蛋白以增加持水能力。Liu Bohui等[9]利用球磨机处理大豆分离蛋白极大提升了蛋白的凝胶强度和持水能力。化学方法主要是通过引入化学基团对蛋白质进行修饰,包括酸碱处理、磷酸化、糖基化和脱酰胺等。例如,Majzoobi等[10]利用乙酰化提高Glu的溶解度和水结合能力。Chen Weijun等[11]利用美拉德反应增强蛋白质与水分子的相互作用从而提升糖基化产物的溶解度。Liu Xiao等[12]通过谷氨酰胺酶脱酰胺改性Glu改善了其理化性质。生物学方法多利用酶水解、酶交联以及蛋白质相互作用等方式修饰蛋白质。如Sun Qian等[13]利用复合蛋白酶酶促修饰提升核桃谷蛋白的持水力和乳化稳定性。pH值偏移处理是一种可以定向诱导蛋白质结构变化从而有效改善蛋白质功能特性的方法,这种改性方法对Glu的影响至今少有人研究。
本研究利用不同pH值偏移处理条件对Glu进行改性,借助动态光散射(dynamic light scattering,DLS)、透射电镜(transmission electron microscope,TEM)、荧光光谱、傅里叶变换红外光谱、紫外光谱、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)等方法探究pH值偏移处理对Glu功能特性的影响。以期通过pH值偏移处理改善中性条件下Glu的溶解性及拓宽其在食品领域的应用范围。
1 材料与方法
1.1 材料与试剂
小麦蛋白 上海阿拉丁生化科技股份有限公司;BCA蛋白浓度检测试剂盒 碧云天生物技术有限公司;β-巯基乙醇 上海麦克林生化科技有限公司;考马斯亮蓝赛国生物科技有限公司;SDS 国药集团化学试剂有限公司;叠氮化钠(NaN3)上海麦克林生化科技有限公司;超纯水 武汉优普仪器设备有限公司。
1.2 仪器与设备
Zeta sizer Nano-ZS 90纳米粒度测定仪 英国马尔文公司;UV2600紫外-可见分光光度计 岛津仪器(苏州)有限公司;F7000荧光分光光度计、H7650 TEM 日立科学仪器(北京)有限公司;Seven Compact精密pH计梅特勒托利多科技(中国)有限公司;Nicoletis-50傅里叶变换红外光谱仪 赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 Glu的提取
将二氯甲烷和小麦蛋白以液固比7∶1(mL/g)混合,3000 r/min搅拌2 h使其均匀分散,并进行抽滤脱脂。将沉淀继续溶于二氯甲烷中以3000 r/min搅拌3 h后抽滤再次脱脂。将沉淀和乙醇以1∶10比例混合搅拌3 h后离心取沉淀物冷冻干燥并粉碎以获得Glu。通过凯氏定氮法测得Glu纯度为(86.0±0.8)%。
1.3.2 Glu的pH值偏移处理
在500 mL 3%的Glu溶液中加入1 mL 0.02%叠氮化钠溶液以防止滋生微生物。用HCl或NaOH溶液调节蛋白溶液pH值至1.0、2.0、3.0、10.0、11.0、12.0和13.0并搅拌4 h。在此期间,每小时测定pH值并调整至初始值。随后将所有样品pH值调至7.0并稳定1 h。冻干成粉末后贮藏于干燥器中备用。根据不同pH值偏移处理将Glu样品分别命名为Glu-1、Glu-2、Glu-3、Glu-10、Glu-11、Glu-12和Glu-13,未经处理的为对照。
1.3.3 蛋白质溶解度测定
将3 份质量分数1%的Glu溶液置于2 mL离心管中10000×g、25 ℃离心10 min,并保留上清液。以牛血清蛋白为标准蛋白,通过BCA试剂盒测定蛋白离心后上清液浓度和未离心前蛋白溶液浓度。蛋白质溶解度可用上清液中蛋白质量浓度与溶液中总蛋白质量浓度的百分比表示。
1.3.4 蛋白质粒径、PDI及Zeta电位的测定
蛋白的粒径、Zeta电位及多分散系数(polydispersity,PDI)均由配备He-Ne激光(633 nm)的DLS纳米粒度电位分析仪测定。测定前不同处理组Glu溶液均在BCA试剂盒下调至蛋白质量浓度一致(0.1 mg/mL)。
1.3.5 蛋白质表面疏水性的测定
以8-苯胺-1-奈磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)作为荧光探针,测定蛋白质表面疏水性。将Glu溶液用BCA试剂盒稀释至0.125~1.000 mg/mL,取5 mL样品与ANS(8 mmol/L,30 μL)在黑暗中混合5 min后采用荧光分光光度计进行测定。激发波长设置为380 nm,发射波长范围设置为400~600 nm,电压设置为400 V,扫描速率设置为12000 nm/min,激发和发射狭缝宽度5 nm。
1.3.6 蛋白质内源荧光光谱的测定
内源荧光光谱由荧光分光光度计测定。所有样品均10000×g、4 ℃离心10 min,测定前将所有样品用BCA试剂盒调成同一质量浓度。将蛋白溶液(0.1 mg/mL)置于四面透光的比色皿中进行测量。激发波长设置为290 nm,发射波长范围为300~460 nm,扫描速率为12000 nm/min,激发和发射狭缝宽度为5 nm。
1.3.7 紫外光谱的测定
紫外光谱测定采用紫外-可见分光光度计。所有样品均10000×g、4 ℃离心10 min,测定前将所有样品用BCA试剂盒调成同一质量浓度。将蛋白溶液(0.1 mg/mL)置于石英比色皿中进行测量。扫描范围为200~500 nm,间隔1 nm。
1.3.8 蛋白质巯基与二硫键含量测定
基于已有研究[14]稍加修改。蛋白质样品用含有8 mol/L尿素(用于测量总巯基)和不含8 mol/L尿素(用于测量暴露巯基)的Tris-Gly缓冲液(86 mmol/L Tris、90 mmol/L甘氨酸、4 mmol/L EDTA)稀释至3 mg/mL。在5 mL样品溶液中加入50 μL的Ellman’s试剂(5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB),4 mg/mL),在黑暗处反应1 h,以不含DTNB的样品作为对照。反应结束后将样品5000×g离心10 min并取上清液在412 nm波长处测定吸光度。测定蛋白质游离巯基的计算公式如下:
式中:A412nm为在412 nm波长处的吸光度;C为样品质量浓度/(mg/mL);D为稀释系数1.01;73.53为106与1.36×104的比值(1.36×104为摩尔消光系数)。
测定二硫键含量时,将3 mg蛋白质样品溶解在含有10 mol/L尿素的1 mL Tris-Gly缓冲液中。然后加入60 µLβ-巯基乙醇以破坏二硫键,反应1 h后,加入5 mL质量分数12%三氯乙酸(trichloroacetic acid,TCA)溶液继续暗反应1 h以沉淀蛋白质。然后将混合物5000×g离心10 min,回收沉淀,用12% TCA洗涤2 次以除去β-巯基乙醇。沉淀中加入3 mL含8 mol/L尿素的Tris-Gly缓冲液和50 µL DTNB在黑暗中反应1 h。5000×g离心10 min后取上清液在412 nm波长处测定吸光度。计算公式如下:
式中:A412nm为412 nm波长处的吸光度;C为样品质量浓度/(mg/mL);D为稀释系数3.05;总游离巯基含量为式(1)的计算结果,μmol/L。
1.3.9 SDS-PAGE分析
参照Peng Weiwei等[15]的研究方法稍作修改。蛋白样品与SDS上样缓冲液(150 mmol/L Tris-HCl、1% SDS、20%甘油、2%β-巯基乙醇、8 mol/L尿素,pH 6.8)按体积比1∶1混合。混合后在99 ℃变性10 min后冷却至室温,2000×g离心2 min后取上清液20 µL置于胶孔中。电泳使用5%的浓缩胶和12%的分离胶在室温70 V运行直到条带从浓缩胶迁移到分离胶中,然后在120 V运行1.5 h。使用考马斯亮蓝染液(30%甲醇、10%乙酸和0.2%考马斯亮蓝R-250)进行染色2 h,然后用脱色液(10%乙酸、30%甲醇、60%超纯水)脱色过夜。脱色后通过凝胶成像系统进行显影。
1.3.10 傅里叶变换红外光谱的测定
通过傅立叶变换红外光谱测定Glu在4000~500 cm-1范围内的红外光谱。结果通过OMNIC 8.2软件和Peakfit 4.12进行拟合分析Glu的二级结构。
1.3.11 蛋白质微观形貌观察
制备质量分数0.1%的Glu溶液,用滴样法将样品滴在铜网上晾干,使用TEM在80 kV下观察Glu的聚集情况。
1.4 统计分析
所有结果均测量3 次取平均值。采用IBM SPSS Statistics 26.0软件进行方差分析,分析组间差异是否具有统计学意义(P<0.05,差异显著)。
2 结果与分析
2.1 pH值偏移处理对Glu溶解度的影响
良好的溶解性是食品蛋白质加工利用的前提条件[16]。如图1A所示,经过不同pH值偏移处理后Glu的溶解度均有所增加。这是由于pH值偏移处理过程中Glu发生了脱酰胺,酰胺键断裂,使酰胺基团转变为羧基,因而蛋白质带负电荷增加且静电斥力变大,同时蛋白质结构中氢键及范德华作用力减弱,导致蛋白质结构展开,水合能力增加[17]。其中碱偏移处理下溶解度明显提高,特别是Glu-13的溶解度接近90%。在图1B可以直接观察到蛋白质溶液的宏观差异,碱偏移处理条件下蛋白溶液较均匀,溶液底部沉淀较少,其中Glu-12和Glu-13底部无明显沉淀。Glu溶解性增加可能是因为蛋白质结构在碱处理条件下形成了熔融球状,这增强了蛋白质-水相互作用的能力,导致Glu的溶解性显著增加;也可能是由于蛋白质构象变化和可溶性蛋白质聚集体的形成[18]。因此碱偏移处理是提高Glu在中性条件下溶解度的有效途径。Zhang Jingnan等[19]研究发现,豌豆蛋白经碱处理后表面疏水性有所增加的同时溶解度也有所改善,这可能是由于蛋白表面疏水基团之间的分子相互作用减弱所致。此外由于蛋白质结构的重排可能会产生新的疏水区域[20]。而Yildiz等[21]也认为,蛋白质的溶解度并不完全取决于疏水区域的暴露程度。
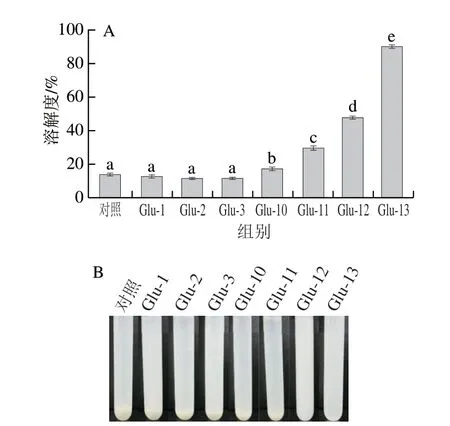
图1 不同 pH 值偏移处理下Glu的溶解度(A)及表观形态(B)Fig.1 Solubility (A) and visual morphology (B) of Glu under different pH-shifting treatments
2.2 粒径、Zeta电位与形貌分析
不同pH值偏移处理下Glu的平均粒径如图2A所示。结果表明,与未处理的Glu相比,不同pH值偏移处理后的Glu平均粒径均显著减小。这可能是因为pH值偏移处理使Glu中的谷氨酰胺发生脱酰胺转换为谷氨酸,增加了蛋白质侧链羧基含量,增加相同条件下Glu的带电量,增大分子间静电斥力,降低氢键相互作用,抑制蛋白质分子的聚集行为,从而致使Glu粒径减小[22]。此外,碱偏移处理效果优于酸偏移处理。一般来说粒径越小的蛋白质聚集体越容易溶解,较小的蛋白质聚集体有助于增加水溶性,因为蛋白质和水分子之间的相互作用面积更大[23]。此外,在pH值偏移处理后Glu的PDI均减小,碱偏移处理下PDI更小,溶液分散性更好。结果表明在碱偏移处理条件下使Glu远离其等电点(pH 4.9),产生了强烈的静电斥力,从而使其分散性更加均匀[24]。
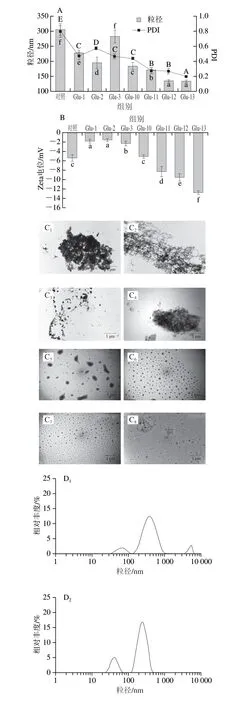
图2 不同pH值偏移处理后Glu的粒径及多分散指数(A)、Zeta电位(B)、TEM图像(C)和粒径分布(D)Fig.2 Particle size and PDI (A),zeta potential (B),TEM images (C)and particle size distribution (D) of Glu solution under different pH-shifting treatments
从图2B可以看出,经过pH值偏移处理后的Glu都带负电荷,这可能是在pH值偏移处理的过程中Glu发生了脱酰胺。大量不带电荷的极性天门冬酰胺和谷氨酰胺的中性酰胺侧链转变成带负电荷的羧酸基,从而生成了天冬氨酸和谷氨酸[25]。碱偏移处理下净负电荷显著升高,表明在一定程度上改变了蛋白质的构象使其暴露了内部的极性基团,因此随着表面极性基团的电离,更多的电荷积聚在分子表面以获得更高的净负电荷。而酸偏移处理下净负电荷略微减小可能是由于蛋白质的重新聚集掩埋了暴露在蛋白质内部分子表面的极性基团。一般情况下由于蛋白质颗粒之间存在较强的静电斥力,因此高净电荷体系相对稳定。带相同电荷的蛋白质链更容易相互排斥、解离或展开[26]。蛋白质的表面电荷受亲水性和疏水性极性残基之间平衡的影响,这Xiong Wenfei等[27]结论一致。
此外,利用TEM观察Glu粒子的形态变化。由图2C可知,未经处理的Glu聚集体尺寸较大且分散不均一,经pH 1~3偏移处理后,Glu的聚集程度没有明显改善,仍处于紧密聚集状态。然而,经碱偏移处理后,其聚集程度显著减弱,且图2D粒径分布也显示粒子尺寸分布较为均匀,这与粒径分析结果一致。
2.3 蛋白质表面疏水性分析
如图3所示,经pH值偏移处理后的Glu表面疏水性均有不同程度的提高。碱偏移处理下Glu的表面疏水性显著高于酸偏移处理,其中pH 13偏移处理下Glu的表面疏水性增加最显著。这可能是由于蛋白质结构在碱处理早期部分展开,导致一种变性与未变性的熔融球态[28]。在此状态下蛋白质的疏水肽段和氨基酸残基的疏水侧链基团暴露增加[29]。许多研究表明在极端酸碱处理条件下,蛋白的三级结构会发生变化,二硫键可能断裂,从而削弱了侧链之间的相互作用,增加了疏水性和分子灵活性[30]。当蛋白质回到中性状态时,蛋白间的重折叠过程会重新排列蛋白质表面的疏水基团。蛋白质表面疏水性受蛋白质表面与极性介质接触的疏水性区域数量的影响[20,31-32]。此外pH值偏移处理过程中Glu发生了脱酰胺,随着脱酰胺的进行能够有效展开蛋白质的高级结构,使本来包埋在蛋白质内部的疏水基团暴露且使蛋白质的两亲性增加,同时增加了蛋白质在水中的溶解性[33]。因此Glu表面疏水性的变化也反映了pH值偏移处理下其溶解性的变化。
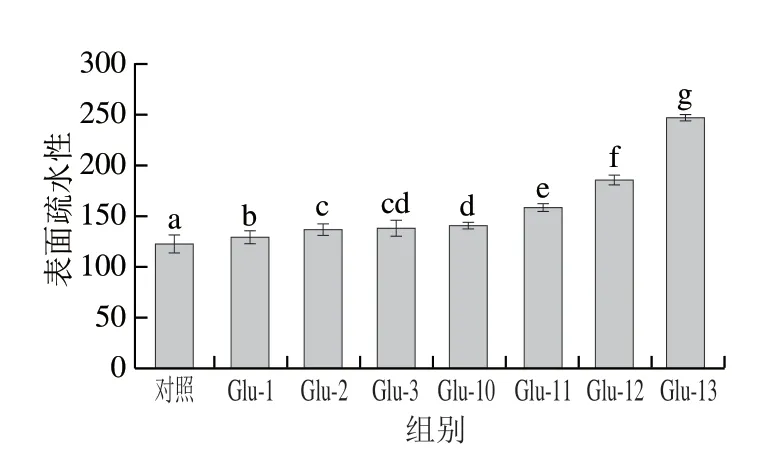
图3 不同pH值偏移处理下Glu的表面疏水性Fig.3 Surface hydrophobicity of Glu under different pH-shifting treatments
2.4 蛋白质内源荧光光谱与紫外光谱分析
如图4A所示,对照组最大发射荧光波长为352 nm,而经过pH值偏移处理Glu样品的最大发射荧光波长均出现蓝移且荧光强度均发生不同程度的增加,碱偏移处理样品的荧光强度增幅更大,结果表明,pH值偏移处理诱导Glu构象发生解折叠,更多的荧光基团暴露出来。Glu的色氨酸微环境向更疏水的微环境偏移,更多疏水基团的暴露致使蛋白质环境更加疏水,这与疏水性结果一致。蛋白质中氨基酸微环境的变化也会改变紫外吸收波长,因此可以用紫外光谱表征蛋白质结构的变化。如图4B所示,对照组最大峰值为276 nm,较对照相比pH值偏移处理后Glu的最大峰值均发生偏移。酸偏移处理下最大峰值偏移更显著(8 nm)。这些最大吸收峰的差异与苯丙氨酸、色氨酸和酪氨酸的残留有关,最大吸收峰的红移表明了Glu氨基酸环境的变化。此外,从图中也可以看出酸偏移处理后的特征吸收峰明显增强,碱偏移处理后的特征吸收峰降低,说明pH值偏移处理会致使Glu构象发生转变[34]。
2.5 蛋白质游离巯基及二硫键含量分析
Glu本身含有巯基及大量分子间二硫键和分子内二硫键,二硫键有助于蛋白质结构的形成[35]。由图5A可知,经pH值偏移处理后Glu中巯基含量增加且总游离巯基含量均高于暴露游离巯基含量,说明蛋白质内部结构中仍存在大量巯基。经过pH值偏移处理后总游离巯基和暴露游离巯基含量均有所增多,较高的游离巯基含量表明由于蛋白质去折叠从而暴露了内部巯基,或是天然蛋白质中S—S键的断裂而产生新的巯基所致。从图5B中二硫键含量上也可以看出,pH值偏移处理后样品的二硫键含量均减少,这说明在pH值偏移处理条件下蛋白质的二硫键发生不同程度的断裂,进而生成新的游离巯基,这也是导致总游离巯基增加的原因之一。同时暴露游离巯基含量的增加可能是由于pH值偏移处理后,Glu颗粒的大小和形态发生了变化,使得隐藏在Glu中的巯基暴露于蛋白质表面[29]。
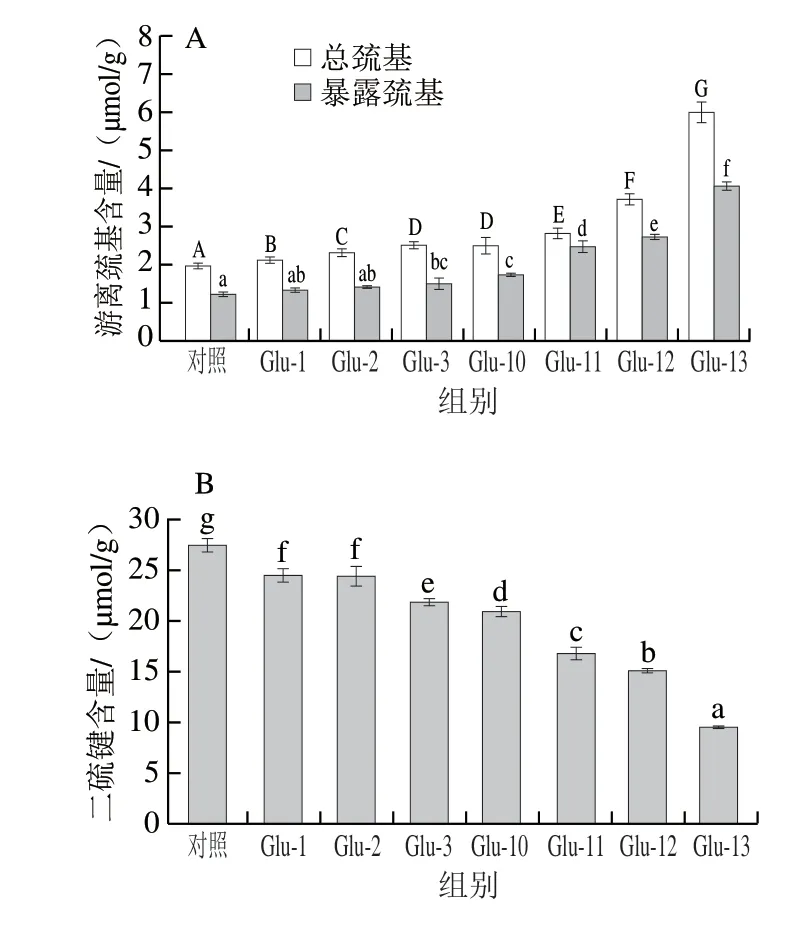
图5 不同pH值偏移处理下Glu的总游离巯基和暴露巯基(A)及二硫键含量(B)Fig.5 Total free sulfhydryl group and exposed sulfhydryl group (A) and disulfide bond contents (B) of Glu under different pH-shifting treatments
2.6 SDS-PAGE分析
采用SDS-PAGE分析pH值偏移处理后Glu分子质量及其主要亚基的变化。Glu由分子间二硫键相连的GS组成,GS中也存在分子内二硫键[1]。通常GS由高分子质量GS和低分子质量GS组成[1]。其中分子质量在20~70 kDa的是低分子质量GS,占Glu的90%,分子质量为80~130 kDa的是高分子质量GS,占Glu的10%。从图6可以观察到,Glu的主要条带集中在20~70 kDa处,在35 kDa处条带最深,表明分子质量大部分集中在此处。经过碱偏移处理后样品在20~25 kDa处产生了新的条带,表明碱偏移处理使Glu分解成了更小分子质量的肽段,这些低分子质量多肽可能是通过β-巯基乙醇分解S—S键而产生[29]。
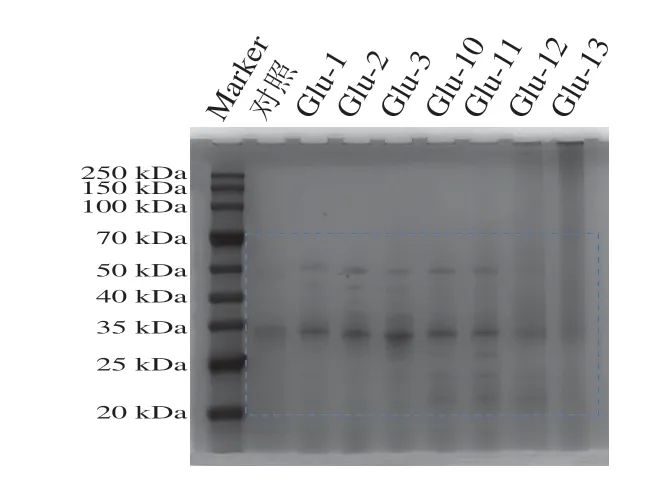
图6 不同pH值偏移处理下Glu的SDS-PAGE图像Fig.6 SDS-PAGE patterns of Glu under different pH-shifting treatments
2.7 蛋白质的二级结构分析
蛋白质有3 条典型的红外吸收带:酰胺I带位于1600~1700 cm-1,主要为C=O及少数C—N;酰胺II带1525~1550 cm-1,主要为N—H及部分C—N;酰胺III带位于1230~1350 cm-1,主要为C—N及少数N—H[36]。从图7可知,Glu在1637、1525 cm-1附近有2 个明显的吸收峰,分别为酰胺I带的C=O和酰胺II带的N—H振动引起的。另外在3300 cm-1附近有较宽的吸收峰,这归因于羟基的伸缩振动。其中,酰胺I带对蛋白二级结构的影响最具价值,因此对酰胺I带进行研究且通过拟合后发现酰胺I带可获得4 个条带,分别是β-折叠、无规卷曲、α-螺旋和β-转角。从表1可以看出,通过pH值偏移处理后Glu的α-螺旋含量下降,有研究表明表面疏水性与α-螺旋含量呈负相关,表面疏水性会随着α-螺旋含量的降低而增加[37],这与疏水性结果一致。另外pH值偏移处理过程中Glu发生了脱酰胺,使谷氨酰胺转变为谷氨酸,从而降低了含有氢键的β-折叠结构,使其转变为更具柔性的无规卷曲和β-转角结构。

表1 不同pH值偏移处理下Glu的二级结构含量Table 1 Secondary structure content of Glu under different pH-shifting treatments %
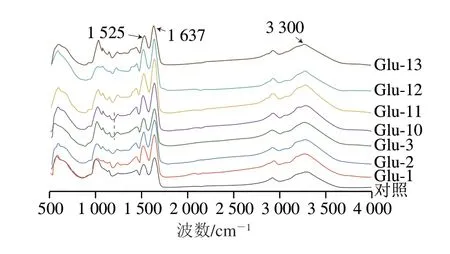
图7 不同pH值偏移处理下Glu的红外光谱图Fig.7 FTIR spectra of Glu under different pH-shifting treatments
3 结论
本研究考察了pH值偏移处理对Glu结构及理化性质的影响。结果表明,碱偏移处理可显著降低Glu分子的聚集程度,有利于Glu的溶解。经pH值偏移处理的Glu表面疏水性均有不同程度的增加,且碱偏移处理下表面疏水性要高于酸偏移处理。此外,pH值偏移处理会导致Glu分子中二硫键不同程度的断裂,且碱偏移处理下更多二硫键断裂生成巯基,使Glu分子中游离巯基含量增加。二级结构分析结果表明,经pH值偏移处理后α-螺旋和β-折叠含量下降,而β-转角和无规卷曲结构含量有所增加。本研究对改善Glu功能特性,拓宽其在食品工业的应用范围具有积极的意义。

