克拉霉素通过抑制小鼠母胎炎症预防早产和降低新生小鼠死亡率的研究
王海燕,黄守国,蒙秋,张静
早产是全球新生儿死亡和患病的主要原因,特别是在发展中国家[1],是全球范围内导致新生儿患病和死亡的主要原因[2]。根据2018 年的全球统计数据,大约有1 500 万例早产,其中约70% 属于自发性早产[3]。自发性早产涉及多种病理生理过程,包括羊膜腔感染和炎症[4]。
相对于由病原体引发的羊膜炎,无菌性羊膜炎症在自发性早产中更为常见[5]。这种无菌性炎症是由内源性危险信号(也称为警报素)触发的。这些警报素包括高迁移率族蛋白B1(high-mobility group box 1, HMGB1)、白细胞介素(interleukin, IL)-1α、IL-33、热休克蛋白和S100 蛋白等[6]。当细胞受到损伤或应激时,这些警报素会被释放到细胞外,从而激活先天免疫系统和炎症反应[7]。HMGB1 是一种高度保守的非组蛋白,具有多种生物学功能,包括稳定核小体和促进基因转录[8]。当细胞受到损伤或坏死时,HMGB1 会被释放到细胞外,作为一种炎症介质,与多种受体[如Toll 样受体4(toll-like receptor 4, TLR4)]结合,激活下游信号通路,并诱导多种参与炎症反应的细胞因子(简称炎症因子)[如IL、趋化因子、干扰素-γ (interferon-γ, IFNG)和肿瘤坏死因子 (tumor necrosis factor, TNF)等]的表达和释放。
有研究表明,早产产妇的HMGB1 水平显著增加[9],而羊水中HMGB1 水平较高的产妇分娩速度更快。这意味着HMGB1 可能作为早产的一个重要预测因子[10]。最近的研究还发现,特定的抗生素(如克拉霉素)不仅具有抗微生物活性,而且在羊膜腔内具有抗炎作用。然而,国内关于通过抑制HMGB1 来缓解早产和新生儿不良结局的研究还很少[12-13]。因此本次研究旨在探究克拉霉素治疗能否通过抑制HMGB1 诱导的炎症反应并进一步评估其对早产和新生小鼠不良结局的影响。
1 材料和方法
1.1 实验仪器与材料
1.1.1 动物 无特定病原体(specific pathogen free, SPF)级别8 周大C57BL/6(B6)小鼠购自上海南方模式生物科技股份有限公司(生产许可证号:SCXK(沪)2019-0002)。
1.1.2 主要仪器 VEVO3100 小动物超声成像系统(加拿大VisualSonics 公司);30 G × ½一次性无菌注射器(美国Becton Dickinson 公司);红外摄像机(日本SONY 公司);Bioanalyzer 2100 生物分析仪(美国Agilent 公司);Luminex FLEXMAP 3D(美国Luminex 公司)。
1.1.3 主要试剂 异氟醚(河北一品制药有限公司);重组人HMGB1 蛋白(美国Abcam 公司);磷酸盐缓冲液(phosphate buffered saline, PBS;上海埃泽思生物科技有限公司);克拉霉素(美国Sigma Aldrich 公司);二甲基亚砜(dimethyl sulfoxide, DMSO;美国Sigma Aldrich 公司);QIAshredders 试剂盒(德国Qiagen 公司);无RNase 的DNase 溶液(德国Qiagen 公司);RNeasy Mini 试剂盒(德国Qiagen 公司);SuperScript IV VILO Master Mix 试剂盒(美国Thermofisher 公司);RNAlater 溶液(美国Thermofisher 公司);Cytokine & Chemokine 36-Plex Mouse Procarta-Plex™ Panel 1A 试剂盒(美国Thermofisher 公司)
1.2 实验方法
1.2.1 小鼠早产模型建立以及分组 雌雄小鼠分笼饲养,食水充足,温度23 ℃,湿度40%~70%,12/12 h 光周期。1 周后,同表型雌雄小鼠1∶2 合笼交配。每天8 时到9 时检测阴栓确定交配成功,记为妊娠第0 天[14]。分笼饲养交配成功的雌雄小鼠,监测雌鼠体重,妊娠第12 天体重增加>2 g 为怀孕[6]。
用HMGB1 羊膜给药,通过促进炎症反应诱导早产和分娩。妊娠第13 天的雌鼠(n=40)吸入2%异氟醚麻醉。剔除胸腹部毛,保持体温(37 ± 1)℃,监测呼吸和心率。超声引导下用注射器向每只雌鼠羊膜内注射100 μl 重组人HMGB1(9 ng)磷酸盐缓冲液,该剂量参考无菌羊膜内炎症女性羊水浓度[15]。超声确认羊膜腔内注射成功。超声后,加热灯下恢复小鼠:10 min 内恢复正常活动。实验过程中有3 只小鼠死亡,余37 只鼠,随机分为实验组(n=19)和对照组(n=18)。恢复后,红外摄像机视频记录小鼠,确定胎龄、早产率、新生小鼠出生和第1 周死亡率[6]。
1.2.2 干预治疗 实验组雌鼠在第13 天通过HMGB1 羊膜给药后,在第6、12、24、48、72、96 h 时皮下注射75 mg/kg 克拉霉素进行干预治疗;对照组雌鼠则在以上6 个时间点皮下注射75 mg/kg DMSO。将溶于DMSO 的克拉霉素和DMSO 溶于无菌5%葡萄糖水。治疗间隔通过录像机观察怀孕雌鼠,评估妊娠和新生小鼠的情况。克拉霉素的剂量根据Tagliabue 等[16]研究确定。
1.2.3 羊膜腔内注射HMGB1 的雌鼠的组织取样 在妊娠第14 天干预治疗后,从对照组和实验组2 组随机各选取5 只,在第18 天干预治疗后2 h(即HMGB1 注射后98 h)安乐死并进行收集蜕膜、子宫、子宫颈、胎儿胎膜、胎盘、胎肺、胎肠、胎肝和胎脾,液氮中速冻并-80 ℃保存。RNA 分离、cDNA合成和逆转录定量PCR 分析按试剂盒使用说明进行。从每个羊膜囊中收集羊水。羊水样品4 ℃下3 000 r/min 离心(离心半径15 cm) 10 min,分离上清液-20 ℃保存。
1.2.4 怀孕雌鼠妊娠和新生小鼠结局检测 参考Gomez-Lopez 等[17]的研究和Garcia-Flore 等[18]的研究方法,连续监测对照组(n=13)和实验组(n=14)怀孕雌鼠以记录妊娠情况,主要测量结果包括早产率和新生小鼠死亡率。妊娠时长为出现阴栓到出现第1 个新生小鼠时间。怀孕第19 天之前分娩则视为早产,早产率为每组小鼠中在怀孕第19 天之前分娩比例。晚期早产为第18 天到第19 天分娩[19]。产后每天观察新生小鼠,评估小鼠的体重和存活情况,统计死亡率。出生后第1 周内死亡的小鼠体重不参与比较。
1.2.5 实时荧光定量PCR 测定组织中炎症因子表达水平 雌性小鼠组织样本使用Trizol 试剂(Invitrogen, Carlsbad, CA)进行均质化,并通过离心法分离总RNA。RNA 的纯度和浓度通过NanoDrop 分光光度计进行检测,接受的A260/A280 比值范围为1.8~2.0。随后,使用DNase I(Invitrogen)对RNA样本进行处理以去除可能的DNA 污染。利用SuperScript IV VILO Master Mix 进行cDNA 的合成,并通过分光光度法测定其浓度。qPCR 分析在Bio-Mark 系统中进行,反应体积为20 μl,包括10 μl 的2X Master Mix,1 μl 的20 μm 引物,2 μl 的模板cDNA,以及7 μl 的无菌水。PCR 反应条件为预变性在95 ℃进行3 min,变性在95 ℃进行15 s,退火在60 ℃进行30 s,延伸在72 ℃进行30 s,总循环次数为40 次。内参基因采用GAPDH,用于归一化目标基因的表达量。引物信息参见表1。数据分析采用采用2-ΔΔCt法计算相对基因表达量。

表1 逆转录定量PCR 引物序列
1.2.5 多重免疫测定羊水中炎症因子的浓度 根据试剂盒说明,通过ProcartaPlex 评估羊水样本的细胞因子浓度。根据Romero 等[20]的研究结果,本次研究测定与羊膜内炎症有关的细胞因子IL-6、IL-1β、TNF、IL-1α、IL-10、IFNG、CCL2(MCP-1)、CCL4(MIP-1α)、CCL5(RANTES)、CXCL1(GRO-α)和CXCL10(IP-10)。使用超高通量液态芯片检测系统计算分析物浓度。
1.3 统计学处理
采用GraphPad Prism 8.0.1 统计学软件进行数据分析。计量资料以±s 表示,采用独立样本t检验;计数资料以频数和百分比(%)表示,组间比较采用χ2检验。Kaplan-Meier 生存曲线用于绘制新生小鼠生存情况。P<0.05 表示差异有统计学意义。
2 结果
2.1 克拉霉素治疗对早产和新生小鼠死亡的影响
与对照组相比,通过克拉霉素处理的雌鼠妊娠期延长。实验组早产率为7.13%(1/14);对照组早产率为46.15%(6/13),2 组相比差异有统计学意义(P=0.033)。Kaplan-Meier 生存曲线分析结果显示,与对照组相比,实验组中有更大比例的新生小鼠能够存活到3 周龄,如图1 所示(P=0.031)。2 组新生小鼠的体重在第1、2、3 周均差异无统计学意义(P>0.05)。见表2。
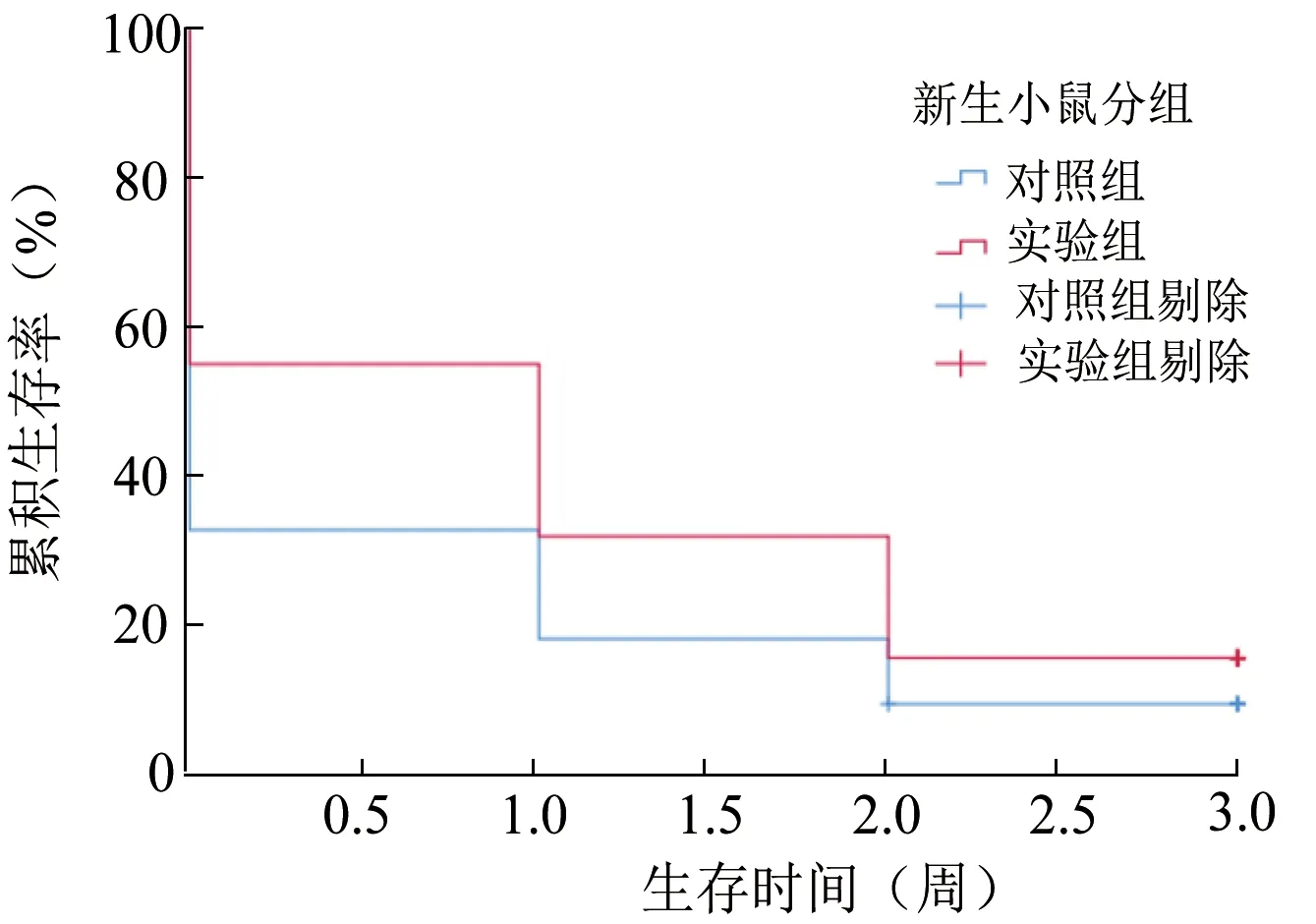
图1 新生小鼠生存分析
表2 对照组和实验组第1、2、3 周龄新生小鼠体重情况(±s)
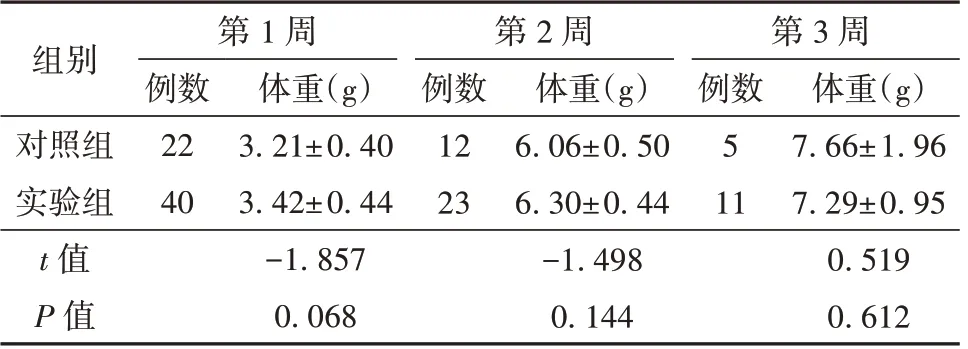
表2 对照组和实验组第1、2、3 周龄新生小鼠体重情况(±s)
组别对照组实验组t 值P 值第1 周第2 周第3 周例数22 40体重(g)3.21±0.40 3.42±0.44-1.857 0.068例数12 23体重(g)6.06±0.50 6.30±0.44-1.498 0.144例数5 11体重(g)7.66±1.96 7.29±0.95 0.519 0.612
2.2 克拉霉素治疗对分娩相关炎症因子基因表达水平的影响
分娩是通过子宫收缩、宫颈扩张、胎膜以及子宫蜕膜等共同作用发生的。实验组雌鼠与对照组雌鼠相比,实验组的炎症因子基因IL-1α、IL-1β 和干扰素-γ(interferon gamma, IFNG)在子宫的表达水平降低;在子宫颈中间隙连接蛋白α-1 基因(gap junction alpha-1 protein, GJA1)和基质金属蛋白酶9基因(matrix metalloprotein 9, MMP-9)的表达明显降低;在胎膜中,核因子κB(nuclear factor kappa-lightchain-enhancer of activated B cell, NF-κB)和半胱天冬氨酸蛋白酶11(caspase 11, CASP-11)的表达也有所下降;在蜕膜中IL-1α、IL12B、CCL22、前列腺素内过氧化物合酶(prostaglandin-endoperoxide synthase 2, PTGS2)和催产素受体基因(oxytocin receptor, Oxtr)的表达降低,IL10 的表达增加。见表3。
表3 雌鼠子宫、子宫颈、胎膜、蜕膜相关炎症基因表达水平(±s)
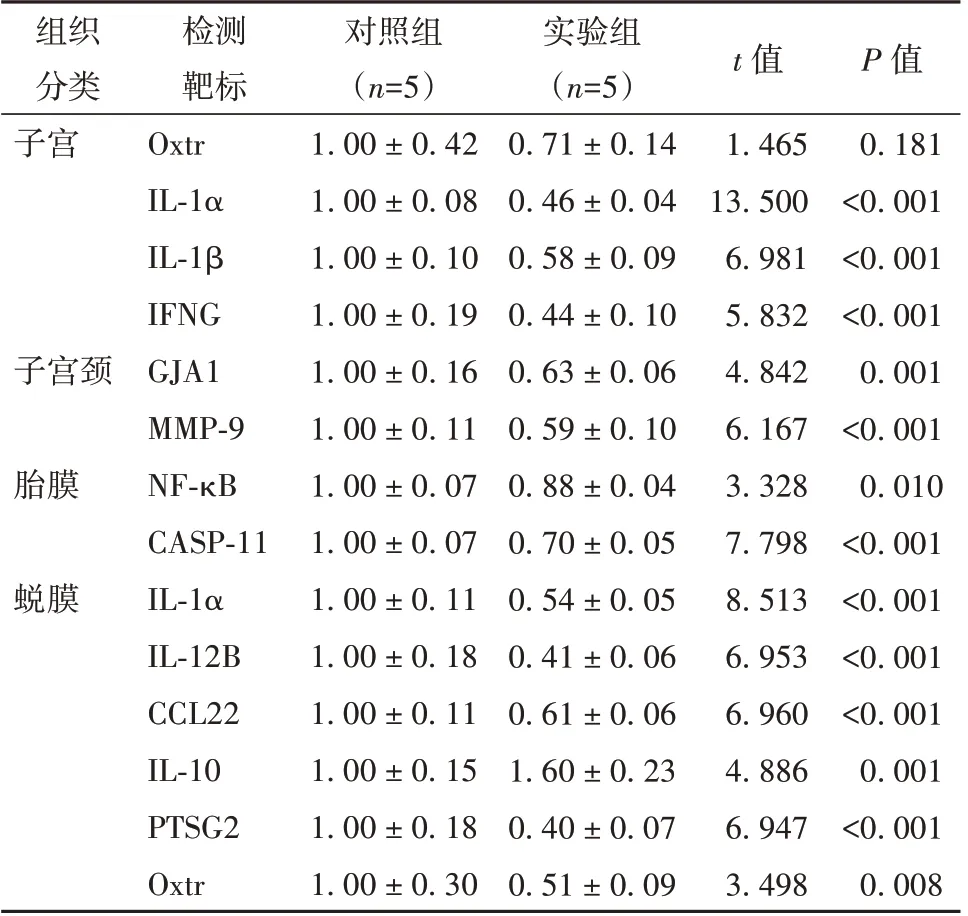
表3 雌鼠子宫、子宫颈、胎膜、蜕膜相关炎症基因表达水平(±s)
注:OXTR 为催产素受体,IL-1α 为白细胞介素-1α,IL-1β 为白细胞介素-1β,IFNG 为干扰素-γ,GJA1 为缝隙连接蛋白α1,MMP-9为基质金属蛋白酶-9,CCL22 为C-C 基序趋化因子配体22,IL-10 为白细胞介素-10,PTSG2 为前列腺素内过氧化物合酶2,NF-κB 为核因子κB,CASP-11 为半胱天冬氨酸蛋白酶11
组织分类子宫检测靶标Oxtr IL-1α IL-1β IFNG GJA1 MMP-9 NF-κB CASP-11 IL-1α IL-12B CCL22 IL-10 PTSG2 Oxtr对照组(n=5)1.00 ± 0.42 1.00 ± 0.08 1.00 ± 0.10 1.00 ± 0.19 1.00 ± 0.16 1.00 ± 0.11 1.00 ± 0.07 1.00 ± 0.07 1.00 ± 0.11 1.00 ± 0.18 1.00 ± 0.11 1.00 ± 0.15 1.00 ± 0.18 1.00 ± 0.30实验组(n=5)0.71 ± 0.14 0.46 ± 0.04 0.58 ± 0.09 0.44 ± 0.10 0.63 ± 0.06 0.59 ± 0.10 0.88 ± 0.04 0.70 ± 0.05 0.54 ± 0.05 0.41 ± 0.06 0.61 ± 0.06 1.60 ± 0.23 0.40 ± 0.07 0.51 ± 0.09 P 值0.181<0.001<0.001<0.001 0.001<0.001 0.010<0.001<0.001<0.001<0.001 0.001<0.001 0.008子宫颈胎膜蜕膜t 值1.465 13.500 6.981 5.832 4.842 6.167 3.328 7.798 8.513 6.953 6.960 4.886 6.947 3.498
2.3 克拉霉素治疗对雌鼠羊膜腔内炎症因子浓度变化的影响
实验组和对照组雌鼠羊水中所评估的所有炎症因子浓度如表4 所示,2 组雌鼠羊水中的IL-6、IL-1β、TNF、IL-1α、IL-10、IFNG、CCL5、CXCL10 浓度相比,差异无统计学意义(P>0.05)。
表4 雌鼠羊水中相关细胞因子浓度(pg/ml, ±s)
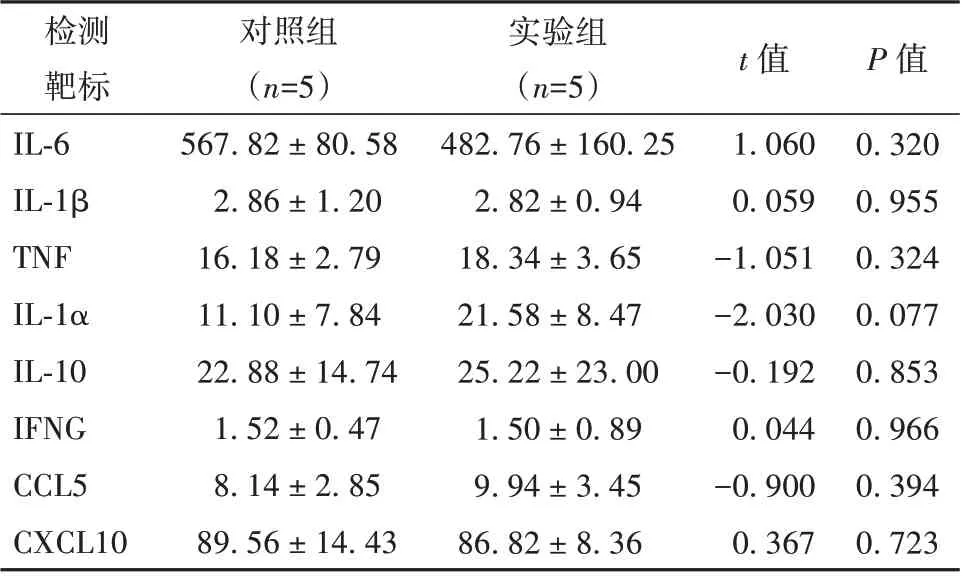
表4 雌鼠羊水中相关细胞因子浓度(pg/ml, ±s)
注:IL-6 为白细胞介素6,IL-1β 为白细胞介素1 亚单位β,TNF为肿瘤坏死因子,IL-1α 为白细胞介素1α,IL-10 为白细胞介素10,IFNG 为干扰素γ,CCL5 为C-C 型趋化因子5,CXCL10 为C-X-C 型趋化因子10
检测靶标IL-6 IL-1β TNF IL-1α IL-10 IFNG CCL5 CXCL10对照组(n=5)567.82 ± 80.58 2.86 ± 1.20 16.18 ± 2.79 11.10 ± 7.84 22.88 ± 14.74 1.52 ± 0.47 8.14 ± 2.85 89.56 ± 14.43实验组(n=5)482.76 ± 160.25 2.82 ± 0.94 18.34 ± 3.65 21.58 ± 8.47 25.22 ± 23.00 1.50 ± 0.89 9.94 ± 3.45 86.82 ± 8.36 P 值0.320 0.955 0.324 0.077 0.853 0.966 0.394 0.723 t 值1.060 0.059-1.051-2.030-0.192 0.044-0.900 0.367
2.4 克拉霉素治疗对雌鼠胎盘炎症因子表达水平的影响
克拉霉素治疗对雌鼠胎盘的影响如表5 所示。相比于对照组雌鼠,实验组雌鼠胎盘组织中炎症因子基因IL-6 和TNF 降低(P<0.05)。此外,炎症因子的多个转录物包括IL-12B、趋化因子配体CCL3、CCL5、CCL22、CXCL9、CXCL10、Toll 样受体9(Tolllike receptor 9, TLR9)和含核苷酸结合寡聚化域蛋白1(nucleotide-binding oligomerization domain 1,NOD1)在实验组雌鼠胎盘中也出现下调(P<0.05)。
表5 雌鼠胎盘中炎症因子基因的表达(±s)

表5 雌鼠胎盘中炎症因子基因的表达(±s)
注:IL-6 为白细胞介素6,TNF 为肿瘤坏死因子,IL-12B 为白细胞介素12 亚单位β,CCL3 为C-C 型趋化因子3,CCL5 为C-C 型趋化因子5,CCL22 为C-C 型趋化因子22,CXCL9 为C-X-C 型趋化因子9,CXCL10 为C-X-C 型趋化因子10,TLR9 为Toll 样受体9,NOD为核苷酸结合寡聚化结构域
检测靶标IL-6 TNF IL-12B CCL3 CCL5 CCL22 CXCL9 CXCL10 TLR9 NOD1对照组(n=5)1.00 ± 0.21 1.00 ± 0.07 1.00 ± 0.09 1.00 ± 0.15 1.00 ± 0.16 1.00 ± 0.14 1.00 ± 0.16 1.00 ± 0.08 1.00 ± 0.05 1.00 ± 0.07实验组(n=5)0.55 ± 0.04 0.54 ± 0.10 0.51 ± 0.08 0.60 ± 0.06 0.54 ± 0.07 0.47 ± 0.10 0.51 ± 0.06 0.63 ± 0.06 0.74 ± 0.06 0.72 ± 0.05 P 值0.043 0.011 0.017 0.044 0.029 0.028 0.039<0.001 0.009 0.010 t 值2.401 3.303 2.997 2.391 2.662 2.667 2.470 8.273 3.435 3.342
2.5 克拉霉素治疗对小鼠胎儿体内器官炎症因子表达水平的影响
克拉霉素治疗对小鼠胎儿的影响如表6 所示,相比于对照组,实验组小鼠胎儿的胎肺中IL-12B,胎肠中NF-κB2、IFNG、CCL5、CXCL9、TLR4 和TLR9,胎肝中IL-1α、TNF、CASP-1、CASP-11、NOD1、CCL5、CCL22、CXCL9、CXCL10,以及胎脾中IL-6、IL-18 的表达水平均出现明显下调(P<0.05)。
表6 实验组小鼠胎儿的肺、肠、肝脏和脾脏相关炎症因子基因表达水平(±s)
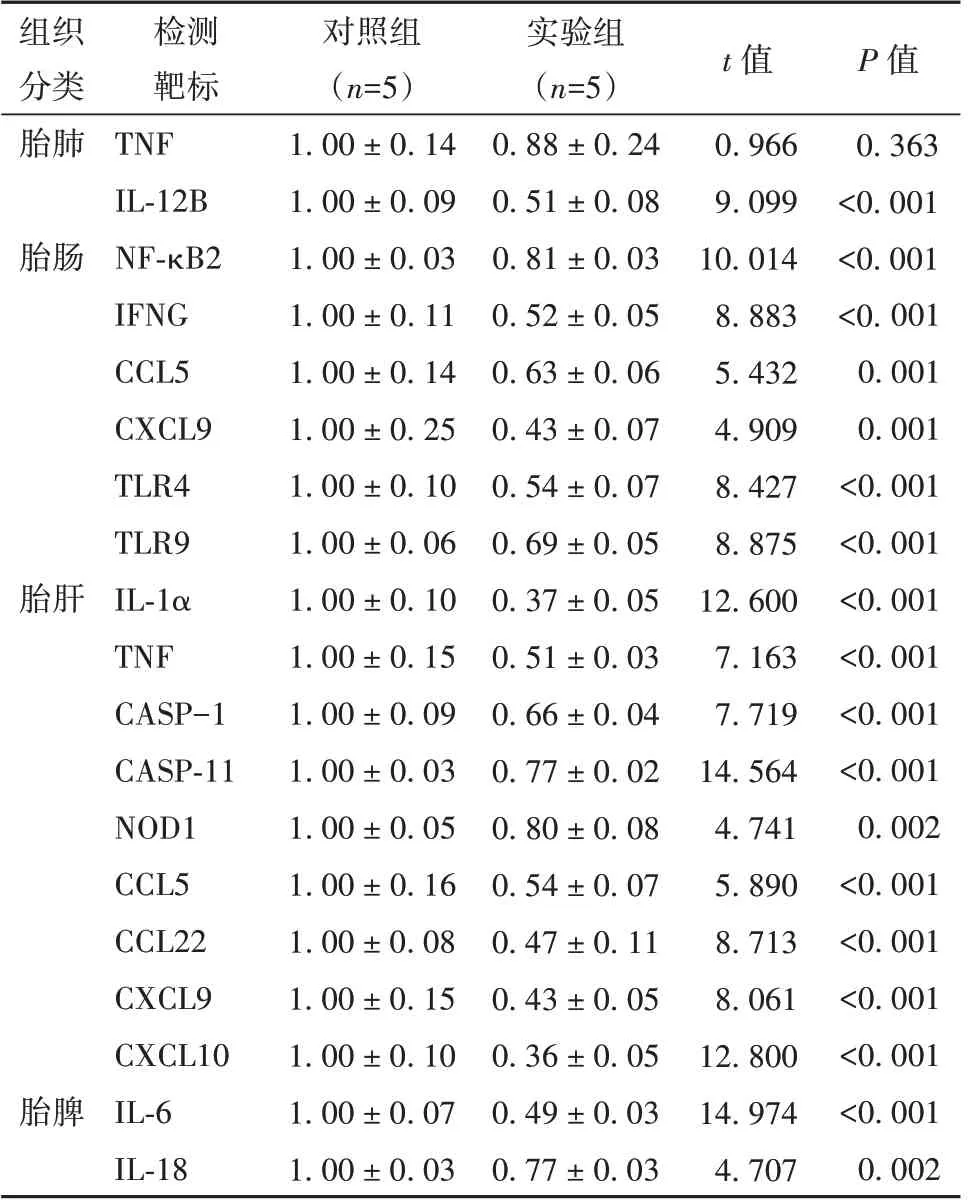
表6 实验组小鼠胎儿的肺、肠、肝脏和脾脏相关炎症因子基因表达水平(±s)
注:TNF 为肿瘤坏死因子,IL-12B 为白细胞介素12 亚单位β,NF-κB2 为核因子κB2 亚单位,IFNG 为干扰素γ,CCL5 为C-C 基序趋化因子配体5,CXCL9 为C-X-C 基序趋化因子配体9,TLR4 为Toll 样受体4,TLR9 为Toll 样受体9,IL-1α 为白细胞介素1α,CASP-1 为半胱天冬氨酸蛋白酶1,CASP-11 为半胱天冬氨酸蛋白酶11,NOD1 为核苷酸结合寡聚化结构域1,CCL22 为C-C 基序趋化因子配体22,CXCL10 为C-X-C 基序趋化因子配体10
组织分类胎肺检测靶标TNF IL-12B NF-κB2 IFNG CCL5 CXCL9 TLR4 TLR9 IL-1α TNF CASP-1 CASP-11 NOD1 CCL5 CCL22 CXCL9 CXCL10 IL-6 IL-18对照组(n=5)1.00 ± 0.14 1.00 ± 0.09 1.00 ± 0.03 1.00 ± 0.11 1.00 ± 0.14 1.00 ± 0.25 1.00 ± 0.10 1.00 ± 0.06 1.00 ± 0.10 1.00 ± 0.15 1.00 ± 0.09 1.00 ± 0.03 1.00 ± 0.05 1.00 ± 0.16 1.00 ± 0.08 1.00 ± 0.15 1.00 ± 0.10 1.00 ± 0.07 1.00 ± 0.03实验组(n=5)0.88 ± 0.24 0.51 ± 0.08 0.81 ± 0.03 0.52 ± 0.05 0.63 ± 0.06 0.43 ± 0.07 0.54 ± 0.07 0.69 ± 0.05 0.37 ± 0.05 0.51 ± 0.03 0.66 ± 0.04 0.77 ± 0.02 0.80 ± 0.08 0.54 ± 0.07 0.47 ± 0.11 0.43 ± 0.05 0.36 ± 0.05 0.49 ± 0.03 0.77 ± 0.03 t 值0.966 9.099 10.014 8.883 5.432 4.909 8.427 8.875 12.600 7.163 7.719 14.564 4.741 5.890 8.713 8.061 12.800 14.974 4.707 P 值0.363<0.001<0.001<0.001 0.001 0.001<0.001<0.001<0.001<0.001<0.001<0.001 0.002<0.001<0.001<0.001<0.001<0.001 0.002胎肠胎肝胎脾
3 讨论
早产是一种包括多种病因的综合征,也是全世界孕产妇及新生儿发病率和死亡率的主要原因[21]。HMGB1 作为一种炎症介质,可以通过结合不同的受体,如RAGE、TLR4、TLR9 等,激活不同的信号通路,如NF-κB、MAPK、PI3K/Akt 等,诱导羊膜-胎盘-子宫组织中的炎症因子表达或释放,从而破坏羊膜完整性、增加羊水感染风险、促进宫颈成熟和子宫收缩[10]。有研究表明,特定的抗生素(如克拉霉素)对羊膜腔内感染的女性表现出抗微生物特性以及抗炎作用[12-13]。本研究旨在探究克拉霉素是否能抑制HMGB1 引发的炎症反应,以及其对降低早产和新生小鼠不良结局的影响。实验结果显示,克拉霉素显著降低了早产率和提高了新生小鼠的存活率,从而验证了本研究的目标和预期。
本研究结果显示,通过克拉霉素处理的实验组雌鼠妊娠期延长,早产率为7.13%(1/14 只),远低于未用克拉霉素治疗对照组雌鼠的早产率46.15%(6/13 只)。此外还发现接受克拉霉素干预的雌鼠中有更大比例的新生小鼠能够存活到3 周龄。这表明克拉霉素治疗可预防羊膜腔内警报素HMGB1诱导的早产和新生小鼠死亡。本研究也探讨了克拉霉素预防早产和新生小鼠不良结局的机制。分娩通过子宫收缩、宫颈扩张、胎膜以及子宫蜕膜等共同作用,还涉及多种促炎介质的表达[22]。本研究通过测定对照组与实验组雌鼠子宫、子宫颈、胎膜和蜕膜相关炎症因子基因表达来判断克拉霉素对分娩共同途径是否有影响。实验组的炎症因子基因IL-1α、IL-1β 和IFNG 在子宫的表达水平降低;在子宫颈中GJA1 和MMP-9 的表达明显降低;在胎膜中,CASP-11 的表达也有所下降;在蜕膜中IL-1α、IL-12B、CCL22、PTGS2、Oxtr 的表达降低,IL-10 的表达增加。这表明克拉霉素在宫内组织中发挥了抗炎作用,影响到分娩的共同途径。Oxtr 以及炎症因子基因IL-1α、IL-1β 和IFNG 是子宫收缩的关键调节因子[23],GJA1 和MMP-9 是参与宫颈收缩和成熟的关键转录物[24],有研究表明克拉霉素通过降低收缩性相关蛋白的基因表达来干扰常见的分娩途径,这些蛋白在早产和足月分娩时会增加[25]。克拉霉素能够通过干扰线粒体蛋白4-硝基苯基磷酸酶结构域和非神经元突触体相关蛋白25 样蛋白同源物-1和-2 来抑制NF-κB 介导的促炎细胞因子的产生[26]。这些数据表明克拉霉素主要通过干扰子宫内母体组织中的炎症反应来预防早产。本研究不仅提供了一种潜在的治疗早产的方法,而且还揭示了克拉霉素在抑制炎症反应方面的作用机制。这一发现具有重要的理论价值,同时也为临床医学提供了新的治疗方案。
为了探究克拉霉素对雌鼠羊水和胎盘的影响,本次研究对对照组和实验组雌鼠的羊水和胎盘进行了检测。与国内外类似的研究相比,本研究明确了克拉霉素对HMGB1 的抑制作用,并详细探究了其作用机制。这一点是本研究的主要创新之处。结果显示,使用克拉霉素治疗的实验组雌鼠和未用克拉霉素治疗的对照组雌鼠羊水中评估的所有细胞因子浓度相比没有显著差异。实验组雌鼠胎盘组织中炎症因子的多个转录物也出现明显下调。这表明克拉霉素改善新生小鼠结局并非完全通过降低羊膜腔内炎症因子浓度来实现,但克拉霉素可减少羊膜腔内HMGB1 诱导的胎盘炎症。这一结果可能与克拉霉素药物本身有关。大环内酯类药物如阿奇霉素或者红霉素治疗能够减少羊膜腔、胎儿肺和/或胎儿皮肤中脲原体诱导的炎症标志物[27]。此外,克拉霉素已成功用于减轻肺部病变患者的炎症,如哮喘、支气管扩张和囊性纤维化[28]。总的来说,这些数据表明克拉霉素提高新生小鼠存活率的机制包括抑制胎儿器官的炎症。但需要进一步的论证来研究接受克拉霉素治疗的雌鼠所生的新生儿是否具有免疫能力。
克拉霉素作为一种广谱的大环内酯类抗生素,除了具有抗菌作用外,还具有抗炎和免疫调节作用。克拉霉素针对HMGB1 的直接分子机制尚不完全清楚,但有一些研究提出了一些可能的途径和机制,例如克拉霉素可以抑制LPS 诱导的巨噬细胞中NF-κB 信号通路的激活,从而降低其下游基因HMGB1 的表达。本研究中也发现克拉霉素治疗对雌鼠胎儿的胎肠中NF-κB2 表达水平均明显下调。后续可以进一步从NF-κB 信号通路来研究克拉霉素针对HMGB1 的分子机制。本研究局限于动物模型,因此其结果可能不能完全适用于人类。此外,样本量相对较小,可能存在统计误差。未来的研究应进一步探究克拉霉素在不同炎症模型中的作用,以及其在人体内的安全性和有效性。这将有助于更全面地了解克拉霉素的治疗潜力和应用范围。
综上所述,在无菌羊膜腔内炎症的情况下,克拉霉素可用于预防早产和提高新生小鼠存活率。克拉霉素预防早产的机制涉及干扰子宫内母体组织(子宫蜕膜和子宫颈)中的炎症级联反应来预防早产。此外,克拉霉素在抑制胎儿炎症反应方面表现出了明显作用,进而改善了新生小鼠结局。

