灰葡萄孢对氟啶胺的敏感性检测及敏感性降低菌株生物学性状研究
王晓辉 向礼波 刘美玲 杨立军 龚双军

关键词:灰葡萄孢;氟啶胺;敏感性;抗性菌株;生物学特性
灰霉病(grey mold)波及范围广,是世界性重要病害之一,该病会导致多种蔬菜果实腐烂变质,是保护地蔬菜生产的一种威胁。其病原菌灰葡萄孢Botrytis cinerea具有寄主范围广泛、产孢量大、易随气流传播、极易对杀菌剂产生抗性等特点。目前,防治灰霉病的主要方法为施用杀菌剂。但是,由于灰葡萄孢基因变异频率较高,生长速度快和产孢量大,其对杀菌剂具有较高抗性风险。已有抗性监测表明,灰葡萄孢对琥珀酸脱氢酶抑制剂(SDHIs)、二甲酰亚胺类(DCFs)、呼吸抑制剂(QOls)和苯并咪唑类(MBCs)杀菌剂等均已产生了抗性。另外,还存在对几种杀菌剂同时表现出多药抗性的菌株。由于灰霉病菌的抗药性导致杀菌剂的防效降低,甚至某些药剂(DCFs和MBCs)在有些地区完全不能使用。
氟啶胺(fluazinam)是吡啶胺类杀菌剂(phe-nylpyrroles)中用于灰霉病防治的重要品种,由日本石原产业公司开发,它的作用机理独特,能够解偶联氧化磷酸化,具有高效和广谱特性。对链格孢属Alternaria、葡萄孢属Botrytis、疫霉属Phytophthora,核盘菌属Sclerotium的病原菌具有很好的防治效果。目前,氟啶胺制剂已经登记防治多种作物病害,尤其在灰霉病防治上应用广泛。
已有的研究表明,植物病原菌对氟啶胺产生抗性风险低,氟啶胺属于低抗性风险杀菌剂;且与其他类型的杀菌剂不存在交互抗性。自从1990年开始应用防治作物病害以来,只有Tamura报道在菜豆田发现了抗氟啶胺的灰葡萄孢菌株。本研究从吉林、江西、湖北、山东、北京、湖南等地区的草莓、辣椒、四季豆、茄子和番茄上采集并分离了灰霉病菌菌株,测定其对氟啶胺的敏感性,比较敏感性下降菌株与敏感菌株之间的生物学性状的差异,研究抗氟啶胺灰葡萄孢菌株的适合度,旨在为灰葡萄孢对氟啶胺的抗性治理及氟啶胺的合理应用提供理论依据。
1材料与方法
1.1供试药剂
95%氟啶胺、98%咯菌腈和97%腐霉利原药分别由湖北正兴源精细化工有限公司、湖北猫尔沃生物医药有限公司和沈阳化工研究院有限公司提供。
1.2菌株的采集與分离
2020年-2021年分别在北京、吉林、湖南、山东、湖北和江西等地各种蔬菜大棚采集灰霉病病叶或病果,将采集的样品带回实验室。18~20℃湿润培养2d后,将具有灰霉病特征的病组织放置于解剖镜下,采用龚国淑等的单孢分离法在PDA培养基上进行纯化,再利用形态特征结合分子生物学方法进行鉴定,分离到的菌株置于4℃冰箱保存备用。
1.3灰霉病菌对氟啶胺敏感性测定
采用菌丝生长速率法测定:以二甲基亚砜为溶剂,将氟啶胺原药配制成浓度为10mg/mL的溶液作为母液,置于4℃冰箱备用。在预备试验的基础上参照Shao等的方法设计带药平板浓度,对敏感性菌株浓度设为:0.001 562 5、0.003 125、0.006 25、0. 012 5、0.025、0.05u/g/mL和0.1ug/mL;对敏感性下降菌株浓度设为:0.0125、0.025、0.05、0.1、0.125、0.25、0.5、1、2ug/mL和4ug/mL,其中4u/g/ml。为最小抑制浓度(MIC)。将药剂母液用二甲基亚砜稀释成系列浓度,等量加入PDA培养基中,倒人灭菌培养皿中(d=9cm),制成带毒平板,以添加等量二甲基亚砜作为空白对照。在预培养好的供试菌株菌落边缘的同一圆周上用打孔器(d=3mm)打取菌饼,菌丝面朝下接种于培养皿中央,3次重复,置于25℃培养箱内黑暗培养。待对照菌落大小接近培养皿边缘时测定各处理菌落直径(mm),与对照处理相比计算出菌落扩展生长抑制率:生长抑制率=(对照菌落直径一处理菌落直径)/(对照菌落直径一菌饼直径)×100%。
以抑制率的几率值y作为纵坐标,药剂浓度对数值z作为横坐标,求出毒力回归方程y=bx+a和相关系数r,计算药剂对病菌的抑制中浓度EC50。
1.4抗药稳定性
将敏感菌株JL106及敏感性下降菌株BJ14、BJ45、BJ46和BJ47在无药PDA平板上培养,当菌丝形成菌落,打取菌饼继代培养。分别测量各菌株的第1代、5代、10代对氟啶胺的敏感性。每代培养3d。
1.5对其他杀菌剂的敏感性
选取4株敏感性下降菌株和11株敏感菌株,分别测定其对二甲酰亚胺类的腐霉利和苯基吡咯类的咯菌腈敏感性,然后分别以对氟啶胺和其他药剂的EC50的对数值为横、纵坐标作图,求出回归直线方程和相关系数。
1.6对氟啶胺敏感性下降的灰葡萄孢菌株的生物学特性测定
1.6.1菌株生长速率测定
田间自然敏感性下降菌株BJ14、BJ45、BJ46和BJ47,敏感菌株HN31,JX83,BJ17和JL106,接种于PDA培养基上,于25℃培养3d后,在菌落边缘同一圆周上打取直径为5mm菌饼,采用菌丝朝下的方式接种到含有15mL PDA培养基的正中间,用封口膜封紧培养皿,每菌株3次重复,置于25℃培养箱中培养3d,测量菌落的生长直径并记录结果,每处理3个重复。
1.6.2菌丝生物量测定
参照Tian等的方法。在20℃条件下培养3d的敏感菌株HN31、JX83、BJ17和JL106及田间自然敏感性下降菌株BJ14、BJ45、BJ46和BJ47的平板上,用直径为3mm的打孔器于菌落边缘同一圆周上打取5枚菌饼,接种于盛有200mL PDB培养液的塑料瓶中,每处理设置3次重复,振荡培养96h去掉培养液,于60℃烘12h。称量各瓶中菌丝干重,取3次重复的平均值为各处理的菌丝生物量。
1.6.3平板上产孢能力及孢子萌发能力
参照Markoglou等的方法,略加改动,方法如下:将在PDA培养基上培养3d的敏感菌株HN31、JX83、BJ17和JL106及敏感性下降菌株BJ14、BJ45、BJ46和BJ47的菌落于20℃,光照周期L∥D=14h∥10h条件下培养7~10d,每皿加20mL浓度为0.1%的葡萄糖液(有利于孢子萌发),用涂布器将所有的菌丝(包括分生孢子)刮下,用4层纱布过滤至50mL塑料离心管中,离心收集孢子,弃上清,用1%葡萄糖溶液重悬,振荡器振荡1min,使孢子充分地分散均匀。用血球计数板计数各菌株孢子悬浮液的浓度,并稀释成80个/mL,取40uL于凹玻片中,于20℃黑暗培养6h,镜检每个菌株共200个孢子中萌发的孢子数,计算萌发率,每菌株设置3次重复。
1.6.4致病力测定
将BJ14、BJ45、BJ46、BJ47和JL106等5个菌株在PDA平板上培养3d备用。选用生长状态和大小相同且表面无明显损伤的番茄果实进行致病力测定。用蒸馏水轻轻清洗果实3次,将盘子(长25cm,宽19.5cm)用75%乙醇清洗消毒,然后用蒸馏水清洗干净,铺3层吸水纸,用蒸馏水湿润。在各菌株的菌落边缘同一圆周上打取5mm菌饼,菌丝面朝下接种到番茄果实中间部位,每菌株3次重复,置于20℃的培养箱中培养8d,统计对番茄的致病力并比较各菌株致病力的差异。试验重复3次。以对氟啶胺敏感的菌株JL106和PDA培养基为阴性对照和空白对照。
1.7统计分析
使用SAS软件(Version 9.13;SAS Institute,Cary,NC)对试验数据进行单因素方差分析,试验数据用平均值±标准差表示。5%水平下LSD多重比较检验各处理平均值之间的差异显著性。
2结果与分析
2.1供试灰葡萄孢对氟啶胺的敏感性
采用菌丝生长速率法测定分离获得的117株灰葡萄孢对氟啶胺的敏感性。菌株BJ14、BJ45、BJ46和BJ47的EC50分别是0.179 8、0.152 4、0.113 7 ug/mL和0. 394 6 ug/mL,显著高于其他113个菌株,并且仅有这4个菌株能够在MIC浓度(4ug/mL)下生长(图1)。剩下113个菌株对氟啶胺的EC50平均值为0.025 1ug/mL,作为本研究的敏感基线。因此,这4个菌株为氟啶胺的敏感性下降菌株,其他菌株为氟啶胺敏感菌株。来自6省市的117株灰霉病菌的EC50的变化见表1,来自湖北的菌株敏感性最高,对氟啶胺的平均EC50最低,为0.002 6ug/mL;来自北京的菌株敏感性最低,对氟啶胺的平均EC50最高,为0.038 9ug/mL。
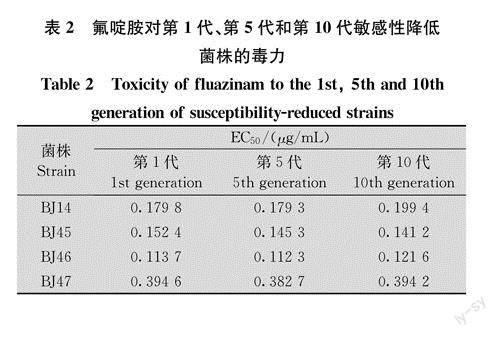
2.2抗性的稳定性
将敏感性降低菌株在不含药剂PDA平板上连续转代培养后,测定其对氟啶胺抗性水平变化。结果(表2)表明,敏感性降低菌株在无药剂条件下连续培养10代后,抗性水平无显著差异,这说明对药剂的不敏感性可以通过无性繁殖稳定表现。
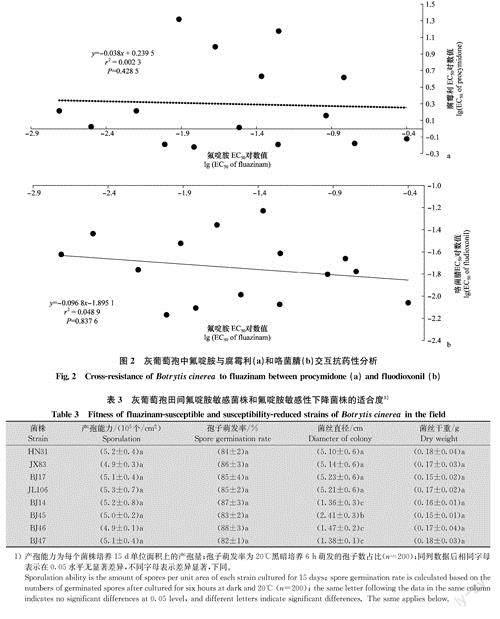
2.3交互抗性特征
氟啶胺敏感菌株和敏感性降低菌株对咯菌腈和腐霉利的敏感性不存在显著差异,因此氟啶胺与咯菌腈、腐霉利之间不存在交互抗性(图2)。
2.4对氟啶胺敏感性下降的灰葡萄孢菌株的生物学特性
2.4.1敏感性下降菌株生长速率、菌丝干重、产孢量和孢子萌发
田间敏感性下降菌株生长速率显著低于敏感菌株,但菌丝生物量与敏感菌株无显著差异。田间敏感性下降菌株的产孢能力和孢子萌发率与敏感菌株也无显著差异(表3)。
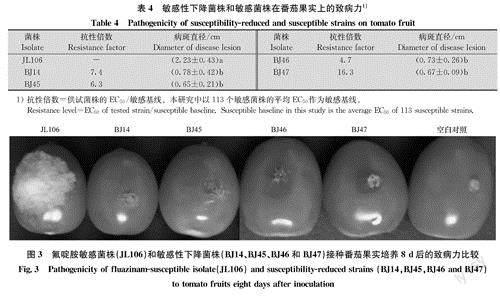
2.4.2敏感性下降菌株的致病力
在番茄果实上进行致病力的试验结果表明,敏感菌株JL106的致病力显著高于4株敏感性下降菌株(图3)。4株敏感性下降的菌株致病力之间无显著差异(表4)。
3结论与讨论
建立敏感基线是病原菌对药剂抗性风险评估中的一项重要内容,尤其是对B.cznerea等有高抗药风险的病原菌。有关氟啶胺的敏感基线的研究已有很多报道,Shao等报道江苏、浙江、辽宁、湖北和重庆等地区的100株灰霉病菌的EC50平均为0.022 7ug/mL,敏感菌株最低抑制浓度(MIC)<4 ug/mL,石妞妞等报道氟啶胺对福建省106株番茄灰霉病菌的EC50平均值为0.022 1ug/mL。本研究测定了采自吉林、北京、江西、山东、湖南和湖北等6省市共计117株灰霉病菌B.cinerea对氟啶胺的敏感性,样本量足够大;除了4株菌敏感性显著降低之外,药剂对其他113株病原群体EC50平均值为0.025 1ug/mL,与前人研究的结果一致。本研究发现的4个菌株都是从北京草莓种植园中分离,这可能与当地用药频率和用药习惯有关,草莓的经济价值高,因此农户用药频次较高,药剂的选择压力大,菌株对药剂的敏感性降低。此外,发现的4株敏感性下降的菌株致病力显著下降。所以,氟啶胺大面积推广应用期间,需要定期监测灰葡萄孢对氟啶胺的抗性发展状况。
国内外有关氟啶胺室内和田间抗药性的报道较少。Tamura报道日本北海道发现了大豆灰霉病菌B.cznerea的田间高抗性菌株,但是关于抗性倍数没有详细介绍。Shao等在室内采用药剂驯化获得抗性突变体菌株,抗性菌株的抗性水平RF(突变体的EC50/亲本菌株的EC50)为23~53,抗性菌株的EC50分布于0.23~0.44ug/mL之间。Vitoratos在室内利用甲基硝基亚硝基胍诱变玉米瘤黑粉菌Ustilago may-dis获得氟啶胺抗性菌株,抗性水平(RF)为11.8~80,EC50分布于0.25~0.48ug/mL之间。本研究分离得到4株对氟啶胺敏感性降低的田间菌株,其EC50为0.113 7~0.394 6ug/mL,其MIC值大于4ug/mL,抗性倍数在4.7和16.3之间,属于低一中抗水平。
了解抗性菌株的生物学特性,可以为解析病原菌对药剂的抗性机制提供帮助。在抗性菌株生物学特性研究中发现,4株敏感性下降菌株生长速率显著低于敏感菌株,菌丝生物量、产孢量和孢子萌发率与敏感菌株无显著差异;致病力测定结果显示敏感性降低的菌株致病力显著下降。说明这4株菌株田间竞争力没有优势,从另一方面也说明为什么氟啶胺使用了快30年,但是在国内外对其抗药性的相关报道比较少。Vitoratos报道的甲基硝基亚硝基胍诱变获得的突变体在生长速率和致病力上与亲本菌株没有差异,Shao等通过药剂筛选获得的突变体在菌丝生物量、产孢量和致病力上显著低于亲本菌株。本研究的结果与以上前人研究结果有差异,推测可能原因是抗性菌株获得方法不同而有差异,抑或是菌株的种类不同而有所不同。交互抗药性研究结果显示,氟啶胺与咯菌腈和腐霉利不存在交互抗药性。目前研究认为腐霉利及咯菌腈的靶标之一可能是双组分信号途径的双组分组氨酸激酶元件OSl,在动物细胞中,氟啶胺通过解偶联氧化磷酸化抑制细胞线粒体的能量合成,具体作用机制尚不清楚。Shao等研究显示,抗性菌株ATP含量下降,然而ATPase活性却显著高于亲本菌株,表明灰葡萄孢对氟啶胺的抗性机制与菌体的能量代谢密切相关。目前能量合成影响的相关研究主要是磷酸化抑制剂。磷酸化抑制剂一般有3类,第一类呼吸抑制剂,这类抑制剂抑制呼吸链的电子传递,也就是抑制氧化,氧化是磷酸化的基础,抑制了氧化也就抑制了磷酸化;第二类磷酸化抑制剂,这类抑制剂抑制ATP的合成,抑制了磷酸化也一定会抑制氧化;第三类解偶联剂,使氧化和磷酸化脱偶联,氧化仍可以进行,而磷酸化不能进行,后两类都抑制能量ATP合成。Vitoratos报道[25]室内获得的U.may-dis抗性突变体和敏感菌株对氟啶胺和磷酸化抑制剂寡霉素敏感性测定,表明两者存在正交互抗药性,而与解偶联剂2,4-二硝基酚不存在交互抗药性,氟啶胺作为磷酸化抑制剂还是作为解偶联剂阻断能量的产生,还需要进一步的研究。在以后的研究中將分析氟啶胺和其他氧化磷酸化抑制剂对灰霉菌线粒体活性的影响,确定氟啶胺的确切作用位点。

