柴胡皂苷D对人肾小管上皮细胞转分化的影响及机制
王珍, 胡浩强, 刘国辉
南方医科大学附属东莞医院 东莞市人民医院肾内科,广东东莞 523000
肾间质纤维化(renal interstitial fibrosis,RIF)是各种慢性肾脏疾病进展为终末期肾衰竭的共同病理基础[1],西医药物治疗不良反应较大,中医治疗肾纤维化取得了明显治疗效果[2]。柴胡有疏散胆经邪气、退热功效,柴胡皂苷D(saikosaponin,SSD)可调节TGF-β/Smad信号通路改善大鼠肝纤维化[3],还能诱导细胞自噬改善Ⅱ型肺泡上皮细胞纤维化改变[4],SSD对RIF的作用效果尚不明确。肾小管上皮细胞-间质转化(epithelial-mesenchymal transition,EMT)是RIF发生、进展的病理变化之一,EMT形成使上皮细胞的黏附功能丧失,肌动蛋白骨架改变,肾小管基底膜被破坏。Wnt/β-catenin信号通路在EMT形成中占据重要作用,抑制该信号通路活化可能是肾脏纤维化治疗的重要靶点[5]。故本研究基于Wnt/β-catenin信号通路从体外细胞水平探讨SSD对人肾小管EMT的作用。
1 材料和方法
1.1 材料、主要试剂和仪器
人近端肾小管上皮细胞HK-2(WN-C45998,武汉华尔纳生物科技有限公司)。SSD(上海源叶生物科技公司),转化生长因子-β1(transforming growth factor-β1,TGF-β1)、Dickkopf-1(DKK-1)(AF-100-21C、120-30,美国Peprotech公司),盐酸贝那普利片(北京诺华制药公司),兔抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、E-钙黏素(E-cadherin)、Snail、MMP-7、N-钙黏素(N-cadherin)一抗(ab150301、ab40772、ab216347、ab207299、ab76011)(Abcam公司),兔抗β-catenin、鼠抗GAPDH一抗(51067-2-AP、60004-1-Ig,PROTEINTECH),Maxima TM SYBR Green/ROX qPCR Master Mix(2X)(Thermo Fisher Scientific)。Step One QPCR仪(Applied Biosystems),Mini-PROTEAN 3 Cell电泳仪(Bio-Rad),Ni-U正置荧光显微镜(日本NIKON),CR22N冷冻离心机(CR22N)。
1.2 细胞培养
将HK-2于含5%胎牛血清的DMEM培养基上进行培养,细胞培养箱孵育条件为37 ℃、5%CO2,待细胞生长融合至80%~90%时按照1∶3比例进行传代培养。
1.3 SSD作用浓度筛选
使用CCK-8法对SSD作用浓度进行筛选,HK-2细胞以1×104个/孔接种至96孔板,待细胞贴壁后加入SSD致其最终浓度为0、1.25、2.50、5.00、10.00、20.00、40.00、80.00、160.00 μmol/L,反应48 h,每孔加入CCK-8溶液10 μL,37 ℃反应2 h,上样酶标仪,检测波长450 nm处的光密度值,观察细胞增殖情况,以SSD对细胞的保护作用来筛选作用浓度。
1.4 细胞分组和干预
将对数期HK-2细胞分为对照组、空白溶剂对照组、RIF组、阳性对照组、SSD组、SSD+DKK-1组,待细胞贴壁后,除对照组、空白溶剂对照组外,其余各组细胞均予以TGF-β1 5 μg/L处理,阳性对照组增加贝那普利10 μmol/L[6]处理,SSD组增加SSD 10.00 μmol/L处理,SSD+DKK-1组增加SSD 10.00 μmol/L、DKK-1 100 μg/L[7]处理,空白溶剂对照组添加等体积DMSO处理,继续作用48 h,光学显微镜下观察各组细胞形态变化。
1.5 免疫荧光检测EMT标志物分布和表达
各组细胞在药物作用48 h后,去除培养基,PBS冲洗2次,4%多聚甲醛固定8 min,PBS冲洗,加入0.3%Triton-X100作用10 min,PBS冲洗,加入10%山羊血清室温封闭30 min,加入兔抗E-cadherin、α-SMA抗体(1∶500)4 ℃过夜,加入兔抗IgG二抗(1∶1 000)室温孵育30 min,PBS冲洗,使用DAPI染色,封片,荧光显微镜观察并采集图片,在高倍镜下每张片子随机选取10个不重叠视野,统计荧光斑(呈明亮点状)数量。
1.6 Western blotting检测蛋白表达
各组细胞在药物作用48 h后,收集细胞,提取细胞总蛋白,BCA法进行蛋白定量。每孔蛋白上样为70 μg,经10%SDS-PAGE电泳恒压分离蛋白(80 V、30 min,120 V、1 h),PVDF膜湿转法转膜(恒压30 V转膜过夜),5%脱脂奶粉室温封闭1 h,加入鼠抗GAPDH(1∶2 000)和兔抗α-SMA(1∶2 000)、E-cadherin(1∶1 000)、Snail(1∶500)、MMP-7(1∶1 000)、β-catenin(1∶1 000)一抗4 ℃过夜,TBST洗膜,加入山羊抗兔/鼠IgG(1∶10 000)室温孵育1 h,TBST洗膜,加入ECL反应液8 min,曝光5 min,采集图片,Image J分析并计算得到目的条带与内参蛋白灰度值比值。
1.7 qRT-PCR检测细胞胶原蛋白ⅠmRNA表达
各组细胞在药物作用48 h后,收集细胞,提取细胞总RNA,反转录成cDNA,使用SYBR Green/ROX qPCR Master Mix进行荧光定量PCR,PCR扩增条件: 94 ℃ 5 min;变性94 ℃ 15 s、退火60 ℃ 1 min、40个循环;94 ℃ 15 s、60 ℃ 60 s,90 ℃ 15 s。实验所用引物均由上海生工设计、合成。引物序列细胞胶原蛋白Ⅰ(Collagen Ⅰ):正向5′-CAATGTGGTTCGTGACCGTG-3′,反向5′-CAGCCTTGGTTGGGGTCAAT-3′,扩增长度183 bp;GAPDH:正向5′-ACTCCTCCACCTTTGACGCT-3′,反向5′-GGTCTCTCTCTTCCTCTTGTGC-3′,扩增长度为187 bp。
1.8 统计学分析
运用SPSS 22.0软件对数据进行分析。计量资料采用单因素方差分析,两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 SSD作用浓度筛选
当SSD作用浓度达到20.00 μmol/L时,HK-2细胞增殖受到抑制,故选取10.00 μmol/L作为后续实验SSD处理浓度(图1)。

图1 不同浓度SSD对HK-2细胞增殖的影响a为P<0.05,与SSD 0 μmol/L比较。
2.2 SSD对HK-2细胞形态变化的影响
对照组、空白溶剂对照组细胞有序、紧密排列,RIF组细胞呈现出长梭形且细胞排列分散;阳性对照组、SSD组和SSD+DKK-1组中长梭形细胞较RIF组减少且细胞分散程度降低(图2)。

图2 各组HK-2细胞形态比较
2.3 SSD对HK-2细胞EMT标志物表达的影响
RIF组EMT标志物E-cadherin的荧光斑低于对照组,α-SMA荧光斑高于对照组(P<0.05);阳性对照组、SSD组和SSD+DDK-1组E-cadherin的荧光斑高于RIF组,α-SMA荧光斑低于RIF组(P<0.05);SSD+DKK-1组E-cadherin的荧光斑高于SSD组,α-SMA荧光斑低于SSD组(P<0.05;表1、图3、图4)。

表1 各组细胞EMT标志物E-cadherin、α-SAM表达的比较

图3 免疫荧光检测HK-2细胞及E-cadherin表达(200×)
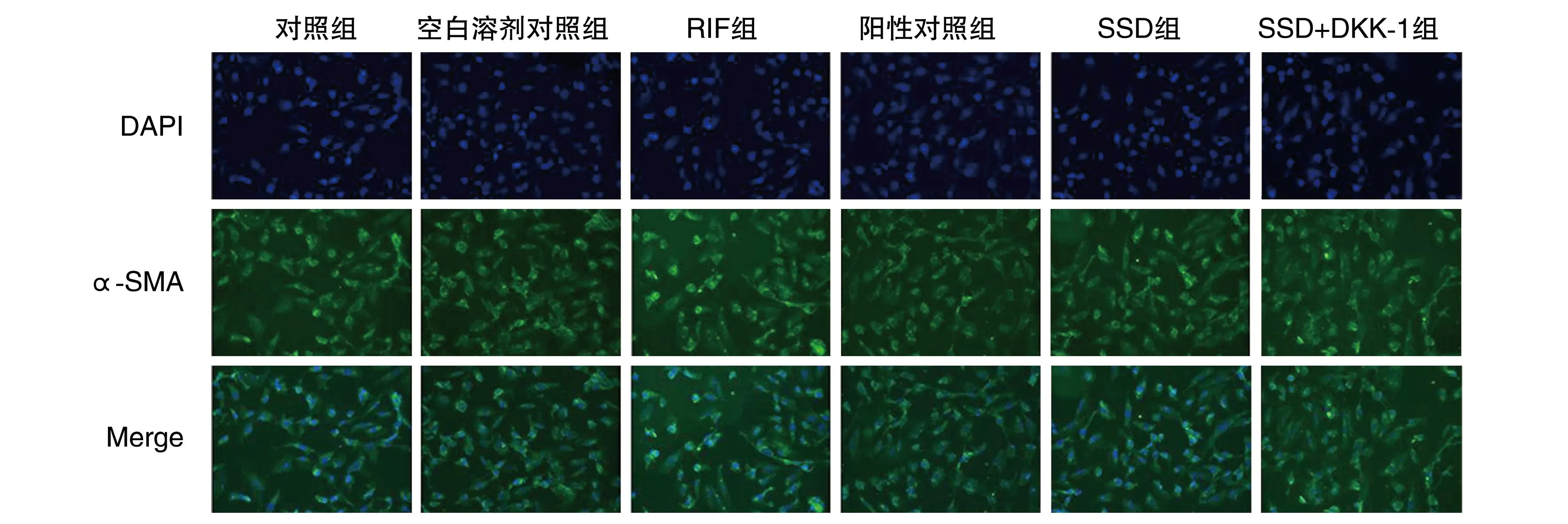
图4 免疫荧光检测HK-2细胞及α-SMA表达(200×)
2.4 SSD对HK-2细胞EMT和Wnt/β-catenin信号通路相关蛋白表达的影响
RIF组MMP-7、Snail、E-cadherin、α-SMA、β-catenin蛋白表达高于对照组(P<0.05);阳性对照组、SSD组和SSD+DDK-1组MMP-7、Snail、α-SMA、β-catenin蛋白表达低于RIF组,E-cadherin蛋白表达高于RIF组(P<0.05);SSD+DKK-1组MMP-7、Snail、α-SMA、β-catenin蛋白表达低于SSD组,E-cadherin蛋白表达高于SSD组(P<0.05;表2和图5)。

表2 各组细胞MMP-7、Snail、E-cadherin、α-SMA、β-catenin蛋白水平的比较

图5 各组细胞MMP-7、Snail、E-cadherin、α-SMA、β-catenin蛋白水平的比较1为对照组;2为空白溶剂对照组;3为RIF组;4为阳性对照组;5为SSD组;6为SSD+DKK-1组。
2.5 SSD对HK-2细胞Collagen Ⅰ基因相对表达量的影响
RIF组Collagen Ⅰ基因相对表达量高于对照组(P<0.05);阳性对照组、SSD组和SSD+DKK-1组Collagen Ⅰ基因相对表达量低于RIF组(P<0.05);SSD+DKK-1组Collagen Ⅰ基因相对表达量低于SSD组(P<0.05;图6)。

图6 各组细胞Collagen Ⅰ基因相对表达量a为P<0.05,与对照组比较;b为P<0.05,与RIF组比较;c为P<0.05,与SSD组比较。
3 讨 论
细胞外基质降解或合成异常所致细胞外基质堆积与基质金属蛋白酶及其抑制酶系统失衡、肾小管上皮细胞和成纤维细胞等有关,成纤维细胞活化会升高α-SMA表达,分泌多种类型胶原,引起细胞外基质在间质累积,促进间质纤维化[8]。TGF-β1可诱发成纤维细胞合成、分泌胶原,抑制细胞外基质蛋白降解酶活力来减少细胞外基质降解[9]。本研究结果显示,正常生长条件下的细胞有序、紧密排列,TGF-β1诱导下的HK-2细胞形态呈长梭形、细胞排列分散,贝那普利、SSD干预可明显改变细胞形态、排列松散情况与文献[10]趋势相似,说明SSD可以改善TGF-β1诱导HK-2细胞形态变化和细胞紧凑程度。
E-cadherin可维持肾小管上皮细胞的结构和功能,正常肾小管上皮细胞α-SMA表达很低,E-cadherin表达降低或丢失、α-SMA表达异常升高时表明上皮细胞形态发生改变[11]。本研究免疫荧光检测结果显示,TGF-β1诱导下HK-2细胞E-cadherin荧光斑数量降低,而α-SMA荧光斑数量增加,贝那普利、SSD干预均可改善E-cadherin、α-SMA荧光斑数量降低、增加趋势,说明SSD可以通过调节E-cadherin、α-SMA表达抑制HK-2细胞EMT形成。
SSD能够缓解高糖所致人肾小管上皮细胞纤维化,其作用机制可能与抑制TGF-β/Smad信号通路有关[12]。本研究结果显示,贝那普利、SSD干预可以明显缓解MMP-7、Snail、α-SMA、β-catenin蛋白表达升高趋势,同时促进E-cadherin蛋白表达,与文献[13]研究结果趋势相似。Collagen Ⅰ细胞外基质的主要成分,Snail可抑制E-cadherin表达和其他表皮因子表达(如闭合蛋白、紧密连接蛋白等)[14],MMP-7可裂解E-cadherin[15],TGF-β1可促进Snail、N-cadherin转录、激活,诱导上皮细胞向成纤维细胞形态进行转变[16],参与EMT进程。本次研究结果说明SSD可以通过降低促EMT相关蛋白表达和Collagen Ⅰ基因水平来抑制HK-2细胞EMT。
细胞外Wnt与细胞膜Fz受体结合,通过信号传递抑制细胞内的糖原合成激酶-3β表达,引起细胞内β-catenin集聚,随后进入细胞核与转录因子T淋巴细胞因子/淋巴增强因子结合,激活编码波形蛋白、纤维连接蛋白、金属蛋白酶Snail家族蛋白等,诱导EMT[17]。DKK-1能够与LRP5/6受体结合抑制Wnt/β-catenin途径活性[18],本研究在TGF-β1、SSD作用基础上增加DKK-1干预,发现HK-2细胞长梭形改变、E-cadherin的荧光斑数量增加、α-SMA荧光斑数量降低和MMP-7、Snail、α-SMA、β-catenin蛋白表达和Collagen Ⅰ基因相对表达量升高趋势较SSD干预效果更加显著,与文献[19]研究结果趋势相似。Wnt/β-catenin信号通路可直接靶向作用MMP-7,可对细胞黏附、EMT以及组织器官的稳定性产生作用[20],促进细胞迁移,该通路活化可促进脏器成纤维细胞活性,促进脏器纤维化,影响脏器功能。本次研究结果说明SSD抑制HK-2细胞EMT可能与抑制Wnt/β-catenin信号通路激活有关。
综上所述,SSD对人肾小管EMT有抑制作用,可能与抑制Wnt/β-catenin途径活化有关,本研究主要是从细胞体外实验层面探究SSD对人肾小管上皮细胞转分化的抑制作用机制,但疾病发生、进展属于极其复杂的过程,受到多种机制调节,后续将开展动物实验进行深入探讨。

