放疗、吉西他滨联合免疫检查点抑制剂的三重疗法对三阴性乳腺癌肿瘤微环境的作用机制
吴苗苗 房 坤
1.中国科学技术大学附属第一医院西区 安徽省肿瘤医院 安徽省立医院西区肿瘤表观遗传学研究室,安徽合肥 230031;2.中国科学技术大学附属第一医院 安徽省立医院生物医学工程处,安徽合肥 230001
三阴性乳腺癌(triple-negative breast cancer,TNBC)是一种侵袭性高、临床预后差、平均生存期低的恶性肿瘤。目前对TNBC 患者常采用化疗和放疗等方法[1-2]。免疫治疗,尤其是程序性死亡受体-1/程序性死亡受体配体1 抑制剂(anti-programmed death-ligand1,aPDL1),在各种癌症中的应用为患者带来了临床效益[3-5]。而TNBC 与其他肿瘤比较,aPD-L1 对其的治疗效果并不理想[6-7]。近年来,研究者发现放疗(radiotherapy,RT)和一些化疗药物如吉西他滨(Gemcitabine,Gem)可以促进aPD-L1 的效果[8-10]。缺氧诱导因子-1α(hypoxia-induciblefactor-1α,HIF-1α)常引起肿瘤细胞的增殖和转移,也可作为一个潜在的治疗靶点[11-12]。本研究拟探讨放疗、Gem 联合免疫检查点抑制剂的三重疗法在小鼠三阴性乳腺癌模型中的效果及可能作用的机制,为TNBC 的临床应用提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 动物、细胞株与主要仪器29 只5 周龄的SPF 级雌性BALB/c 小鼠,体重18~20 g,购于江苏华创信诺医药科技有限公司。实验动物生产许可证号:SCXK(苏)2020-0009;质量合格证号:202 226029;使用许可证号:SYXK(皖)2021-005。实验动物饲养于中国科技大学附属第一医院(安徽省立医院)动物实验中心,本研究经中国科技大学附属第一医院(安徽省立医院)实验动物伦理委员会批准[2021-N(A)-230]。饲养条件:室温20~25℃,相对湿度45%~65%,标准饲料喂养,自由进食,普通光照。BALB/c 自发性乳腺癌细胞系4T1 细胞株购自中国科学院上海细胞库。CO2细胞培养箱(美国Thermo);Tanon 6200 化学发光成像系统(上海天能生命科学有限公司);CytoFLEX 流式细胞仪(美国Beckman-Coulter);CX43 显微镜(日本Olympus);BA410E 荧光显微镜[麦克奥迪(厦门)电气股份有限公司]。
1.1.2 主要试剂 盐酸Gem(Cat.NO.MB1113,大连美仑生物技术有限公司);aPD-L1 人源化单克隆抗体KL-A167 注射液(四川科伦博泰生物医药股份有限公司);胎牛血清(Cat.NO.10099-141)和RPMI-1640细胞培养基(Cat.NO.31870074)(美国Gibco);红细胞裂解液(Cat.NO.R1010,北京索莱宝科技有限公司);CD4-FITC 抗体(Cat.NO.11-0041-82)、CD8a-PE 抗体(Cat.NO.12-0081-82)、CD3e-PE-cyanine5 抗 体(Cat.NO.15-0031-82)(美国Invitrogen);TUNEL 凋亡检测试剂盒(Cat.NO.C1088,上海碧云天生物技术有限公司);小鼠白细胞介素-6(interleukin-6,IL-6)(Cat.NO.E-EL-M0044c)、γ 干扰素(interferon-γ,IFN-γ)(Cat.NO.E-EL-M0048c)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)(Cat.NO.E-EL-M0049c)酶联免疫吸附试验试剂盒(武汉伊莱瑞特生物科技有限公司);BCA 蛋白定量分析试剂盒(Cat.NO.23227,美国Pierce);HIF-1α 抗体(Cat.NO.#36169,美国CST);血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体(Cat.NO.bs-0279R,博士德生物工程有限公司);GAPDH 抗体(Cat.NO.10494-1-AP,武汉三鹰生物技术有限公司);PierceTMECL-Plus-Western-Blotting 底物试剂盒(Cat.NO.#34080,美国Thermo)。
1.2 研究方法
1.2.1 细胞培养 将4T1 细胞培养于含10%胎牛血清的RPMI-1640 细胞培养基中,并置于37℃、5%CO2/95%空气增湿的培养箱中。
1.2.2 分组及干预措施 实验第1 天,于动物左腹部皮下注射约1×106个4T1 细胞,待肿瘤体积增长至100 mm3时采用随机数字表法将其分为对照组(5 只)、aPD-L1组(6 只)、RT+aPD-L1 组(6 只)、Gem+aPD-L1 组(6 只)和三联组(6 只)。实验第6、8、10 天于瘤内注射药物(Gem 5 mg/kg,aPD-L1 3 mg/kg),每次注射24 h 后,对RT+aPD-L1 组和三联组用医用电子直线加速器(瑞典医科达)进行RT,2 Gy/d。实验中每隔2 d 记录小鼠体重,实验期为30 d,结束后脱颈处死小鼠,采集肿瘤、血液和主要器官进一步分析。将小鼠的心脏、肝脏、脾脏、肾脏收集固定于4%多聚甲醛,石蜡包埋,切片后进行苏木精-伊红染色。
1.2.3 流式细胞仪检测 取各组小鼠外周血经红细胞裂解液裂解后待用。另收集各组小鼠肿瘤组织,用透明质酸酶/胶原酶Ⅳ和DNA 酶Ⅰ37℃下消化2 h,裂解红细胞并过滤获得单细胞悬液待用。按照说明书取CD4-FITC、CD8a-PE 和CD3e-PE-cyanine5 抗体与外周血或单细胞悬液共孵育,流式细胞仪检测各染色细胞,并用CytExpert 2.4.0.28 进行分析。
1.2.4 炎症因子的检测 取各组外周血,取血清待用。另取各组肿瘤组织匀浆后待用。根据说明书采用酶联免疫吸附试验试剂盒检测外周血血清中和肿瘤匀浆内IFN-γ、TNF-α 和IL-6 的表达。
1.2.5 免疫组织化学染色和TUNEL 检测 取肿瘤组织石蜡切片用Ki-67(1∶800)、CD31(1∶200)和γH2AX 的(1∶100)抗体孵育,再与种属特异性二抗(1∶1 000)孵育。清洗后,与二氨基联苯胺显色剂孵育3~5 min,用苏木精反染后在显微镜下观察。另取肿瘤组织石蜡切片,根据说明书用TUNEL 检测试剂盒染色,荧光显微镜下观察,评估细胞凋亡情况。关于微血管密度(microvessel density,MVD)的测定,每组取5 个CD31 高阳性热点微血管数值的平均值。每组取5 个高倍视野计算γH2AX 阳性细胞比率作为DNA 损伤的定量分析。
1.2.6 Western blot 取各组肿瘤组织提取蛋白。用BCA 蛋白定量分析试剂盒对总蛋白定量。各组蛋白(100 μg/孔)经SDS-PAGE 电泳分离后转移到PVDF膜,封闭后,与一抗HIF-1α(1∶1 000)、VEGF(1∶1 000)和GAPDH(1∶1 000)孵育。洗膜后,与种属特异性二抗(1∶2 000)孵育。洗膜后,将膜曝光并扫描保存。
1.3 统计学方法
采用GraphPad Prism 8 软件进行数据分析。计量资料采用均数±标准差(±s)表示,比较采用t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 五组体重、瘤重的比较及重要器官情况
实验过程中各组体重比较,差异无统计学意义(P>0.05)。实验结束时,RT+aPD-L1 组、三联组瘤重均低于aPD-L1 组,三联组低于RT+aPD-L1 组(P<0.05)。苏木精-伊红染色显示各组心脏、肝脏、脾脏、肾脏没有明显损伤。见图1。
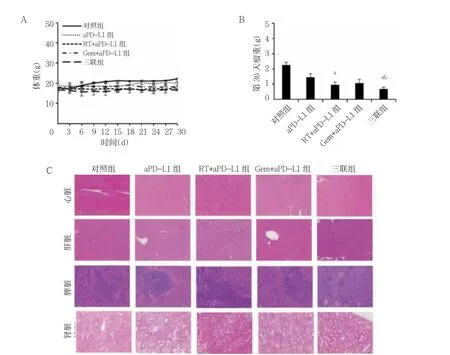
图1 不同治疗对肿瘤生长的影响
2.2 五组外周血及肿瘤中CD3+CD8+T 细胞绝对百分比、IFN-γ、TNF-α、IL-6 比较
aPD-L1 组外周血CD3+CD8+T 细胞绝对百分比、TNF-α、IL-6 高于对照组;RT+aPD-L1 组外周血IL-6 高于aPD-L1 组,三联组外周血CD3+CD8+T 细胞绝对百分比、IFN-γ、IL-6 高于aPD-L1 组;三联组外周血CD3+CD8+T 细胞绝对百分比高于RT+aPD-L1组、Gem+aPD-L1 组,IL-6 高于Gem+aPD-L1 组(P<0.05)。aPD-L1 组肿瘤组织中CD3+CD8+T 细胞绝对百分比、IFN-γ、TNF-α、IL-6 高于对照组;RT+aPD-L1组、Gem+aPD-L1 组、三联组肿瘤组织中CD3+CD8+T细胞绝对百分比高于aPD-L1 组,三联组TNF-α、IL-6 高于aPD-L1 组;三联组肿瘤组织中CD3+CD8+T细胞绝对百分比、IL-6 高于RT+aPD-L1 组、Gem+aPDL1 组,IFN-γ 高于RT+aPD-L1 组(P<0.05)。见图2。
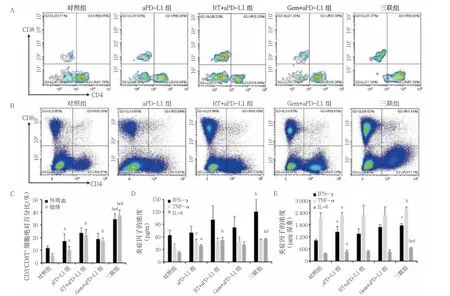
图2 五组外周血及肿瘤中CD3+CD8+T 细胞绝对百分比、IFN-γ、TNF-α、IL-6 比较
2.3 五组Ki-67、细胞凋亡情况及MVD-CD31、γH2AX阳性细胞比率及HIF-1α、VEGF 比较
免疫组织化学染色和TUNEL 检测显示三联组肿瘤组织中Ki-67 的表达减少,凋亡的细胞增多。三联组MVD-CD31 低于aPD-L1 组,γH2AX 阳性细胞比率高于aPD-L1 组、Gem+aPD-L1 组(P<0.05)。aPD-L1组VEGF 低于对照组,RT+aPD-L1 组、Gem+aPD-L1组、三联组VEGF 低于aPD-L1 组,三联组HIF-1α 低于aPD-L1 组和RT+aPD-L1 组(P<0.05)。见图3。
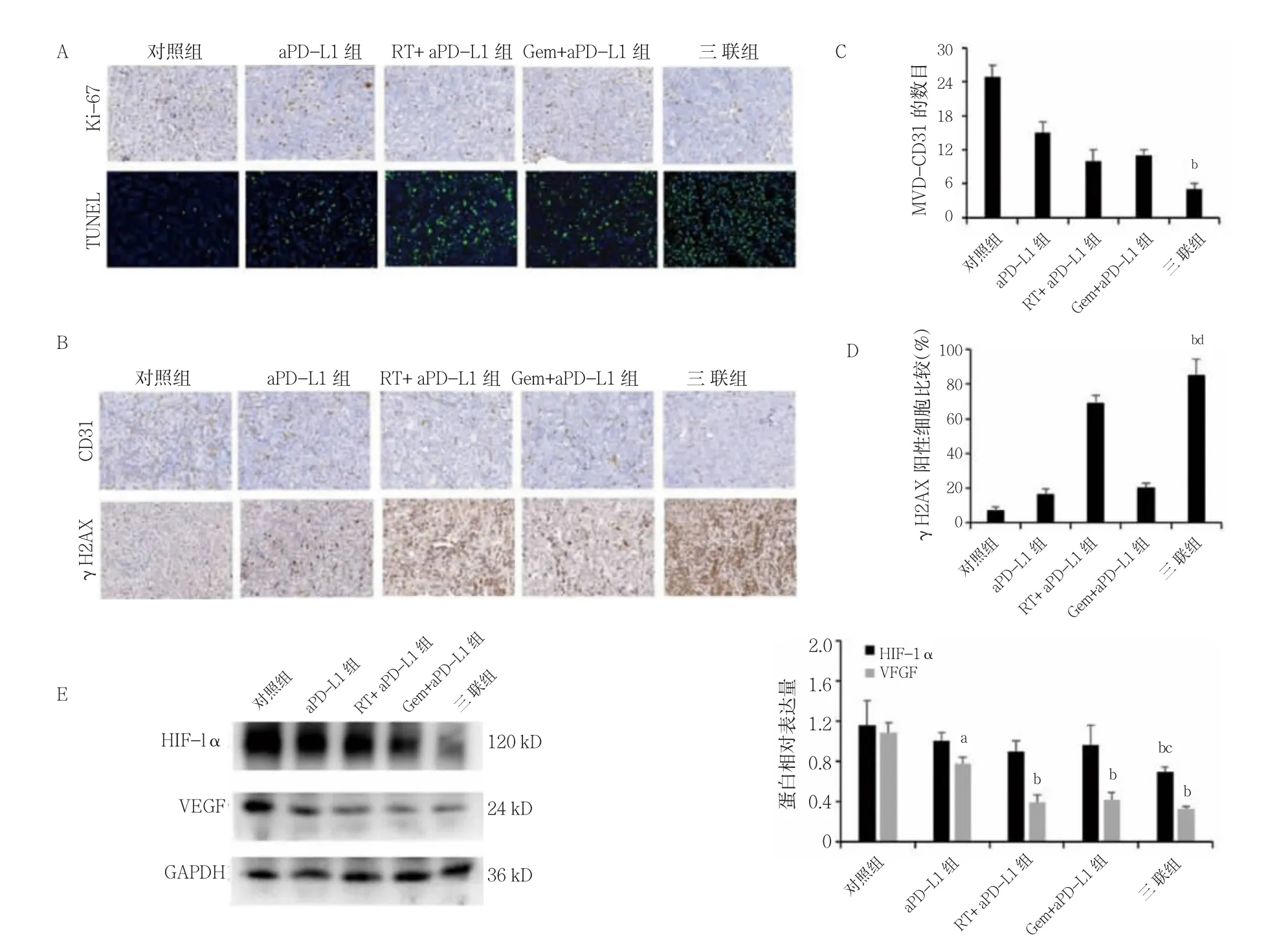
图3 五组Ki-67、细胞凋亡情况及MVD-CD31、γH2AX 阳性细胞比率及HIF-1α、VEGF 比较
3 讨论
实体瘤的治疗手段通常是化疗和放疗,TNBC 也不例外。近年来,能刺激宿主免疫系统来攻击肿瘤细胞的免疫治疗有望成为下一代癌症治疗策略。其中,免疫检查点阻断是常用的方法。
4T1 是来源于BALB/c 小鼠的三阴性乳腺癌细胞,与晚期人类癌症相似[13]。本研究建立了小鼠乳腺癌细胞系4T1 的BALB/c 小鼠移植瘤模型,观察到了三重治疗可以减缓肿瘤的生长。进一步发现该治疗效果可能与CD8+细胞毒性T 细胞(cytotoxic T cells,CTL)数量增加有关,CD8+CTL 是直接杀死肿瘤细胞的免疫效应细胞。研究表明,较高数量的CD8+T 细胞与各种癌症较好的结局相关[14-16]。另外,三重治疗增加了与细胞杀伤有关的炎症因子如IFN-γ、TNF-α、IL-6 的表达。PD-L1 是由效应T 细胞释放的IFN-γ在转录水平上诱导的,TNF-α 可以阻止肿瘤发生、发展[17-19]。IL-6 是典型的促炎性细胞因子,可以预测免疫应答[20]。
由于不规则的血管生成和细胞增殖,肿瘤组织比正常组织更加缺氧。在TNBC 中,肿瘤缺氧微环境的免疫抑制功能会逐渐增强肿瘤的进化[21-22]。有研究表明,下调HIF-1α 在TNBC 中的表达可以部分抑制癌细胞增殖和转移[23]。VEGF 是血管生成的关键调节因子,同时也是一个免疫抑制因子[24-25]。三重治疗组中HIF-1α 和VEGF 的表达较低,提示三重治疗还可以改善肿瘤缺氧微环境,抑制微血管生成。
综上所述,本研究在小鼠TNBC 移植瘤模型中应用了RT、Gem 联合免疫检查点抑制剂的三重疗法。虽然单独使用aPD-L1 有一定治疗作用,但三重疗法不仅可以作为调节浸润性T 淋巴细胞的“蓄水池”,还可以改善瘤内缺氧状况,并且抑制微血管生长。关于临床的进一步应用,需要深入研究和优化药物使用剂量和治疗频率。

