ZIF-8基仿生碳酸酐酶构建及对CO2高效矿化
刘清, 刘奇, 潘琦, 李国印, 王睿猛, 宋明新, 李俊仪, 周利琴, 赵祯霞, 赵钟兴*
(1.广西大学 化学化工学院, 广西 南宁 530004;2.广西高校低碳绿色化工新技术重点实验室, 广西 南宁 530004)
0 引言
随着全球工业化的不断发展,化石燃料的过度消耗使得大气中CO2排放量大幅增加,温室效应不断加剧导致频繁发生自然灾害,并引发一系列社会和生态问题[1]。CO2的环境处理过程主要由CO2的捕获、储存和利用等3个部分组成,提高CO2利用效率一直备受科研工作者的关注[2]。在各种CO2捕获再利用方法中,生物利用法因能耗低和使用条件温和等原因而被广泛研究,这其中碳酸酐酶催化CO2转化是研究的热点。碳酸酐酶(carbonic anhydrase, CA)是目前已报道具有最高CO2催化转化活性的生物酶,其能催化CO2与水合成碳酸氢根和质子,从而实现对环境中CO2的捕获[3]。
碳酸酐酶作为生物酶受限于pH值敏感性高、热和化学稳定性低、价格高昂和难以回收等问题而使其工业应用困难,为此,很多研究者尝试基于碳酸酐酶活性中心结构合成仿生碳酸酐酶纳米酶,利用纳米材料本身的高结构稳定性、利于回收和价格较低廉的优势开展CO2催化转化利用研究。例如,Jin等[4]基于碳酸酐酶活性中心Zn与组氨酸的配位结构,合成了一种新型碳酸酐酶金属有机框架材料(metal-organic frameworks, MOFs)(Zn)纳米酶,该材料具有良好的酯酶催化性能,对CO2的速率达2.14 μmol/min。Liang等[5]同样也基于碳酸酐酶活性中心结构,合成了一种由Zn三唑配位聚合物构成的碳酸酐酶纳米酶,也实现了对CO2的高效催化转化,其速率达到4.43 μmol/min。虽然目前的研究通过对碳酸酐酶的仿生实现了对CO2的高效转化,但是目前合成的碳酸酐酶纳米酶与天然碳酸酐酶相比其催化反应速率依然较低,而且关于合成后HCO3-的利用也没有深入研究。如何提升碳酸酐酶纳米酶的催化活性并进行深加工应用,从而实现对CO2的高效矿化再利用是目前该领域研究的热点问题。
本文中以具有类碳酸酐酶活性中心结构的典型MOFs(Zn)材料ZIF-8为研究对象,将碳酸酐酶中常见的氨基酸天冬门氨酸(Asp)、谷氨酸(Glu)原位植入ZIF-8骨架中,合成具有高催化活性的碳酸酐酶仿生纳米酶,并设计以碳酸酐酶纳米酶为核心的CO2连续矿化装置,实现了CO2的有效连续矿化。该工作为开展碳酸酐酶仿生纳米酶连续高效分离矿化CO2的工业化应用提供有效的理论数据。
1 实验
1.1 试剂及仪器
试剂:六水合硝酸锌、2-甲基咪唑(美国 Sigma-Aldrich 公司);L-天门冬氨酸、L- 谷氨酸、氯化钙、4-羟乙基哌嗪乙磺酸(上海阿拉丁试剂有限公司);三乙胺(上海萨恩化学技术有限公司);无水甲醇、无水乙醇(广东光华科技有限公司);氢氧化钠、N,N-二甲基甲酰胺、乙腈(国药集团化学试剂有限公司);乙酸对硝基苯酯(上海麦克林生化有限公司);高纯氮气、二氧化碳(纯度为99.999%,广西空分气体有限公司),石英砂(粒径为0.5~1 mm,广西中硅新型材料有限公司),试剂均为分析纯。
仪器:台式高速离心机(TG16G型,湖南凯达科学仪器有限公司);pH计(PHS-3E型,上海仪电科学仪器股份有限公司);扫描电子显微镜(Hitachi SU8220型,日本日立公司);X射线衍射仪(SMARTLAB3KW型,日本理学公司);核磁共振仪(Bruker ARX-400 NMR型,德国布鲁克技术有限公司);比表面积和孔径分析仪(ASAP2450型,美国麦克有限公司);紫外可见分光光度仪(TU-1901型,北京普析通用仪器有限公司);热重分析仪(TGA/DSC 3+型,瑞士梅特勒-托利多公司)。
1.2 材料的合成
1.2.1 ZIF-8的制备
称取1.504 g (5 mmol) Zn(NO3)2·6H2O和3.284 g (40 mmol) 2-甲基咪唑分别溶于70.8 mL甲醇中,然后将Zn(NO3)2·6H2O的甲醇溶液滴入2-甲基咪唑的甲醇溶液中。在30 ℃下反应24 h,得到白色乳浊液。将白色乳浊液以转速为7 000 r/min离心分离8 min,用甲醇洗3次,120 ℃下真空干燥12 h,得到白色粉末即为ZIF-8。
1.2.2 氨基酸修饰ZIF-8材料的制备
称取0.744 g (2.5 mmol) Zn(NO3)2·6H2O溶于50 mL超纯水中,再分别称取 20 mmol的天门冬氨酸(Asp)和谷氨酸(Glu)于50 mL超纯水中,加入三乙胺5.56 mL (40 mmol)使其溶解,然后加入1.641 g (20 mmol) 2-甲基咪唑。称取2份0.744 g (2.5 mmol) Zn(NO3)2·6H2O分别溶于50 mL超纯水中,将Zn(NO3)2·6H2O溶液滴入氨基酸和2-甲基咪唑的混合溶液中。在30 ℃下反应24 h,得到白色乳浊液。将白色乳浊液以传速为7 000 r/min离心分离8 min,用甲醇洗3次,120 ℃下真空干燥12 h,得到白色粉末分别记为ZIF-Asp和ZIF-Glu。
1.3 材料酶活检测
碳酸酐酶的活性通过酯酶法进行测定[6]。该方法以p-NPA为底物,利用仿生碳酸酐酶材料的酯酶活性催化p-NPA,p-NPA 在其催化作用下变成对硝基苯酚(p-NP)。p-NPA水解反应方程式为
因为p-NP在波长402 nm 处有1个特征吸收峰,因此反应特定时间后,以不加材料的溶液作为空白对照组,用紫外分光光度计测定溶液在402 nm处吸光度值随时间的变化,以此计算p-NP的浓度随时间的变化,进而推算材料的催化活性。具体步骤:量取26.7 mL缓冲溶液(浓度为0.1 mol/L, pH=8.5 HEPES Buffer溶液),加入3 mL的ZIFs溶液(浓度为0.7 mmol/L,溶剂为DMF)和0.3 mL的p-NPA溶液(浓度为50 mmol/L,溶剂为乙腈),测定室温下反应时间分别为1、3、5、10、15、20、25、30 min时,反应体系在402 nm处的吸光度值,再利用p-NPA的吸光度—浓度标准曲线(浓度为0.434 8~10.345 2 μmol/L)计算对应的浓度,计算公式为
yt=115.923 1xt-0.797 6,R2=0.999 8,
(1)
式中:yt为t时刻p-NP的浓度,μmol/L;xt为t时刻p-NP的吸光度值。
1.4 CO2的矿化
依次将合成的碳酸酐酶纳米酶ZIF-8、ZIF-Asp、ZIF-Glu按照质量比为1∶10与石英砂混合装填成柱[尺寸为18 mm×200 mm(内径×长度)]制备CO2连续矿化装置(图1)。
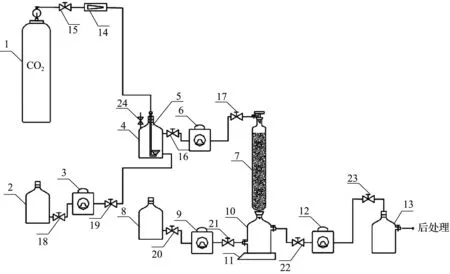
1-CO2气瓶;2-缓冲溶液瓶;4-预混合瓶;3、6、9、12-蠕动泵;5-细化器;7-催化柱;8-CaCl2溶液瓶;10-反应瓶;11-磁力搅拌器;13-收集瓶;14-气体流量计;15~23-节流阀;24-泄压阀。
在装置开启前,先利用CO2气瓶1输送CO2进入装置内通气30 min,排除空气后关闭进气阀,然后通过蠕动泵3将缓冲溶液瓶2中的HEPES缓冲液(pH=8.5,浓度为0.1 mol/L)输送至预混合瓶4中加至2/3处。之后正式开始实验,CO2气瓶1以体积流量90 mL/min的速率输送CO2至预混合瓶4中与缓冲液进行预混合,同时利用蠕动泵3为预混合瓶4进料,蠕动泵6将气液混合物输送进入催化柱7(碳酸酐酶石英砂按照质量比为1∶10混合装料)进行转化反应。反应后的气液混合物流入反应瓶10,与蠕动泵9输送来的CaCl2溶液瓶8中浓度为0.4 mol/L的CaCl2溶液混合,并在磁力搅拌器11的作用下进行搅拌混合反应,反应瓶10中混有生成的碳酸钙晶体颗粒的溶液通过蠕动泵12输送到收集瓶13,反应1 h后停止。收集液布氏漏斗过滤、乙醇洗涤后干燥称重,对滤液进行后处理,向滤液中加入浓度为0.5 mol/L的NaOH溶液进行中和,使其pH维持在8.5左右,所得的缓冲溶液再进入体系中进行循环利用。 通过计算CO2通入反应体系的质量与生成产物的质量之比,可以得到反应体系中CO2的转化率,即
(2)
式中:η为CO2的转化率,%;P为实验环境大气压,Pa;Q为CO2的体积流量,m3/h;M为CO2的相对分子质量,g/mol;R为摩尔气体常量,R=8.314 J/(mol·K);T为实验环境温度,K;m为所得产品的质量,g。
2 结果与讨论
2.1 材料表征
2.1.1 扫描电镜(SEM)
ZIF-8、ZIF-Asp、ZIF-Glu的SEM图像如图2所示。由图2(a)可知,ZIF-8表面光滑,大小均匀,呈现规则且均匀的十二面体结构,晶粒尺寸大小为50 nm左右。由图2(b)、(c)可知,经过Asp、Glu修饰后,ZIF-8晶体形貌较为不规整且晶粒尺寸明显增大,说明不同种类氨基酸的掺杂在不同程度上影响ZIF-8的成核速率,从而进一步影响ZIF-8晶体的生长[7]。

(a) ZIF-8
2.1.2 X射线衍射(XRD)
ZIF-8、ZIF-Asp、ZIF-Glu的XRD谱图如图3所示。由图3可知,在2θ分别为7.5°、10.5°、12.9°、14.8°、16.6°、18.2°时分别对应ZIF-8的(011)、(002)、(112)、(002)、(013)、(222)晶面,证明了ZIF-8的成功合成[8]。经过氨基酸修饰后的ZIF-Asp、ZIF-Glu与ZIF-8具有相同的衍射图谱,说明经过氨基酸修饰后ZIF-Asp、ZIF-Glu依然保持原有ZIF-8的拓扑结构和近似的单元参数[9],但ZIF-Asp、ZIF-Glu的(011)晶面的衍射峰强度明显降低,说明Asp、Glu的掺杂抑制ZIF-8晶体(011)晶面的生长,导致结晶度下降。
2.1.3 N2等温吸附-脱附分析
ZIF-8、ZIF-Asp、ZIF-Glu的N2吸附-脱附等温曲线如图4所示。由图4可见,ZIF-8的N2吸附等温线在相对压力p/p0<0.01范围内吸附量随着压力的增大迅速增大,无滞后现象,且随着相对压力的不断增大,吸附量曲线呈现水平状,符合Ⅰ型等温线特征,表明ZIF-8均为典型的微孔结构材料[10]。经氨基酸修饰后,ZIF-Asp、ZIF-Glu的吸附等温线不仅在相对压力p/p0<0.01范围内吸附量急剧上升,且在相对压力p/p0为0.01~0.20范围内吸附量具有平缓上升趋势,表明经氨基酸修饰后样品中产生介孔结构。

图4 ZIF-8、ZIF-Asp、ZIF-Glu的N2吸附-脱附等温曲线Fig.4 N2 adsorption-desorption curves of ZIF-8, ZIF-Asp, ZIF-Glu
ZIF-8、ZIF-Asp、ZIF-Glu的比表面积和孔结构参数见表1。从表1可见,ZIF-8的比表面积为1 420 m2/g且以微孔为主,而ZIF-Asp、ZIF-Glu的比表面积显著减小,分别为765、662 m2/g,并且2个样品的介孔比表面积和介孔体积明显增大,与图4的N2吸附-脱附等温曲线结论一致。导致ZIF-Asp、ZIF-Glu存在缺陷孔的原因可能是Asp、Glu上的羧基无法与Zn2+产生强配位作用,从而导致骨架中存在部分单臂配位而产生缺陷介孔[11],这些暴露出的介孔将会强化纳米酶所形成缺陷Zn簇的催化活性[12],而且还有利于CO2在纳米酶中的扩散[13]。
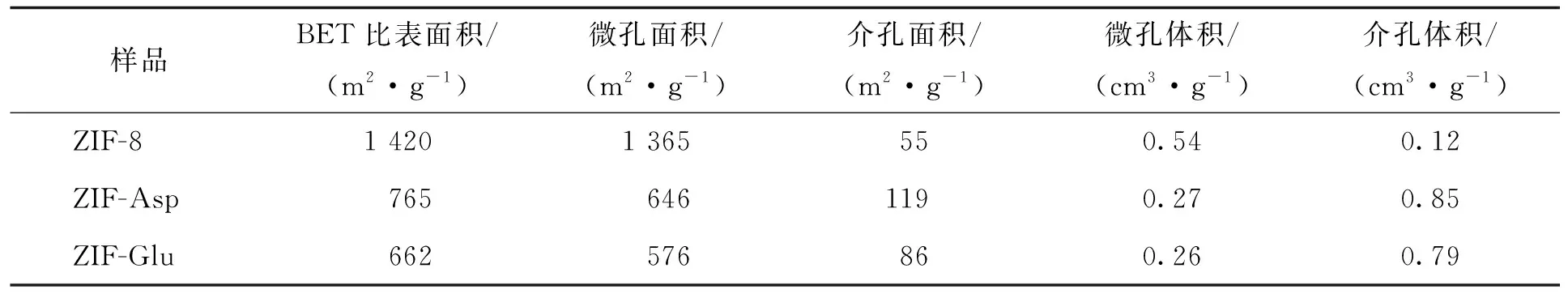
表1 不同样品的比表面积和孔结构参数Tab.1 Surface area and pore textural parameters of different samples
2.1.4 核磁共振波谱(1H-NMR)
为了进一步证实氨基酸对ZIF-8的修饰作用,对所有材料进行1H-NMR光谱分析。ZIF-8、ZIF-Asp、ZIF-Glu的1H-NMR谱图如图5所示。从图5可见,化学位移δ(11.6)归属于溶剂峰CF3COOD,化学位移δ(2.8、7.4)的共振峰分别归属于2-甲基咪唑的甲基和次甲基。在ZIF-Asp的1H-NMR谱图中化学位移δ(4.9、3.8)处出现了Asp的α-H和β-H的共振峰,化学位移δ(8.8)的共振峰归属于Asp中的氨基。在ZIF-Glu的1H-NMR谱图中化学位移δ(5.0、3.6、3.4)处分别出现了Glu的α-H、β-H和γ-H的共振峰,化学位移δ(8.7)的共振峰归属于Glu中的氨基,以上结果说明Asp和Glu被成功植入ZIF-Asp、ZIF-Glu骨架中。
2.1.5 热重分析
ZIF-8、ZIF-Asp、ZIF-Glu的热重分析(thermo gravimetric analyzer, TGA)曲线如图6所示。从图6可见,ZIF-8的失质量分为2个阶段:第1阶段为180~420 ℃,失质量原因是ZIF-8在制备过程中吸附的水分或其他客体分子分解[14],失质量分数为10.7%;第2阶段为420~800 ℃,主要是有机配体发生分解,造成ZIF-8骨架结构坍塌[15]。ZIF-Asp、ZIF-Glu的失质量曲线与ZIF-8相似,但ZIF-Asp、ZIF-Glu具有更高的热稳定性温度(425、443 ℃),说明氨基酸修饰的材料也具有较高的热稳定性。而ZIF-Asp、ZIF-Glu的第1阶段失质量分数明显大于ZIF-8(16.3%和17.5%),可能是Asp、Glu的掺杂使ZIF-8暴露了更多的缺陷位,从而更利于水的吸附所致[11]。这些结果进一步验证Asp、Glu的修饰没有改变ZIF-8的骨架结构,并且结合水含量结果说明极性增加,更有利于CO2的吸附。

图6 ZIF-8、ZIF-Asp、ZIF-Glu的TGA曲线Fig.6 TGA curves of ZIF-8, ZIF-Asp, ZIF-Glu
2.2 碳酸酐酶仿生酶催化矿化性能测定
2.2.1 碳酸酐酶仿生酶催化活性测定
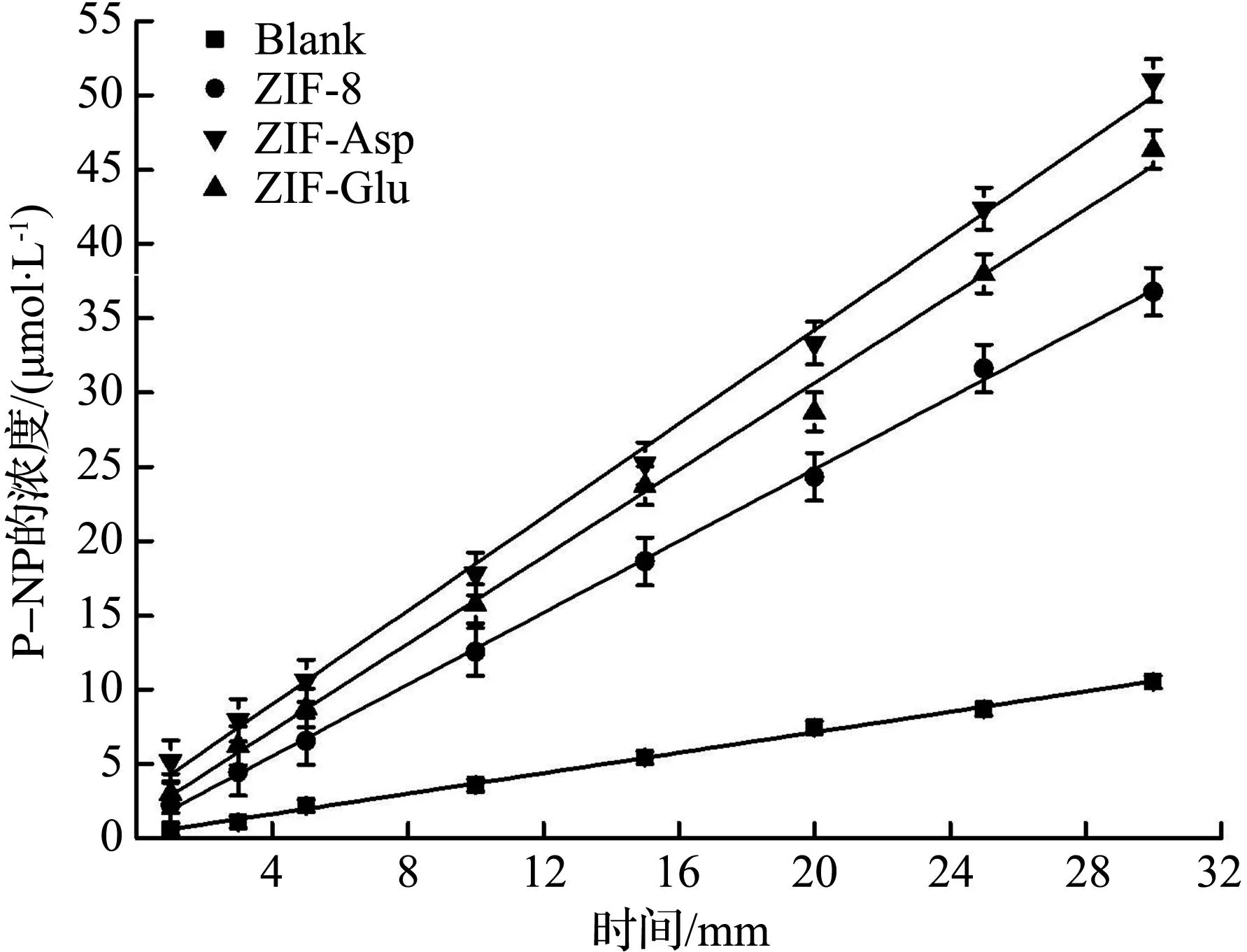
碳酸酐酶仿生酶催化活性测定结果如图7所示。
(a) 催化动力学曲线
采用酯酶法对ZIF-8、ZIF-Asp和ZIF-Glu的酶活性能进行测定,结果如图7(a)所示。基于式(1)计算不同纳米酶催化p-NPA水解为p-NP过程中,体系中p-NP的浓度随时间的变化,通过拟合取反应30 min内催化动力学曲线得到不同纳米酶的催化初速率,结果如图7(b)所示。从图7(b)中可见,ZIF-Asp、ZIF-Glu在30 min内的催化速率分别达到1.69、1.55 μmol/min,是ZIF-8催化活性的1.38、1.27倍,而没有加入纳米酶时p-NP的产率极低。随后,进一步考察ZIF-Asp的循环稳定性,将ZIF-Asp反应2 h后再收集循环测试3次,结果如图7(c)所示。从图7(c)可见,ZIF-Asp经过3次循环催化后,p-NPA的水解转化率仅下降了2.7%,并且将3次循环后的ZIF-Asp进行XRD分析,并与反应前ZIF-Asp的XRD图谱进行比较[图7(d)],发现2条谱线之间没有明显区别,说明ZIF-Asp不仅具有较高的催化活性,还具有稳定的循环催化性能。 本文将ZIF-Asp、ZIF-Glu的催化活性与目前已报道的碳酸酐酶仿生酶催化活性数据相比较(表2),发现本文中合成的ZIF-Asp、ZIF-Glu具有较高的碳酸酐酶催化活性,说明基于碳酸酐酶活性中心常见氨基酸构建纳米酶,能有效提高碳酸酐酶纳米酶的酶活性。

表2 不同文献报道碳酸酐酶仿生酶催化活性对比Tab.2 Comparison of biomimetic enzyme catalytic activity of carbonic anhydrase reported in different literature
2.2.2 碳酸酐酶仿生酶连续矿化性能测定
碳酸酐酶仿生酶连续矿化性能测定如图9所示。
将碳酸酐酶纳米酶应用到CO2连续化转化具有实际工业意义,基于此设计连续固定床CO2转化装置,将ZIF-Asp、ZIF-8分别与石英砂混合装填成柱,与CO2充分反应1 h后收集获得的水合矿化产物并称重,结果如图8(a)所示。从图8(a)可见,ZIF-Asp催化CO2的水合矿化产物质量达到1 171 mg,分别是ZIF-8和没有纳米酶催化剂的1.41、4.63倍,该结果与图7(b)的纳米酶的催化性能结果基本一致,并且ZIF-Asp对CO2的转化率达到72.3%,分别是原始ZIF-8和没有纳米酶催化剂的1.41、4.63倍,说明所合成碳酸酐酶纳米酶具有较好的CO2利用效率。为了确定CO2的矿化产物的类型,对其进行XRD检测结果如图8(b)所示。从图8中可以看出,产物具有方解石碳酸钙晶体的特征衍射峰:23(012)、29(104)、36(110)、39(113)、43(202)、47.5(018)、48.5(116),与标准的方解石结构碳酸钙XRD谱图相符合[17],对其进行SEM表征[图8(c)、(d)],也可以看出,产物为立方体结构,粒径约为5 μm,因此判断该产物为方解石结构的碳酸钙[18]。微米尺度的碳酸钙在在食品、橡胶、造纸、医药等等行业具有广泛应用[19-20],特别是人工合成的碳酸钙可进行各种功能改性,能显著提升其产品附加值,因此利用碳酸酐酶纳米酶将CO2矿化生成碳酸钙具有广阔的应用前景。

(a) 矿化固定CO2的产物产量对比
3 结论
本文中基于用氨基酸仿生策略将碳酸酐酶活性中心中常见氨基酸Asp、Glu植入到ZIF-8骨架中,成功合成仿生碳酸酐酶材料ZIF-Asp、ZIF-Glu,并设计CO2矿化装置实现了CO2的连续化制备。通过实验室研究发现,ZIF-Asp、ZIF-Glu具有较高的碳酸酐酶活性,且循环稳定性较好,其酶活是ZIF-8的1.38、1.27倍,与目前已报道最好碳酸酐酶纳米酶活性接近。随后对ZIF-Asp、ZIF-8进行连续矿化实验也证明,ZIF-Asp能有效矿化CO2,反应1 h能生成1 171 mg的微米尺度碳酸钙并实现72.3%的CO2转化率。本文中制备了仿生碳酸酐酶纳米酶,并且设计的小试装置为其工业化应用提供了理论数据,对CO2转化为高附加值工业化学品的设计和合成提供借鉴。

