中药复方馥感啉口服液对不同年龄段SD大鼠发育毒性
郭健敏*,张文强*,邓应华,蒙飞彪,梁纯,杨威
(1.广州湾区生物医药研究院,广东莱恩医药研究院有限公司,广东省药物非临床评价研究企业重点实验室,国家中药现代化工程技术研究中心中药非临床评价分中心,广东省创新药物评价与研究工程技术研究中心,广东 广州 510990;2.香港科技大学生命科学部,香港 999077)
馥感啉口服液(Fuganlin oral liquid,FGLOL)是一种已获批上市使用的中药复方制剂,来源于民间经验方,主要用于治疗儿童气虚感冒所引起的发热、咳嗽、气喘和咽喉肿痛,在临床上已使用超过半个世纪[1]。人用药品注册技术要求国际协调会(ICH)指导原则S11 指出,对于已上市中药制剂拟增加儿科用药人群范围和(或)新适应证时,若无系统的儿童用药临床和非临床安全性评价资料,应补充进行幼龄动物试验(juvenile animal study,JAS)[2]。JAS 评价指标除一般状况、体重、摄食量、血液学及组织病理检查外,还根据不同年龄阶段的幼龄动物发育特征选择具体的生长发育指标,如体格、骨骼、神经和性发育检查等[3-4]。针对不同年龄段儿童用药人群,本研究采用三段式JAS,评估FGLOL对不同年龄阶段幼年SD大鼠的发育毒性。
1 材料与方法
1.1 动物
选用由孕15 日龄健康SD 大鼠自然分娩的仔大鼠128 只,雌雄各半,体重7~12 g,孕大鼠购自湖南斯莱克景达实验动物有限公司,生产许可证号:SCXK(湘)2019-0004。大鼠饲养于广东莱恩医药研究院SPF 级动物房,自由摄食、饮水,动物房环境温度控制在20~26 ℃,相对湿度为40%~70%,每小时最小换气次数15 次,12 h 光照/黑暗交替。本研究实施经广东莱恩医药研究院动物福利与伦理委员会审核批准,编号:IA-SE2019032-01,02和03。
1.2 药物、试剂和主要仪器
FGLOL(规格:每支30 mL,浓度:1079 mg·L-1,批准文号:国药准字Z20025275;批号:SY1011-9001),广州一品红制药有限公司;(R,S)-告依春、甘草苷、甘草酸铵和蒙花苷对照品(批号分别为:11753-202007,111610-201908,110731-201720和111528-201911),中国食品药品检定研究院。Agilent1260 型高效液相色谱仪和Agilent TC-C18型色谱柱,美国Agilent Technologies 公司;InAlyzer 型双能X 射线动物身体成分分析系统,韩国MEDIKORS公司;7180型全自动生化分析仪,日本日立公司;C3510 型全自动凝血分析仪,中国北京普利生仪器有限公司;ELx808型酶标分析仪,美国BioTek 公司;DM3000 型生物显微镜,德国LEICA公司。
1.3 试验设计和分组
根据FGLOL 临床拟用的儿科人群,设计三段式JAS。第一阶段给药期为出生后4 日龄(postnatal day 4,PND4)至PND21(相当于人类≤2 岁婴幼儿时期),恢复期PND22~PND42(相当于人类2~12岁儿童时期);第二阶段给药期PND15~PND45(包括人类婴幼儿和儿童时期),恢复期PND46~PND61(相当于人类12~14 岁青少年时期);第三阶段给药期PND40~PND105,恢复期PND106~PND134,此阶段大鼠已进入青少年时期,各大系统发育基本完全,故选择与常规重复给药毒性试验相结合的设计。
上述三段式JAS 中,均选用PND2仔大鼠进行试验,选择每窝活仔数>10只的整窝仔大鼠,将每窝仔鼠调整为雌雄各4 只,采用交叉抚育法[5]进行分组,每阶段试验均分为4 组,即溶剂对照组和FGLOL 3个剂量组,每组4窝,每窝8只,雌雄各半,共16 窝128 只,ig 给药。第一阶段:FGLOL 3.88,11.64 和38.75 g·kg-1(约相当于临床1 岁内小儿日用量的1.1,3.3 和19.7 倍),给药容积为5 mL·kg-1,每天1 次,给药18 d,停药观察3 周;第二阶段:FGLOL 3.88,11.64 和38.75 g·kg-1(约相当于临床<6岁小儿日用量的1.7,5.0和16.8倍),给药容积为10 mL·kg-1,每天1 次,给药31 d,停药观察3 周;第三阶段:FGLOL 29.06,58.13 和116.25 g·kg-1(约相当于临床7~12 岁儿童日用量的6.5,12.9 和25.7 倍),给药容积为15 mL·kg-1,每天1 次,给药66 d,停药观察4 周。溶剂对照组均给予等体积纯水。
1.4 检测指标
三段式JAS 期间,每天观察1 次大鼠的一般状况,每3 d称量1次仔大鼠体重;仔大鼠离乳后,每周测定1次摄食量;第一和第二阶段试验期间,对各组大鼠的生长发育(耳廓分离、下门齿萌出、睁眼、张耳、腹毛生长、睾丸下降和阴道开口等)和神经反射发育(翻正反射、痛觉反射、视觉定位反射、听觉惊愕反射、嗅觉反射、触须定位反射、断崖回避反射和瞳孔对光反射)指标进行达标率测定;第三阶段试验期间,通过旷场和八臂迷宫2 项试验测定各组大鼠的学习记忆功能,旷场试验主要测定大鼠的自主活动方式和探索行为(总运动距离及中心、角落和边缘运动距离),八臂迷宫试验主要测定大鼠的运动、学习和记忆能力(总运动距离、潜伏期、工作记忆错误和参考记忆错误)。各阶段试验自PND7起,每周检查1 次大鼠体格(体长);于给药期结束和恢复期结束时分别对各组16/32 和16/16 大鼠的全身和股骨骨密度(bone mineral density,BMD)进行检查;给药期结束和恢复期结束采血并解剖各组16/32和16/16 只大鼠,用于白细胞(white blood cells,WBC)数、红细胞(red blood cells,RBC)数、血小板(platelet count,PLT)数等血液学和凝血以及谷氨酸脱氢酶(glutamate dehydrogenase,GLDH)、尿素氮(urea nitrogen,BUN)和甘油三酯(triglycerides,TG)等血液生化指标的检测和组织病理检查。
1.5 统计学分析
2 结果
2.1 一般状况
观察结果表明,在第一、第二和第三阶段的给药期和恢复期,各组仔大鼠吸乳、摄食、排泄和毛色等均未见明显异常。
2.2 摄食量和体重
第一阶段恢复期,FGLOL 3.88,11.64 和38.75 g·kg-1组大鼠摄食量均有增加现象,考虑停药后大鼠为保持饱腹感会摄入更多饲料,判断为正常的生理现象。其余各阶段给药及恢复期各给药组大鼠摄食量均未见有指导意义的变化。
第一阶段给药前期,FGLOL 38.75 g·kg-1组雄性大鼠体重明显低于溶剂对照组(P<0.05),但组间差异<10%,且未见剂量-毒性关系,认为非药物因素导致;第二和三第阶段给药期及恢复期,与溶剂对照组相比,FGLOL各剂量组体重增加均未见明显差异(图1)。

Fig.1 Effect of Fuganline oral liquid(FGLOL)on body mass of juvenile rats.A:stage 1,the juvenile SD rats were ig given pure water(vehicle control)and FGLOL(3.88,11.64 and 38.75 g·kg-1),once a day,for 18 d.Rats were observated for 21 d after administration(A).±s,n=16 in administration period [postnatal day 4(PND4)-PND21],n=8 in drug stop period(PND22-PND42).B:stage 2,the juvenile SD rats were ig given pure water and FGLOL(3.88,11.64 and 38.75 g·kg-1),once a day,for 31 d.The remaining rats in each group were observed for 16 d after administration.±s,n=16 in period PND4-PND45,n=8 in period PND46-PND61.C:stage 3,the juvenile SD rats were ig given pure water and FGLOL(29.06,58.13 and 116.25 g·kg-1),once a day,for 66 d.The remaining rats in each group were observed for 28 d after administration.±s,n=16 in period PND40-PND105,n=8 in period PND106-PND134.1:male;2:female.*P<0.05,**P<0.01,compared with vehicle control group.
2.3 生长发育和神经反射发育
实验结果(图2)显示,第一和第二阶段试验期间,与溶剂对照组相比、FGLOL 3.88,11.64 和38.75 g·kg-1组仔大鼠生长发育和神经反射发育各项检查指标无统计学差异,达标率均为100%。
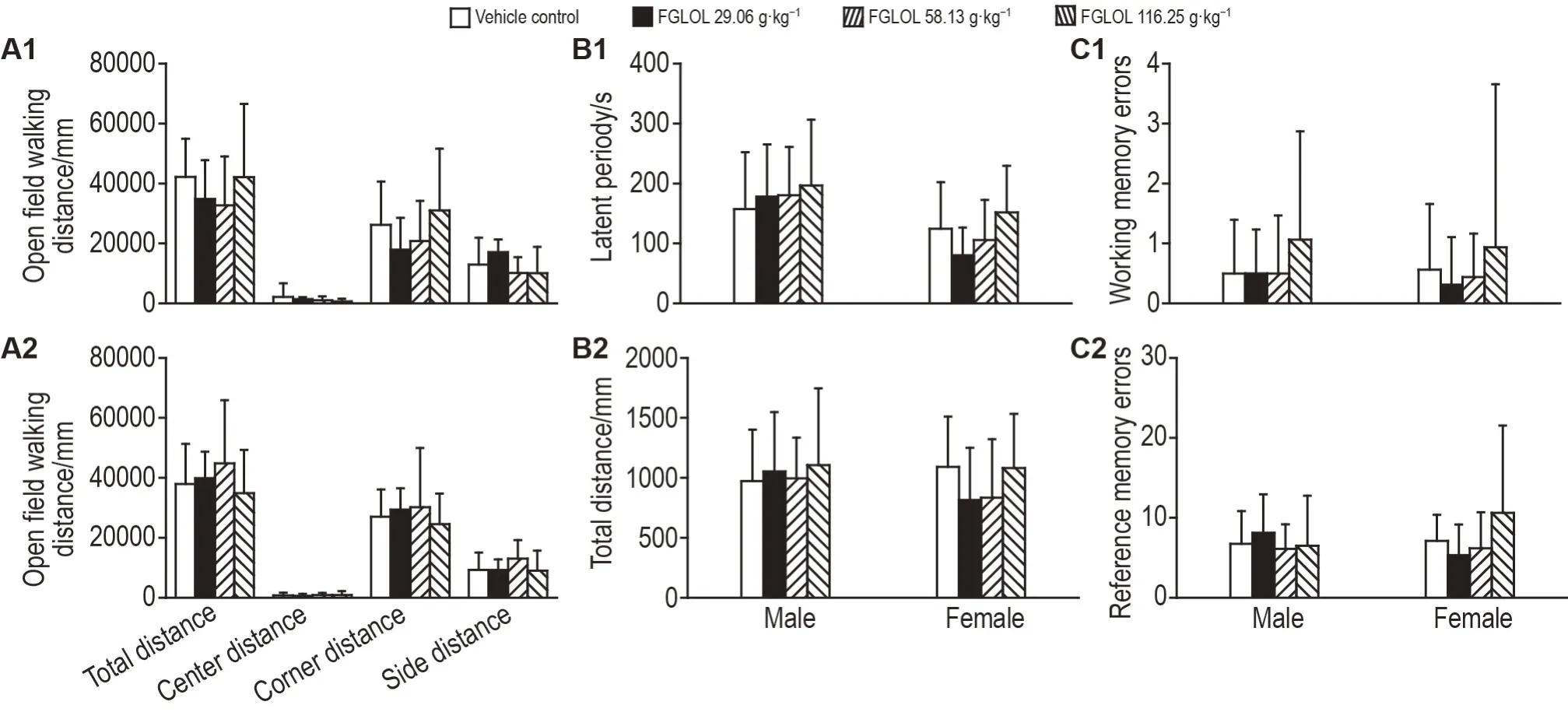
Fig.2 Effect of FGLOL on neural reflex development of juvenile rats.See Fig.1C for the rat treatment.A1:open field walking distance of male rats;A2:open field walking distance of female rats;B1:latent period;B2:total distance;C1:working memory errors;C2:reference memory errors.±s,n=16.
第三阶段试验期间,与溶剂对照组相比,FGLOL 29.06,58.13 和116.25 g·kg-1组仔大鼠开阔场中总运动距离及中心、角落和边缘运动距离均无统计学差异;八臂迷宫试验中,FGLOL 各剂量组仔大鼠潜伏期、总运动距离、工作记忆错误和参考记忆错误次数均无统计学差异。表明各组仔大鼠在活动正常情况下,未见活动减少或焦虑行为,学习记忆能力亦呈现一致性。
2.4 体格
体格检查结果表明,第一阶段给药期间,与溶剂对照组相比,FGLOL 38.75 g·kg-1组仔大鼠体长均明显降低(P<0.05),停药后逐渐恢复正常,提示在哺乳期ig 给予FGLOL 38.75 g·kg-1可能会影响仔大鼠的正常进食进而导致体重降低和体格发育减缓。第二和第三阶段,与溶剂对照组相比,FGLOL 3.88 g·kg-1组(第二阶段)及58.13 和116.25 g·kg-1组(第三阶段)大鼠个别时间点体长明显降低(P<0.05),但未见持续性降低,判断此现象无生理学意义(图3)。

Fig.3 Effect of FGLOL on body length of juvenile rats.See Fig.1 for the rat treatment.A:stage 1,±s,n=16(PND7-PND21),8(PND22-PND42);B:stage 2,±s,n=16 in period PND7-PND42,n=8 in period PND45-PND65;C:stage 3,±s,n=16 in period PND7-PND105,n=8 in period PND106-PND134;1:male;2.female.*P<0.05,compared with vehicle control group.
2.5 骨骼
骨骼检查结果表明,与溶剂对照组相比,3 个阶段FGLOL各组大鼠的全身和股骨BMD均未见明显差异(图4),表明FGLOL对骨骼发育无明显影响。

Fig.4 Effect of FGLOL on bone mineral density of juvenile rats.A:stage 1;B:stage 2;C:stage3;1:male;2.female.See Fig.1 for the rat treatment.±s,n=8.
2.6 血液学和凝血
血液学和凝血检测结果(图5)表明,在第一和第三阶段给药末期,与溶剂对照组比,FGLOL11.64和38.75 g·kg-1组(第一阶段)及FGLOL 116.25 g·kg-1组(第三阶段)大鼠WBC有明显降低或升高变化,此变化无规律性且在恢复期得以恢复,判断为无毒理学意义;第一和第二阶段给药末期,与溶剂对照组比,FGLOL 3.88 和11.64 g·kg-1组大鼠RBC 显著升高(P<0.05);上述指标变化均<10%,且在恢复期与正常仔大鼠亦未见明显差异,考虑到第一和二阶段给药期仔大鼠处于快速发育阶段,RBC发育和分布均有一定差异,判断上述变化无生理学意义。在第一阶段给药末期,与溶剂对照组比,FGLOL 3.88和38.75 g·kg-1组仔大鼠PLT 显著降低(P<0.05),但变化较小且在正常范围内,认为此变化无毒理学意义。

Fig.5 Effect of FGLOL on hematology and coagulation of juvenile rats.See Fig.1 for the rat treatment.A:stage 1;B:stage 2;C:stage 3;1:white blood cells(WBC);2:red blood cells(RBC);3:platelet count(PLT).±s,n=8.*P<0.05,compared with vehile control group of the same time and gender.
2.7 血液生化
血液生化检测结果表明,在第二阶段给药末期,与溶剂对照组比,FGLOL 38.75 g·kg-1组仔大鼠GLDH 显著降低(P<0.05),在第一和第三阶段给药末期和恢复期、第二阶段恢复期并未发现此现象,判断为无毒理学意义;第二和第三阶段给药末期,与溶剂对照组比,FGLOL 3.88 g·kg-1(第二阶段)和FGLOL 116.25 g·kg-1组(第三阶段)大鼠BUN均明显增加(P<0.05),但组间差异在正常范围内,恢复期未见此变化,判断为无毒理学意义;第二和第三阶段给药末期和恢复期,与溶剂对照组比,FGLOL 3.88和38.75 g·kg-1(第二阶段)和FGLOL 58.13 g·kg-1组(第三阶段)大鼠TG 明显降低或升高(P<0.05),但数值呈无规律变化,且在正常范围内波动,认为此变化无生理学意义(图6)。

Fig.6 Effect of FGLOL on blood biochemistry of juvenile rats.See Fig.1 for the rat treatment.A:stage 1;B:stage 2;C:stage 3;1:glutamate dehydrogenase(GLDH);2:urea nitrogen(BUN);3:triglycerides(TG).±s,n=8.*P<0.05,**P<0.01,compared with vehile control group of the same time and gender.
2.8 组织病理变化
3 个阶段组织病理学检查结果表明,溶剂对照组和FGLOL 38.75 和116.25 g·kg-1组大鼠心、肝、脾、肺和肾等多个器官组织,除个别大鼠个别器官组织异常变化,其余未见明显异常变化。3 个阶段溶剂对照组和高剂量组部分器官组织病理照片见图7。

Fig.7 Partial pathological photos of juvenile rats by HE staining.See Fig.1 for the rat treatment.
3 讨论
近年来的临床扩展应用发现,FGLOL应用于咳嗽变异性哮喘效果良好[6-7]。前期药效学研究亦证实,其对屋尘螨及卵清蛋白诱发的幼龄动物哮喘模型具有显著改善作用[8-10]。因此,拟新增FGLOL 用于治疗儿童哮喘适应证的对症治疗。虽FGLOL 临床用药周期较短,但其覆盖的临床应用儿科人群年龄段较广,1 岁以内~12 岁均可应用。因此,在JAS中,如果按照全年龄段连续给药,给药周期远超过治疗周期,可能会产生与临床应用相关性较小的毒性反应,对药物临床应用带来阻碍[11-12]。本研究采用同一批孕大鼠分娩的仔大鼠,保持动物背景一致;并在不同起始年龄段,根据临床拟用药周期和用药儿童年龄的不同,分别给予短期、中期、中长期用药,根据发育年龄交叉覆盖的原则[13-14],设计了三段式JAS,旨在客观评价FGLOL对幼龄大鼠的发育毒性。
三段式JAS 研究结果表明,使用同一批妊娠日期相同的孕大鼠分娩的仔大鼠进行试验,可以较好控制仔大鼠的生长背景,各项生长发育指标结果较为一致,更容易发现药物的毒性反应。妊娠日期相同的孕大鼠,分娩日期基本可控制在前后3 d,可满足使用相同年龄的仔大鼠进行3~4 个试验,统筹进行减少了孕大鼠的使用数量,更符合动物福利减少和优化的设计要求[15]。在第三阶段的研究中,由于起始给药年龄与常规重复给药毒性试验年龄一致,因此本研究将2 个试验糅合到一起,同时观察JAS指标和重复给药毒性指标,给药剂量也较第一阶段和第二阶段有所增加。结果显示,FGLOL安全性良好,未出现与药物相关的明显毒性。
此外,本研究结果表明,第一阶段给药期间,FGLOL 38.75 g·kg-1明显降低大鼠的体重增长和体格发育,而FGLOL 3.88和11.64 g·kg-1无显著影响,推测此现象与药物浓度相关,对幼龄大鼠给予浓稠药物会影响其觅乳,进而影响身体发育必需营养物质的摄入。
本研究结果发现,个别FGLOL 剂量组幼龄大鼠的体重、体格、血液学、凝血或血液生化指标有明显变化,但变化呈现无规律性或幅度较小,且多在给药期发生,恢复期得以恢复,判断此类变化无毒理学意义;而其他一般状况、生长发育、神经反射发育、骨骼发育和组织病理检查指标均未见明显改变;未见不良反应剂量(no observed adverse effect level,NOAEL)为各阶段的高剂量。
综上所述,FGLOL在PND4(约相当于人类婴儿时期)起开始ig 给药,连续给药18 d,对幼龄SD 大鼠NOAEL 为38.75 g·kg-1,相当于临床1 岁内小儿日用量的19.7倍。FGLOL在PND15(约相当于人类婴幼儿时期)起开始ig 给药,连续给药31 d,NOAEL为38.75 g·kg-1,相当于临床<6 岁小儿日用量的16.8倍。FGLOL在PND40(约相当于人类青少年时期)起开始ig 给药,连续给药66 d,NOAEL 为116.25 g·kg-1,相当于临床7~12 岁儿童日用量的25.7倍。

