不同矿化水对纳米纤维素-铁螯合物的影响及其在矫治梨缺铁黄化中的应用
边艺伟, 郭献平, 王东升*, 姚春玲 , 毋青男, 赵 凡, 吴中营, 何 睿, 王合中
(1. 鄢陵县甘罗养生养老有限公司, 河南许昌 461200; 2. 河南省农业科学院园艺研究所, 郑州 450002; 3. 河南农业大学植物保护学院, 郑州 450002)
植物生长在石灰性(高浓度碳酸钙)或碱性土壤(pH 7~9)中,土壤中铁以植物难以利用的形式存在,易出现缺铁黄化现象[1]。铁是植物生长所必需的微量营养元素,缺铁会严重影响植物的光合作用[2]。梨树属于对铁营养素敏感的植物,我国陕西、湖北、河南以及沿海地区的大部分梨园均存在不同程度的缺铁黄化现象[3], 导致梨树果实产量下降[4]。
纳米科技与农业科技的相互渗透,为农业科学研究提供了新的理论、方法和技术手段。纳米材料通常是指那些在三维空间中至少一维的尺寸在1~100 nm范围内的材料[5]。纤维素是植物或细菌生物合成的产物,纳米纤维素(nanocellulose, NC)是指具有纳米尺度结构的纤维素提取物或加工材料[6]。纳米纤维素因其可再生性、良好的生物相容性、可修饰的表面化学等独特性质,因而在材料科学和生物医学工程领域得到了广泛应用[7]。据报道[8], 纳米纤维素具有优异的化学吸附性能,其表面的功能性基团可通过与重金属离子以共价键的方式进行螯合,可用于污水中重金属离子的去除。Anayet等[9]研究发现,在纳米纤维素表面引入聚电解质可提高其金属离子螯合能力,在酸性和碱性条件下均可高效地螯合Fe (Ⅱ)。有机螯合铁化合物,如Fe-EDDHA (乙二胺二邻羟苯基乙酸铁)是矫治植物缺铁黄化常用的土施铁肥[10]; 用[Fe(mpp)3](3-羟基-4-吡啶酮)螯合铁喷施黄化叶片,可提高叶绿素含量和根生物量[11], 但这些传统有机物对土壤和水源的危害性极大[12]。近年来, (S S)-乙二胺-N,N-二琥珀酸三钠铁[13]、腐殖质纳米铁肥[14]、N,N-二羟基-N,N’-二异丙基己二胺和偶氮螯合素[15]等可生物降解的新型铁螯合剂引起了人们广泛关注。纳米螯合铁肥因其独特的性能可提高铁营养素向植物的输送效率,使水稻等作物增产[16], 是一类环境友好型铁肥。
作者[17]前期研究表明,纳米纤维素与铁在电荷密度比1∶(300~30 000)的范围内可有机螯合。在透射电镜下,可观察到纳米纤维素-铁仍然保持晶须状的形态,且粒子的尺寸较纳米纤维素的尺寸稍大,同时还观察到纳米纤维素粒子的表面有一些点状物(Fe)。在等同于硫酸亚铁喷施浓度为0.002~0.01 mg·L-1的剂量时,用去离子水按纳米纤维素、铁的电荷比为1∶300、1∶3 000、1∶30 000来配制纳米纤维素-铁螯合物(NC-Fe)并进行生物试验,能显著提高缺铁黄化杜梨叶片的叶绿素含量和有效铁含量, 3种电荷比配制的NC-Fe处理后叶片SPAD值高于化学螯合铁Fe-EDTA, 也高于单独喷施FeSO4, 且以1∶3 000效果最佳; 显著提高净光合速率,且上调铁蛋白基因的表达,下调果胶甲酯酶基因的表达[18]。通过转录组分析, NC-Fe可调动更多的基因和代谢通路,使叶片的复绿效果强于FeSO4处理[19]。但在生产上一般采用地下水或自来水作为水源配制铁肥。根据地下水环境质量标准(GB 14848-93), 地下水矿化度(溶解性总固体)分为5类,即≤300 mg·L-1为Ⅰ类, 300~500 mg·L-1为Ⅱ类, 500~1 000 mg·L-1为Ⅲ类, 1 000~2 000 mg·L-1为Ⅳ类, >2 000 mg·L-1为Ⅴ类[20]。梨树缺铁黄化主要发生在石灰性土壤地区,该地区生产用水矿化度较高,因此选用750、1 500、3 000 mg·L-1离子浓度的溶液,模拟生产用水矿化度,探究其对NC-Fe以电荷比1∶3 000螯合物的响应,以及对黄化梨树的复绿效果,为生产应用提供理论支持。
1 材料与方法
1.1 供试材料
溶解级软木硫化纸(Temalfa 95A, 美国Rayonier Advanced Materials公司); 95%~98%浓硫酸(洛阳昊华化学试剂公司); 超纯水(去离子水)用纯水仪(Direct-Q 5 UV, 美国密理博公司)自制; 高精度即用型透析袋(JMD45-1214-0.5, 北京索莱宝科技公司); 其他化学试剂碳酸钙、碳酸氢钠、七水硫酸亚铁(纯度>98%)、氯化钠、氯化钾、盐酸(36%~38%)和氢氧化钠等均为分析纯(上海生工生物工程公司); TIANGEN植物总RNA提取试剂盒、反转录试剂盒(FSQ-101)[东洋纺反转录试剂盒(上海)]; 杜梨种子、进口丹麦泥炭基质土[品氏托普园艺(上海)公司], 吐温-80 (TW-80,试剂级,上海生工生物工程公司)。
1.2 试验设计
配制750、1 500、3 000 m·L-1离子浓度的矿化水溶液, pH值分别为6.54、6.44、6.40; 对预黄化杜梨苗(叶片SPAD值在20~30之间)进行5个处理, 每处理3个重复(表1)。FeSO4喷施浓度为2 mmol·L-1, 表面活性剂采用0.15%吐温-80 (0.15% TW)。每处理喷施1次, 处理72 h后采样。
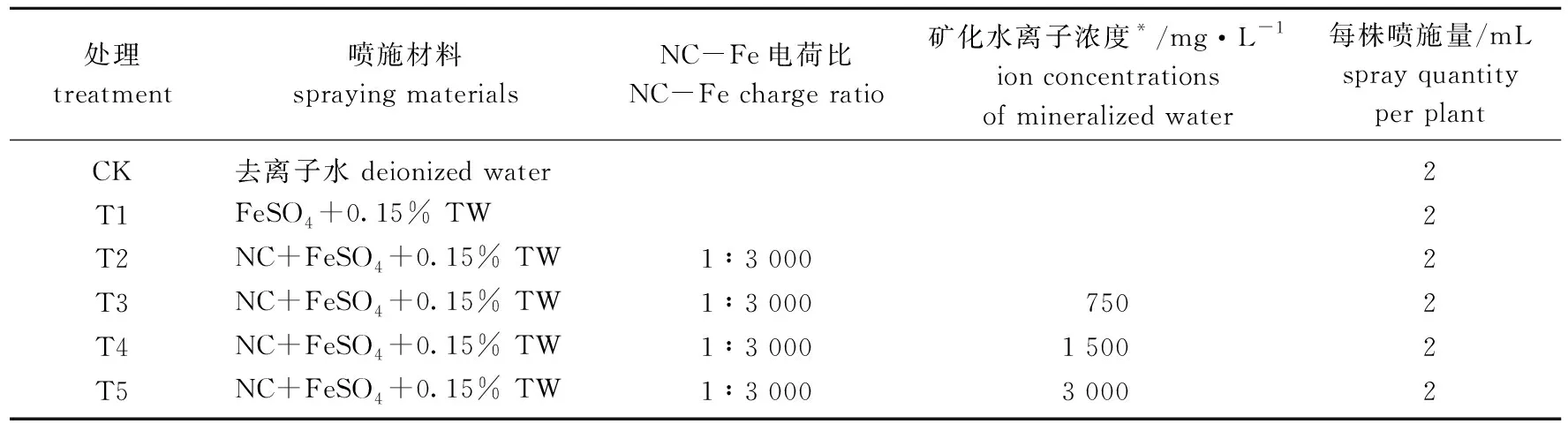
表1 不同处理喷施的溶剂Tab.1 Treatments with different formulations
1.3 测定项目与方法
1.3.1 纳米纤维素制备
采用硫酸水解法制备纳米纤维素悬浮液[18]。将20 g软木硫化纸与45 ℃、64%浓硫酸(200 mL)混合, 45 ℃反应45 min, 以制备纳米纤维素悬浮液。
1.3.2 纳米纤维素表征
1) 纳米纤维素浓度及电荷密度: 采用干燥失重法测定纳米纤维素浓度,电导率滴定法检测电荷密度[21]。向25 mL纳米纤维素中滴加5 μL的5 mol·L-1NaCl以调整滴定体系的离子浓度,逐滴加入0.02 mol·L-1NaOH 40 μL, 并记录电导率,计算纳米纤维素的电荷密度。电荷密度/mmol·g-1=出现拐点时滴加的NaOH体积×NaOH浓度/(纳米纤维素浓度×纳米纤维素初始体积)。
2) 纳米纤维素粒径、Zeta电位检测: 根据动态光散射(dynamic light scattering, DLS)原理,将纳米纤维素悬浮液稀释20倍,用马尔文粒度仪(Zetasizer ZS90, 英国马尔文公司)进行粒径、电位的测量。
1.3.3 NC-Fe理化性质检测
1) X射线光电子能谱(X-ray photoelectron spectroscopy, XPS)检测: 测试使用Al靶,单色化AlKa 源,能量为1 486.6 eV。
2) 傅里叶红外光谱(Fourier transform infrared spectroscopy, FTIR)检测: 采用KBr压片法进行制样,仪器以4 cm-1的分辨率运行,样品的扫描速度为45次·s-1, 分析波数为4 000~400 cm-1的吸收峰。
3) X射线衍射(X-ray diffraction, XRD)检测: 选用波长为1.540 60 Å的铜靶,测试范围为10°~80°, 以2°·min-1的速度进行扫描,并计算相对结晶度ε。ε=Ic/(Ic+Ia)×100%, 式中Ic为结晶峰的积分强度,Ia为非晶峰的积分强度。
1.3.4 黄化梨苗培养
杜梨种子经层积后播种,当其长出5片真叶时转入霍格兰营养液中培养,生长稳定后,转入含铁量为1×10-8mol·L-1的缺铁营养液中,并加入0.15 g·L-1NaHCO3、0.3 g·L-1CaCO3, 以稳定营养液的pH值。培养约30 d后得到杜梨黄化苗[22]。
1.3.5 矿质营养元素含量测定
将叶片105 ℃杀青30 min, 80 ℃烘干至恒重, 取0.1 g烘干叶片,在1 mol·L-1HCl (10 mL)中浸提,连续振荡24 h, 过滤后用电感耦合等离子体发射光谱仪(ICP-OES)测定浸提液中矿质营养元素含量[19]。
1.3.6 铁蛋白基因表达量测定
设计杜梨叶片铁蛋白基因PbFER1引物,以梨Actin基因作为内参:Fer1-F序列为GGGCCATTTCGACGTTTTCC,Fer1-R序列为TTTTCGAGTTTTCGCTGCG;Actin-F序列为CTTCCCGATGGCCAAGTCAT,Actin-R序列为CATGAATGCCAGCAGCTTCC。实时荧光定量PCR反应体系按下述进行: 95 ℃预变性5 min; 95 ℃变性15 s, 60 ℃退火延伸1 min, 共40个循环。数据采用2-ΔΔCt法进行分析。
1.4 统计分析
用Excel软件进行数据的记录与统计,用SPSS 22.0软件进行数据统计分析。
2 结果与分析
2.1 纳米纤维素的相关表征
纳米纤维素浓度为8.51 g·L-1时,粒径为75.63 nm, Zeta电位为-34.93 mV (图1); 通过电导滴定法测定纳米纤维素的电荷密度,根据数据作出典型的V型滴定曲线(图2), 与文献[21]报道的一致,测得的纳米纤维素电荷密度为0.213 5 mmol·g-1。
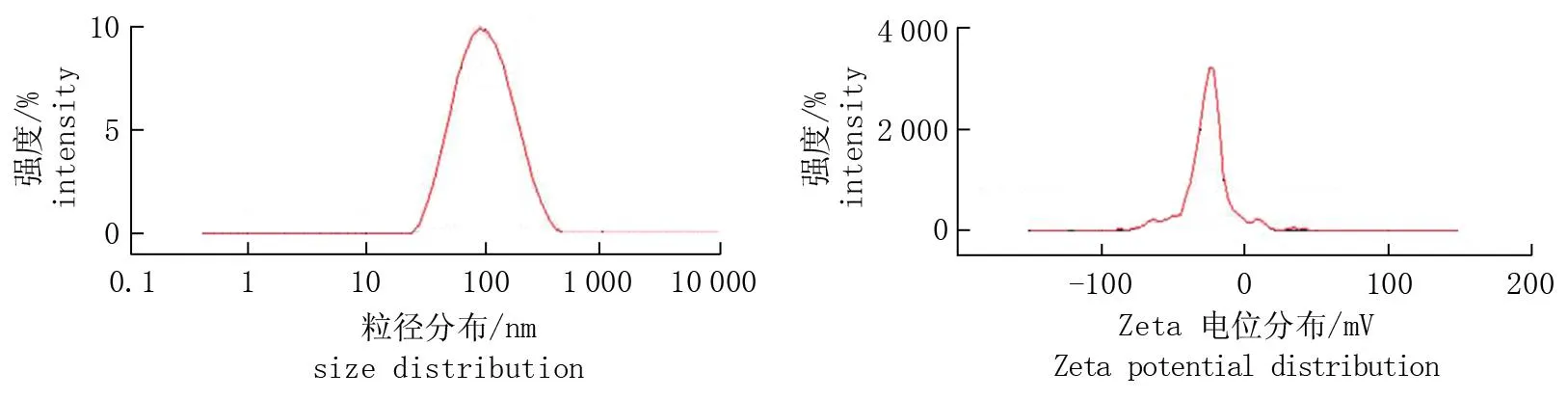
图1 纳米纤维素的粒径及Zeta电位Fig.1 Particle size and Zeta potential of NC
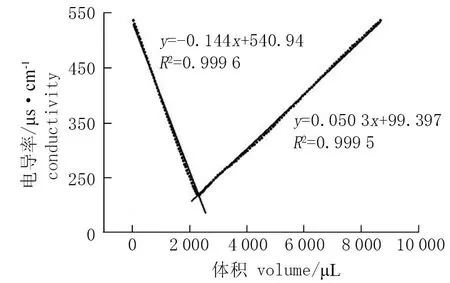
图2 测定纳米纤维素综合电荷密度的电导率滴定曲线示意图Fig.2 Conductometric titration curve for determination of net charge density of NC
2.2 NC-Fe的螯合作用
2.2.1 X射线光电子能谱分析
由图3.A可知,纳米纤维素呈现出3个基本电子能谱O1s、C1s和S1s, 分别在532.0、286.4、165.3 eV处,其中S来源于磺酸基。在FeSO4的电子能谱中, 铁的电子能谱在710 eV处(图3.D)。在以1∶3 000电荷比配制的NC-Fe的XPS能谱中,由于纳米纤维素量少, C1s未能检测到,显示铁的电子能谱峰值接近于FeSO4(图3.C)。 当电荷比为1∶30时,可看到XPS谱图中C1s明显呈现(图3.B)。据前期研究[18]结果和生产实际需要, NC-Fe以1∶3 000的电荷比配制的螯合物,极少量的纳米纤维素仍能提高叶片有效铁含量,促进光合作用,有效地矫治梨叶片的缺铁黄化。
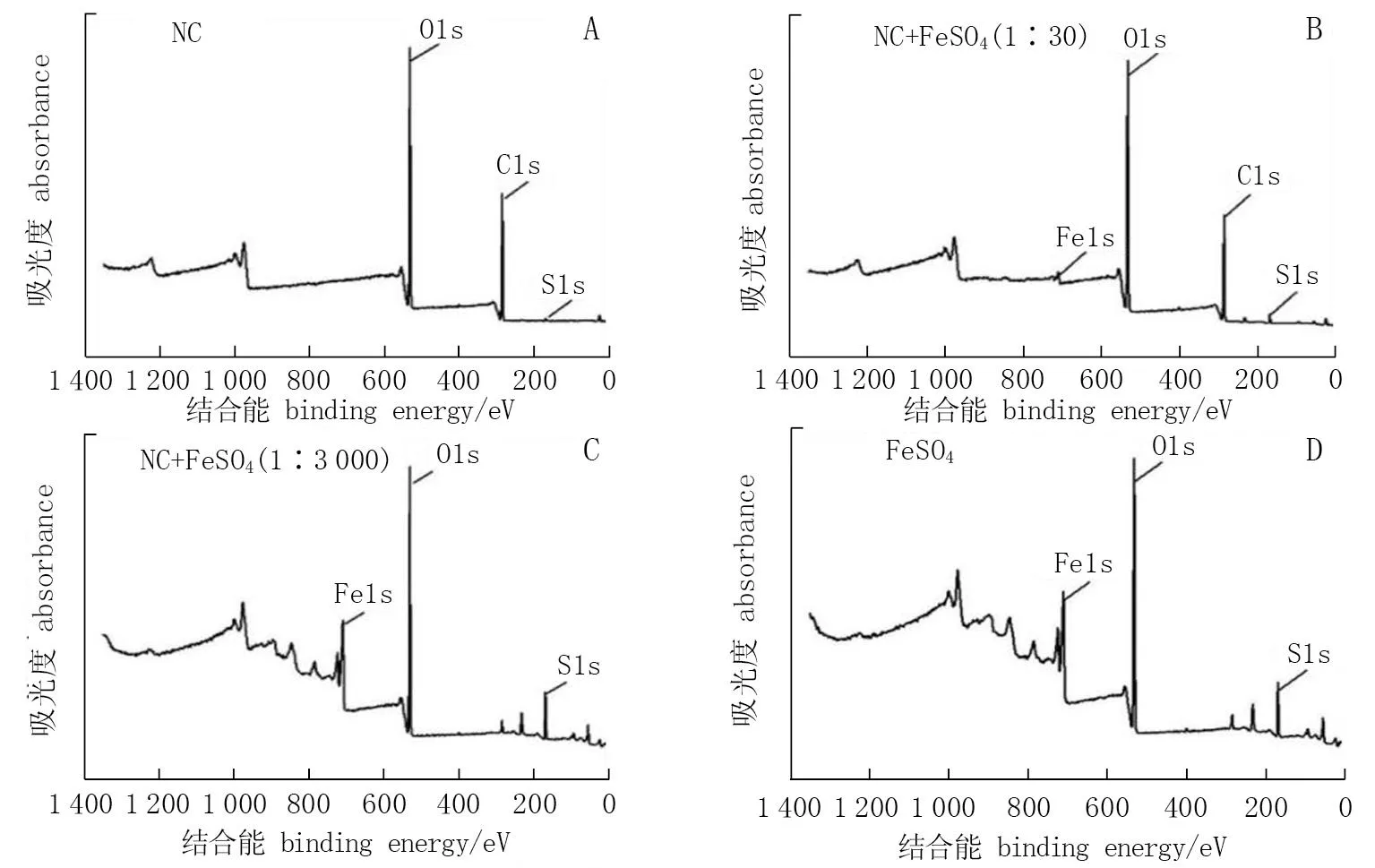
图3 X射线光电子能谱谱图*Fig.3 XPS spectrum* A. 纳米纤维素; B. 纳米纤维素-铁净电荷比1∶30的混合物; C. 纳米纤维素-铁净电荷比1∶3 000的混合物; D. FeSO4。* A. NC; B. the chelates formulated at a ratio of net charge density of NC to Fe 1∶30; C. the chelates formulated at a ratio of net charge density of NC to Fe of 1∶3 000; D. FeSO4.
2.2.2 傅里叶红外光谱分析


图4 纳米纤维素、FeSO4、NC-Fe的红外吸光度扫描图像*Fig.4 Fourier transform infrared spectroscopy (FTIR) patterns of nanocrystal cellulose (NC), NC-Fe and FeSO4* NC-Fe净电荷比为1∶30的混合物。* The che-lates were formulated at a ratio of the net charge density of NC to Fe of 1∶30.图5 纳米纤维素、FeSO4、NC-Fe的XRD图像*Fig.5 XRD patterns of nanocrystal cellulose (NC), NC-Fe and FeSO4* NC-Fe净电荷比为1∶30的混合物。* The chelates were formulated at a ratio of the net charge densi-ty of NC to Fe of 1∶30.
2.2.3 NC-Fe螯合物的晶型变化
纯纳米纤维素具有高结晶度[23]。纳米纤维素的结晶度为63.12%, 分析纯FeSO4粉末的结晶度为97.75%。当纳米纤维素以电荷比1∶30加入FeSO4后, NC-Fe的结晶度为29.60%, 总体的结晶度下降,结晶性变差; 与纳米纤维素相比,加入FeSO4后纳米纤维素在20°处有Fe峰出现,且在16°、17°、23°处的峰强明显变弱(图5)。
2.3 矿化水中金属离子对NC-Fe螯合物的影响
与以去离子水制备的NC-Fe粒径和Zeta电位相比,随水矿化度的增大, NC-Fe粒径呈上升趋势(图6.A), 以浓度为3 000 mg·L-1的矿化水制备的NC-Fe粒径与以浓度为1 500、750 mg·L-1的矿化水制备的NC-Fe粒径有显著差异。水矿化度越高, NC-Fe的Zeta电位越大(图6.B), 且以浓度为3 000 mg·L-1的矿化水制备的NC-Fe电位与1 500、750 mg·L-1的矿化水制备的NC-Fe电位有显著差异。
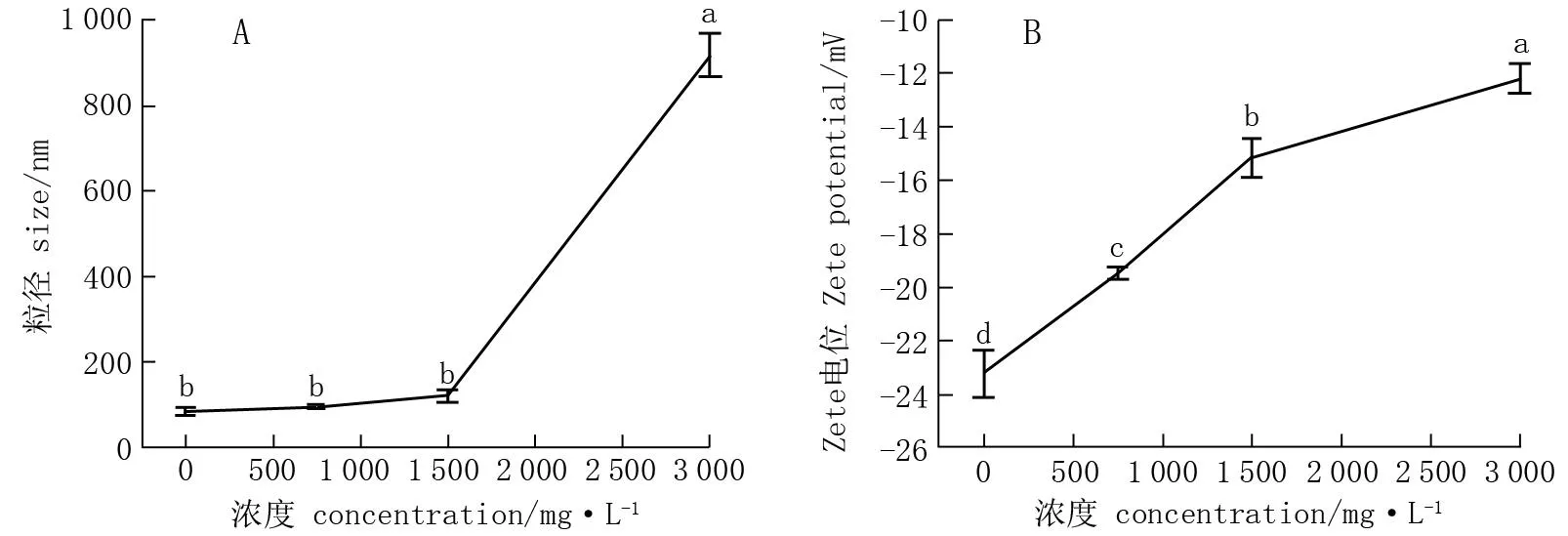
图6 不同浓度矿化水对NC-Fe的粒径(A)和Zeta电位(B)的影响*Fig.6 Effects of different concentrations of mineralized water on particle size (A) and Zeta potential (B) of NC-Fe chelate* 不同小写字母处理间差异显著(P<0.05)。* Different letters indicate significant differences (P<0.05).
2.4 不同喷施处理对叶片营养元素含量的影响
由图7可知,不同喷施处理对叶片营养元素含量有明显的影响。各处理活性铁含量由高到低依次为T2、T3、T4、T5、T1、CK处理,与T2处理相比, T3、T4、T5处理分别下降9.1%、23.6%、40.3%; 与T3处理相比, T4处理显著下降16.0%, T5处理显著下降34.4% (图7.A)。叶片内的全钙含量关系由高到低依次为T2、T3、T4、T1、CK、T5处理 (图7.B), 全镁含量由高到低依次为T2、T3、T1、CK、T4、T5处理 (图7.C), 全钠含量由高到低依次为T5、T4、T3、T1、T2、CK处理 (图7.D), T5处理全钠含量最高, CK全钠含量最低。
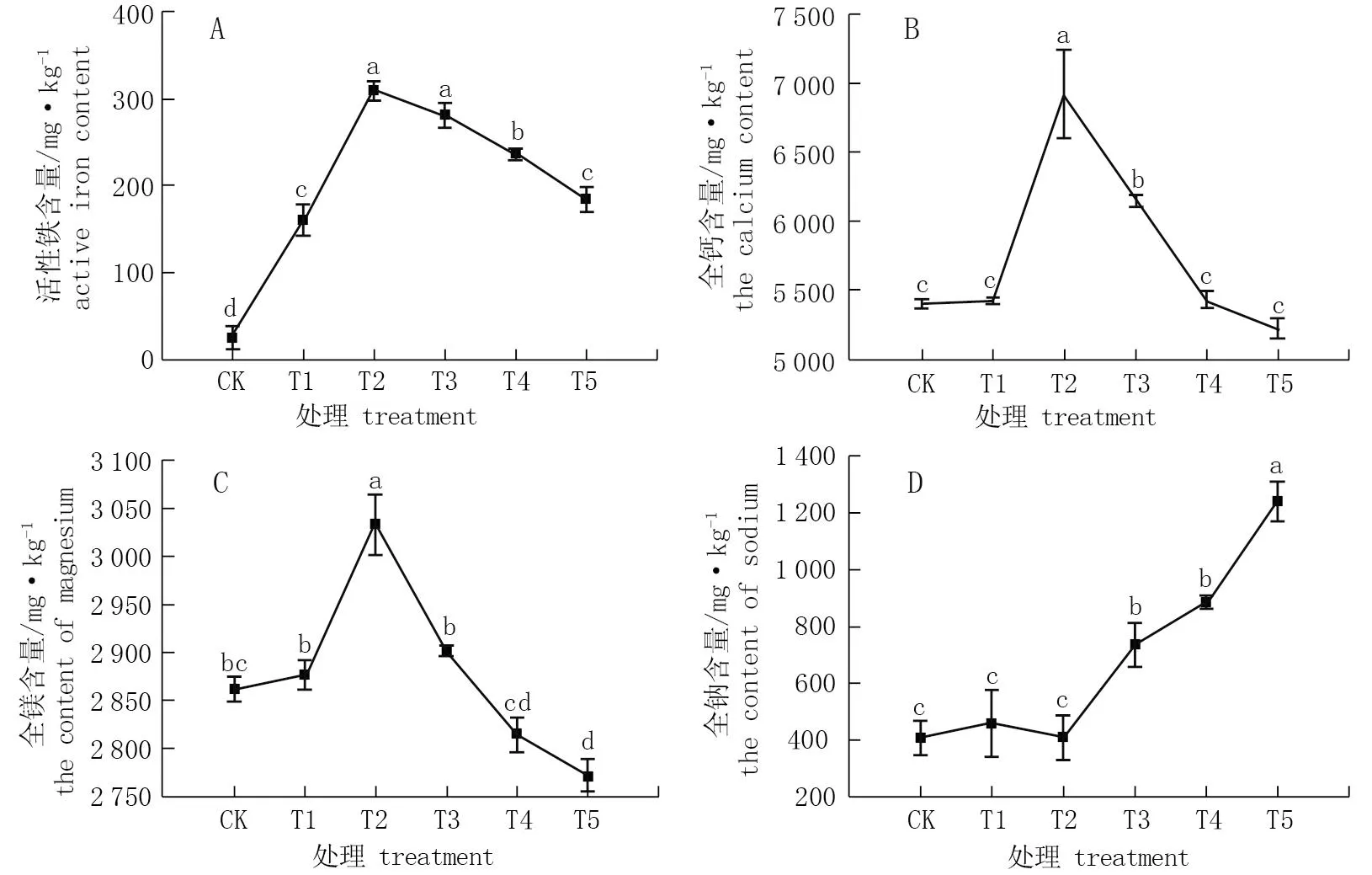
图7 不同处理72 h后叶片中各营养元素含量*Fig.7 Contents of nutrient elements in leaves after 72 h treatments* 不同小写字母处理间差异显著(P<0.05)。* Different letters indicate significant differences (P<0.05).
2.5 叶片铁蛋白相对表达量
由图8可见,杜梨叶片铁蛋白基因Fer1的相对表达量发生了明显变化, T2处理相对表达量显著高于CK、T1、T3、T4、T5处理, T2处理相对表达量是T3处理的1.3倍,是T4处理的1.9倍,是T5处理的3.6倍。此外, T3处理相对表达量显著高于CK、T1、T4、T5处理; T3处理相对表达量是T4处理的1.5倍, 是T5处理的2.7倍,且与T1处理相比, T3处理铁蛋白基因Fer1的相对表达量显著增加1.0倍。
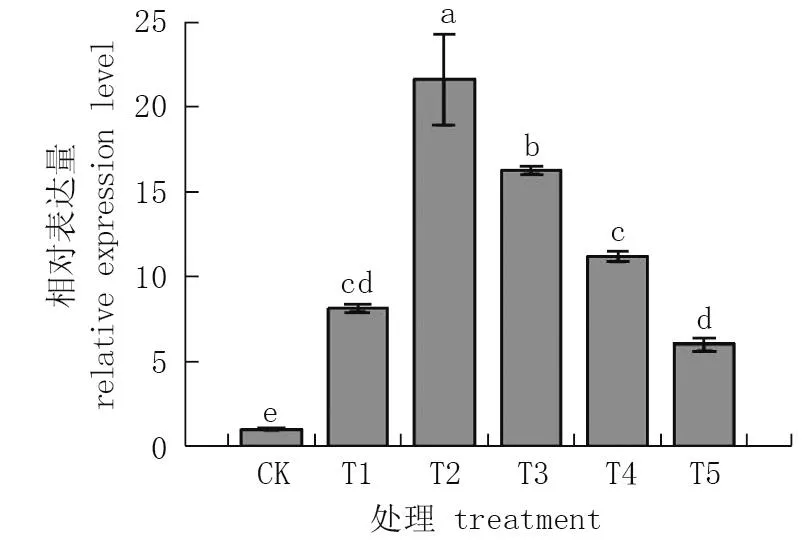
图8 杜梨叶片铁蛋白基因Fer1的相对表达量*Fig.8 The relative expression level of ferritin gene Fer1 in pear leaves* 不同小写字母处理间差异显著(P<0.05)。* Different letters indicate significant differences (P<0.05).
3 讨论
3.1 矿化水中金属离子对NC-Fe螯合的影响
在纳米纤维素的制备过程中, C6被氧化,纤维素表面引入磺酸基。在水溶液中,磺酸基去质子化后呈离子状态而使纳米粒子带负电。由于带负电荷的硫酸酯基团之间的静电排斥作用,纳米纤维素颗粒能很好地分散在超纯水中。在纳米纤维素水悬浮液中增加无机阳离子会导致纳米纤维素聚集。有研究[23]表明,在0~50 mmol·L-1的Na+浓度范围以及在0~5 mmol·L-1的Ca2+浓度范围内,纳米纤维素的粒径和Zeta电位均呈一定的上升趋势, Ca2+溶液中的纳米纤维素稳定性比在Na+溶液中差。NC-Fe在用浓度低于1 500 mg·L-1的矿化水作为配制溶剂时,对杜梨黄化叶片的补铁效果高于单独喷施FeSO4; 且由于矿化水中金属阳离子的干扰,纳米纤维素的粒径和Zeta电位均有变化,对纳米纤维素的特性均产生一定的影响,比如携带的电荷量减少,粒径增大。与上述研究相比,随着金属阳离子浓度的增大,粒径和Zeta电位增大的趋势相一致,从而印证矿化水中的金属阳离子会干扰纳米纤维素和铁的螯合,且对纳米纤维素的性质有一定的影响,因此纳米纤维素螯合的铁量减少,造成喷施的一部分Fe2+与空气中的氧气接触而氧化,而Fe3+不溶于水,不能被叶片所利用[1]。理论上, Zeta电位越高,粒子的分散度越好,但金属离子与NC-Fe 螯合物中的Fe2+有竞争关系,可能影响铁与纳米纤维素的螯合,当处于动态平衡时, Zeta电位增加,说明系统中来源于矿化水中的金属离子越多,或游离,或替代铁与纳米纤维素螯合,因而叶片中的有效铁含量下降,黄化效果减弱。
3.2 不同浓度矿化水中NC-Fe处理叶片矿质营养元素含量的变化
活性铁是叶片中铁营养水平的指标。本研究结果显示,与CK和T1处理相比, T2、T3、T4、T5处理活性铁含量均高于其他两组,且随矿化度的升高,活性铁含量逐渐下降。T2、T3处理叶片的全镁、全钙含量均高于CK、T1处理,也高于T4、T5处理,浓度越高,叶片的全镁、全钙含量越低。Ca2+在植物叶片中主要用于合成新的细胞壁,植物膜功能的正常运行也离不开钙,且低水平的钙肥可提高叶片叶绿素含量,提高植物的抗逆性[25-26]。而Mg2+是叶绿素分子的中心原子,调节关键光合酶活性[27], 叶面喷施镁肥对酿酒葡萄叶片的光合特性改善作用显著[28]。因此叶片的活性铁含量、全钙含量、全镁含量间接反映了叶片的光合作用强弱, 3个指标均随矿化度的增大而下降,说明黄化叶片的复绿效果随矿化度的升高而越来越差。
对玉米叶片研究发现,当植物细胞盐离子浓度过高时会引起离子毒害和离子不平衡,高浓度Na+可置换出细胞质膜和内膜系统中的Ca2+[29]。钠盐浓度在100 mmol·L-1及其以上时均会造成叶片中Na+浓度上升,而高浓度Na+会阻碍叶片对Ca2+的吸收[30]。盐胁迫下,植物体内的Na+会引起K+、Ca2+、Mg2+浓度的变化[31], 孙景波等[32]研究发现当Na+浓度逐渐逼近并超过150 mmol·L-1的过程中,桑树叶片中Na+浓度逐渐上升直至达到饱和,且迫使叶片中K+、Ca2+、Mg2+浓度下降。本研究中喷施铁肥时Na+浓度已引起黄化叶片的盐胁迫,结果显示,叶片中全钠含量逐渐上升,与全钙及全镁含量的变化趋势截然相反,且T5处理全钙、全镁含量低于CK, 证实了盐胁迫下Na+与Ca2+、Mg2+的拮抗关系。盐胁迫会影响植物的叶绿素含量和光合荧光参数[33], 叶片光合作用减弱,叶片复绿效果变差。
3.3 不同浓度矿化水中NC-Fe处理叶片铁蛋白基因相对表达量的变化
铁蛋白是一种由24亚单位组成的多聚体蛋白质,其中心腔内可容纳约4 500个铁原子[34]。本研究对叶片铁蛋白基因的表达量进行了分析, T3处理表达量显著高于T4处理,也显著高于T1、T5处理和CK; 且与T1处理相比, T3处理提高99%, T4处理提高37%, 说明低浓度矿化水会影响NC-Fe矫治梨树缺铁黄化的效果,但仍比单独喷施FeSO4效果好。T5处理稍低于T1处理,一方面是由于Na+浓度过高而引起叶片的盐胁迫,另一方面可能是因为杜梨铁蛋白家族基因的积累通过不同的转导途径进行。李希宽等[35]对梨树叶片的4个铁蛋白基因(Fer1、Fer2、Fer3、Fer4)的表达模式进行了研究,结果显示,这4种基因在非生物胁迫和激素刺激的情况下会出现差异性表达,在盐胁迫6 h后Fer1基因的表达量显著增加。
4 结论
纤维素是一种可再生的生物材料,其特殊的理化特性使其在诸多领域得到广泛应用。由酸水解制备的纳米晶体纤维素须带有从酸中引入的负电荷,因而具有很好地螯合铁离子的能力。而含有其他金属阳离子的矿化水配制的纳米纤维素-铁(NC-Fe)对梨树缺铁黄化的矫治效果下降。但当生产用水的矿化度小于1 500 mg·L-1时配制NC-Fe螯合物,与喷施FeSO4相比,对活性铁含量、铁蛋白Fer1表达仍有显著的促进作用,本研究可作为螯合铁在植物缺铁黄化病防治理应用的参考和补充策略。

