环磷酰胺聚乳酸微球的制备及其缓释过程的研究*
吴慧敏,钱文斌
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.湖北科技学院医学部基础医学院)
环磷酰胺(cyclophosphamide,CP)是临床上最常见的烷化剂类抗肿瘤药,应用范围广,主要用于淋巴瘤、骨髓瘤、乳腺癌、肺癌和卵巢癌等[1-2],治疗效果好。由于CP进入人体后对癌细胞和正常细胞的非选择特异性,使得药物在治疗癌症的同时也产生了严重的毒副作用[3]。CP具有明显的疗效-剂量依赖关系[4-5],因此,如何提高药物的局部浓度,降低毒副作用一直是研究的重要方向。将CP与高分子材料混合制成聚合物缓释微球,不仅可以减少给药次数,降低毒副作用,还可以提高药物的生物利用度。
微球(microspheres)是粒径范围1~1000μm,以适宜高分子材料为载体包裹或吸附药物而制成的球形或类球形微粒。微球作为药物载体不仅可以提高药物的生物利用度,降低药物不良反应,在抗癌药物上还具有靶向性[6]。高分子材料聚乳酸(Polylactic acid,PLA)作为无毒、可生物降解的高分子材料已被FDA批准用作药物缓、控释制剂的载体。目前,以聚乳酸为载体的抗癌药物的研究主要有表阿霉素、紫杉醇、甲氨蝶呤和氟尿嘧啶等[7-10],很少有环磷酰胺聚乳酸微球的研究。因此,本文采用乳化溶剂挥发法[11],以PLA为载体材料,二氯甲烷为溶剂,环磷酰胺为模型药物,制备了高分子微球,为临床应用提供参考数据。
1 材料与方法
1.1 主要材料与仪器
实验所需的主要材料与仪器详见表1、2。

表1 实验所需主要材料
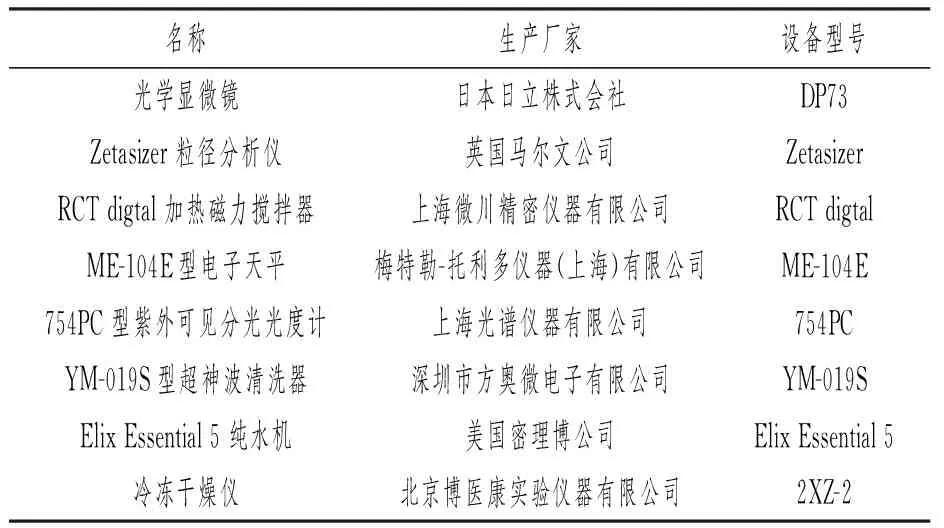
表2 实验所需仪器
1.2 方法
1.2.1 检测方法的确定
检测波长的确定:精密称取环磷酰胺并用纯水定容后,在190~400nm波长范围内进行实验,结果显示,在195nm处环磷酰胺的吸光度最大。
标准曲线的确定:分别精密取环磷酰胺标准品0.02、0.03、0.05、0.12g将其溶于纯水中并定容至1L。用纯水做空白组对照,用紫外分光光度计于195nm处检测吸光度A。以环磷酰胺的浓度(x)对吸光度A值(y)进行线性回归。
1.2.2 载药微球的制备方法
采用O/W型乳化溶剂挥发法制备载药微球。水相准备:精密称取表面活性剂放入圆底烧瓶中,倒入40mL纯水,置于加热磁力搅拌器上搅拌,表面活性剂完全溶解后冷却到室温备用。油相准备:称取一定量的PLA放入圆底烧瓶中,加入4mL CH2Cl2,放在超声波清洗器中超声乳化10min,再加入CP超声乳化30s,形成油相。在磁力搅拌的条件下,将有机相缓慢匀速的加入水相中,持续搅拌数小时确保有机溶剂最大限度的被挥发,然后离心,用纯水冲洗最少3次,烘干,得到环磷酰胺聚乳酸微球。
1.3 单因素考察
本研究采用单因素试验筛选出制备环磷酰胺聚乳酸载药微球的最佳工艺。 在进行试验之前,通过查阅相关文献,确定了油相与水相体积比为1∶10[12]。以载药微球外观、粒径及聚合物分散性指数(polymer dispersity index,PDI)为评价指标,PDI反映粒径分布宽度,范围0~1,数值越小,代表粒度越均匀,粒度分布越集中。采用单因素实验方法探讨各种因素对载药微球质量的影响。考察因素包括表面活性剂的种类及浓度、聚乳酸的浓度、环磷酰胺与聚乳酸的比例、搅拌速度及挥发时间。通过粒径分布、显微镜观察判断载药微球的质量,选出最优方案制备载药微球,并计算包封率与载药量。
1.3.1 表面活性剂的选择
以载药微球的外观、粒径和PDI为评价指标,对制备过程中使用的表面活性剂Tween20、Tween80和PVA进行考察,根据外观、粒径和PDI实验结果选择最佳的表面活性剂。
1.3.2 表面活性剂浓度的考察
固定其他条件不变,精密称取一定量的PVA,分别考察PVA浓度为0.5%、1%、2%、3%、4%时对载药微球的外观、粒径以及PDI的影响。
1.3.3 PLA浓度的考察
固定其他条件不变,精密称取一定量的PLA,分别配制浓度为5、10、15、20、30mg/mL PLA对载药微球的外观、粒径以及PDI的影响。
1.3.4 CP与PLA比例的考察
将CP与PLA的比例分别设置为1∶3、1∶6和1∶10,其他条件不变,考察其对载药微球的粒径和PDI的影响。
1.3.5 搅拌速度的考察
将磁力搅拌器的搅拌速度设置为300、400、500rpm,固定其他条件,考察搅拌速度对载药微球的粒径及PDI的影响。
1.3.6 搅拌时间的考察
固定其它条件不变,分别考察搅拌1、3、5、7、12h时对载药微球外观、粒径以及PDI的影响。
1.4 载药微球的形态观察及粒径分布
用光学显微镜初步观察微球的外观形态,用激光粒度分析仪分析粒径,并用Origin(2019版)绘图。
1.5 载药量与包封率
载药量是载药微球中所含药物的重量百分率,载药量可由下式计算:

(1)
包封率是载药微球内药量占投药量的百分比,包封率可通过下式计算:

(2)
1.6 体外模拟
采用透析膜囊[12]进行体外模拟实验,精密称取环磷酰胺聚乳酸微球50mg,置于透析袋内,加入3mL透析介质并将透析袋两端扎紧,将其投入含有100mL pH为7.4的磷酸缓冲液的烧杯中,以100rpm转速,(37±0.5)℃恒温水浴震荡,分别于0、1、3、5、7、12、24、36、48、96、108h取出1mL磷酸缓冲液,并向烧杯内补加同体积的磷酸缓冲液。用紫外可见分光光度计对取出的溶液进行分析,测定载药微球的药物含量,计算累计释药率,绘制释放曲线。
2 结 果
2.1 标准曲线
以环磷酰胺的浓度(x)对吸光度A值(y)进行线性回归,得到的回归方程y=3.4x-0.00035,R2=0.999,见图1。
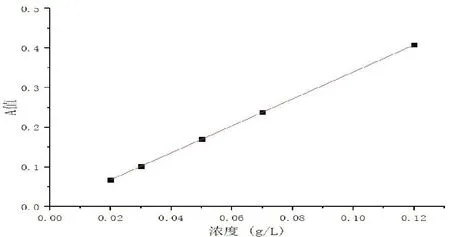
图1 环磷酰胺标准曲线
2.2 表面活性剂的选择
表面活性剂具有较强的亲水基和亲油基,乳化能力强,在乳化的过程中能有效的降低两相间的界面张力,形成乳滴。因此,选择合适的表面活性剂是制备微球的关键因素之一。实验结果如表3所示,表面活性PVA制备的载药微球平均粒径和PDI均是最小的,由于粒径小载药微球的降解速度较快,能快速达到血药浓度。因此,本实验选定表面活性剂为PVA。
表3 不同表面活性剂制备的聚乳酸载药微球
2.3 表面活性剂(PVA)浓度的选择
表面活性剂能防止PLA聚集,当PVA质量分数低时,相界面上吸附的PVA分子较少,界面膜强度较差,形成的乳滴稳定性也较差。当PVA浓度增高,界面膜强度相应增强;使分子聚结时阻力变大,形成的乳滴稳定性更好。但是随着PVA浓度的增加,载药微球出现黏连,粒径变大。因此,当 PVA在适当浓度才具有更佳的效果[13]。从实验结果(图2)可看出,当PVA浓度为0.5%时平均粒径虽然最小,但是PDI相对较高,粒径分布宽,分子量分布不均匀。当PVA浓度为1%、2%、3%时,载药微球的平均粒径相差不大,而PVA的浓度为1%时PDI最小,故选定PVA的浓度为1%。
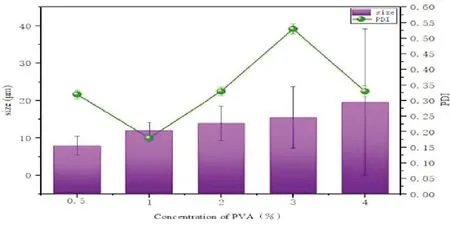
图2 不同浓度PVA制作的载药微球
2.4 聚乳酸浓度的选择
在成球范围内,聚乳酸的浓度与载药微球的平均粒径成正比。这是因为聚乳酸浓度越大,内分散相的黏度就越大,相同转速下更不易分散,微球的粒径也随之逐渐增大。但聚乳酸的浓度过小,会造成载药微球表面塌陷[10]。实验结果(图3)显示当PLA的浓度为10、15、20mg/mL时所制作的载药微球的平均粒径差距不明显,但在PLA的浓度为20mg/mL时PDI的值最小,因此,选定PLA的浓度为20mg/mL。
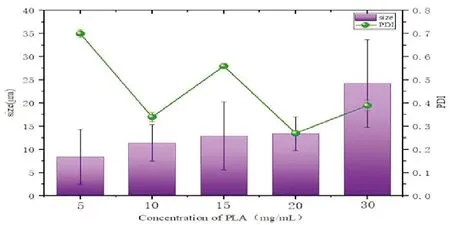
图3 不同浓度PLA制作的载药微球
2.5 环磷酰胺与聚乳酸的比例
用显微镜可以观察到微球粒径随CP含量的增加而变大,PDI无明显差异(见表4)。而且在CP与PLA的比例为1∶3时,内分散相的浓度较高,500rpm的搅拌速度不能使内分散相完全分散到外分散相中[14]。根据实验结果绘制了不同比例下载药微球粒径正态分布图(如图4),三种比例的载药微球均成正态分布,且CP与PLA的比例为1∶10时微球的总量最多,平均粒径最小,因此,选定CP与PLA的比例为1∶10。
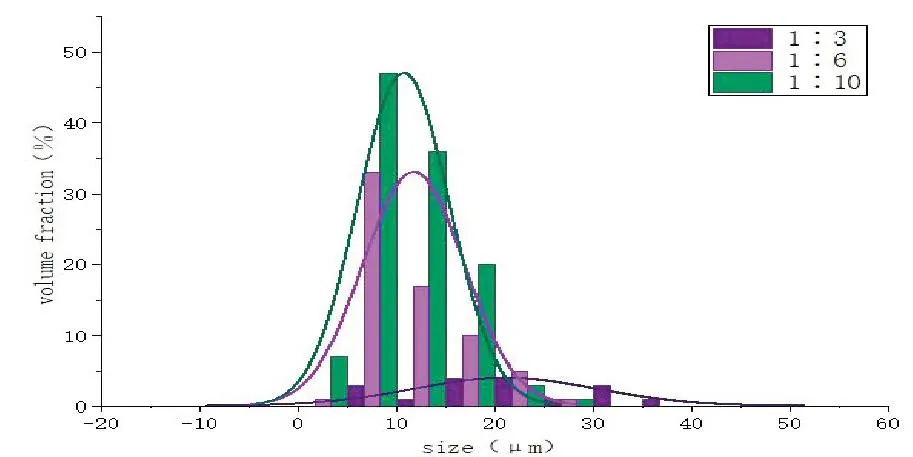
图4 不同CP与PLA的比例制作的载药微球正态分布图
表4 不同CP与PLA的比例制作的载药微球
2.6 搅拌速度
实验结果如图5,在300~500rpm内,环磷胺聚乳酸载药微球的平均粒径随着转速的增加而减小,PDI差距均小于0.35,微球粒径分布均一。多次实验结果显示,在搅拌速度为500rpm时,载药微球的平均粒径为(12.35±3.86)μm,PDI的平均值为(0.31±0.012)。因此,搅拌速度500rpm为最佳转速。
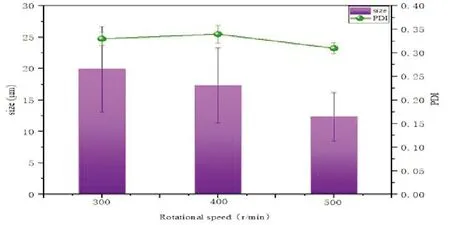
图5 不同搅拌速度制备的载药微球
2.7 搅拌时间
不同搅拌时间制备的环磷酰胺聚乳酸载药微球的粒径、PDI结果见图6。在1~7h内,随着搅拌时间的增加,平均粒径逐渐减小,搅拌时间为1h时,由于时间太短,水相与油相的聚结和团聚尚未全部完成。挥发时间至7h时,制得的平均粒径最小为13.02μm,PDI的平均值为0.22。当挥发时间加到12h时,平均粒径为12.99μm,但是PDI数值明显增加,载药微球大小分布不均一,也不符合工业化生产的要求。混合相在磁力搅拌7h后,环磷酰胺聚乳酸载药微球的粒径及PDI进一步降低,继续搅拌至12h与搅拌7h比较,搅拌7h各项指标更优,故确定制备工艺搅拌时间为7h。
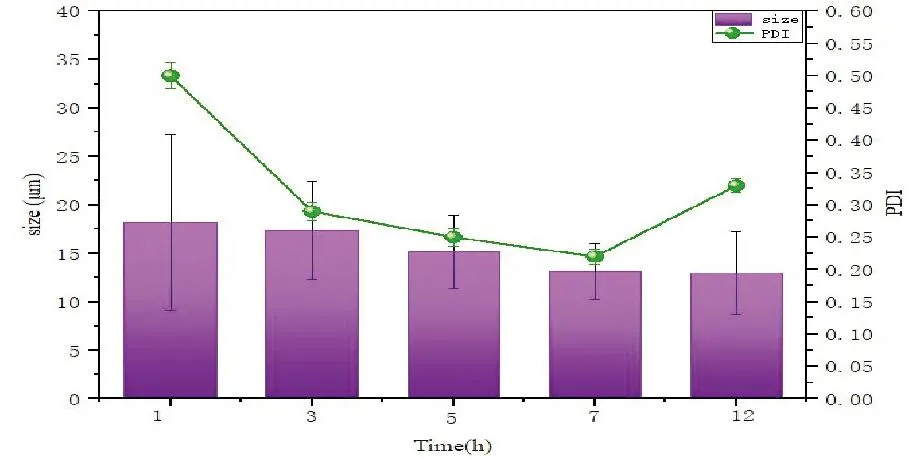
图6 不同搅拌时间制备的环磷酰胺载药微球
2.8 载药微球性能
2.8.1 最佳实验条件下载药微球的表征
最佳实验条件如表5所示,在最佳实验条件下多次实验得到了平均粒径为(12.67±3.67)μm,分布均匀的环磷酰胺聚乳酸微球,如图7所示。

a.载药微球荧光显微镜图(×200);b.载药微球扫描电镜图(×10K)。图7 最优实验方案的微球图
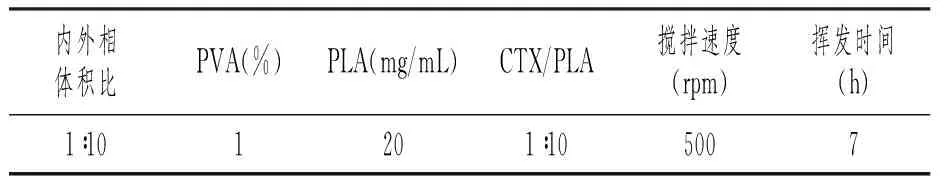
表5 最佳实验方案
2.8.2 载药量和包封率的测定
按照最优实验方案制备3批环磷酰胺聚乳酸载药微球,分别按公式(1)和(2)计算载药量和包封率,平均载药量为15.38%,包封率为62.5%。
2.8.3 环磷酰胺聚乳酸载药微球的体外模拟
用零级释放动力学方程、一级释放动力学方程以及Higuchi方程对最优制备工艺下制备的载药微球在pH 7.4磷酸缓冲液中的释放曲线进行拟合,详见表6。从动力学拟合方程中R2进行分析,Higuchi动力学模型对环磷酰胺聚乳酸微球的体外释放有很好的拟合度。从释放曲线(图8)可以看出药物在前12h释放速度快,释放了33.98%,这可能是在包埋过程中,游离态的环磷酰胺附着在聚乳酸微球的表面,在磷酸盐缓冲液中很快就释放出来。108h释放84.07%。
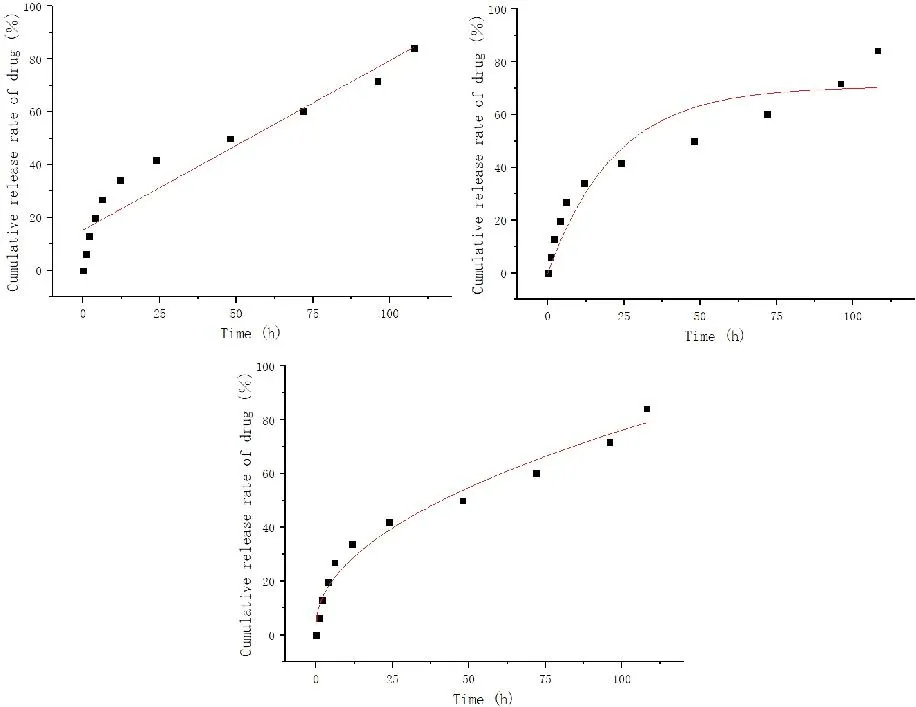
a.零级动力学模型;b.一级动力学模型;c.Higuchi模型。图8 环磷酰胺聚乳酸微球的体外释放曲线

表6 体外动力学模型的拟合
3 讨 论
环磷酰胺是经典抗癌药,本研究以聚乳酸为包材,环磷酰胺为囊材,以二氯甲烷为溶剂,聚乙烯醇为表面活性剂,用O/W乳化溶剂挥发法制备了环磷酰胺聚乳酸微球,制备方法简单,制备的载药微球形态规整,呈球型,分布均匀,平均粒径(12.67±3.67)μm,平均载药量为15.38%,包封率为62.5%。实验结果表明载药微球在体外释放效果良好,为进一步的细胞实验、动物实验以及临床应用提供了参考数据。

