基于AMPK信号通路探究樱桃李多酚提取物对胰岛素抵抗HepG2细胞糖代谢的作用*
苏黑艳·帕尔哈提,张姣姣,王俊人,赵家琪,李艳红
(新疆特殊环境物种多样性应用与调控实验室,新疆特殊环境物种保护与调控生物学实验室,新疆师范大学生命科学学院,新疆 乌鲁木齐 830054)
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种常见的代谢性疾病,在全球约5.37 亿糖尿病病例中占90%[1]。T2DM 的主要发病机制是胰岛素抵抗,胰岛素抵抗会导致β 细胞损伤、凋亡和血糖水平升高,从而发展为T2DM[2-3]。胰岛素抵抗主要发生在肝脏、脂肪和骨骼肌,其中肝脏作为糖脂代谢的枢纽,通过调节肝葡萄糖的利用或产生,在维持血浆葡萄糖水平方面起着至关重要的作用[4]。
AMP 活化蛋白激酶(AMP-activated protein kinase,AMPK)是普遍存在的丝氨酸/苏氨酸蛋白激酶,被提议作为“燃料计”[5]。研究表明,AMPK 的激活在调节体重,全身葡萄糖稳态,脂质代谢和线粒体生物发生过程中起着重要作用,暗示其可成为治疗糖尿病的潜在靶点。AMPK 作为肝脏中调节糖、脂质代谢的关键激酶,激活后可促进葡萄糖和脂肪酸的摄取并抑制葡萄糖和脂质合成,从而能够有效缓解肝脏糖、脂代谢紊乱[6]。同时,AMPK 的激活可降低转录因子FoxO1 和PGC-1α 的表达,并进一步抑制糖异生途径中G6Pase 和PEPCK 的表达,从而达到降低血糖水平的目的[7,11]。此外,糖原合成激酶3(glycogen synthase kinase 3,GSK3)位于几个信号轴的汇合处,包括PI3K/AKT/mTOR、AMPK 和Wnt 通路,其影响蛋白质和脂质合成、葡萄糖和线粒体代谢[12]。
多酚作为天然植物中一类次生代谢物,在各项生命活动中发挥着重要作用[8]。目前,被报道的天然多酚种类较多,其中大多数黄酮类化合物在体内和体外模型实验中表现出能够调节糖脂代谢和改善胰岛素抵抗等作用。
樱桃李(PrunuscerasiferaEhrh.)为蔷薇科李属,主要分布于新疆伊犁霍城县。前期,课题组检测发现樱桃李果实含有丰富的多酚类物质[9],能够通过激活AMPK 信号通路调控下游转录因子来改善肥胖小鼠脂代谢紊乱[10]。樱桃李多酚提取物是否具有调节糖代谢的作用未见报道。本研究利用高糖高胰岛素诱导建立胰岛素抵抗HepG2 细胞(IR-HepG2)模型,评价樱桃李多酚提取物对IR-HepG2 细胞糖代谢的改善作用及可能机制,为进一步在动物水平深入研究樱桃李多酚的降糖功能提供实验基础,同时为樱桃李的开发利用提供依据。
材 料 和 方 法
1 细胞与实验材料
HepG2 细胞购自武汉普诺赛生命科技有限公司;高糖DMEM 培养液、低糖MEM 培养液、PBS 缓冲液、青链霉素双抗、胰蛋白酶购自HyClone;胎牛血清购自ABI;葡萄糖含量检测试剂盒购自南京建成生物工程有限公司;胰岛素、MTT、BCA 试剂盒购自北京索莱宝生物科技有限公司;Trizol、cDNA 反转录试剂盒和荧光定量PCR 试剂盒购自北京天根生化科技有限公司;蛋白检测所用Ⅰ抗、Ⅱ抗及显色液购自上海碧云天生物技术有限公司;TEMED、MTT 和PVDF 膜购自Sigma;所用引物均由上海生工生物工程有限公司合成。
樱桃李多酚提取物(PrunuscerasiferaEhrh. polyphenol extract,PCE),本课题组前期采用有机溶剂法提取[9]。
2 方法
2.1 胰岛素抵抗模型的建立及鉴定 HepG2 细胞用含10%血清、1%双抗的低糖MEM 培养液培养,当细胞融合到70%时,用含10 mg/L 胰岛素的高糖DMEM 培养液培养36 h,检测培养液中葡萄糖含量,确定HepG2细胞形成胰岛素抵抗模型。
2.2 实验分组 将HepG2 细胞分为对照(control,Con)组、胰岛素抵抗(insulin resistance,IR)模型组、二甲双胍(metformin,Met)组(IR+Met)、IR+PCE 组,除对照组外,其他组细胞均进行胰岛素抵抗模型构建,樱桃李多酚提取物组细胞分别用100、200、400 mg/L 的PCE 进行干预,二甲双胍组用2 mmol/L 的二甲双胍进行处理。
2.3 MTT 法测定细胞活力 收集对数期细胞,接种至96孔板,每孔约5×103个细胞,培养24 h后,加入不同浓度(50、100、200、400、600、800、1000、1 200 和1 500 mg/L)的PCE 200 μL,处理24 h(每个处理6 个复孔),对照孔加入等体积的培养液,24 h 后,每孔加入20 μL 5 g/L 的MTT 溶液反应4 h,加入150 μL DMSO,用酶标仪测570 nm 处的吸光度(A),根据公式计算细胞相对活力。细胞相对活力(%)=A570,加药/A570,空白×100%
2.4 葡萄糖消耗的测定 收集对数期细胞,接种至96孔板,每孔约5×103个细胞,培养24 h后,分别加入50、100、200和400 mg/L的PCE处理24 h(每个处理6个复孔),空白对照孔加入等体积的培养液,阳性对照孔加入2 mmol/L 二甲双胍,收集培养液,按照试剂盒说明书操作,根据公式计算培养液中葡萄糖的消耗量。葡萄糖消耗量(mmol/L)=空白对照孔培养液葡萄糖浓度-阳性对照孔或药物处理孔培养液葡萄糖浓度。
2.5 Real-time PCR 检测基因的表达 分别以100、200 和400 mg/L 的PCE 处理24 h 后,离心收集细胞,采用Trizol法提取总RNA,反转录成cDNA,根据基因序列设计特异性引物,引物序列见表1。以β-actin为内参照,采用2-ΔΔCt法计算mRNA的相对表达量。

表1 引物序列Table 1. Sequences of the primers
2.6 Western blot 检测蛋白的表达 分别以100、200 和400 mg/L 的PCE 处理24 h 后,离心收集细胞,加入蛋白裂解液提取细胞总蛋白,BCA 法定量蛋白浓度,12% SDS-PAGE 分离蛋白,再以湿法转移至PVDF 膜上,5%脱脂奶粉溶液封闭,并先后加入Ⅰ抗、Ⅱ抗进行孵育。采用ECL 化学发光试剂盒显色,化学发光仪拍照,ImageJ 软件对蛋白条带进行灰度分析,计算蛋白的相对表达量。
3 统计学处理
所有计量数据均以均数±标准差(mean±SD)表示。采用GraphPad Prism 8.0 和SPSS 23.0 软件进行分析。各组均数比较采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著性差异法(LSD法)。以P<0.05为差异有统计学意义。
结 果
1 PCE对HepG2细胞活力的影响
检测不同浓度的PCE 处理HepG2细胞后的细胞活力,确定PCE 对HepG2 细胞的毒性作用。结果显示,与对照组相比,50、100、200和400 mg/L的PCE对HepG2 细胞活力无显著影响(P>0.05),而600、800、1 000、1 200 和1 500 mg/L 的PCE 可显著降低HepG2细胞活力(P<0.01),见图1。因此,后续实验选用50、100、200和400 mg/L的浓度进行处理。

Figure 1. Effect of different concentrations of PCE on HepG2 cell activity. Mean±SD. n=6. **P<0.01 vs Con group.图1 不同浓度PCE对 HepG2细胞活力的影响
2 PCE对IR-HepG2细胞葡萄糖消耗的影响
检测不同浓度PCE 处理HepG2细胞后的葡萄糖消耗量,确定PCE 对IR-HepG2 细胞葡萄糖消耗的改善作用。与Con 组相比,IR 组的葡萄糖消耗量显著降低(P<0.01),表明其胰岛素抵抗模型建模成功,可用于后续实验。Met 能显著升高胰岛素抵抗HepG2细胞的葡萄糖消耗(P<0.01)。PCE 干预细胞后,葡萄糖消耗量逐渐升高,呈剂量依赖性,说明PCE 可减轻胰岛素抵抗。但浓度为50 mg/L 时,与IR 组相比,无显著性差异(P>0.05),见图2。因此,后续选择100、200和400 mg/L的PCE进行实验。
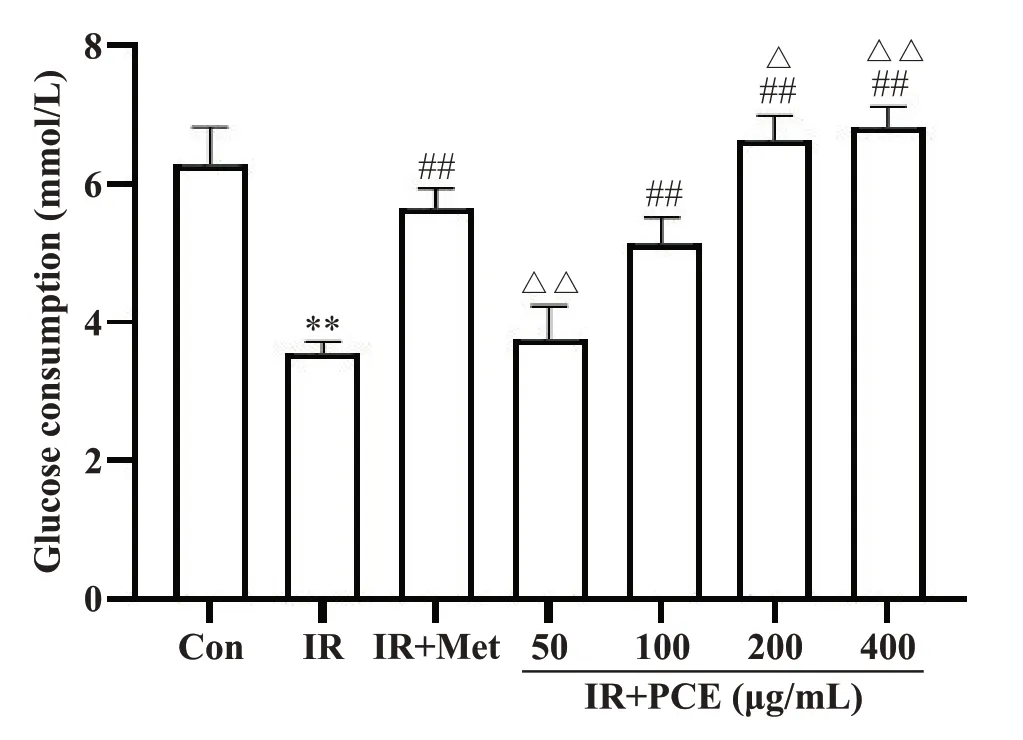
Figure 2. Effect of PCE on glucose consumption of IR-HepG2 cells. Mean±SD. n=6. *P<0.05,**P<0.01 vs Con group; ##P<0.01 vs IR group; △P<0.05,△△P<0.01 vs IR+Met group.图2 PCE对IR-HepG2细胞葡萄糖消耗的影响
3 PCE 对IR-HepG2 细胞糖异生相关因子mRNA及蛋白表达的影响
采用real-time PCR 和Western blot检测糖异生途径中PGC-1α、FoxO1、G6Pase 和PEPCK mRNA 及蛋白的表达水平,确定PCE 对IR-HepG2 细胞糖异生的作用。在mRNA 及蛋白水平,与Con 组相比,IR 组的FoxO1、PGC-1α、G6Pase 和PEPCK 的表达量显著提高(P<0.05);与IR 组相比,100、200 和400 mg/L PCE和Met 处理后,除100 mg/L PCE 处理的IR-HepG2 细胞FoxO1 蛋白表达量显著升高,其他组IR-HepG2 细胞的FoxO1、PGC-1α、G6Pase 和PEPCK mRNA 和蛋白的表达量均显著降低(P<0.05),见图3、4。

Figure 3. Effect of PCE on mRNA expression of PGC-1a,FoxO1,G6Pase and PEPCK in IR-HepG2 cells. Mean±SD. n=5. *P<0.05,**P<0.01 vs Con group; #P<0.05,##P<0.01 vs IR group; △P<0.05,△△P<0.01 vs IR+Met group.图3 PCE对 IR-HepG2细胞糖异生相关因子mRNA表达的影响

Figure 4. Effect of PCE on expression of gluconeogenesis-related proteins (PGC-1a,FoxO1,G6Pase and PEPCK) in IR-HepG2 cells. Mean±SD. n=3. **P<0.01 vs Con group; #P<0.05,##P<0.01 vs IR group; △P<0.05,△△P<0.01 vs IR+Met group.图4 PCE对IR-HepG2细胞糖异生相关蛋白表达的影响
4 PCE 对IR-HepG2 细胞糖原合成相关因子mRNA及蛋白表达的影响
检测糖原合成途径GSK3β mRNA 及蛋白的表达,确定PCE 对IR-HepG2 细胞糖原合成的促进作用。与Con 组比较,IR 组HepG2 细胞中GSK3β mRNA 和蛋白表达量均显著上调(P<0.01);与IR 组比较,100、200 和400 mg/L PCE 和Met 处理细胞后,细胞中GSK3β mRNA和蛋白表达量均显著降低且接近于正常组(P<0.05),见图5。

Figure 5. Effect of PCE on mRNA (A) and protein (B) expression of GSK3β in IR-HepG2 cells. Mean±SD. n=3. **P<0.01 vs Con group; #P<0.05,##P<0.01 vs IR group; △P<0.05,△△P<0.01 vs IR+Met group.图5 PCE对IR-HepG2细胞糖原合成相关因子GSK3β mRNA及蛋白表达的影响
5 PCE 对IR-HepG2 细胞AMPK mRNA 及蛋白表达的影响
与Con 组相比,IR 组HepG2 细胞AMPK mRNA水平及p-AMPK/AMPK 比值显著降低(P<0.01)。与IR 组相比,200、400 mg/L PCE 处理组和IR+Met 组的AMPK mRNA 水平及p-AMPK/AMPK 比值均显著升高(P<0.05),见图6。

Figure 6. The effect of PCE on AMPK mRNA (A) and protein (B) expression in IR-HepG2 cells. Mean±SD. n=3. **P<0.01 vs Con group; #P<0.05,##P<0.01 vs IR group; △△P<0.01 vs IR+Met group.图6 PCE对IR-HepG2细胞AMPK mRNA及蛋白表达的影响
讨 论
胰岛素抵抗是代谢障碍人群发展为2 型糖尿病的主要病因之一[13]。流行病学数据显示,肝脏胰岛素抵抗是肥胖、非酒精性脂肪肝等代谢性疾病的共同特征[14]。因此,研发改善胰岛素抵抗的药物并探讨其发病机制,对代谢性疾病的治疗具有重要的现实意义。二甲双胍是治疗2 型糖尿病常用的口服降糖药,但伴随着明显的副作用,如胃胀等[15-16]。相较于西药,天然活性物质在改善胰岛素抵抗方面具有一定的优势。故本研究利用高糖高胰岛素诱导胰岛素抵抗细胞模型,检测细胞活力及葡萄糖消耗量。结果显示,IR 模型组的葡萄糖消耗量显著低于Con组,说明胰岛素抵抗模型构建成功。随着PCE 浓度的增加,葡萄糖消耗量逐渐增加且呈剂量效应;高浓度的PCE 对细胞生长增殖有抑制作用,但整体仍表现对葡萄糖消耗的促进作用。
糖异生在糖代谢方面发挥着重要作用,尤其是氨基酸等非糖物质转化为葡萄糖的过程,其中PEPCK 和G6Pase 是调节糖异生的两个关键酶,FoxO1 和PGC-1α 是两个重要的转录因子,间接调节糖异生途径[17]。已有研究表明,当细胞处于胰岛素抵抗时,FoxO1 和PGC-1α 转录活性就会增强,从而增加了PEPCK 和G6Pase 的活性,促进糖异生[18]。Xia 等[19]研究表明多酚类物质可以逆转这种结果的发生,通过抑制FoxO1 和PGC-1α 转录活性来抑制PEPCK 和G6Pase 酶的活性。以上研究提示FoxO1、PGC-1α、PEPCK 和G6Pase在调节糖代谢中发挥着重要作用。本研究使用不同浓度的PCE 干预胰岛素抵抗HepG2 细胞,检测其糖异生相关因子mRNA 及蛋白的表达,结果显示PCE 能通过降低转录因子FoxO1、PGC1-α 的表达,抑制G6Pase、PEPCK 酶的表达,从而抑制糖异生的发生,并改善HepG2细胞的胰岛素抵抗。
除了调节糖异生之外,调节糖原的合成也可以维持葡萄糖稳态。GSK3β 是抑制糖原合成的限速酶,参与血糖调节、胰岛素匮乏和胰岛素抵抗[20]。Zhang 等[21]研究表明,二芳基庚烷(DPH5)减轻胰岛素抵抗HepG2 细胞的作用机制与PI3K/AKT 和Nrf2/HO-1 介导的GSK3β 信号通路调节有关。Guo 等[22]通过体外模型,证明了肝细胞中GSK3β的磷酸化,能控制胰腺β 细胞增殖,从而减轻胰岛素抵抗。Wang等[23]研究表明,棕榈酸酯通过降低胰岛素抵抗HepG 2 细胞GSK3β 蛋白表达,增加p-GSK3β 的表达来改善胰岛素抵抗。本研究结果显示,PCE 能够显著降低GSK3β基因及蛋白的表达水平,促进糖原的合成,改善糖代谢。
AMPK 信号通路是细胞能量稳态的主要因素之一,被认为是预防和治疗肥胖和糖尿病的关键靶点[24]。AMPK 在肝脏、骨骼肌组织、脂肪组织和下丘脑中都有作用,能够调节脂质和葡萄糖代谢[25-28]。Hao 等[29]研究表明,虎杖苷可通过增加AMPK 和GSK-3β 的磷酸化水平,以及增加肝糖原的生成来调节糖代谢。Zhou 等[30]通过体内和体外实验证明,白杨素通过激活AMPK 途径调节GSK3β、G6Paes、PEPCK 的表达水平,进一步改善糖原合成并抑制糖异生。随着AMPK 活性的增加,它会抑制多种参与葡萄糖代谢的因子,包括PGC-1α、FoxO1、PEPCK、G6Pase和GSK3β[31-33]。以上研究提示,AMPK 信号通路是改善胰岛素抵抗的关键因素。本研究研究显示,PCE 能激活AMPK 蛋白的表达,提高AMPK 磷酸化,调节下游转录因子及糖代谢相关酶的表达,进而调节胰岛素抵抗HepG 2细胞糖代谢。
综上所述,樱桃李多酚提取物能够提高细胞葡萄糖消耗量,同时能够通过激活AMPK 信号通路调控下游转录因子FoxO1、PGC-1α 及PEPCK、G6Pase、GSK3β 的表达量来减少糖异生和糖原的合成,改善胰岛素抵抗状态。

