拉曼光谱在细胞成像中的研究进展
曾敏静,马玮玮,唐浴尘,高婷娟
(华中师范大学 化学学院 绿色农药全国重点实验室 农药与化学生物学教育部重点实验室,湖北 武汉 430079)
光学显微成像可以清晰地观察细胞的形态和大小,实现细胞的可视化。为进一步理解细胞的生理活动调控机制,全面了解各组分的动态变化十分必要[1]。细胞器和生物分子是细胞的重要组成部分,通过生物传感技术监测它们的生理活动对于研究其生命功能具有重要意义[2]。荧光法是细胞成像中应用最成熟的技术,具有较高的时间和空间分辨率[3],但荧光光谱谱带较宽,易发生光谱重叠或光漂白现象,对于实现3~5个通道以上的多色细胞成像面临较大挑战[4]。
拉曼是一种非弹性散射光谱技术,在较宽的谱带范围(~200-4 000 cm-1)内呈现较为特征的指纹信号峰(~10 cm-1),相比于荧光光谱具有更多的成像通路,可对细胞内多种细胞器进行多色成像[5-6]。与荧光光谱相比,拉曼光谱无需标记或染色,可以直接检测胞内蛋白质、脂质和DNA 的指纹信息,通过分析就能观测它们的分布[7]。然而,自发拉曼光谱信号弱、需要延长采集时间或增强激光功率以获得特征图谱,此时细胞存在光毒性风险。为了克服这些问题,表面增强拉曼光谱(SERS)、相干拉曼光谱(CRS)和共振拉曼光谱(RRS)常用于增强拉曼信号。上述技术在细胞成像和生物传感领域已展开深入研究[8]。
基于Web of science 数据库的文献统计分析,近年来,拉曼光谱在细胞成像领域的研究热度不断上升(表1)。本文将细胞拉曼成像分为无标记和标记两个类别进行系统介绍,综述了SERS、CRS、RRS等拉曼增强技术在细胞成像方面的应用,最后对目前细胞拉曼成像面临的问题和未来的发展趋势进行了总结和展望。
1 拉曼增强
1.1 表面增强拉曼光谱
1.1.1 传统纳米粒子增强拉曼光谱SERS 是细胞成像中的一个重要手段,其增强机制包括电磁增强(EM)和化学增强(CM),其中EM 是SERS 增强的主要机制[9]。当入射光的频率接近贵金属纳米离子表面自由电子的振荡频率时,产生局域等离子体共振效应(LSPR,图1A)[10];当相邻的金或银纳米颗粒相互靠近时,它们的等离子激元相互作用会形成“热点”区域(图1B)[11],即形成局域极高电场强度,从而增强样品的拉曼信号。SERS 的发生要求纳米颗粒间隙小于10 nm,通常需要通过调节材料的纳米阵列结构来实现。优化后的纳米阵列基底可达到极高的增强因子(1010~1012)[12]。灵敏的SERS 技术被用于细胞免疫检测,如上海师范大学杨海峰教授课题组制备了4-巯基苯甲酸(4-MBA)修饰金纳米颗粒(Au NPs)的SERS 探针,并利用Fe3O4优化Au NPs 等离子体共振,增强4-MBA 的SERS 信号,进而实现禽流感病毒H3N2的灵敏检测[13]。

图1 LSPR示意图[10](A),“热点”示意图[11](B)及SERS细胞成像图[18](C),TERS示意图[20](D)及TERS识别单个DNA碱基[21](E),SHINERS示意图[24](F)及SHINERS用于癌细胞成像[26](G)Fig.1 (A) Schematic of LSPR [10],(B) hot spot [11] ,(C) SERS cell imaging pictures [18];(D) Schematic of TERS [20],(E)TERS identification of individual DNA bases [21];(F) Schematic of SHINERS [24],(G) SHINERS imaging of cancer cells [26]
结合适当的标签,SERS 技术能实现细胞成像,如湖南大学李继山教授课题组利用炔烃标记AuAg@p-SiO2NP探针,实现了活细胞内H2O2的成像[14]。吉林大学徐抒平和梁重阳教授课题组利用炔烃标记SERS探针靶向脱氧核糖核酸(DNA),实现细胞核的精确定位[15]。上海交通大学叶坚教授课题组报道了一种具有花瓣状壳结构的P-GERTs颗粒,颗粒内部的亚纳米间隙和外部的花瓣状壳结构具有较多的强电磁热点,可以高速实现细胞组织成像[16]。此外,在长时间的细胞孵育过程中,SERS颗粒可能与细胞中抗体蛋白发生非特异性吸附,进而导致假阳性结果。为解决上述问题,沈爱国和胡继明教授课题组提出了一种Click-SERS 的技术,利用三键信号分子在细胞拉曼静默区的较强信号[17],通过分步加入探针实现靶向和探针杂交,实现多个目标物的特征信号识别,从而避免假阳性结果(图1C)[18]。
1.1.2 针尖增强拉曼光谱常规SERS成像技术的空间分辨率仅能达到200~300 nm,而针尖增强拉曼(TERS)作为一种新型SERS手段,利用LSPR在尖端顶点发生纳米聚焦效应,使成像的空间分辨率突破了光学衍射极限,达到纳米级别[19]。在细胞成像时,TERS尖端附近的强电磁场会明显增强邻近分子的拉曼信号(图1D)[20],可以同时提供细胞组分的化学键指纹信息和表面形貌信息。TERS 原子力显微镜实现了双链DNA 上单个碱基的识别(图1E)[21]。结合全内反射(TIR)的TERS 技术,可实现Tau 蛋白/肝素纤维的纳米尺度成像[22]。Kumar等[19]应用TERS 实现了小鼠脂肪细胞的纳米级绘图,以20 nm 的空间分辨率绘制了胞内磷脂分子的二维图像。
1.1.3 壳层隔绝纳米粒子增强拉曼光谱壳层隔绝纳米粒子增强拉曼(SHINERS)是一种改进的SERS技术,由厦门大学李剑锋教授课题组提出[23]。SHINERS 在金银SERS 颗粒表面涂覆2 nm 厚的惰性层,隔离SERS纳米结构,使其不与目标分子发生接触或反应,并减少纳米颗粒团聚,进而提高检测信号的稳定性(图1F)[24]。SHINERS 被有效应用于活细胞研究,如吉林大学徐蔚青教授课题组采用Au@SiO2壳层隔绝纳米粒子,基于SHINERS光谱和成像图的差异区分正常乳腺细胞和癌变细胞[25]。此外,石墨烯具有较高的物理化学稳定性和生物相容性,被认为是SHINERS的理想惰性壳层。湖南大学陈卓和谭蔚泓教授课题组制作了石墨烯涂覆的金纳米粒子(GIAN),利用其在1 325 cm-1和1 595 cm-1附近的强SERS振动信号(分别对应石墨烯壳层的D、G 拉曼振动模式),实现了MCF-7乳腺癌细胞的拉曼成像(图1G)[26]。此外,SHINERS 在食品安全、环境检测中也具有应用潜力,可用于检测果蔬中的农药残留、非法食品添加剂以及环境中的亚硝酸根等污染物[27]。
基于等离激元效应的SERS 技术在细胞成像方面表现出色,但SERS 纳米颗粒可能对细胞的生理活动产生一定影响。此外,用于细胞拉曼成像的材料也需要达到更高的制备要求:TERS技术需制作耐激光加热和抗污染的针尖,SHINERS 需精确控制纳米颗粒的大小、形状和表面惰性层的厚度,以获得稳定的光谱信号。因此,非线性拉曼光谱和分子内拉曼增强等方法有可能避免上述问题,改进细胞拉曼成像的效果。其具体研究进展综述如下。
1.2 相干拉曼光谱
1.2.1 相干反斯托克斯拉曼光谱CRS 是非线性拉曼光谱技术,包括相干反斯托克斯拉曼散射(CARS)和受激拉曼散射(SRS)。泵浦光(ω1)是激发样品的光源,将原子或分子激发到高能级。斯托克斯光(ω2)是泵浦光与样品相互作用,并发生能量损耗后产生的拉曼散射光。当泵浦光和斯托克斯光的频差与分子的振动频率匹配时,产生与振动相关的相干极化。然后利用探测光(ω3)与样品进一步相互作用,产生反斯托克斯的相干辐射(ω4),即CARS 现象(图2A)[28]。CARS 增强了拉曼信号,提高了成像速度,可以实现活细胞中脂滴等大分子物质的无标记拉曼成像(图2B)[29]。Borri 等[30]利用CARS 区分脂质类型和量化脂滴的空间分布,观察了细胞分化过程中的脂质摄取过程。而由于CARS 技术在宽视场照明中通常需要较高的激光功率,研究人员结合了SERS信号增强以减少功率消耗[31]。例如,添加4-巯基吡啶(4-Mpy)修饰的Au 纳米颗粒后,CARS 所需的功率密度降低了1 000 倍,同时实现了每秒120帧的成像速度。利用这项技术观察了饥饿细胞释放生物分子的动态过程。

图2 CARS光谱能级跃迁图[28](A)及CARS无标记活细胞成像[29](B),SRS光谱能级跃迁图[32](C)及SRS氘标记细胞成像[36](D),EPR-SRS光谱能级跃迁图[37](E)及EPR-SRS神经元细胞成像[39](F)Fig.2 (A) Energy transition process diagram of CARS [28],(B) label-free live-cell CARS imaging picture[29];(C) Energy transition process diagram of SRS[32],(D) SRS imaging of deuterium-labeled cells[36];(E) Energy transition process diagrams of EPR-SRS[37],(F) EPR-SRS imaging of neuronal cells[39]
1.2.2 受激拉曼光谱SRS是当泵浦光和斯托克斯光的频差与分子的振动频率匹配时,自发散射过程转变为受激过程,泵浦光的强度降低,斯托克斯光的强度增大(图2C)[32]。谢晓亮教授课题组首次将SRS 技术用于显微成像,发现该技术不易受到虚假背景的干扰[33],并通过增强反向散射信号的收集提高SRS 成像质量,实现了高灵敏、高分辨和高速度的SRS 生物成像[34]。该技术可在无标记条件下对组织进行观察,例如跟踪脂质、蛋白质药物在小鼠和人体皮肤中的渗透路径。Cunha 等[35]在观察小鼠脑组织Aβ斑块时,发现以酰胺B作为指纹的SRS成像比CARS成像具有更高的分辨率和更快的成像速度。但SRS 也存在局限性,如蛋白质、核酸、聚糖等分子在化学组成上无明显区别,其SRS 信号非常相似,很难区分。为解决这一问题,研究人员引入同位素标记的方法,同位素D 标记后的分子会产生与C—H键不同振动频率的C—D键,从而与背景信号分开。闵玮教授课题组利用D2O标记HeLa细胞等动物活细胞,由于不同类型大分子中C—D键周围的化学环境不同,其拉曼位移不同,可以分别实现蛋白质、脂质和DNA的成像(图2D)[36]。
1.2.3 电子预共振受激拉曼光谱CARS 和SRS均发生在非电子能级共振区域。当泵浦光能量与分子内电子跃迁能级接近时,分子的振动信号会通过电子振动耦合增强(图2E)[37]。闵玮教授课题组报道了这种电子预共振受激拉曼(EPR-SRS)技术[37-40]。当振动被调到预共振状态,拉曼峰信号可增强5 个数量级,从而实现胞内DNA 和蛋白的快速稳定成像。因为EPR-SRS 的振动线宽(10 cm-1)比荧光显微镜(1 500 cm-1)窄约100倍,可以实现多色拉曼成像(图2F)[39]。闵玮等基于氰基、炔基的特征信号设计了调色方案,获得了8 种MARS 染料,当与商用荧光染料结合使用时,可提供16 种清晰的颜色用于活细胞成像。
无标记CARS 技术的空间分辨率能达到亚微米级别,适用于观察高浓度分子或生物大分子。但CARS易受到非共振背景的干扰,从而限制了其在细胞分析中的应用。SRS技术需要在强烈的斯托克斯光和泵浦光之间检测非常小的差分信号,这需要调制敏感的传输方案才能实现,且SRS 的光谱窗口有限,将其扩展到全波段模式具有技术挑战。EPR-SRS 通常需要较高的光谱能量密度来探测低浓度的生物分子,成像时难以避免高功率激光对细胞的光毒性。总体来说,此类CRS 技术需要复杂、高端的光学仪器才能实现。与此相比,分子内增强拉曼的思路有望摆脱这方面困扰。如果与特定的小分子拉曼探针相结合,这种增强策略将大幅降低对细胞成像光学仪器的苛刻要求,有望实现细胞不同组分的特异性高灵敏成像。
1.3 共振拉曼光谱
1.3.1 表面增强共振拉曼光谱共振拉曼光谱(RRS)利用共振效应实现拉曼信号增强,一般可实现2~4 个数量级的增强[41]。表面共振增强拉曼散射(SERRS)利用信号分子的共振效应和LSPR 效应相结合,可以进一步提高SERS 的灵敏度。如Kaya 等[42]将银负载铁-氨基三乙酸(Fe-NTA)的SERRS 探针用于检测多巴胺,在银纳米颗粒表面产生LSPR 效应增强拉曼信号,同时NTA-Fe-多巴胺复合物通过与633 nm激光的共振进一步增强拉曼信号,可以实现多巴胺的灵敏检测,检出限低至0.5 pmol/L(图3A)。此外,SERRS 技术可以检测到非常小的癌前病变[43]并进行癌细胞成像(图3B)[44]。Harmsen 等[43]开发了一种生物相容和检出限极低(10-15mol/L)的SERRS-NPs(纳米粒子),通过小鼠肠胃内窥镜的拉曼成像观察到癌前病变组织。Jermyn 等[45]应用SERRS 在手术中观察肿瘤边缘,准确区分了正常脑细胞和癌变细胞。该技术在指导癌症治疗方面具有较大应用潜力。

图3 银纳米粒子负载Fe-NTA的SERRS示意图[42](A)及癌细胞SERRS成像[44](B),AERS示意图[52](C)及AERS线粒体成像[52](D)Fig.3 (A) Schematic of SERRS using silver nanoparticles loaded with Fe-NTA[42],(B) cancer cell SERRS imaging[44];(C) Schematic of AERS[52],(D) mitochondrial AERS imaging[52]
1.3.2 分子内共振拉曼光谱类胡萝卜素和细胞色素等细胞分子在可见光区有较强吸收,通过观察其共振增强拉曼信号,可以实现无标记RRS 成像[46-48]。但大多数细胞分子仅吸收紫外光,而紫外光对细胞具有光毒性,限制了RRS无标记成像的应用[49]。为解决上述问题,研究人员设计了一种适用于细胞成像的共振拉曼探针,该探针在475 nm处具有最大吸收峰,在532 nm激光激发下可将偶氮苯的特征信号(1 375 cm-1)提高550 倍,实现较低光毒性的RRS 成像[50-51]。该研究展示了此探针用于细胞膜、线粒体的高对比度成像和免疫标记成像。
本课题组提出了偶氮增强拉曼散射(AERS)的新方法,合成了系列AERS 探针的分子库,揭示了其分子结构对信号增强的影响机制(图3C)[52]:通过共轭链接偶氮苯与特征振动基团,增加电子能级与振动能级的耦合程度,分子吸收峰红移至可见区,可实现共振拉曼效应,大幅提高拉曼散射强度。同时,偶氮苯顺反异构化导致非辐射能量释放,抑制荧光背景,可进一步提高拉曼散射的信噪比。将偶氮苯作为增强模块,可使多种振动模式的拉曼信号增强至2~4 个数量级。基于此,设计了可以靶向线粒体的灵敏AERS 探针,并实现了多色细胞成像(图3D)和多色标记的混合细胞解码。由于AERS 的多色成像和多色编码可用于多个对象的同时观测,该技术将为研究细胞内不同细胞器和生物分子之间的相互作用提供有效工具[53]。
综上所述,共振拉曼技术可以增强拉曼信号的强度。但SERRS共振标签和目标分子在颗粒表面的吸附并不均匀,难以利用其拉曼散射信号强度定量分析细胞分子的浓度;分子内共振拉曼散射要求设计与合成分子内共轭结构,同时避免共轭结构的荧光背景干扰。
2 细胞拉曼成像
不同的拉曼增强技术具有不同的优势。SERS技术具有较高的灵敏度,CRS技术可实现高分辨快速成像,而RRS 技术结合小分子探针可实现全谱带高分辨快速成像。它们在细胞成像领域均有广泛应用,其应用范围分为无标记和标记拉曼成像。无标记成像具有较高的生物相容性,而标记成像可在复杂的细胞环境中特异性识别目标物。利用这些技术观察细胞器的动态变化和生物分子的代谢过程,对于了解细胞的生理状态具有重要意义。
2.1 细胞无标记拉曼成像
无标记拉曼成像技术在不添加探针标记的前提下,直接进行活细胞成像。通常无标记拉曼成像需使用非线性CRS 技术增强信号强度。脂滴是脂质的聚集体,含有大量相同的C—H 键,使得脂滴非常适合进行相干成像,成为常见的研究对象[54]。基于—CH2—键的伸缩振动峰(2 845 cm-1),Fueser 等[55]对线虫体内脂滴进行了CARS成像,并观察了环境污染物微塑料对线虫体内脂滴分布的影响,发现0.1µm的聚苯乙烯微球(PS)会导致脂滴的明显积累。Borri等[30]利用CARS观察了脂肪干细胞中单个脂滴的时空分布,发现脂肪干细胞分化成熟后,细胞内脂滴的化学含量对外源变化的反应速度会显著降低(图4)。此外,拉曼成像可以作为一种细胞脂滴含量的测量工具。Pacia等[56]利用拉曼成像分析了内皮细胞中脂滴的含量,并分析了脂滴的不饱和程度。虽然无标记拉曼成像被广泛应用,但在实际应用中仍存在挑战,例如成像分辨率不高、难以区分结构相似的生物分子等。为解决这些问题,标记拉曼技术被广泛采用。

图4 脂肪干细胞中的脂滴CARS成像[30]Fig.4 CARS imaging of lipid droplets in adipose-derived stem cells[30]
2.2 细胞标记拉曼成像
2.2.1 细胞器标记拉曼成像线粒体是细胞供能、代谢调节、应激响应的重要细胞器[57]。线粒体中含有大量细胞色素C,当激发光与细胞色素C产生共振效应时,可以进行线粒体的无标记成像[58-59]。但细胞色素C 的特征谱带可能被细胞内蛋白质和脂质的拉曼信号掩盖[60]。为实现更准确的线粒体成像,研究者开发了特异靶向线粒体的拉曼探针。Sodeoka 课题组将双芳基丁二炔(BADY)与三苯基膦(TPP+)连接合成线粒体探针(MitoBADY),利用带正电荷的TPP+特异性靶向带高负电荷的线粒体,实现细胞内线粒体的准确成像[61]。Wilson 等[62]添加Mitokyne探针实现HeLa细胞中线粒体的高分辨率成像,并利用探针对pH 的拉曼光谱响应,实现了线粒体pH 传感。新加坡国立大学黄志伟教授课题组设计了一种二炔拉曼标记探针(BDDBPDM),将两个苯环连接到二炔键的两端以增强C≡C 键周围的电子离域程度[63]。BDDBPDM 探针与三苯基膦(TPP)链接后,可以高特异性地靶向线粒体。利用SRS显微镜,观察了药物诱导后线粒体的分离和聚集过程(图5A)。此外,线粒体的多色、动态成像对于研究其生命功能具有重要意义。复旦大学季敏标教授课题组通过设计炔标记的二芳基乙烯(DTE)实现线粒体的光致多色成像[64]。当DTE 发生光致异构化时,闭环反应会改变DTE 的电子结构,诱导共轭炔基发生拉曼位移并增强SRS 信号。他们通过小范围紫外线照射的方式使部分线粒体光致变色,利用SRS 显微镜实现了线粒体的多色成像和动态观察。
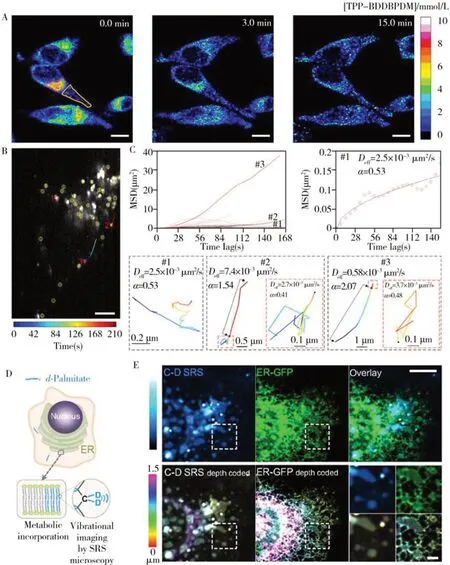
图5 BDDBPDM-TPP探针的线粒体标记拉曼成像[63](A);DAERI溶酶体成像图[67](B),溶酶体均方位移(MSD)动力学分析及溶酶体运动轨迹示例[67](C);氘标记的SRS成像示意图[71](D)及内质网-氘标记的SRS成像[71](E)Fig.5 (A) BDDBPDM-TPP labeled mitochondrial Raman imaging[63];(B) DAERI of lysosomes[67],(C) mean square displacement analysis of lysosomes and motion tracks of lysosomes[67];(D) Schematic of deuterium-labeled SRS imaging[71],(E) ERdeuterium-labeled SRS imaging[71]
溶酶体是细胞物质和能量循环的重要场所,参与细胞的自噬过程,其主要功能是清除细胞内外源有害物质,如错误折叠的蛋白质、受损细胞器和病原体等[65]。Prasad 教授课题组设计了BBQ650-Lyso探针,其共振拉曼增强发生于低毒性的红光光谱范围,减少了细胞的光损伤,可以实现对活细胞中溶酶体的准确成像[66]。华中科技大学罗亮教授课题组采用主客体拓扑化学聚合策略进行二乙炔聚合,此PDDA-Lyso 探针可以实现胞内溶酶体的高分辨成像[32]。本课题组开发了基于偶氮增强的活细胞高分辨快速动态拉曼成像技术(DAERI),展示了70个溶酶体的生物物理特征统计以及每个溶酶体的生理运动轨迹(图5B、C)[67]。DAERI 采用低功率(75 µW/µm2)和线扫描的方式,可以实现多细胞器的高分辨(270 nm)、快速动态(3.5 s/frame)、全谱(500~3 200 cm-1)自发拉曼成像。
内质网(ER)是细胞中蛋白质和脂质合成的重要场所和胞内最大的膜结构[68]。ER 中含有高浓度的磷脂,Czamara 等[69]利用磷脂胆碱中N+(CH3)3的伸缩振动峰(720 cm-1)实现ER 的成像。但Majzner 等认为其他细胞器中也含有磷脂,利用脂质中—CH2—的伸缩振动峰(2 830~2 900 cm-1)进行区分的准确性更高,他们利用这个特征信号实现了ER的成像[70]。另外,棕榈酸酯是脂质合成的主要原料之一,闵玮教授课题组利用氘标记的棕榈酸酯也实现了ER 成像(图5D、E)[71]。他们基于C—D 键的SRS 图像,观察到新合成的脂质在ER上会发生相分离。
2.2.2 生物分子标记拉曼成像蛋白质是细胞修复与再生的主要原料,参与细胞代谢、信号传导和化学运输等重要过程。拉曼探针标记可以实现胞内蛋白质成像。Fujioka等[72]设计了4种氰基拉曼探针,分别靶向3种氨肽酶和1种糖苷酶,实现了活细胞中4种酶的同时成像。特异性识别细胞或组织表面的蛋白质,可为肿瘤或癌细胞的诊断提供依据[73]。北京大学汤新景教授课题组设计了3种生物正交SERS纳米探针,分别靶向3 种癌细胞标志物核仁素、αvβ3 整合素和CD44,实现了乳腺癌细胞多色成像[74]。北京航空航天大学王晓天教授课题组设计了SERS 纳米探针B-TiO2,能够快速靶向MCF-7/ADR 癌细胞表面的P-糖蛋白,实现癌细胞成像[75]。湖南大学陈卓和谭蔚泓教授课题组设计了一系列同位素C13石墨烯-Au 纳米探针(GIAN),利用不同探针与膜蛋白的亲和力差异,开发了一种SERS 条形码癌细胞分选系统,通过A549 和HepG2 的分子表达区分,实现了癌细胞多色成像(图6)[76]。GIAN 编码器具有高灵敏度和低荧光背景干扰的特点,在癌细胞鉴定方面具有应用潜力。

图6 GIAN编码器识别癌细胞示意图[76](A)及A549、HepG2癌细胞成像[76](B)Fig.6 (A) Schematic of GIAN-encoders identifying cancer cells[76],(B) A549 and HepG2 cell imaging[76]
糖类是细胞活动所需能量的主要来源。糖类代谢异常可作为糖尿病、肿瘤发生的诊断指标[64]。同位素标记通常不会干扰糖类的正常功能,是糖类等小分子代谢的理想示踪剂。Li等[77]利用氘标记的葡萄糖探针(D7-glucose),通过SRS 观测了胰腺癌细胞中葡萄糖用于脂质的合成过程(图7A),为细胞代谢中的异质性研究提供了一种可视化手段。闵玮教授课题组报道了炔基标记的葡萄糖探针(3-OPG)用于观察单细胞的葡萄糖摄取过程,借助细胞拉曼静默区的特征拉曼信号,实现高特异性的葡萄糖SRS成像[78]。由于3-OPG(2 129 cm-1)和D7-glucose(2 060~2 250 cm-1宽峰)之间的拉曼峰有光谱重叠,很难实现双色成像。该课题组利用同位素C13标记3-OPG 探针(2 053 cm-1),将其特征峰与D7-glucose 的宽峰分离,从而利用两者的特征信号实现了双色成像,同时观察了小鼠脑组织细胞的葡萄糖摄入和异质性代谢过程[79]。
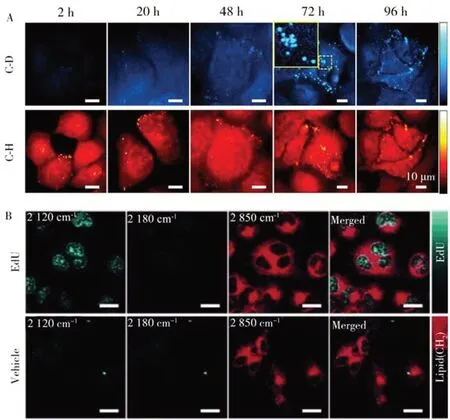
图7 细胞葡萄糖代谢过程的SRS成像[77](A),EdU标记的HeLa细胞核SRS成像[83](B)Fig.7 (A) SRS imaging of cellular glucose metabolism[77];(B) SRS imaging of EdU labeled HeLa nucleus[83]
核酸是遗传信息的载体,指导基因表达和蛋白质合成。核酸的突变或异常调节可能导致疾病发生,因此胞内核酸成像具有重要意义[80]。Meister 等[81]发现5-乙炔基-2'脱氧尿嘧啶核苷(EdU)易于整合到细胞DNA 并在细胞核中积累,随后日本Sodeoka 教授课题组[82]报道了炔基标记EdU 探针用于细胞成像,并观察了HeLa 细胞增殖时DNA 的合成过程。北京大学黄岩谊教授和陈兴教授课题组开发了一种生物正交SRS 成像技术,利用炔类标签处于1 800~2 800 cm-1拉曼静默区的特征信号,明显提升了EdU 的SRS 成像效果,准确定位了细胞核(图7B)[83]。黄岩谊课题组利用具有大量π 共轭结构的苯乙炔(PPE)衍生物作为探针,进一步提升了细胞成像的对比度[84]。该研究展示了共轭多炔聚合物在细胞成像中的应用潜力。SERS探针也被广泛应用于核酸成像,如Huefner等[85]利用Au-NPs探针连接靶向核酸的肽序列(Flu),实现细胞核的准确成像。异常表达的微小核糖核酸(miRNA)有望作为癌症发生的标志物,但其浓度极低、较难被检测。湖南大学李继山教授课题组通过核酸酶和DNA 水凝胶制成了SERS 传感阵列,利用SERS增强拉曼信号,实现了miRNA的识别和定量[86]。
2.2.3 离子标记拉曼成像离子在调节细胞内渗透压和酶催化反应中发挥重要作用。目前常用的细胞离子成像方法包括二次离子质谱法、荧光探针法和拉曼探针法等[87-88]。其中,二次离子质谱和荧光探针法可以实现细胞内Al3+、K+、Ca2+等金属离子成像。4-MBA、4-Mpy 等拉曼探针可用于胞内质子成像[89]。厦门大学任斌教授课题组将4-Mpy 修饰在SERS 粒子表面,利用4-Mpy 的苯环C=C对称伸缩峰(1 610 cm-1)和苯环C=C反对称伸缩峰(1 575 cm-1)进行比例型pH 传感,观察了癌细胞凋亡过程中的pH 变化[90]。由于在成像过程中SERS 颗粒易受到胞内其他小分子干扰,南京大学王康教授课题组利用涂覆在颗粒表面的精氨酸作为保护壳层,实现修饰后探针的较高稳定性,使探针在酸碱介质中24 h 内仍具备pH 传感能力[91]。相比于大尺寸的SERS探针,小分子拉曼pH 探针具有更高的生物相容性。Wilson等[62]报道了一种pH-mito 探针靶向线粒体,利用酚羟基的得失质子能力产生拉曼响应,实现胞内线粒体的氢质子成像。本课题组设计了一种AERS-pH 探针,灵敏地观察到质子化/去质子化过程中化学键的断裂与生成。由此引起的1 350 cm-1和1 606 cm-1处振动指纹的比例型变化,可用于观测溶酶体在正常和饥饿状态下的质子分布变化(图8)[92]。
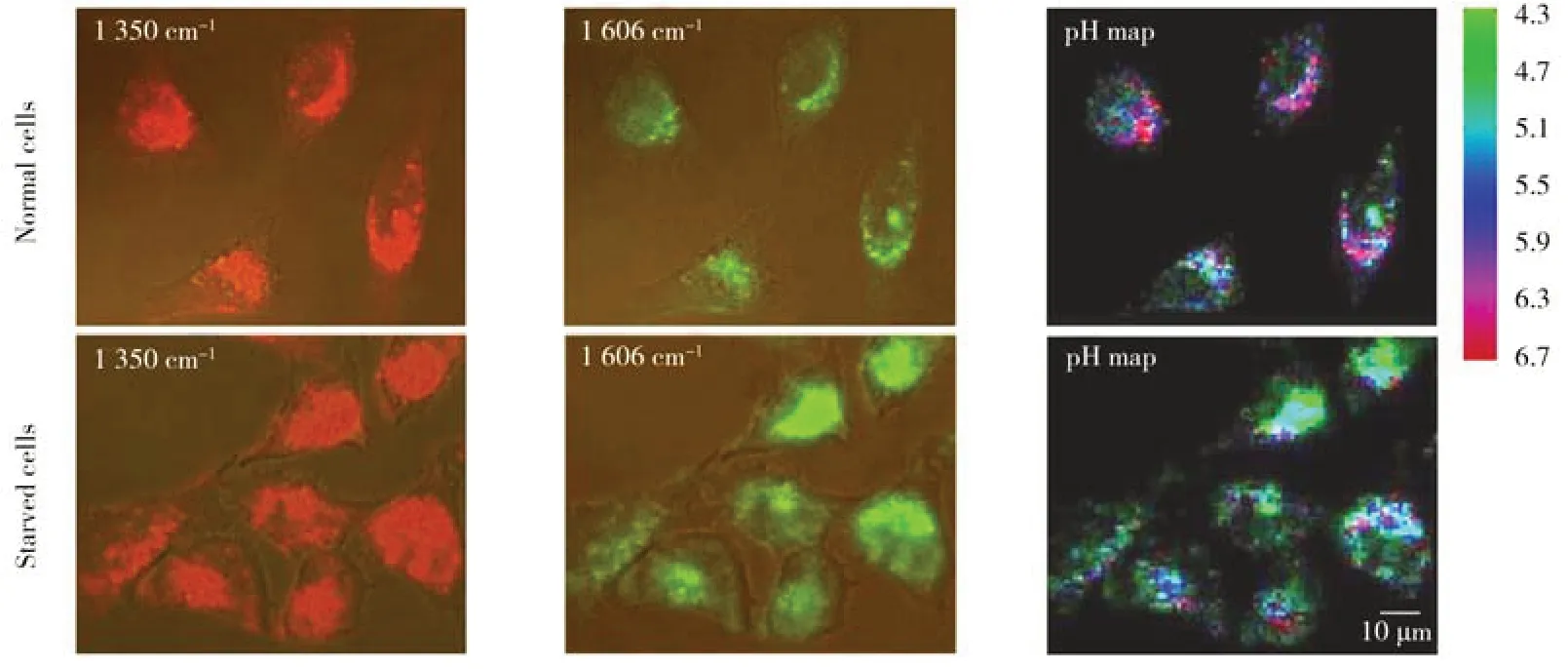
图8 HeLa细胞溶酶体内质子分布的AERS成像[92]Fig.8 AERS imaging of proton distribution in HeLa cell lysosomes[92]
3 总结与展望
细胞拉曼成像在生命科学和药物研究领域具有广阔的应用前景,其优点包括振动指纹传感的特异性和多色细胞成像的能力。各种细胞拉曼成像技术具有各自的特点(表2)。SERS 技术使用纳米颗粒作为探针,需要有效提升等离基元材料的性能重现性,并避免其对细胞的生理干扰。SRS 技术具有较高的细胞成像质量,但在一次测量中只能获取有限的拉曼探测波段信息,限制了其用于多色成像的便利程度。分子内共振拉曼技术借助小分子拉曼探针的化学结构设计,具有更大的灵活性。其灵活性不仅提供细胞成像所需的灵敏度,还提供了各种细胞器、胞内生物分子、离子等的靶向或响应位点,因此分子内共振拉曼技术也展现了细胞成像的应用潜力。将分子内共振拉曼技术与SERS、CRS、TERS 等相结合,是未来值得尝试的新方向,有可能进一步提高细胞成像的时间和空间分辨率。

表2 细胞拉曼成像技术总结Table 2 Summary of cell Raman imaging methods
目前拉曼成像技术主要处于实验室研究阶段,未来这些技术能否在医学基础研究甚至临床应用研究中发挥关键作用,将依赖于细胞拉曼成像的具体应用场景,并取决于相应的细胞拉曼成像技术攻关。这一重要目标的实现,需要相关交叉领域的研究者们未来共同携手努力。

