邻苯二甲酸二(2-乙基己基)酯致人脐静脉内皮细胞氧化损伤及白藜芦醇的修复作用
王子璇, 刘伟, 蔺博涵, 李涛, 杨琴, 虞绮雯, 朱伟, 孙晓春
(1. 江苏大学医学院, 江苏 镇江 212013; 2. 江苏大学第四附属医院妇女保健科, 江苏 镇江 212000)
邻苯二甲酸酯是一种广泛用于聚氯乙烯塑料中的增塑剂,可通过食物链和水循环进入人体[1]。邻苯二甲酸二(2-乙基己基)酯(di-2-ethylhexyl phthalate,DEHP)是最常见的邻苯二甲酸酯类型,通常存在于聚合物产品中,可使塑料变得柔韧。DEHP用于大量常见的家庭生活用品,例如包装食品和饮料、玩具、床垫、浴帘、雨衣、地砖以及化妆品和个人护理产品[2]。此外,DEHP还存在于许多医疗器械中,例如静脉袋、血袋、导管以及透析袋[3]。由于与塑料中的聚合物为非共价结合,DEHP逐渐从聚合物基质中释放到环境中,成为一种广泛存在的环境污染物,大量暴露于普通人群之中[4]。研究表明,DEHP通过促进氧化应激对细胞造成损伤[5],从而对肝脏[6]、肾脏[7]、神经系统[8]、生殖系统[9]等产生不良影响。作为一种高暴露率的毒物,DEHP在体内循环时间长,因此心血管系统很有可能受到DEHP的氧化损伤。
白藜芦醇是一种天然存在的多酚和植物抗毒素,富含于桑葚、葡萄和红酒中[10]。白藜芦醇以其作为活性氧清除剂的抗氧化特性而闻名,例如清除羟基、超氧化物和金属诱导的自由基[11]。此外,白藜芦醇因其在低等生物体中观察到的抗衰老作用以及抗癌作用而得到广泛关注[12]。
本研究拟观察DEHP在人脐带内皮细胞(human umbilical vein endothelial cells,HUVEC)中通过氧化应激途径造成细胞生物学特性的改变,以及白藜芦醇对该损伤的修复作用。
1 材料与方法
1.1 实验细胞与器材
HUVEC(中国科学院上海细胞库);DEHP(上海罗恩试剂公司);H-DMEM培养基、胎牛血清(德国Viva Cell公司);二甲基亚砜溶液(上海生工公司);胰酶(美国Gibco公司);细胞凋亡检测试剂盒、青霉素-链霉素溶液(上海碧云天公司);PBS溶液(北京Biosharp公司);丙二醛检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒、线粒体膜电位检测试剂盒(南京建成生物工程研究所);活性氧检测试剂盒(大连美伦生物);CCK8试剂盒(南京诺唯赞公司);抗Bax、Bcl-2抗体(美国Cell Signaling Technology公司);HRP标记羊抗兔IgG(上海爱必信公司);白藜芦醇(北京索莱宝公司);基质胶(上海康宁公司)。
实验所用CO2细胞培养箱为美国Thermo公司产品;倒置显微镜为日本Olympus公司产品;酶标仪为美国Biotek公司产品。
1.2 实验方法
1.2.1 细胞培养 HUVEC在H-DMEM培养基中培养,该培养基补充了10%热灭活胎牛血清、青霉素(100 IU/mL)、链霉素(100 mg/mL)和2 mmol/L L-谷氨酰胺,在37 ℃、5% CO2的加湿培养箱中进行培养。细胞保持对数生长期,每隔3~4 d传代1次。
1.2.2 CCK8实验检测细胞活性 将HUVEC接种到96孔板中24 h,然后添加不同浓度的DEHP(0、10、20、40和80 μmol/L)或白藜芦醇(0、5、10、20和40 μmol/L),24 h后将CCK8溶液(每孔10 μL)添加到96孔板中。细胞在37 ℃下孵育1 h,用酶标仪测定450 nm处的光密度。细胞增殖率=(实验孔光密度-空白孔光密度)/(对照孔光密度-空白孔光密度)。依据结果挑选出合适的处理浓度,使用CCK8试剂盒检测各组HUVEC处理后的细胞活性。
1.2.3 实验分组及处理 将DEHP溶解在DMSO中作为储备溶液,DEHP工作溶液在给药前即时制备。HUVEC细胞在板中培养24 h后,对照组用0.1% DMSO处理,损伤组和修复组加入80 μmol/L DEHP,继续孵育24 h。随后对照组和损伤组更换为正常培养液(0.1% DMSO),处理组更换为含有40 μmol/L白藜芦醇的培养液孵育24 h。
1.2.4 化学比色法检测丙二醛水平和SOD活性 按“1.2.3”的方案于12孔板中培养并收集细胞,用RIPA缓冲液裂解细胞,提取细胞总蛋白检测浓度后备用。根据试剂说明书操作,使用丙二醛检测试剂盒、SOD检测试剂盒检测HUVEC的丙二醛水平(nmol/mgprot)和SOD活性(U/mgprot)。每个样本设3个复孔,实验独立重复3次。
1.2.5 DHE探针检测活性氧水平 按“1.2.3”的方案于12孔板中培养细胞,使用无血清的DMEM高糖培养基稀释DHE探针使其终浓度为2 μmol/L,弃去板内培养基并用PBS清洗各孔1次,再于各孔加入含有探针的培养基500 μL,将细胞在37 ℃下孵育20 min。PBS洗涤3次后,立即将板放入荧光显微镜下进行荧光检测和拍照。
1.2.6 JC-1探针检测线粒体膜电位变化 按“1.2.3”的方案于12孔板中培养细胞,按照JC-1染液(200×)∶去离子水=1∶160的比例稀释JC-1染液,充分溶解并混匀,之后按混合液∶JC-1缓冲液(5×)=4∶1的比例加入JC-1缓冲液(5×)配置成JC-1工作液,弃去板内培养基并用PBS清洗各孔1次,将细胞在37 ℃下孵育20 min。使用JC-1缓冲液(1×)洗涤3次后,立即将板放入荧光显微镜下进行荧光检测和拍照。
1.2.7 划痕实验检测HUVEC迁移能力 按“1.2.3”的方案于6孔板中培养细胞,调整细胞浓度为5×105/孔,用200 μL的枪头对不同处理组的HUVEC垂直于6孔板划线,用PBS清洗划线脱落的细胞,加入无血清的H-DMEM培养液,用倒置显微镜观察划痕并拍照记录(0 h),继续放入37 ℃、5% CO2加湿培养箱中培养24 h,用倒置显微镜观察划痕(24 h)相对于0 h的愈合情况。通过Image J分析划痕面积,计算划痕愈合率。
1.2.8 Transwell迁移实验检测HUVEC迁移能力 将“1.2.3”中处理后的HUVEC进行消化,并用无血清H-DMEM细胞培养液重悬细胞,调整细胞种板数量为1×105个/小室并种于Transwell小室中。于24孔细胞培养板中按分组各加入600 μL含有10% 胎牛血清的H-DMEM细胞培养液,置于37 ℃、5% CO2加湿培养箱中12 h。取出小室后用PBS清洗2~3次,使用4%多聚甲醛溶液固定30 min,PBS清洗2~3次,使用结晶紫溶液于室温染色30 min,最后用PBS清洗2~3次,洗净残余物质后用棉签将上室细胞擦拭干净,室温晾干后在镜下随机观察小室底部细胞迁移情况,进行相应组别小室细胞的拍照与计数。
1.2.9 体外成管实验检测HUVEC体外成管能力 按“1.2.3”的方案培养细胞后,制备细胞悬液,调整细胞密度为1×106个/mL。按照每孔50 μL将细胞悬液滴加到预先涂有基质胶的96孔板中,分为对照组、损伤组和修复组。轻轻振荡,使细胞分布均匀,在培养箱中常规培养4 h。倒置显微镜观察拍摄细胞成管情况,Image J软件分析图片结果,定义至少3条管的交汇处为1个交点,以交点数目表示各组成管结果。
1.2.10 流式细胞实验检测HUVEC凋亡率 在6孔板中按“1.2.3”的方案培养细胞。处理结束后,用不含乙二胺四乙酸的胰酶消化并收集细胞。细胞用预冷的PBS漂洗2次后,用100 μL结合缓冲液重悬细胞,加入5 μL Annexin V-FITC和5 μL PI染色液室温避光孵育10 min。孵育结束后加入400 μL结合缓冲液,轻轻混匀。将对照组、损伤组和修复组细胞分别进行Annexin V-FITC和PI单染。于1 h内用流式细胞仪检测细胞样品,在双色流式细胞仪散点图上,早期凋亡细胞散在分布于右下象限,晚期凋亡细胞散在分布于右上象限。存活细胞和坏死细胞分别散布在左下象限和左上象限。凋亡率计算公式:凋亡率=早期凋亡率+晚期凋亡率。
1.2.11 蛋白质印迹实验检测HUVEC内凋亡相关蛋白表达 按“1.2.3”的方案培养细胞后,收集细胞,使用RIPA缓冲液裂解细胞,提取蛋白以供后续实验使用。配制电泳胶,于电泳设备中加入蛋白样本,70 V电泳30 h后加压至110 V继续电泳直至不同分子量蛋白分离,在200 mA下将蛋白转至PVDF薄膜上并使用BSA封闭液封闭2 h,相关一抗孵育过夜,标记二抗后于化学发光仪器中曝光后进行结果分析。
1.3 统计学分析
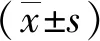
2 结果
2.1 DEHP浓度筛选和HUVEC细胞增殖能力变化
使用不同浓度的DEHP处理HUVEC 24 h后,80 μmol/L处理组的细胞增殖率为0.81±0.05,增殖率被明显抑制(t=5.18,P<0.01),其余各组未出现抑制现象,故选用80 μmol/L作为后续DEHP损伤的处理浓度。使用不同浓度白藜芦醇处理24 h后,各组HUVEC的细胞增殖能力均未受到抑制,参考先前研究白藜芦醇的处理浓度以及为了后续结果的显著性,选用40 μmol/L作为后续白藜芦醇修复的处理浓度。后续实验中,对照组细胞增殖率为1.00±0.02,损伤组为0.76±0.04,修复组为0.92±0.04,说明DEHP对HUVEC的增殖能力有抑制作用(t=5.41,P<0.01),同时白藜芦醇可以修复该种损伤(t=3.72,P<0.05)。见图1。

图1 不同浓度DEHP与白藜芦醇处理HUVEC后细胞增殖能力的比较
2.2 HUVEC内丙二醛水平和SOD活性变化
结果显示,相比对照组,损伤组HUVEC的丙二醛水平明显上升(t=10.81,P<0.01),SOD活性明显上升(t=6.29,P<0.01)。修复组相比损伤组,HUVEC的丙二醛水平明显下降(t=5.56,P<0.01),SOD活性明显下降(t=4.16,P<0.05)。见图2。
图2 HUVEC中丙二醛水平和SOD活性的变化
2.3 HUVEC中活性氧水平变化
结果显示,损伤组HUVEC的活性氧水平明显高于对照组(t=10.16,P<0.01),修复组HUVEC的活性氧水平明显低于损伤组(t=6.55,P<0.01)。见图3。

图3 各组HUVEC中活性氧水平的变化(×400)
2.4 HUVEC中线粒体膜电位变化
结果表明,损伤组HUVEC细胞的线粒体膜电位相比对照组有明显损失(t=21.72,P<0.01),而修复组HUVEC细胞的线粒体膜电位相比损伤组有明显上升(t=13.64,P<0.01)。见图4。

图4 各组HUVEC中线粒体膜电位的变化(×400)
2.5 HUVEC迁移能力变化
损伤组HUVEC的划痕愈合能力相较于对照组明显下降(t=7.71,P<0.01),修复组HUVEC相较于损伤组该能力得到了较大提升(t=7.22,P<0.01)。损伤组HUVEC在Transwell小室中迁移能力相较于对照组明显下降(t=10.47,P<0.01),修复组HUVEC相较于损伤组该能力得到了较大提升(t=8.64,P<0.01)。见图5、图6。

图5 各组HUVEC划痕愈合能力的变化(×100)

图6 各组HUVEC在Transwell小室中迁移能力的变化(×200)
2.6 HUVEC血管形成能力变化
对照组与修复组细胞多为拉长的梭形,互相连接成网状,形成的管状结构在6 h时趋于稳定,随着时间的延长逐渐崩解。损伤组细胞有较多孤立的圆形、卵圆形,散乱分布在视野中。量化结果后,损伤组分支点形成数明显低于对照组(t=8.93,P<0.01),而修复组分支点形成数明显高于损伤组(t=8.88,P<0.01)。见图7。

图7 HUVEC血管形成能力的变化(×100)
2.7 HUVEC凋亡情况
细胞流式实验结果表明,损伤组HUVEC细胞凋亡率相较对照组明显升高(t=20.50,P<0.01),修复组HUVEC细胞凋亡率相较损伤组明显下降(t=13.97,P<0.01)。蛋白质印迹实验结果表明,损伤组HUVEC相较对照组,Bax表达水平升高(t=4.02,P<0.05),Bcl-2表达水平下降(t=5.07,P<0.01),Bcl-2/Bax比值下降(t=18.55,P<0.01);修复组HUVEC相较损伤组Bax表达水平下降(t=3.04,P<0.05),Bcl-2表达水平上升(t=3.47,P<0.05),Bcl-2/Bax比值上升(t=30.76,P<0.01)。见图8、图9。

图8 HUVEC细胞凋亡率的变化
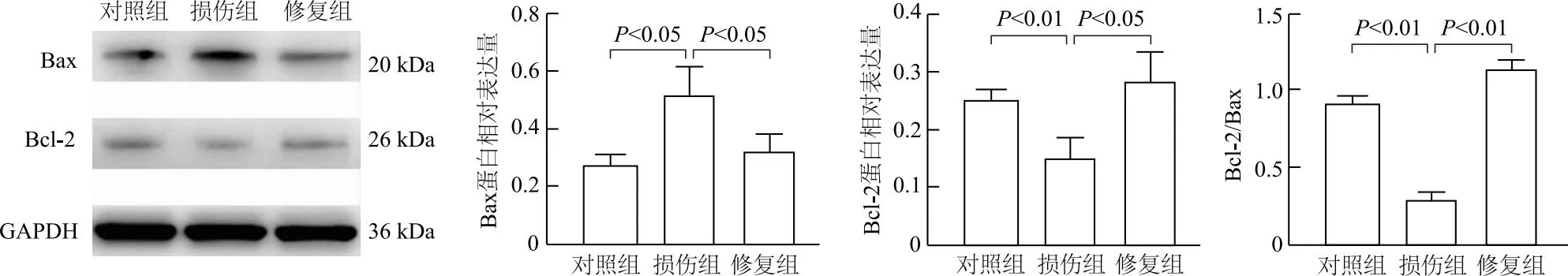
图9 HUVEC凋亡相关蛋白相对表达的变化
3 讨论
DEHP是美国食品和药物协会批准的医疗器械中最常用的增塑剂,应用于储血袋、管道回路、肠内营养管、气管插管等[3]。生活中进入人体的DEHP的量与生活方式和医疗器械的使用情况相关,接受医疗措施患者的血液DEHP浓度往往较高[13]。DEHP可对人体造成多种损伤,如甲状腺损伤、肝脏损伤、神经系统损伤和生殖系统损伤等[14]。本文以HUVEC为观察对象,研究DEHP对心血管系统的不利影响。
氧化应激是由自由基在体内产生的一种负面作用,自由基可以直接或间接氧化或损伤DNA、蛋白质和脂质,进而诱发基因突变、蛋白质变性和脂质过氧化[15]。细胞膜中脂质过氧化的增加还可能引发基因表达量的改变,从而引发细胞凋亡[16]。丙二醛是由活性氧和自由基诱导的脂质过氧化的最终产物之一,其水平反映细胞氧化损伤程度[17-18]。线粒体在启动细胞凋亡中至关重要,过氧化氢可诱导线粒体通透性增加、线粒体膜电位破坏,从而诱导细胞的凋亡[19]。
本研究建立了DEHP暴露后的HUVEC体外模型,模拟DEHP在进入人体后对心血管系统造成损伤的微环境,初步探究了DEHP对HUVEC损伤的机制。结果显示,相较于对照组,损伤组中HUVEC的活性氧和丙二醛水平明显升高,SOD活性明显增强,线粒体膜电位水平明显下降,这说明DEHP对HUVEC造成了氧化损伤,使HUVEC处于氧化应激状态。损伤组HUVEC的Bax表达量上升,Bcl-2表达量下降,Bcl-2/Bax比值下降,这说明DEHP对HUVEC的氧化损伤,通过改变HUVEC中凋亡相关蛋白的表达,诱导细胞凋亡。多项实验结果表明,DEHP对HUVEC的氧化损伤抑制了HUVEC的增殖、迁移和血管形成等能力。
白藜芦醇是具有生物学活性的多酚类化合物,由于其分子结构中含有羟基基团,是天然的自由基清除剂[20],研究表明白藜芦醇具有保护心血管的功能[21]。本研究中在DEHP损伤HUVEC后使用白藜芦醇进行修复。相较于损伤组,修复组HUVEC中的活性氧被白藜芦醇有效清除;丙二醛水平和SOD活性下降,线粒体膜电位回升,说明白藜芦醇的抗氧化作用有效缓解了HUVEC的氧化应激状态。凋亡相关蛋白结果表明,白藜芦醇的抗氧化作用一定程度上抑制了HUVEC的凋亡。
综上所述,本研究初步证明了DEHP可通过氧化应激途径抑制HUVEC的增殖、迁移和成管能力并诱导其发生凋亡,同时白藜芦醇可以发挥其抗氧化作用以修复该种损伤。由于氧化应激涉及的信号通路十分复杂,体内实验研究尚未完善,DEHP在体内组织中的代谢、代谢产物对心血管系统影响的具体机制以及白藜芦醇对该类损伤的修复作用还有待进一步研究。

