植物类外泌体样纳米颗粒特性、成分与功能研究进展
陈春苹 徐红艳, 刘帅辰 田雨欣 王羽琛
(1. 延边大学融合学院,吉林 延吉 133002;2. 延边大学农学院,吉林 延吉 133002)
植物细胞以传递性或调节性方式分泌的纳米级囊泡,即类外泌体样纳米颗粒(exosome-like nanoparticles,ELNs),是细胞间重要的通信工具[1]。根据生物发生机制(图1),可分为3类:① 外泌体:直径为30~150 nm,来自细胞的胞内体;② 微囊泡:直径100~1 000 nm,由质膜向外释放(出芽)产生;③ 凋亡小体:直径1 000~5 000 nm,由凋亡细胞释放[2]。外泌体和微囊泡的生物发生并不是严格分开的,可以同时形成,并且两者在物理性质和组成上差异较小[3],它们常被称为“纳米囊泡”“微囊泡”“外泌体”或“外泌体样囊泡”。国际细胞外囊泡协会(international society for extracellular vesicles,ISEV)号召对植物ELNs研究要标准与严谨[4],从植物源分离的粒径在1 000 nm以下的纳米级囊泡,将其称为植物ELNs。
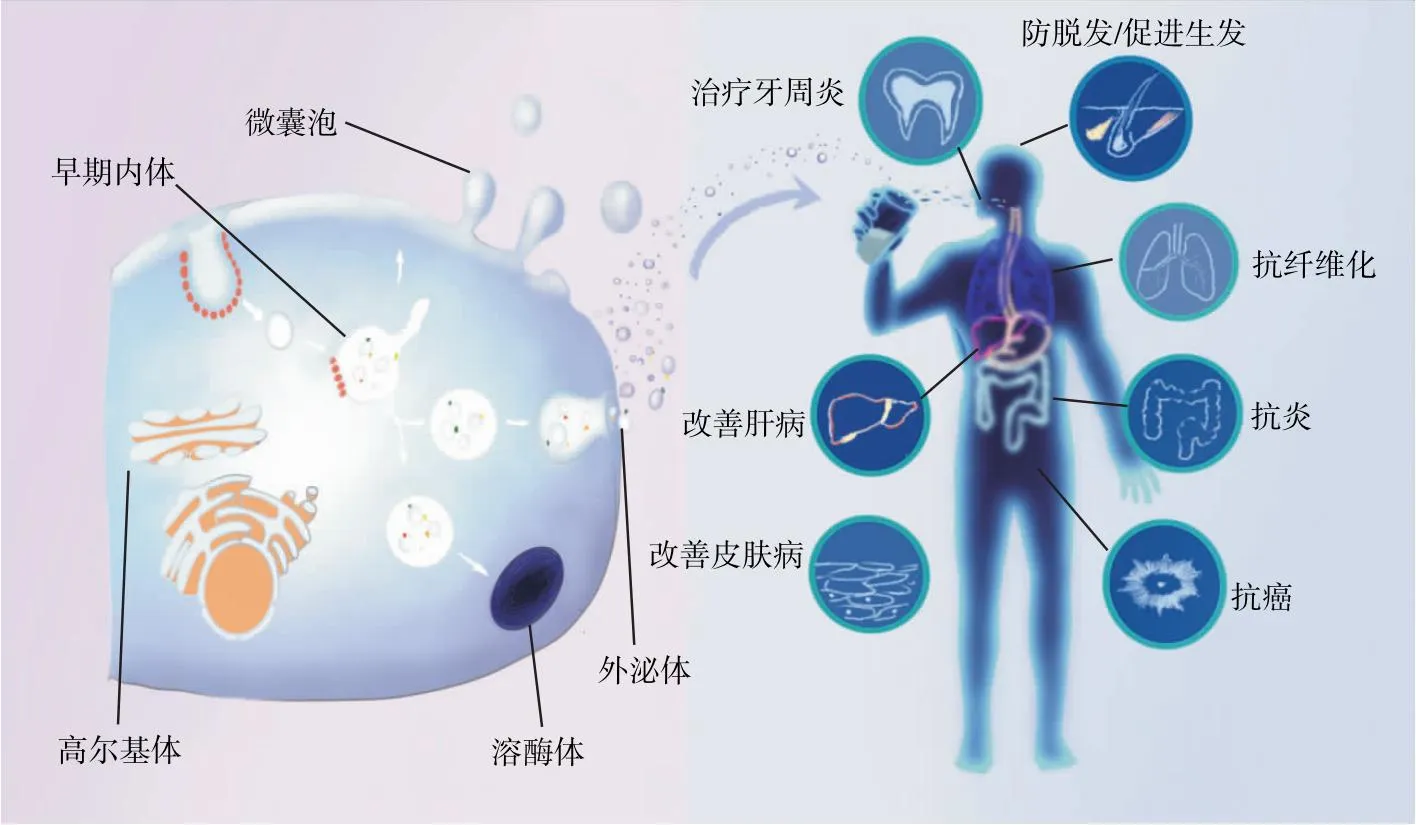
图1 植物ELNs的形成及其作为生物药物在预防和治疗各种疾病中的应用
近年来,随着动物ELNs在诊断、治疗、药物载体等领域的广泛应用,植物ELNs的功能作用也越来越受关注[5-6]。与动物ELNs相比,植物ELNs具有来源广、可大量获取等优点。植物ELNs具有种间“通信”能力,可在动物疾病模型中发挥治疗作用(图1)。一方面是由于其本身存在的生物活性物质。Deng等[7]从西兰花中分离出ELNs,证明其可作用于肠道上皮细胞并维持肠道免疫稳态。另一方面,植物ELNs也可以用作药物载体,如装载miRNAs、蛋白质和其他药物,低免疫原性的特点和表面特殊的成分可促进其进入器官、组织和细胞[8-9]。Xu等[10]发现人参ELNs可将装载的miRNAs转移到骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs),促进BMSCs的神经分化;与番茄ELNs相比,葡萄ELNs表现出更好的负载外源性蛋白Hsp70并递送到神经胶质瘤细胞的能力[11]。因此,含有活性成分和可作为载体的植物ELNs具有较好的研究前景。文章拟总结近年来植物ELNs的分离方法、特性、组成成分及功能,以期为植物ELNs的功能食品开发提供理论参考。
1 植物ELNs的分离
依据植物ELNs的大小、形态、表面标志物等特征,其常见的分离方法主要有超速离心、蔗糖密度梯度离心、超滤、聚合物沉淀、免疫亲和、体积排阻色谱、微流体技术、亲和捕获和非对称流场流分馏技术等(表1)。目前,大多采用超高速离心法和蔗糖密度梯度离心法分离并纯化植物ELNs[7,10-11],但存在ELNs受损、纯度低、耗时长等缺点。近年来,新兴技术(微流体、电、声、力等)逐渐被用于ELNs的分离,并表现出相对更好的分离效果,但仍不完善[12-13]。因此,植物ELNs不同的分离方法具有不同的优点和局限性,分离技术的选择取决于样品的性质和后续试验需求。
2 植物ELNs的特性
2.1 稳定性
超高速离心法被称为ELNs提取的“金标准”[14]。但反复超高速离心会造成ELNs损伤,影响其生物活性[14-15]。植物ELNs提取后,悬浮于PBS缓冲液中,短期保存于4 ℃,长期贮藏于-80 ℃,需避免反复冻融。4 ℃条件下,百合、黄精和天麻ELNs随贮藏时间延长,粒径逐渐增大,可能发生了颗粒聚集;但在-80 ℃环境下,粒径均未发生明显变化[16]。化学解构剂Triton X-100和超声可破坏ELNs的磷脂膜,使其结构不完整。Triton X-100处理后人参ELNs的粒径无法测得,且诱导巨噬细胞极化的能力被显著降低[14]。此外,超声处理也降低了植物ELNs的抗氧化活性和细胞内吞能力[16]。综上,植物ELNs的稳定性受其提取方法、贮藏条件和结构完整性的影响。
2.2 耐酸性
在胃肠道溶液中保持稳定性是植物ELNs可以口服的前提。分别在水、0.5 mol/L HCl和0.5 mol/L NaOH溶液中37 ℃孵育30 min,相较于中性和碱性溶液,葡萄柚ELNs在酸性溶液中粒径分布最均匀。胃液中不仅具有低pH,还存在多种消化酶[17-18]。体外模拟消化评估生姜ELNs的消化稳定性[19-20],其粒径在模拟胃液中增加,在模拟小肠液中则进一步增大;同时,在模拟胃液中,Zeta电位从负变为正,而在模拟小肠液中,Zeta电位从正向负转变;活体成像和器官成像结果也表明其主要富集在结肠组织,表明生姜ELNs可通过低pH的胃到达高pH的结肠中。综上,植物ELNs在酸溶液中粒径更稳定。
2.3 内含物差异性
植物ELNs含有脂质、miRNAs和蛋白质等生物活性成分。同一品种不同大小叶片的茶叶ELNs,液相色谱与串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)结果表明脂质组成具有差异性,但都主要为磷脂酸(PA,占总脂质的32.7%~45.7%)、磷脂酰甘油(PG,占总脂质的19.3%~22.7%)和磷脂酰肌醇(PC,占总脂质的13.6%~19.2%)[21]。植物ELNs含有多种miRNAs,但不同物种的miRNAs类型和水平与其来源有关。11种果蔬ELNs样本中,共鉴定418种miRNAs,每个物种分别含有32~127种;其中生姜ELNs的miRNAs种类最少(n=32),大豆ELNs的miRNAs种类相对较多(n=127)[22]。与柠檬的蛋白质数据库相比,柠檬ELNs的蛋白质种类的覆盖率达到84%[23]。因此,植物ELNs的内含物具有差异性。
2.4 低免疫原性
植物ELNs的功能作用取决于多种因素,包括来源、组成成分、验证模型和给药途径等。在果蔬中分离得到的植物ELNs,例如葡萄[24]、葡萄柚[25]、生姜[19-20,26]、柠檬[17]、西兰花[7]、胡萝卜[27]、椰子[28-29]、苹果[30]、人参[31]和蓝莓[32],不携带人畜共患病原体,具有安全可靠、副作用小、生物利用度高等优点。肠黏膜免疫系统在食物(如植物ELNs)导致的不良反应方面起着重要作用[33]。从葡萄柚中分离的ELNs可以被肠道巨噬细胞选择性吸收,从而改善葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)诱导的结肠炎。柠檬ELNs通过胃肠道转运入血液中并送达肾区,阻断草酸钙结石诱导的细胞内质网应激反应,将受激的胞内钙信号恢复稳态,改善肾结石[34]。此外,植物ELNs可作为药物载体,相比人造纳米载体[例如基于共聚物的纳米颗粒、金属基纳米颗粒(金/银)和碳基纳米颗粒],具有低免疫原性[35-37]。用葡萄柚或生姜ELNs装载药物后不会增加炎性因子或转氨酶的表达水平,也不会引起组织病理学损伤[38-39]。不同的给药途径也会影响ELNs的安全。口服植物ELNs不会影响试验动物的生理生化指标,也不会引起局部或全身毒性[20,24],但其他给药方式是否具有危险性目前仍不清楚。综上,植物ELNs安全性仍然缺乏证据,还需要进一步研究。
2.5 生物相容性
众所周知,食物对哺乳动物细胞稳态的调节有很大的影响,特别是消化系统中的细胞。天然来源的植物ELNs,因其可逃避免疫系统分解的生物相容性而受到关注,并且其跨物种传递“信息”的功能也得到了广泛关注。芦荟ELNs在人类皮肤细胞上表现出良好的细胞相容性,通过激活Nrf2信号通路促进伤口愈合[40]。ELNs能在细胞间通信,可能是自身的miRNAs、脂质和蛋白质等生物活性物质在发挥作用。生姜ELNs中的脂质可通过抑制NLRP3炎症小体活化,治疗慢性牙周炎[41];黄豆ELNs中的miRNA-5781可以直接靶向白细胞介素-17A,在炎症反应中起重要作用[22];大蒜ELNs的表面配体(II凝集素)与HepG2细胞上的CD98糖蛋白结合并介导ELNs的内化以发挥抗炎作用[42]。植物ELNs不仅可跨物种与动物交流“信息”,还可以与微生物交流。拟南芥ELNs中siRNA能够跨物种运输进入疫霉菌,抑制疫霉菌的生长[43]。综上,植物ELNs可跨物种传递“信息”,具有一定的生物相容性。
2.6 靶向性
植物ELNs的囊泡状结构使其可以装载脂溶性物质、核酸或蛋白质等,通过ELNs表面受体或胞吞作用与靶细胞膜融合将“货物”释放到细胞质中来发挥作用[44]。柠檬ELNs可通过特异性靶向肿瘤部位,激活TRAIL信号通路引发细胞凋亡,抑制癌细胞增殖[45]。西兰花ELNs可作用于肠道树突状细胞,靶向效应器核糖体蛋白S6激酶1调节mTOR信号通路,激活树突状细胞AMPK以释放炎症因子,维持肠道免疫稳态[7]。Kalarikkal等[46]通过提取生姜以及柚子来源ELNs中的miRNAs,筛选出22个可能针对SARS-CoV-2基因组的miRNAs,发现其中11个miRNAs对SARS-CoV-2具有绝对的靶向性。综上,植物ELNs具有多组分,分别可与受体发生特异性识别,具有靶向性。
3 植物ELNs的成分分析
植物ELNs可将自身生物活性物质运输到特定部位并发挥作用(图2)[10,12,44]。随着测序和质谱技术的不断发展,涌现出的脂质组学、转录组学和蛋白质组学等技术能够在不同维度上反映植物ELNs的组成成分,多组学探究植物ELNs的功能逐渐成为研究热点。通过组学对植物ELNs在分子水平进行探究,可为植物ELNs的结构、功能和应用等方面提供参考。
3.1 脂质分析方法及功能
脂质主要存在于植物ELNs双层磷脂膜上,常用有机溶剂法提取,如Folch法、Bligh-Dyer法和Matyash法等。脂质分析方法主要有薄层色谱法(thin-layer chromatography,TLC)和LC-MS/MS。TLC是最早运用在脂质组学中的色谱工具,分析步骤主要包括薄层板的制备、点样、展开、显色和分析。Bokka等[47]通过TLC证明了番茄ELNs中含有磷脂酰丝氨酸(PS)、PA、PC和磷脂酰乙醇胺(PE)。但TLC检测范围小,灵敏度较低。目前,LC-MS/MS在植物ELNs的脂质分析中应用较多(表2)。通过三重四极杆质谱仪分析确定生姜ELNs富含PC(占比47%)[41];电喷雾电离三重四极杆质谱仪对大蒜ELNs进行脂质鉴定,发现其主要含有PC(占比43%)和PE(占比33%)[48]。

表2 脂质组学在植物ELNs功能研究中的应用
脂质对ELNs有直接的保护作用。脂质主要位于ELNs的外层膜上,可保护内含物抵御外界环境的变化,温度、pH、模拟生理环境和超声等[33]。体外模拟消化表明植物ELNs在胃液中较稳定,可被肠道微生物或者肠道上皮细胞吸收[17]。被荧光染料标记后蓝莓和大蒜ELNs主要富集在结肠组织[32,48]。植物ELNs中主要为磷脂类脂质,对机体也可发挥间接调控作用,如抗炎、抗癌、调节肠道菌群等功能(表2)。生姜ELNs中的脂质通过作用于原代骨髓巨噬细胞(bone marrow derived macrophage,BMDM)的NLRP3炎症小体,发挥抗炎作用[49];大蒜ELNs中的PA可与脑酸溶性蛋白1(BASP1)发生作用,使更多钙调素被招募到BASP1,导致缺乏维持c-Myc活性所需的c-Myc/钙调素复合物的形成,抑制脑小胶质细胞中的c-Myc基因的激活,从而抑制c-GAS/STING炎症通路相关因子表达[48];磷脂也可影响植物ELNs在肠道中的存在时间和积累程度,改变肠道菌群的丰度[53]。综上,脂质是植物ELNs的重要成分,对内含物有直接的保护作用和间接的功能作用。
3.2 miRNA分析方法及功能
miRNA是高效的基因表达调控因子,不仅在机体内执行生物学功能,还可跨界调控基因表达[43]。植物ELNs中的miRNA相对分子质量小、含量低,磷脂双分子层保护其不被降解[32]。微量RNA提取试剂盒或ELNs-RNA提取专用试剂盒可用来提取植物ELNs中的RNAs。琼脂糖凝胶电泳对RNAs进行表征是比较传统的方法。通过提取蓝莓RNAs,1%琼脂糖凝胶电泳表明其主要含有小相对分子质量RNAs[32]。测序技术可对miRNA定性和定量,并通过靶基因预测植物ELNs的功能作用(表3)。

表3 测序技术在植物ELNs功能研究中的应用
植物ELNs中的miRNAs可跨物种进入细胞。通过ExoGlow RNA EV试剂盒标记生姜ELNs的RNA,激光共聚焦显微镜下观察到RNA穿过BMDM细胞膜被运输到细胞核附近[52]。植物ELNs的miRNAs具有抗炎、抗癌、抗氧化以及改善神经性退行性疾病等作用(表3)。Xiao等[22]对11种果蔬ELNs进行miRNA测序,生物信息学分析表明可靶向编码炎症相关基因(如白细胞介素-6、白细胞介素-2、白细胞介素-5和白细胞介素-1)和癌症相关基因(如小细胞肺癌、子宫内膜癌和结直肠癌等)。因此,植物ELNs的miRNA可跨物种发挥作用,具有调节基因表达影响机体功能的作用。
3.3 蛋白质分析方法及功能
蛋白质的传统表征方法有聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)和Western Blot。SDS-PAGE可以鉴定出是否具有蛋白质以及蛋白质相对分子质量区间,但不能确定含有的蛋白质种类。Western Blot可对ELNs的标志蛋白(CD9、CD81等)进行鉴定,但目前植物ELNs的标志蛋白尚未统一。蛋白质组学可以在一定水平上探究蛋白质的特征,包括蛋白质的表达水平、翻译后的修饰、蛋白与蛋白相互作用等,定性和定量分析某些关键蛋白,来获得对蛋白质水平上的疾病发生及细胞代谢等过程的整体认识,并且结合生物信息学方法对关键蛋白功能进行挖掘,揭示植物ELNs的生理病理功能。常用于植物ELNs蛋白质组学的研究方法有LC-MS/MS、纳米高效液相色谱—电喷雾电离(ESI)—质谱分析、鸟枪法和标记技术等(表4)。

表4 蛋白组学在植物ELNs功能研究中的应用
蛋白质浓度和囊泡数量可以用来评估ELNs的纯度[54]。囊泡数量与蛋白质浓度的比值越高,表明提取到的ELNs纯度越好。ELNs磷脂膜结构的稳定性也与蛋白质的含量和存在位置有关(表4)。较高含量的膜相关蛋白会增加离子和水分子的转运,维持囊泡结构的稳态[12]。植物ELNs中的蛋白质主要来源于胞质,多数为膜相关蛋白[23,51,61-62]。西兰花ELNs中的水通道蛋白与囊泡的稳定性和通透性有关[58]。通道蛋白也可影响植物ELNs的贮藏稳定性[63]。此外,植物ELNs中的蛋白也可在生理代谢、信号传导等方面发挥作用。植物ELNs磷脂膜表面的蛋白配体,可促进机体识别并摄入ELNs。大蒜ELNs的表面配体(II凝集素)与HepG2细胞上的CD98糖蛋白结合并介导大蒜ELNs的内化以发挥抗炎作用[42]。综上,植物ELNs中蛋白含量丰富,多数为膜蛋白,可维持ELNs结构的稳定以及作为生物活性成分发挥作用。
3.4 其他活性物质
植物ELNs还含有糖类、酯类和酚类物质等。西兰花ELNs中的莱菔硫烷通过激活AMPK,导致树突状细胞发生耐受并改善结肠炎[7]。生姜ELNs中的6-姜醇可激活核因子Nrf2从而改善小鼠酒精性肝损伤[19]。苹果衍生的ELNs含有的类黄酮和呋喃香豆素,被证明具有抗菌作用[64]。来自生姜的ELNs含有姜黄素类似物6-姜辣素和6-大黄素,具有抗氧化的作用[64-65]。草莓ELNs富含花青素、叶酸、黄酮醇和维生素C,对BMSCs没有细胞毒性,并且以剂量依赖性方式预防BMSCs的氧化应激[54]。柠檬和柑橘ELNs具有多种黄酮类化合物,例如柠檬黄素、槲皮素、维西宁-2、柚皮苷、橙皮苷和柠檬苦素等,这可能使其发挥抗炎作用[53]。综上,植物ELNs似乎具有多种组分,充分体现了多靶点、多功能的特点。
4 结论及展望
植物类外泌体样纳米颗粒(ELNs)含有脂质、miRNA、蛋白质等生物活性成分,具有一定的稳定性、耐酸性、内含物差异性、低毒性以及较好的生物相容性和靶向性,多组学分析技术也逐渐应用在植物ELNs的功能研究上。但相较于动物ELNs,植物ELNs研究仍具有很大的发展空间。关于植物ELNs的研究仍存在以下问题:① 植物ELNs的表征主要是通过形貌观察以及组分进行确定,关于其标志性蛋白尚未统一;考虑到未来更进一步在临床上的应用,其纯度也需要作为表征因素之一。② 由于植物ELNs的形成通常受到植物的季节性和区域性因素的限制,并且长期的田间培养是一个耗时费力的过程,可尝试组织培养技术来提供持续、稳定和可大量分离植物ELNs的解决方案。③ 植物ELNs具有多种组分,可通过多组学联用的方法,多角度去探究功能。虽然目前植物ELNs存在较多未知与挑战,但其在生物相容性、治疗能力、靶向能力和细胞摄取等方面也显示出许多优势,可通过多学科交叉融合,开发为多种常见疾病的可靠治疗剂。

