医用镁合金表面氟化改性的研究现状及演进方向*
冀盛亚,常 成,常帅兵,倪艳荣,王 雷
(1.河南工学院 电缆工程学院,河南 新乡 453003;2.河南工学院 车辆与交通工程学院,河南 新乡 453003;3.河南工学院 电气工程与自动化学院,河南 新乡 453003)
0 引言
作为人体所必须的营养元素,镁不但参与600多种酶的合成,而且可以改善人体中胰岛素的稳定性,促进糖类正常代谢,降低冠心病及高血压的患病机率[1]。凭借着良好的生物安全性(植入医用镁合金后的人体没有出现明显的过敏、炎症和排斥反应,无生物毒性)、生物相容性(医用镁合金的屈服强度、弹性模量与自然骨最为接近,能有效避免“应力屏蔽效应”的发生)[2]及可贵的自降解性能[1],医用镁合金有望在骨植入、心血管支架等领域成为传统惰性金属植入材料(不可降解的钴铬钼合金、钛合金、不锈钢材料、镍钛合金)的最佳替代者。作为心血管支架,可以有效改善心肌供血。作为骨植入材料不但可以有效治愈骨组织损(创)伤,减轻患者病痛,而且可以提高患者的生活品质。
近年来,随着医疗技术的成熟及多年的市场培育,骨组织损(创)伤患者对医用骨植入材料的心理接受度不断提高。中商产业研究院公布的数据显示[3],2016~2020年我国骨植入材料应用年均复合增长率为17.7%(从191亿元增长至367亿元)。在可预见的未来,中国对高端医用骨植入材料的需求仍将持续增长。
然而,过高的降解速率严重降低了医用镁合金在人体中的有效服役期限(在37℃模拟体液中的有效服役期为3~6个月或降解速率≤0.5 mm/年)[4-5],短期内加速释放的过量H2(镁的降解析氢反应)形成的皮下气囊不但会引发局部炎症,也阻滞了植入体上细胞的增殖与粘附,成为制约医用镁合金临床应用的瓶颈因素。
表面改性处理简单、经济,已成为当前调控医用镁合金降解速率、限制析氢数量的有效手段,不但能够在医用镁合金植入人体的早期有效减缓其降解速率,从而避免了合金元素的大量溶出及碱性环境对植入体周围细胞、组织的毒副作用,同时,也为植入部位提供了足够的力学支撑,促进患处组织修复和功能重建。
相对于表面结构改性(离子注入法[6-8]、强流脉冲电子束(HCPEB)表面改性[9-12])、表面涂覆或沉积转化涂层(阳极氧化涂层[13]、微弧氧化涂层[14-17]、生物陶瓷活性涂层[18-20]、可降解高分子聚合物涂层[21-23]、溶胶凝胶涂层[24])等表面改性技术,氟化物涂层制备工艺简单、成本低廉、涂层与医用镁合金基体结合紧密(氢氟酸(HF)与合金表发生化学反应)、耐蚀性好(涂层结构致密),赢得国内外众多学者的青睐和重视。
1 医用镁合金氟化物涂层的组织及性能特征
氟化处理是将医用镁合金浸没在HF溶液中,在试样表面生成MgF2涂层(见图1)的一种表面改性工艺[25]。由于MgF2涂层结构致密,不但有效地阻滞了Cl-向基体的渗入,而且成为基体(α-Mg)与金属间化合物(第二相)之间的屏障,减弱了医用镁合金的微电偶腐蚀效应,有效降低了合金降解速率[26-27]。氟化处理后镁及镁合金在不同腐蚀介质中的性能分析见表1,由表1可知,氟化处理可明显改善镁及镁合金的耐蚀性能。
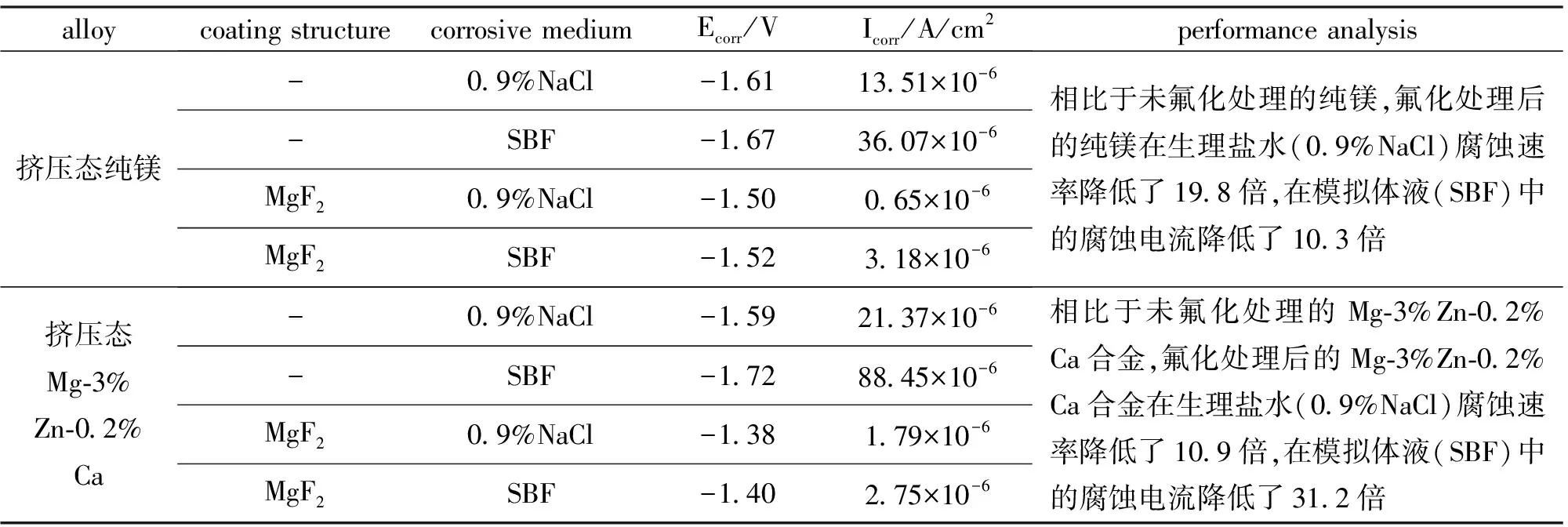
表1 纯镁及镁合金氟化处理后在不同腐蚀介质中性能分析[25]

图1 纯镁氟化处理后:(a)SEM照片; (b)EDS分析; (c)XRD分析[25]
作为人体所必须的微量元素,氟不仅存在于脾、肾等人体器官中,也存在于牙齿、骨骼等人体组织中。适量的氟不但可以改善人体内分泌系统,还有助于骨钙的沉积,促进成骨[28-29]。YAN[30]研究发现,MgF2涂层具有良好的生物安全性(对骨髓间充质干细胞(BMMSCs)无毒性)。将氟化处理过的医用镁合金试样浸没于仿生血浆中,试样表面会生成羟基磷灰石,让MgF2涂层展现出优异的生物相容性。LALK M等[31]将医用镁合金(AX30)植入白兔股骨中,发现制备有MgF2涂层的镁合金更易整合到骨骼中,具有更好的生物相容性。YU等[32]研究发现,MgF2涂层不但增强了镁合金(AZ31)支架的耐蚀性,而且有利于大鼠骨髓基质细胞(rBMSCs)的附着、增殖及成骨化。毛琳等[33]研究发现镁合金(JDBM)表面的纳米(200~300nm)MgF2涂层可以将合金的腐蚀速率降低20%,纳米级鳞片状的MgF2涂层也促进了内皮细胞的粘附与增殖,有利于提高血管支架材料的组织相容性。
资料显示[34-35],氟化处理对镁合金降解速率的阻滞效应取决于氟化物涂层的厚度,涂层越厚,阻滞效应越明显。表2是HF浓度及浸没时间对镁合金(AZ31)耐蚀性能的影响,由表2可知,制备时间的延长、制备浓度的提高均有利于提高涂层厚度(对比图2(b)(d)~(f))及耐蚀性能。BARAJASA J D等[35]发现,镁合金表面氟化物涂层的厚度随制备时间的延长呈抛物线型增长,但过长的制备时间(10 vol% HF,制备时间≥72h) 会导致涂层表面出现贯穿涂层的微裂纹(如图2(e)(f)),这些微裂纹加剧了合金的点蚀,同时,点蚀产生的腐蚀产物又导致氟化物涂层从基体上剥落。同时,BARAJASA J D等[35]认为,经HF酸处理后,镁合金(AZ31)表面生成的涂层成分主要由O和F两种元素组成,两元素在整个涂层上分布均匀,涂层成分的化学式为Mg(OH)2-xFx。
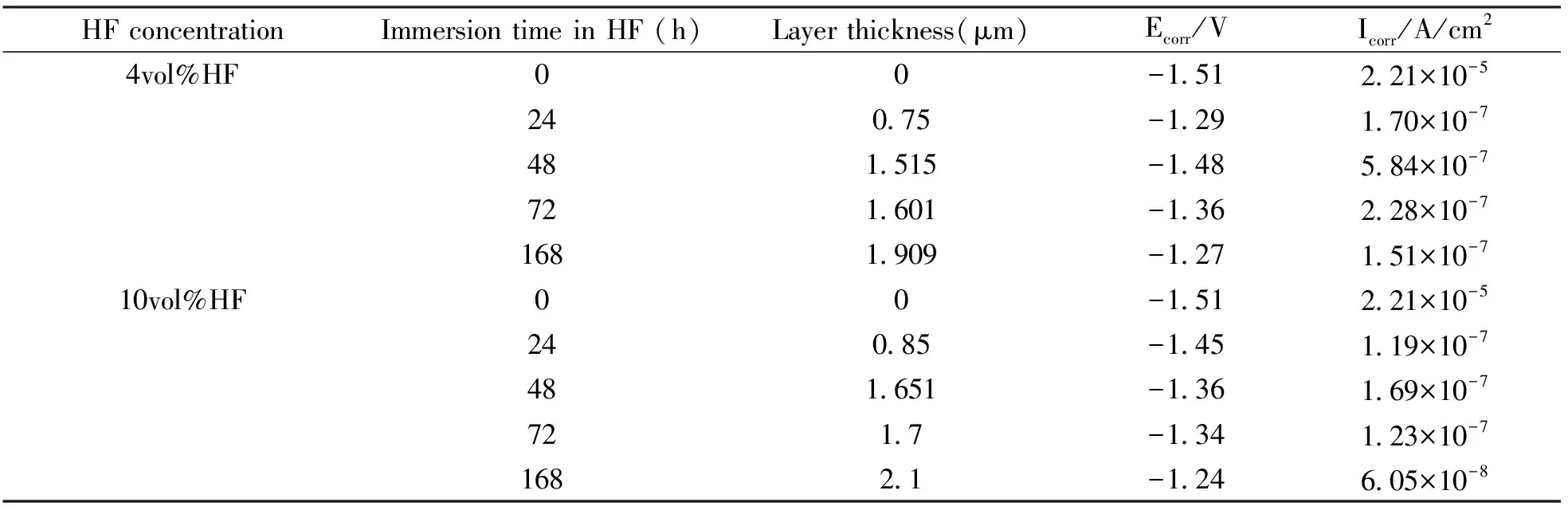
表2 HF浓度及浸没时间对镁合金(AZ31)耐蚀性能的影响[35]

图2 镁合金(AZ31)试样在不同浓度HF酸处理后的扫描电镜图片及EDX分析:(a)4 vol% HF, 24h; (b)4 vol% HF处理24h后的试样纵剖面; (c)10 vol% HF, 24h; (d)10 vol% HF处理24h后的试样纵剖面; (e)10 vol% HF处理72h后的试样纵剖面; (f)10 vol% HF处理168h后的试样纵剖面; (g)10 vol% HF处理168h后的试样纵剖面; (h)10 vol% HF处理168h后的试样纵剖EDX分析[35]
张春艳等[36]发现,在Hank’s仿生液中,氟化物涂层对医用镁合金耐蚀保护随浸没时间的延长而降低,贯穿涂层内部的微孔导致合金表面易发生点蚀。浸没第15min,合金表面即发生小孔侵蚀;浸没的第7d,小孔表面区域的涂层发生穿透溶解;浸没第15d,小孔周边发生明显的点蚀,镁合金腐蚀加速。
可见,单一氟化物涂层虽然能明显延缓医用镁合金的降解速率,但氟化物涂层较薄的厚度、涂层微孔的不可避免决定了单一涂层有效保护时间的短暂性,而氟化物涂层成分的单一性也决定了涂层功能的单调性。基于氟化物涂层简单、低廉、与基体结合紧密的特性,在医用镁合金耐蚀保护领域,氟化物涂层往往是作为基底涂层(复合涂层的预处理层),通过良好结合强度与生物活性、功能多样化的统一,来实现医用镁合金保护效果的有效性[36-37]。
2 医用镁合金MgF2复合涂层的研究与发展
2.1 MgF2/无机复合涂层
人体结构的多层次多功能的复杂体系决定了不同临床应用植入镁合金表面改性需求的差异性,镁合金血管支架侧重于抗菌消炎性、抗血栓性、载药缓释性及促内皮化。而作为骨植入材料,在镁合金表面构建的表面涂层则需要良好的生物相容性,生物降解性、诱导再生性。在现有表面改性材料中,钙盐类无机陶瓷材料(CaF2、CaP、羟基磷灰石(HA)、磷酸三钙(EP)、酸式磷酸钙(DCPD))与骨骼的主要无机成分(生物磷灰石(CaP))相同或性能最为接近,凭借优异的耐蚀性能、生物相容性、生物诱导性,钙盐类生物陶瓷成为骨植入镁合金表面涂层的主流研究材料之一[29,38]。
2.1.1 MgF2/钙复合涂层
张世雨等[39]将镁合金(AZ31)浸没于室温下40%的HF溶液中7d,然后将氟化处理后的合金浸没于澄清后的Ca(OH)2溶液中24h,在镁合金表面制备了MgF2/CaF2复合涂层。Hank’s溶液中的电化学测试显示,相对于单一MgF2涂层,复合涂层显著提升了镁合金的耐蚀性能。这主要是由于镁合金与HF反应的释H2效应造成MgF2涂层上少数微孔的不可避免(如图3(a)),而CaF2涂层及其上的微纳米片状结构(如图3(b))对MgF2涂层有很好的封孔效应(如图3(c)),这有效避免了单一MgF2涂层早期发生的点蚀。Hank’s模拟体液的13d浸泡实验发现,表层CaF2涂层虽然降解缓慢,但会发生局部脱落,故增强涂层间的结合力成为提高MgF2/CaF2复合涂层耐蚀性能的关键因素。

图3 镁合金(AZ31)经氟处理及氟-钙处理后表面SEM照片及XRD分析:(a)40 vol% HF, 7d; (b)40 vol% HF, 7d+Ca(OH)2, 24h; (c)40 vol% HF, 7d+Ca(OH)2, 24h后合金纵剖面; (d)纵剖面XRD[39]
SU等[40]通过两步法(HF浸没+磷化法沉积CaP)在镁合金(AZ60)表面制备了MgF2/CaP复合涂层,相对与单一MgF2涂层或CaP涂层,MgF2/CaP复合涂层结构更致密,表面更光洁。模拟体液中的电化学检测显示,MgF2/CaP复合涂层的极化电阻是单一CaP涂层的27倍。同时,基于MgF2涂层良好的生物相容性,MgF2/CaP复合涂层更有利于细胞的粘附和生长。REN等[41]在HF预处理后的镁合金(AZ31)表面通过溶胶-凝胶浸涂法制备了MgF2/CaP复合涂层,该复合涂层组织均匀,表面光滑,与镁基体结合紧密。模拟体液(SBF)中的电化学检测显示,MgF2/CaP复合涂层不但提高了合金的腐蚀电位和电荷转移阻抗,而且显著降低了合金的腐蚀电流密度,随后的18d模拟体液(SBF)降解实验进一步印证了制备有MgF2/CaP复合涂层的镁合金具有更好的耐蚀性。
然而,无论是微纳米片状结构CaF2涂层,还是CaP涂层,其表面大量的微小缝隙和孔洞为腐蚀介质进入镁合金基体提供了可能的通道,这严重削弱了复合涂层的耐蚀性能。将CaF2(CaP)涂层与其他表面致密的涂层复合,成为克服这一缺陷的有效途径之一。当前,已有相关学者选取聚乳酸(PLA)、TiO2作为封孔材料,通过制备CaP/PLA复合涂层、CaP/TiO2复合涂层来提高CaP涂层的耐蚀性能[42]。
2.1.2 MgF2/羟基磷灰石(HA) 复合涂层
羟基磷灰石(Ca10(PO4)6(OH)2,HA)是一种易溶于酸、难溶于碱、微溶于水的具有高结晶度的磷酸钙盐,作为一种公认的骨植入表面改性适配材料,HA不但具有良好的生物相容性(人体骨骼的主要无机成分),而且具有良好的成骨诱导性能,这主要归功于HA疏松多孔的晶体结构增大了与骨细胞的接触面,便于PO43-、Ca2+离子的沉积[43],同时HA还可以通过与人体组织形成化学键合来促进骨细胞的粘附与生长[44]。
张春艳等[45]将HF处理后的镁合金(AZ31)(图4(a))浸没在Ca(OH)2溶液中24h,生成纳米针状CaF2(图4(b)),然后以处理后的试样为阴极、不锈钢为阳极进行电化学沉积,在镁合金表面制备了MgF2/CaF2/HA复合涂层(图4(c))。研究表明,在电化学沉积过程中,MgF2涂层并未溶解,仍作为中间层存在,CaF2/HA涂层对MgF2涂层有良好的封孔效应(图4(c)(d))。Hank’s仿生液中的电化学实验证实,MgF2/CaF2/HA复合涂层的阻抗值随浸没时间的延长而降低,在12d的浸没实验中,涂层未发生明显的脱落与溶解,表现出良好的结合强度。制备有MgF2/CaF2/HA复合涂层的镁合金的腐蚀形式以点蚀为主(Hank’s仿生液渗透至基体)。

图4 镁合金(AZ31)经化学及电化学沉积后表面SEM照片及XRD分析:(a)40 vol% HF, 7d; (b)40 vol% HF, 7d+Ca(OH)2, 24h; (c)40 vol% HF, 7d+Ca(OH)2, 24h+电化学沉积, 2h; (d)电化学沉积后纵剖面; (e)试样XRD[45]
着眼于先进生物材料的仿生策略设计,SHEN S B等[46]通过微波水性法在镁合金表面制备了双层纳米针状阵列的氟化羟基磷灰石(FHA)涂层。体外生物学试验表明,纳米FHA涂层不但显著提高了镁合金的耐蚀能力,而且具有良好的成骨分化能力,这源于双层纳米阵列的针状间隙与破骨细胞的吸收凹窝结构类似,促进了成骨细胞的分化和增殖。
BAKHSHESHI-Rad等[47]先将镁合金(Mg-Ca-Zn)浸没在40%HF溶液中,然后再通过电化学沉积和碱热处理,在镁合金表面制备了MgF2/HA复合涂层。电化学实验显示,相对于无涂层的镁合金,单一MgF2涂层和MgF2/HA复合涂层均使镁合金的腐蚀电流密度降低了接近2个数量级。为了更好地开发应用F的生物活性(生物安全性、成骨效应),简化镁合金表面涂层的制备工艺,BAKHSHESHI-Rad等[48]将2 mmol/L NaF添加进电解液中(0.042mol/L Ca(NO3)2,0.025mol/L NH4H2PO4,0.1mol/L NaNO3,10mol/L H2O2,通过HNO3和(CH2OH)3CNH2调控Ph=5.0),直接采用电化学沉积法在镁合金(Mg-Ca)表面制备了氟掺杂的FHA涂层,花瓣状的FHA涂层不但能加速镁合金表面骨状磷灰石层的形成,而且有效地提高了镁合金的耐蚀性能。
MENG等[49]发现传统恒流阴极电沉积工艺(traditional cathodic process,TED)制备的FHA涂层成分不均匀、粘度低,且疏松、多孔(见图5(a)),这导致FHA涂层在后期降解过程中易发生剥落和崩塌(见图5(c)),而采用脉冲反向电流工艺(pulse reverse current,PRC)在镁合金(Mg-Ca-Zn)表面制备的FHA涂层更加致密均匀(见图5(b)),耐蚀性更高(见图5(d))。
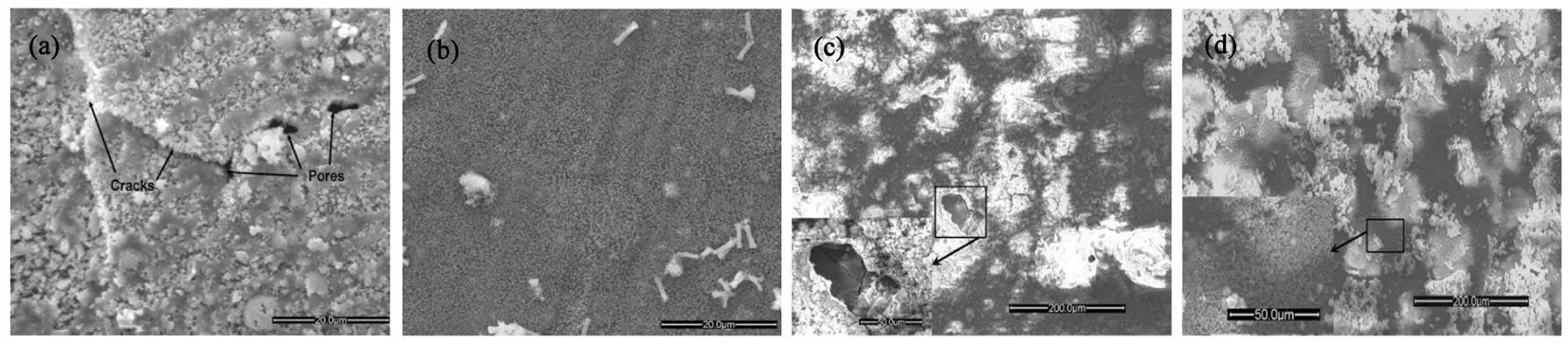
图5 镁合金(Mg-Ca-Zn)经电化学沉积及在SBF模拟体液中腐蚀5天后SEM照片:(a)TED制备的FHA涂层; (b)PRC制备的FHA涂层; (c)TED 制备的FHA涂层腐蚀形貌; (d) PRC制备的FHA涂层腐蚀形貌[49]
研究发现,MgF2/HA复合涂层间的结合强度、表层HA形貌及致密度成为决定其耐蚀性的关键因素。在已开发出的多种医用镁合金表面制备HA涂层工艺中,电化学沉积(常电势法、电流脉冲法、TED、PRC)由于制备过程的释H2效应,会降低基体与涂层、涂层与涂层间的结合强度[43]。溶胶凝胶法制备的HA涂层与基体(涂层)粘附性差,且疏松多孔[43]。磁控溅射[50]作为一种物理气象沉积技术(利用电场中的电子轰击氩原子,带正电的氩离子以高能状态轰击靶材,中性的靶原子(分子)溅射沉积在基材上),具有沉积速度高、沉积面积大、涂层密度高、均匀性好、与基体结合紧密、适配各种基材及可制备多层复杂涂层的特点,但其整个工艺流程复杂(基体的电化学预处理、磁控溅射、后期热处理),影响因素多(预处理电压参数的选择、磁控溅射参数选择(靶-基距、溅射功率、工作电压、氩气流量、溅射时间)、热处理温度(时间)选择),限制了其使用范围。水热法[43](在高温高压的反应釜中,以水溶液为介质,在镁合金生成各种表面涂层的工艺方法)简单经济、绿色环保、工艺参数便于控制、所得涂层与基体结合牢固、涂层纯度高,已成为各种金属基材料表面制备HA的重要工艺之一。而水热法制备MgF2/HA多级复合涂层尚待深入研究。
当前,医用镁合金表面复合涂层的研究正朝着功能多样化和生物活性化方向快速迈进,MgF2/CaP(HA)复合涂层在提高医用镁合金的耐蚀性、成骨诱导性方面展现出广阔的应用前景。而钙盐类无机陶瓷材料的固有脆性(较低的抗断裂性及拉伸性)导致其在镁合金的释H2反应下易发生溶胀失效[44],同时,如何提高钙盐类无机陶瓷材料致密度,如何提高MgF2、无机涂层间的结合强度已成为MgF2/无机复合涂层走向应用的首要问题。
2.2 MgF2/有机复合涂层
近年来,凭借工艺简单、种类繁多、良好的生物安全性、生物相容性、广泛的适应性,有机涂层材料(植酸(PA)、多巴胺(DA)、聚乳酸-乙醇酸共聚物(PLGA)、壳聚糖(CS)、聚乳酸(PLA)、硬脂酸(SA)、聚已内酯(PCL))在医用镁合金表面改性领域获得众多学者的青睐。这些有机涂层材料不但具有好的耐蚀性能、高的粘附强度,而且在镁合金植入材料的多功能性方面带来了更多的可能。
2.2.1 MgF2/聚多巴胺(PDA)复合涂层
聚多巴胺(Polydopaminc,PDA)的开发与使用始于贻贝的仿生学研究,依靠足丝分泌的含有大量左旋多巴胺(L-3,4-dihydroxyphenylalanine)的粘附蛋白,海洋生物贻贝可以牢固地粘附于各种基体的表面,受此启发,学者们研究了与贻贝的粘附蛋白有相似结构的多巴胺(C8H12NO2,DA),发现DA在碱性条件下会发生有氧自聚反应,在所有材料表面生成粘附性极强的一薄层PDA[44,51]。PDA涂层具有独特的高稳定性、(涂层厚度)可调控性、高亲水性(有利于细胞的粘附与增殖)、二次反应功能(含有大量官能团可将各种功能性分子加载在材料表面)等特性[44,52],在表面改性、生物催化领域展现出巨大的应用潜力。
镁合金的化学活性较高,在合金表面采用浸渍法(碱性盐酸DA溶液为浸渍剂)制备PDA涂层时,镁与溶剂中的水发生反应生成的H2(产生鼓泡效应)会降低PDA涂层在镁合金的附着效应,浸渍剂中大量的Cl-会促进Mg(OH)2的溶解(镁的水蚀产物),造成PDA涂层的龟裂[44],同时,PDA涂层抗凝血性能较差[53-54],这些都限制了单一PDA涂层在镁合金耐蚀领域的应用。
LIU等[55]分别将镁合金(Mg-Zn-Y-Nd)浸渍在HF、盐酸DA溶液中,采用两步浸渍法在镁合金表面制备了MgF2/PDA复合涂层。图6为镁合金不同处理状态水接触角SEM照片及所有试样在腐蚀液浸没不同时间的SEM照片。对比图6(a)~(c),相对于没有涂层的镁合金而言,制备了MgF2涂层及MgF2/PDA复合涂层的镁合金表面不但组织更加致密均匀,而且具有更好的亲水性(水接触角从43.74°±2.8°分别减小到15.64°±0.33°和28.01°±2.98°)。电化学测试表明,单一MgF2涂层虽然与基体结合较好,但厚度较薄,对镁合金的保护有限,而制备了MgF2/PDA复合涂层的镁合金(Mg-Zn-Y-Nd)具有最低的腐蚀速率。体外浸渍实验证实(如图6(a1)~(c4)), MgF2/PDA复合涂层可明显提高镁合金(Mg-Zn-Y-Nd)耐蚀性能。同时,细胞培养测试实验显示,MgF2/PDA复合涂层有利于细胞的粘附、增殖与生长。

图6 镁合金不同处理状态水接触角、SEM照片及SEM局部放大照片: (a)无表面涂层镁合金; (b)40 vol% HF, 48h; (c)40 vol% HF, 48h+盐酸多巴胺溶液, 2h. 所有试样在腐蚀液(DMEM+40 g/L BSA)浸没不同时间的SEM照片: (a1)~(a4)镁合金;(b1)~(b4)40 vol% HF, 48h; (c1)~(c4) 40 vol% HF, 48h+盐酸多巴胺溶液, 2h[55]
ZHANG等[56]在经过HF预处理的镁合金(AZ31)表面通过浸涂法制备了MgF2/PDA/SA(硬脂酸)复合涂层。研究发现,在MgF2/PDA/SA复合涂层中,作为中间层的高粘附PDA涂层为MgF2涂层与SA涂层提供了高效的锚固效应,复合涂层组织致密、均匀,复合涂层间、复合涂层与基体结合紧密。相对于没有涂层的镁合金,MgF2/PDA/SA复合涂层将镁合金的耐蚀性提高了3个数量级。
硬脂酸(C18H36O2,SA) 是一种油脂水解后的产物,作为一种优点(良好超疏水性能)与缺点(表面附着力差)并存的材料[57],与镁基体结合紧密的涂层(氟化涂层、微弧氧化涂层[58-59])取长补短,强强结合,是SA涂层在镁合金耐蚀应用领域的不二选择。
透明质酸(HA,也称玻尿酸),作为细胞外基质(ECM)的重要组成成分之一,在细胞的粘附、增殖、生长与迁移中发挥着极其重要的作用[60-61]。王烁等[62]首先制备了透明质酸(HA)/聚乙烯亚胺(PEI)纳米颗粒,然后将镁合金(Mg-Zn-Y-Nd)依次浸渍在HF、盐酸DA溶液、不同浓度的纳米颗粒透明质酸(HA)/PEI溶液中,采用三步浸渍法在镁合金表面制备了纳米颗粒MgF2/PDA/透明质酸(HA)/PEI复合涂层。傅里叶变换红外光谱仪(FTIR)检测表明纳米颗粒透明质酸(HA)/PEI成功固定在MgF2/PDA涂层上,HBSS(Hank’s平衡盐溶液,pH=7.4)浸没实验及电化学测试表明,制备了纳米颗粒MgF2/PDA/透明质酸(HA)/PEI复合涂层的镁合金(Mg-Zn-Y-Nd)具有更好的润湿性、抗降解性。生物学测试(血小板粘附与激活、纤维蛋白原粘附与变性、溶血率、内皮细胞(平滑肌细胞、巨噬细胞)静态培养)证实纳米颗粒MgF2/PDA/HA/PEI复合涂层具有良好的血液相容性和促进内皮粘附与增殖、抑制病理性平滑细胞(巨噬细胞)粘附与增殖的效果。浓度为1.5 mg/mL、2.5 mg/mL的纳米颗粒透明质酸(HA)/PEI溶液制备的MgF2/PDA/透明质酸(HA)/PEI复合涂层表现出最佳的综合性能。
然而,人体透明质酸酶对透明质酸(HA)快速的降解效应限制了透明质酸(HA)涂层的临床疗效[63]。基于磺化透明质酸(S-HA)比透明质酸(HA) (在人体透明质酸酶环境)更好的稳定性,于洋等[64]首先制备了S-HA,然后将镁合金(ZE21B)依次浸渍在HF、盐酸DA溶液、S-HA溶液中,采用三步浸渍法在镁合金表面制备了MgF2/PDA/S-HA复合涂层,检测发现,拥有独特网状结构的MgF2/PDA/S-HA复合涂层具有较大的粗糙度(Ra为64.73±4.47 nm,Rq为82.30±6.00 nm),较好的亲水性能(水接触角仅为10.33±1.61°),较高的耐蚀性及优异的抗凝血功能和细胞相容性。
依靠与基体结合紧密的氟化物涂层、微弧氧化(MAO)涂层为基底,以具有良好生物活性的可降解有(无)机涂层为外涂层的多级复合涂层,已成为医用镁合金植入材料表面改性技术的主要发展趋势。相对于MAO/PDA复合涂层(专用设备、高电压、后期附加封孔工艺),MgF2/PDA复合涂层无设备、电压需求,无需封孔,工艺简单,具有较高的成本优势。同时,PDA涂层厚度的可调控性(有利于可控降解的实现)、高亲水性(有利于细胞的粘附与增殖)、高稳定性引人注目,其包含的大量强螯合能力的官能团也为各种功能性分子加载在材料表面提供了可贵的机遇。因此,以PDA涂层的性能优势为推手,开发具有良好生物活性及多功能性的MgF2/PDA多级复合涂层已势在必行。
2.2.2 MgF2/植酸(PA)复合涂层
植酸(phytic acid,PA)是一种普遍存在于植物(豆类、谷物)种子和麸皮(胚芽)中的无生物毒性的天然有机材料。由于每个PA分子(包括1个碳六环、12个羟基、6个磷酸基)的12个羟基上的氢原子均可电离,因此PA具有极强的多齿螯合功能[65-67]。这种多齿螯合功能不但赋予PA在金属表面极强的涂层形成及附着能力(通过与Zn2+、Fe3+、Fe2+、Mg2+、Ti4+和Ca2+等金属离子形成络合物),而且可以改变材料(蛋白质、淀粉、矿物质)的溶解性、吸附性及增加功能特性[65,66,68]。
崔秀芳等[69]学者认为镁合金表面PA涂层的形成依赖于镁合金的快速降解(PA与大量溶解的镁合金络合)。HERNANDEZ-ALVARADO L A等[70]研究发现镁合金快速降解时会释放大量H2,这些H2在溢出过程中会在PA涂层表面形成大量的微裂纹(微裂纹的大小取决于H2溢出量),削弱PA涂层对镁合金的防护效果。图7为不同工艺参数条件下PA涂层的形貌变化。由图7可见,通过调整制备工艺参数(制备时间、制备温度、PA溶液的浓度、pH值等)可以改善PA涂层致密度,提高镁合金基体耐蚀性[70],但PA涂层有限的厚度、大量微裂纹的不可避免,限制了单一PA涂层在镁合金耐蚀领域的应用推广。

图7 不同工艺参数条件下PA涂层微观形貌[70]:(a)~(d) pH2.0, 植酸浓度0.5%v/v; (e)~(h) pH2.0, 植酸浓度2.0%v/v
为克服单一PA涂层的性能弱点,刘欢等[71]将镁合金(AZ80)分别浸渍在0.1M氟化钾(KF)、PA溶液(5g/L)中,采用两步浸渍法在镁合金表面制备了Mg(OH)2/MgF2/PA复合涂层。电化学检测及Hank’s模拟体液120h浸没实验显示,相对于无涂层、Mg(OH)2/MgF2涂层和Mg(OH)2/PA涂层试样,制备了Mg(OH)2/MgF2/PA复合涂层的镁合金(AZ80)试样耐蚀性能最好(自腐蚀电位(-1.267V)最高、自腐蚀电流密度(7.121×10-7A/cm2)最小、析氢量(3.48±0.11mL)及失重速率(0.34±0.02mg cm-2d-1)最小)。图8即为AZ80镁合金表面Mg(OH)2/MgF2/PA复合涂层的成形机理示意图。刘欢将Mg(OH)2/MgF2/PA复合涂层的成形过程分为四个阶段,每一阶段的反应方程式见公式[71](1)~(9)。由图8和公式(1)~(9)可知,一方面,Mg(OH)2/MgF2/PA复合涂层厚度最大,且涂层间均匀致密,连续性好(MgF2涂层促进了基体在PA转化液的均匀降解,显著提高了PA与镁基体的螯合效应);另一方面,作为中间层的MgF2涂层对PA涂层的显微裂纹具有较好的封孔效果,因此,Mg(OH)2/MgF2/PA复合涂层显著提高了镁合金(AZ80)的耐蚀性能。
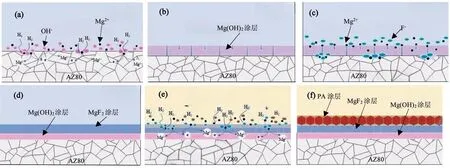
图8 AZ80镁合金表面Mg(OH)2/MgF2/PA复合涂层的成形机理示意图[71]

(1)(2)
图8(b)阶段反应 Mg2++2OH-→Mg(OH)2
(3)

(4)(5)

(6)(7)(8)(9)
目前,MgF2/PA复合涂层的研究主要集中在耐蚀性及MgF2涂层对PA涂层的封孔效应方面。以MgF2/PA为基底的多级复合涂层的交互探索、PA耦合剂在多级复合涂层中的作用机理、各涂层在腐蚀进程中的失效机制等尚需进一步深耕。如何更好地利用PA多齿螯合功能来实现MgF2/PA复合涂层的抗菌抑菌性、载药缓释性及诱导再生性等多功能化方面还需要快速迈进。
2.2.3 MgF2/聚乳酸(PLA)复合涂层
聚乳酸(polylactic acid, PLA)是乳酸或丙交酯发生聚合反应生成的脂肪族聚酯类新型可降解高分子材料,包含外消旋聚乳酸、左旋聚乳酸(PLLA)、右旋聚乳酸三种异构体[2]。PLA材料不但来源广泛(其原材料乳酸主要来源于淀粉(玉米、大米、纤维素))、成本低廉、工艺简单、结晶度高,加工性好(良好的热塑性)[42,72],而且其降解产物(二氧化碳和水)安全无毒,弱酸性的降解产物也可中和Mg降解所产生的弱碱性[2,73],因此,在生物医药领域引起了较为广泛的关注[72]。但传统工艺(浸渍提拉法和旋涂法)制备的PLA涂层(与镁合金基体是结合力较弱的物理结合)易于破裂和剥落,所以近年来科研工作者尝试通过复合涂层的制备来改善PLA涂层与镁合金基体的结合强度。
WANG等[74]通过浸渍法及表面旋涂法在镁合金(AZ31)表面制备了MgF2/PLLA复合涂层,研究表明,MgF2涂层生成阶段的释H2效应造成涂层表面不均匀地分布着尺寸不一的细小孔隙,PLLA涂层通过填充这些细小的孔隙实现涂层间的机械锚固,提高了MgF2/PLLA复合涂层间的界面结合强度。同时,PLLA涂层的填充也对MgF2涂层的孔隙起到了有效的封孔作用。MgF2/PLLA复合涂层比单一涂层(MgF2涂层、PLLA涂层)具有更好的耐腐蚀性能。
王鑫雨[75]通过浸渍法及表面旋涂法在镁合金(Mg-Zn)表面制备了MgF2/PLLA+PTMC(聚三亚甲基碳酸酯)复合涂层,研究发现,增大氟化液浓度及延长氟化处理时间有利于细化MgF2晶粒,减少MgF2涂层表面缺陷,提高MgF2涂层整体均匀性及致密度。同时,作为中间层的MgF2表面粗糙,这不但为聚合物PLLA+PTMC提供了更多的固化位点,增大了聚合物固化量,而且有利于加强复合涂层间的机械结合强度。同时,表层亲水性能较差的PLLA+PTMC也阻滞了H2O分子在表层的吸附作用。图9为不同涂层的镁合金(Mg-Zn)在Hank’s溶液中浸泡后的SEM形貌,对比图9,在Hank’s溶液中浸泡7天后,无涂层的镁合金基体表面、单一MgF2涂层表面及单一PLLA+PTMC涂层表面均遍布腐蚀产物、裂纹或腐蚀坑,而包覆有MgF2/PLLA+PTMC复合涂层的镁合金表面仍保持完整。电化学实验显示,相较于未处理的镁合金(Mg-Zn),制备了MgF2/PLLA+PTMC复合涂层的镁合金(Mg-Zn)的腐蚀电流密度降低了3个数量级(由4.95×10-6A/cm2降低到7.89×10-9A/cm2)。均匀致密的MgF2/PLLA+PTMC复合涂层可有效阻滞腐蚀介质对基体的侵蚀。

图9 不同涂层的镁合金(Mg-Zn)在Hank’s溶液中浸泡后的SEM形貌[75]
PLLA涂层通过填充MgF2表面的孔隙实现了封孔和机械锚固的双重效应,不但增强了涂层与涂层间的界面结合强度,而且克服了单一PLLA涂层(与镁合金基体是结合力较弱的物理结合)易于破裂和剥落的性能弱点,同时,也继承了单一PLLA涂层优良的生物安全性、降解产物的酸碱中和性及优异的可加工性。目前,对MgF2/PLLA复合涂层的研究多集中在体外(模拟体液)的耐蚀性、涂层间的结合机制方面,而通过MgF2/PLLA复合涂层与其他有(无)机涂层的交叉组合来实现镁合金植入材料降解速率与有效服役期限的有效匹配、多级复合涂层多功能拓展尚待深入。
3 总结与展望
近年来,随着国民整体收入水平的不断提高、医保覆盖面的不断扩大、老龄人口比重的持续上升及医疗观念的转变,对新型医用植入材料的需求、研发与生产越来越迫切。表面改性处理已成为当前破解医用镁合金的临床应用瓶颈的有效手段。MgF2复合涂层凭借其成本低廉、工艺简单、生物安全、生物相容等特点成为医用镁合金表面改性处理的优先选项之一。
表3为不同镁合金表面各种MgF2及其复合涂层耐蚀性能比较,由前面的分析和表3的性能对比可以明显的看出,相对于无涂层镁合金、单一MgF2涂层、单一有(无)机涂层,MgF2复合涂层在耐蚀性、生物功能多样性(生物矿化能力,细胞的粘附、增殖与生长,促进内皮粘附与增殖,抑制病理性平滑细胞(巨噬细胞)粘附与增殖)方面表现出优异的性能。

表3 镁合金表面各种MgF2及其复合涂层耐蚀性能比较
然而,相对其他复合涂层(如微弧氧化)的研究,MgF2复合涂层在侵蚀机制、失效机理方面有待深入,在综合性组合、功能化交互方面的研究不多。鉴于当前的研究现状,MgF2复合涂层的发展应从以下几方面入手:
(1) 前期的研究侧重于涂层和基体间、涂层间的结合状况及相关性能检测(耐蚀性、抗凝血功能和细胞相容性等),而腐蚀液对MgF2复合涂层的侵蚀机制、复合涂层的失效机理尚需大量的实验去补充和验证。
(2) 一些性能优异的涂层材料(壳聚糖(CS,在药物载体、抗菌抑菌、人造皮肤及组织工程较好的应用前景)[76-79],聚乳酸-乙醇酸共聚物(PLGA,优异的生物安全性、生物相容性、可降解性能及载药释放功能)[80-83],聚已内酯(PCL,良好的生物安全性、生物降解性、聚合物混溶性及优异的载药缓释功能)[84-87],胶原蛋白(Collagen,优良的诱导再生性及自组装成纤维的能力)[88-89]等)和氟化物涂层的组合与交互研究尚待开展。而通过多重涂层的交互组合来实现镁合金植入材料生物功能多样性(药物输送及缓释给药性、可控降解性、广谱抑菌性等)的探索也势在必行。
(3)动物体内植入部位功能性需求的差异(镁合金支架侧重于抗菌消炎性、抗血栓性、载药缓释性及促内皮化,镁合金骨植入材料侧重于适当的降解速率、匹配的力学性能、细胞的诱导再生性)对MgF2复合涂层的研究开发提出了多样性及非均一性要求。
(4)资料显示,MgF2复合涂层的性能检测以模拟体液的体外实验为主,而医用镁合金在动物体内腐蚀形式的多样性、腐蚀因素的复杂性、腐蚀状态的随机多变性限制了体外仿真模拟实验数据的可靠性,为加快医用镁合金临床应用进程,相关的动物体内实验迫在眉睫。

