环孢素A和他克莫司的高效液相色谱-串联质谱检测及其室内质控评价
钟里科,米秀芳,舒琦,许高奇,何超能,朱俊峰
(浙江省肿瘤医院药剂科,中国科学院杭州医学研究所,杭州 310022)
治疗药物监测(therapeutic drug monitoring,TDM)是个体化医疗的重要组成部分,可以帮助患者在正确的时间接受最佳剂量的药物,提高药物的有效性和安全性,改善患者的预后。环孢素A和他克莫司是临床上应用最广泛的2种免疫抑制剂,常用于治疗移植排斥反应和自身免疫性疾病[1-2]。然而,这2种药物的治疗窗狭窄,药动学个体差异大,因此用药期间需要进行TDM[3-4]。
高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectormetry,HPLC-MS/MS)法是一种强大的分析技术,已被广泛用于生物样品等复杂基质中药物的定量测定。HPLC-MS/MS具有高选择性、高灵敏度和高精确度的特点,已成为环孢素A和他克莫司TDM的理想方法[5],其准确性和精确度受到几个因素的影响,包括基质效应、离子抑制和校准曲线拟合等。因此,有必要建立和评估室内质量控制系统以确保方法的可靠性和重复性。
本研究旨在利用HPLC-MS/MS建立一种快速、可靠的环孢素A和他克莫司TDM方法,并应用Westgard 多规则质控体系对2022年第3季度环孢素A和他克莫司TDM过程中的随行质控样品测定值进行Levery-Jennings和Z分数质控图分析,以期完善环孢素A和他克莫司治疗药物监测的室内质量控制体系,提高血药浓度监测的准确性,为临床提供参考。
1 仪器与试剂
1.1仪器 AB SCIEX Triple Quad 4500MD液相色谱串联质谱检测系统(美国AB SCIEX公司);HERAEUS MULTIFUGE 3SR+低温离心机(美国Thermo Scientific公司);BS124S电子天平(北京赛多利斯仪器系统有限公司,感量:0.1 mg);DMT-2500多管漩涡混合仪(杭州米欧仪器有限公司);CASCADA I超纯水制备仪(美国 PALL 公司)。
1.2试剂 环孢素A对照品(批号:GC113281,含量>98%),他克莫司对照品(批号:GC162331,含量>98%),环孢素D(作为环孢素A的内标)对照品(批号:GC118661,含量>98%),子囊霉素(作为他克莫司的内标)对照品(批号:GC132151,含量>98%),均购自美国GlpBio公司。甲酸和乙酸铵均为色谱纯,购自上海阿拉丁生化科技股份有限公司;甲醇和乙腈均为色谱纯,购自德国Merck公司。
2 方法与结果
2.1溶液的配制
2.1.1储备液的配制 分别精密称取环孢素A 10.4 mg和他克莫司9.9 mg于不同10 mL量瓶,用甲醇溶解并定容,制得1.04 mg·mL-1的环孢素A标准储备液和0.99 mg·mL-1的他克莫司标准储备液各1份;同法分别制备1.10 mg·mL-1的环孢素A质控储备液和0.99 mg·mL-1的他克莫司质控储备液各1份;同法分别制备1.00 mg·mL-1的环孢素D内标储备液和0.95 mg·mL-1的子囊霉素内标储备液各1份。储备液于-30 ℃保存。
2.1.2工作液的配制 精密吸取环孢素A标准储备液100 μL和他克莫司标准储备液5 μL于同一个10 mL量瓶,用50%甲醇稀释至刻度,制得环孢素A和他克莫司浓度分别为10 400.00和495.00 ng·mL-1的混标工作液;同法用质控储备液制得环孢素A和他克莫司浓度分别为8 800.00和396.00 ng·mL-1的质控工作液;同法用内标储备液制得环孢素D和子囊霉素浓度分别为500.00和49.50 ng·mL-1的内标工作液。
2.1.3校正样品及质控样品的制备 将人空白全血与混标工作液按9:1混合,制得环孢素A和他克莫司浓度分别为1 040.00和49.50 ng·mL-1的定量上限样品,之后用空白全血逐级稀释,制得一系列浓度梯度的校正样品,其中环孢素A的浓度梯度为:10.40、20.80、52.00、104.00、08.00、20.00、1 040.00 ng·mL-1,他克莫司的浓度梯度为:0.50、0.99、2.48、4.95、9.90、24.75、49.50 ng·mL-1。同法用质控工作液制得3个浓度水平的质控样品,其中环孢素A的浓度为17.60、88.00、880.00 ng·mL-1,他克莫司的浓度为0.79、3.96、39.60 ng·mL-1。
2.2样品前处理 精密吸取全血100 μL于1.5 mL EP管,加入内标工作液10 μL混匀,然后加入浓度为100 mmol·L-1的硫酸锌溶液100 μL,2 500 r·min-1涡旋3 min,静置5 min。之后加入乙腈300 μL沉淀蛋白,2 500 r·min-1涡旋3 min后以15 000 r·min-1离心10 min。离心后取上清液进样分析。
2.3色谱条件 色谱柱为WatersXbridge C18(2.1 mm×50 mm,3.5 μm);流动相为2 mmol·L-1乙酸铵-0.1%甲酸溶液(A):2 mmol·L-1乙酸铵-0.1%甲酸甲醇溶液(B),梯度洗脱:0—0.2min,10% B;0.2—0.7min,10%→100% B;0.7—2.0min,100% B;2.0—2.25min,100%→10% B;2.25—3.5 min,10% B;分析时间3.5 min;流速0.5 mL·min-1;柱温60 ℃;进样量10 μL。
2.4质谱条件 采用电喷雾离子源(electron spray ionization,ESI)离子源,正离子模式,多反应监测模式(multiple reaction monitoring mode,MRM)扫描。优化后的离子源参数:气帘气为35 psi,离子化电压为5 500 V,温度(temperature,TEM)为450 ℃,喷雾气为40 psi,辅助加热气为40 psi,碰撞气为7 psi。各化合物的子离子扫描图见图1,优化后的MRM参数见表1。
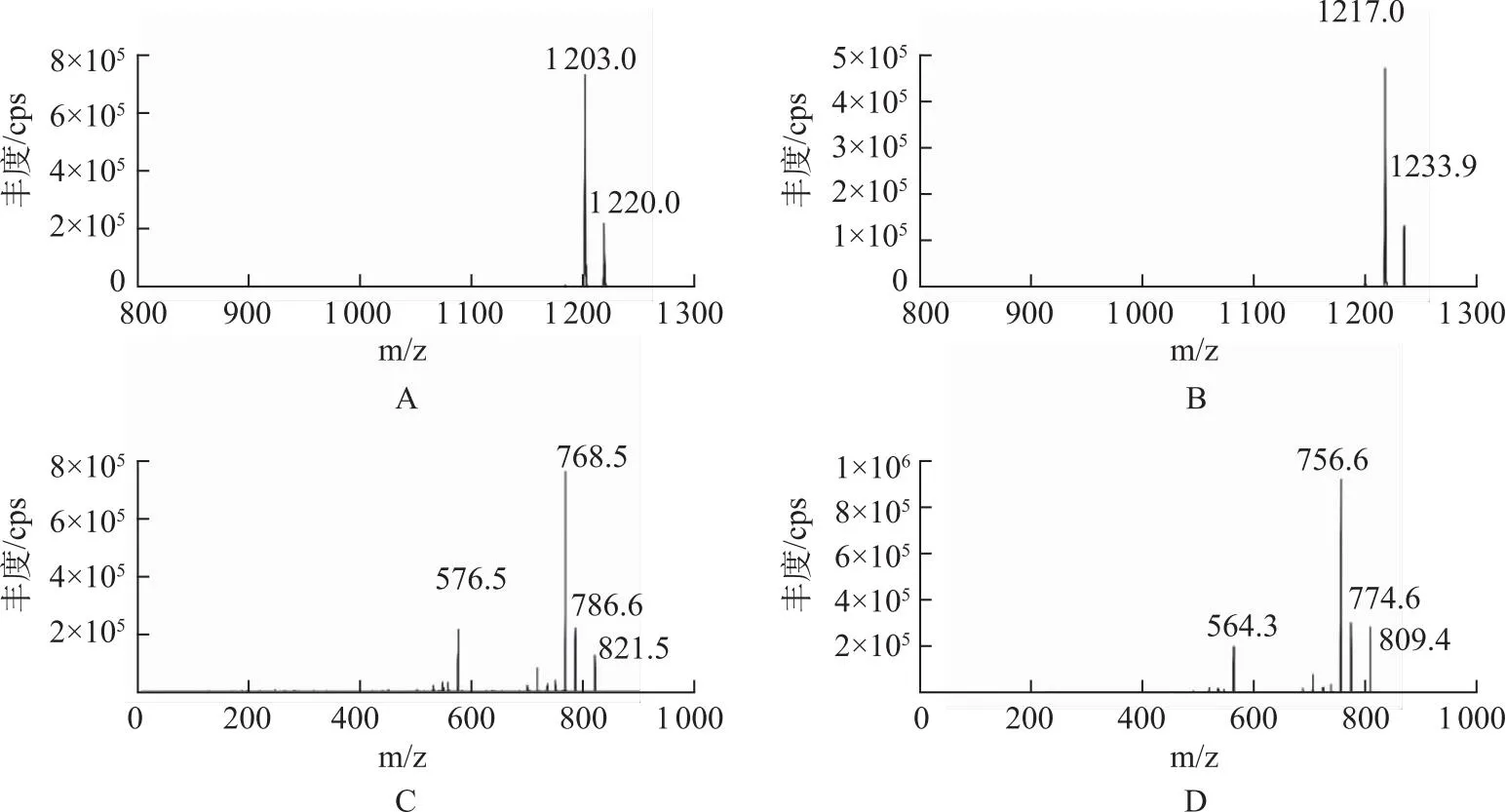
图1 环孢素A(A)、环孢素D(B)、他克莫司(C)及子囊霉素(D)的离子扫描图

表1 优化后的化合物MRM参数
2.5方法学评价
2.5.1专属性 在上述条件下,环孢素A及其内标环孢素D的保留时间分别为1.49和1.50 min,他克莫司及其内标子囊霉素的保留时间均为1.44 min。同时,定量下限样品中待测物的响应值为空白全血的10倍以上,全血中的内源性成分对待测物及内标无干扰,表明本方法专属性良好,见图2。
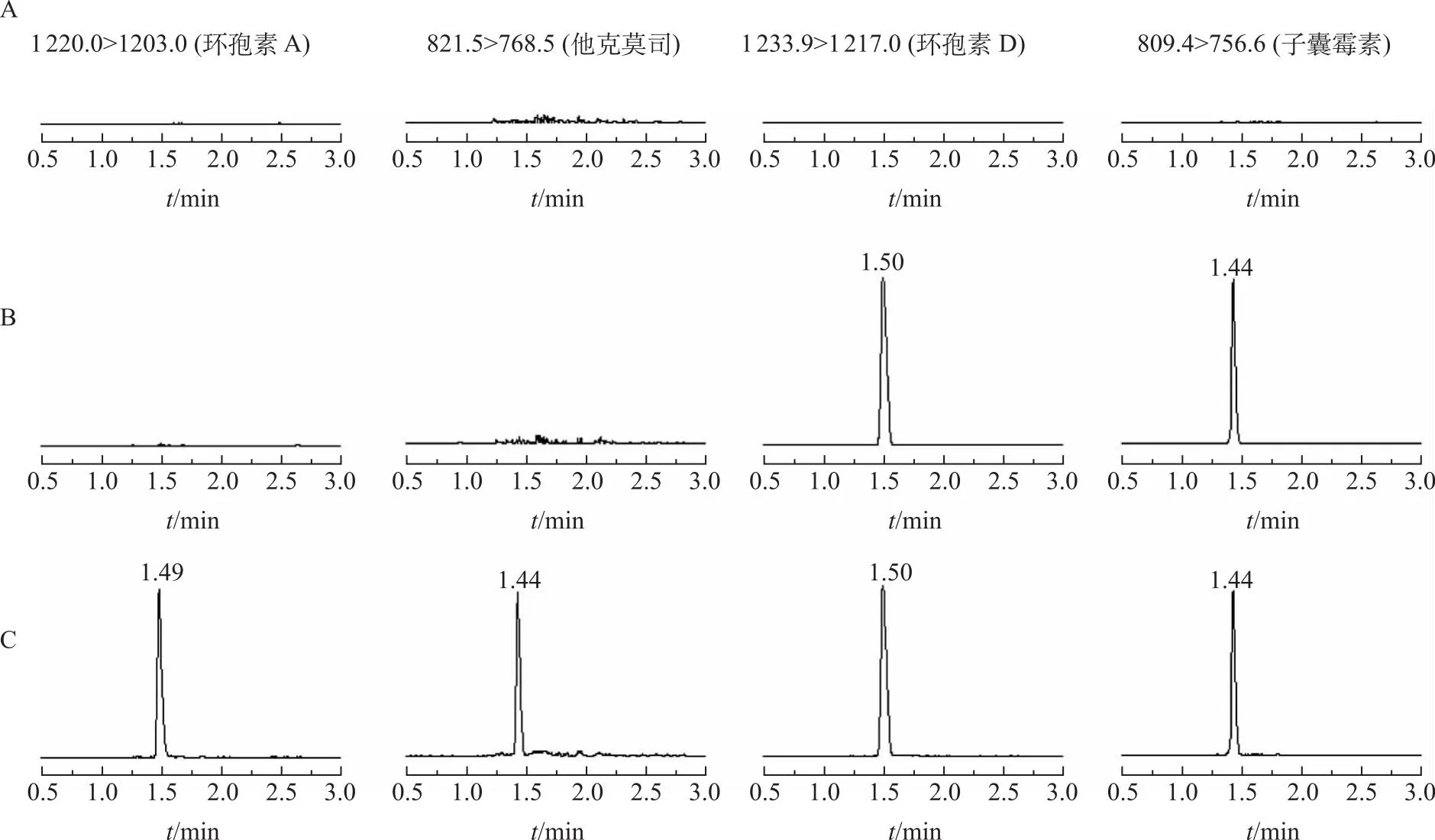
图2 环孢素A、他克莫司、环孢素D和子囊霉素在空白全血(A)、零点样品(B)及定量下限样品(C)中的色谱图
2.5.2线性及定量下限 环孢素A在10.40~1 040.00 ng·mL-1范围内线性关系良好,线性方程为Y=0.019 63X+0.029 62(r=0.999 3);他克莫司在0.50~49.50 ng·mL-1范围内线性关系良好,线性方程为Y=0.190 64X+0.066 03(r=0.999 5)。环孢素A及他克莫司的定量下限分别为10.40和0.50 ng·mL-1,其定量下限的准确度及精密度见表2。偏差(Bias,%)及变异系数(CV,%)均<20.0%,满足生物样品定量分析要求。

表2 环孢素A及他克莫司的日内、日间准确度和精密度
2.5.3准确度和精密度 不同浓度环孢素A及他克莫司的日内和日间准确度Bias均在±15.0%以内,精密度CV≤15.0%,满足生物样品定量分析要求,见表2。
2.5.4提取回收率 不同浓度环孢素A的提取回收率为108.61%~113.24%,他克莫司的提取回收率为101.99%~109.37%,见表3。
表3 环孢素A及他克莫司的提取回收率和基质效应
2.5.5基质效应 不同浓度环孢素A的基质因子(matrix factors,MF)为70.46%~71.86%,其内标归一化的基质因子为106.68%~111.27%;他克莫司的基质因子为99.80%~106.55%,其内标归一化的基质因子为95.70%~97.81%,均符合生物样本定量分析要求,见表3。
2.5.6稳定性实验 不同浓度环孢素A及他克莫司在室温不避光放置6 h、在4 ℃放置3 d、在处理后放置于自动进样器24 h的Bias为-1.62%~14.40%,CV为1.41%~9.05%,表明环孢素A及他克莫司在相应条件下基本稳定。
2.5.7进样残留 在连续进样2针定量上限样品后的空白样品中未检测到待测物和内标的残留。
2.5.8稀释倍数 为了应对临床上可能遇到的极高浓度样品,本研究将10倍定量上限样品用空白全血稀释10倍后分析,环孢素A的准确度Bias为-1.30%,精密度CV为3.30%;他克莫司的准确度Bias为7.85%,精密度CV为2.53%,表明在相关范围内可采用空白全血稀释高浓度样品后进行测定。
2.6Westgard多规则质量控制评价

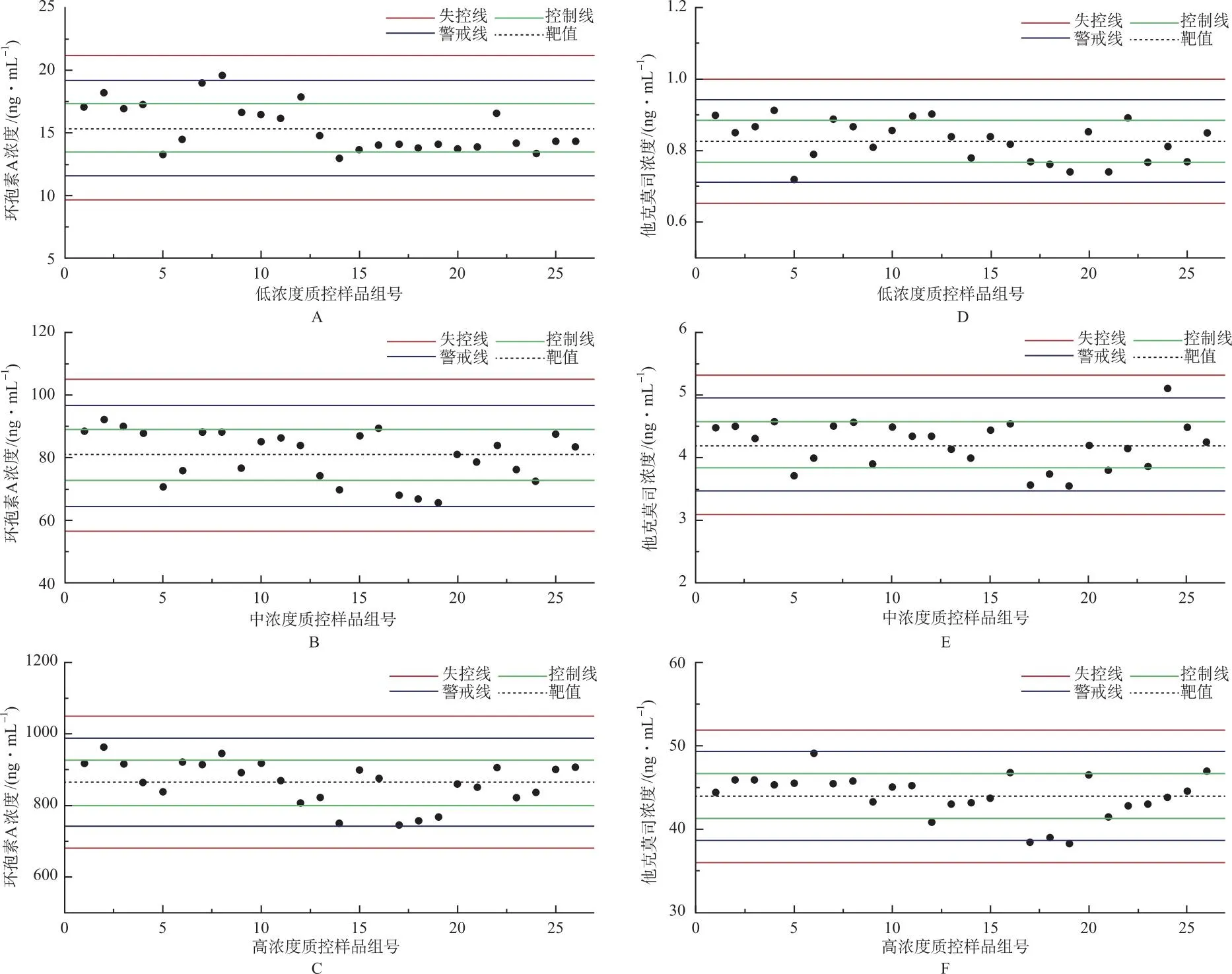
A:低浓度环孢素A;B:中浓度环孢素A;C:高浓度环孢素A;D:低浓度他克莫司;E:中浓度他克莫司;F:他克莫司高浓度。

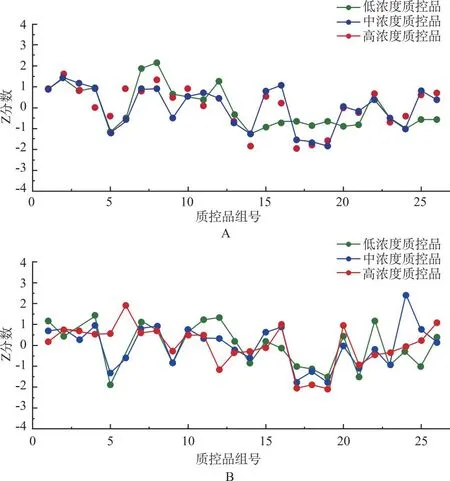
A:环孢素A;B:他克莫司。
2.7方法应用 采用建立的血药浓度检测方法测定临床样本中的环孢素A和他克莫司浓度。2022年第三季度共有33个环孢素A血样送检,测定值为(206.18±189.28) ng·mL-1;8个他克莫司血样送检,测定值为(6.12±5.67) ng·mL-1。结果表明,患者体内的环孢素A和他克莫司谷浓度个体间差异很大,见图5。结合随行质控与Westgard 多规则理论评价,本时间段环孢素A和他克莫司血药浓度检测结果稳定可靠,可以有效帮助医生调整临床给药剂量。

图5 环孢素A和他克莫司的谷浓度
3 讨论
环孢素A和他克莫司均为钙调神经磷酸酶抑制剂,能够通过抑制细胞因子的产生,减少淋巴细胞增殖,发挥免疫抑制作用。其在血液中的分布较为复杂,大部分分布于红细胞,因此往往以全血药物浓度作为反映其药效或毒性的药动学指标[6]。环孢素A和他克莫司的治疗窗分别为150~350和5~20 ng·mL-1,因此在全血中所需的检测限度要求分别为20和1 ng·mL-1[7]。目前,国内多采用免疫法检测人全血中的环孢素A和他克莫司浓度,但免疫法的选择性不佳,可能存在代谢物干扰,且所需的试剂盒价格昂贵,并无法同时检测多种免疫抑制剂。LC-MS/MS法作为治疗药物监测的金标准,专属性好,灵敏度高,能够同时检测多种药物[8]。基于此,本文通过HPLC-MS/MS技术建立了一种快速、可靠的环孢素A和他克莫司全血药物浓度检测方法。方法学验证按照FDA制定的生物分析方法验证指南进行[9-11],将简单的细胞裂解+蛋白沉淀作为样品前处理方法,分析时间仅为3.5 min,环孢素A及他克莫司的定量下限分别为10.40和0.50 ng·mL-1,能够很好地满足临床治疗药物监测需求。
在TDM中,质量控制有助于检测结果的标准化和可靠性,促进患者用药安全,因此,室内质量控制评估对TDM具有重要意义[12]。目前,在同时检测环孢素A和他克莫司血药浓度的TDM方法中,大部分是基于免疫分析法的室内质控研究[13],尚无LC-MS/MS检测方法的室内质控研究报道。本研究中,笔者联合Levery-Jennings质控图和Z分数质控图,应用Westgard 多规则理论进行质控评价,对LC-MS/MS 测定环孢素A和他克莫司血药浓度的室内质量控制进行深入的探索。Levery-Jennings质控图通过将1倍、2倍和3倍标准差作为控制线、警戒线和失控线,可以提高实验的精度和准确性,但只适用于同一水平的质量控制,不适用于不同阶段或不同体积的样品质量控制[14]。Z分数质控图可以将不同水平的质控样品测定值转换成同一标准,使其可以在同一张图上直观地显示比较结果[15]。该2种方法虽然操作简便,但仅对随机误差敏感,无法十分准确地发现系统误差。置换Westgard多规则是第2代质量控制方法,通过设定12S/13S/22S/R4S/41S/10X 规则,结合Levey-Jennings质控图来判断测定结果是否可控,不仅可敏锐地发现随机误差,还能够准确地判断系统误差,显著提高误差检出能力[16-17]。与仅仅依靠随行质控判断是否处于控制状态的“即刻法”不同,使用Westgard多规则理论进行血药浓度质量控制更加精确和有效,该方法不仅可以帮助检测出异常的数据,还可以通过指定多个规则来维护稳定的分析表现,已被广泛应用于药物治疗监测领域,并取得了不错的效果,因此受到越来越多的关注和认可[15-17]。笔者在本研究中利用该方法对2022年第三季度期间环孢素A和他克莫司的血药浓度监测进行质量评估,发现警告4次(违反12s规则),其余样品均在控,提示建立的LC-MS/MS在环孢素A和他克莫司血药浓度的长期检测中具有较好的稳定性。
综上所述,本研究利用LC-MS/MS 技术建立一种灵敏、快速、可靠的环孢素A和他克莫司血药浓度检测方法。通过完善室内质控评估体系,可以从根本上提高环孢素A和他克莫司血药浓度检测的精准度和综合质量,确保患者的治疗效果和临床安全。同时,该质控评估体系也可以为临床实践提供科学可靠的指导,为医疗工作者的临床决策提供支持。

