牛布氏杆菌病和分枝杆菌病二联表位疫苗的构建及其免疫效果评价
卢宝平,扈立伟,任君,杜荣起,顾天越,包利霞,刘青,朱凡杰,张东超,2*,金天明
(1. 天津农学院/天津市农业动物繁育与健康养殖重点实验室,天津 300392;2. 天津农学院动物科学与动物医学学院/天津市畜禽病原检测与基因工程疫苗工程技术中心,天津 300392;3. 天津市农业科学院/天津市畜禽分子育种与生物技术重点实验室,天津 300192)
牛布氏杆菌病(bovine brucellosis)在世界范围内广泛流行,是一种人畜共患传染病[1]。布氏杆菌生存能力特别强,能很快适应新的宿主,可以直接或间接地传播给主要宿主和易感宿主[2]。牛分枝杆菌病(bovine mycobacteriosis)是一种牛的慢性疾病,常导致生产力下降,同时可引起重大的公共卫生风险[3]。目前预防两种疾病的疫苗存在免疫效果不理想和毒力返强风险等,且市场上尚无牛布氏杆菌病和分枝杆菌病的二联疫苗。因此,研发一种更安全、有效地防控牛布氏杆菌病和分枝杆菌病的二联疫苗具有实际意义。
布氏杆菌Omp25作为一种菌体外膜蛋白,具有良好的免疫原性,可诱导动物机体产生特异性抗体。最新研究发现,布氏杆菌的毒力与Omp25有关,缺失Omp25的疫苗菌株在动物模型中毒力减弱,且提供的免疫保护水平与商品化减毒疫苗的保护效果相似[4]。分枝杆菌基因组上的3个独立基因编码的抗原85(Ag85)复合物是牛分枝杆菌、结核分枝杆菌(Mtb)和卡介苗(BCG)分泌蛋白,这些蛋白质是分枝杆菌细胞壁合成所需的转移酶[5]。Ag85A作为主要的分枝杆菌分泌蛋白,在诱导强烈的体液免疫和细胞免疫反应中发挥重要作用[6]。
表位疫苗是基于已知核苷酸或氨基酸序列,利用计算机辅助的免疫信息学分析等技术确定和筛选可能的优势表位,然后人工合成或借助基因工程技术制备含有优势表位的多肽疫苗[7]。表位疫苗最大的优点是免疫优势表位的聚集,提高了疫苗的免疫原性,减少其不良反应。
本研究通过在线生物软件对Omp25和Ag85A蛋白进行表位筛选,通过连接肽对所筛选的表位进行连接,构建出2条具有高免疫原性、副作用较小的新表位基因肽段NewⅠ和NewⅡ。将NewⅠ、Omp25、NewⅡ、Ag85A依次用自剪切肽T2A、P2A、E2A进行连接,设计出串联基因COE,并构建重组质粒GV658-COE。免疫动物后,可通过NewⅠ和NewⅡ多表位基因肽段激发机体细胞免疫,并通过布氏杆菌Omp25和牛分枝杆菌Ag85A特异性抗原激发机体免疫反应,进而实现多基因的协同免疫效应,为牛布氏杆菌病和分枝杆菌病的基因疫苗研究提供试验基础和理论支持。
1 材料与方法
1.1 主要试剂及试验动物
限制性内切酶PacⅠ和EcoRⅤ购自赛默飞世尔科技(中国)有限公司;Flag/HA/Myc/His 标记小鼠单克隆抗体、辣根过氧化物酶(HRP)标记山羊抗小鼠IgG(H+L)和Lipo8000TM转染试剂购自上海碧云天生物技术有限公司;无内毒素质粒大提试剂盒购自天根生化科技(北京)有限公司;细胞计数试剂(CCK-8)试剂盒购自金克隆北京生物技术有限公司;异硫氰酸荧光素(FITC)标记的大鼠抗CD3+IgG,藻胆蛋白(APC)标记的大鼠抗CD4+IgG,藻红蛋白(PE)标记的大鼠抗CD8+IgG抗体均购自biosciences pharmingen公司;ELISA试剂盒购自江苏酶免实业有限公司;6周龄SD大鼠购自北京斯贝福生物科技有限公司(许可证号:SCXK(京)2019-0010)。
1.2 目的基因与序列合成
根据NCBI数据库中布氏杆菌Omp25基因(GenBank:AM694369.2)和牛分枝杆菌Ag85A基因(GenBank:GQ150315.1)的核苷酸序列,通过在线软件ABCPerd和IEBD预测Omp25基因的B细胞和T细胞表位,将所选取的肽段通过VaxiJen软件预测其免疫原性,同时用ToxinPred软件预测是否具有细胞毒性,最后选取肽段高评分、免疫原性好且无细胞毒性肽段的表位作为目标表位[8]。将上述筛选出来的细胞表位通过GPGPG/GPLS连接肽进行连接,构建出新的肽段NewⅠ。同法预测Ag85A基因,构建出肽段NewⅡ。将NewⅠ、Omp25、NewⅡ和Ag85A依次用自剪切肽T2A、P2A和E2A进行连接,构建出新的肽段,将其命名为COE。根据大鼠表达蛋白质偏好密码子进行基因序列优化,同时在4个氨基酸序列之后分别添加Flag、HA、Myc和His标签。将COE基因构建至真核表达载体GV658的PacⅠ和EcoRⅤ酶切位点之间,最后由上海吉凯生物技术有限公司合成并提供目的质粒、阴性质粒及其甘油菌。
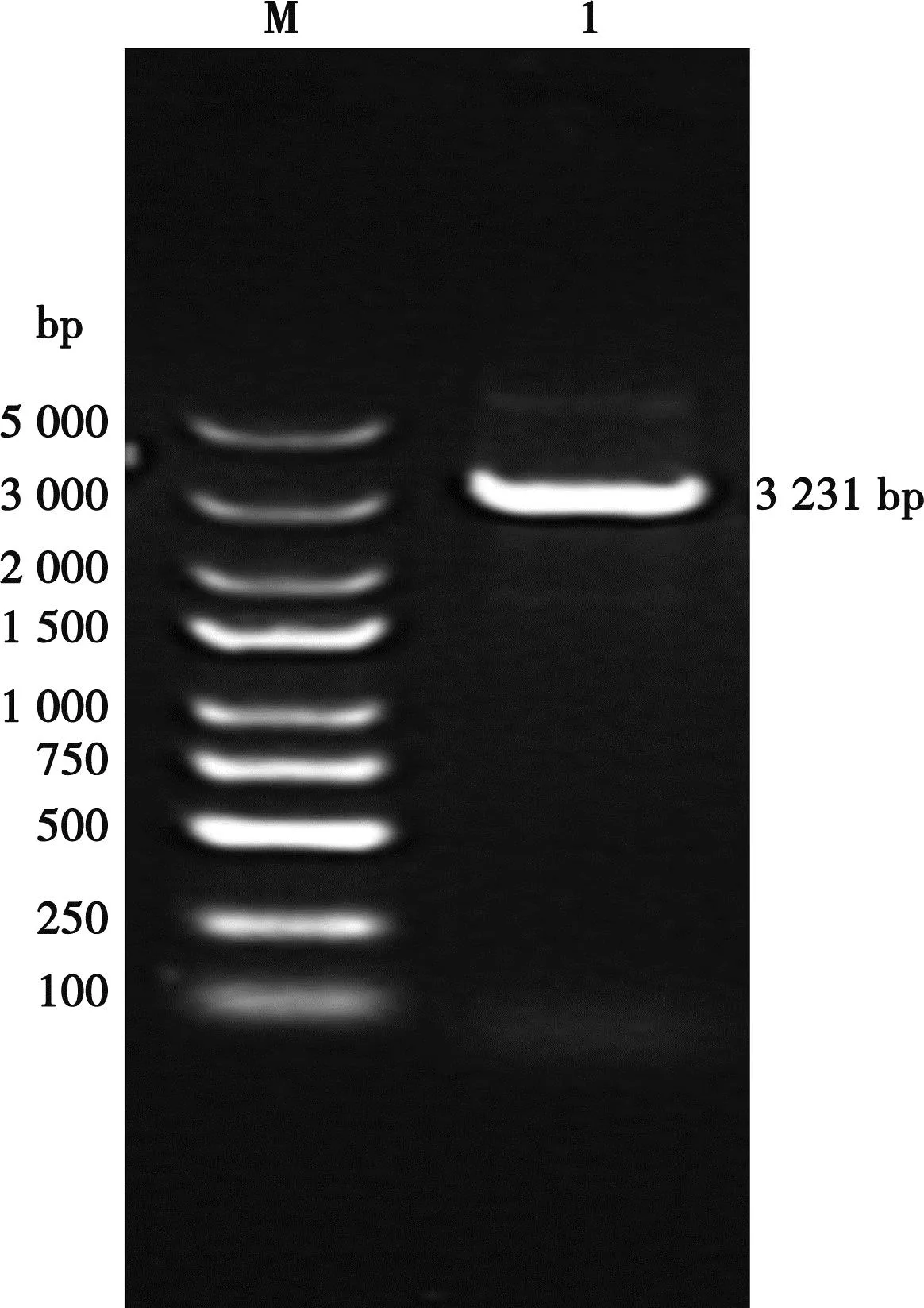
M. DNA Marker;1. COE基因PCR产物。

M. DNA Marker;1. GV658-COE质粒;2. 线性化GV658质粒;3. GV658-COE质粒双酶切。
1.3 COE基因的PCR及双酶切鉴定
根据上述构建的COE基因序列设计特异性引物,COE-F:5′-GTGGATCCGAGCTCGGTACCCGCCACGATATCCATCCAGGAGCAGCCCCCCGTGCCCGCCCCCGTGGAG-3′;COE-R:5′-ATATTTTATTACCGGTTTAATTAACTAGTGGTGGTGGTGGTGGTGGGCGCCCTGGGGGGC-3′,其中加粗碱基为交换配对碱基,斜体碱基为酶切位点。
将获得的甘油菌接种氨苄抗性培养基,培养12 h后,利用上述引物进行菌液PCR,反应体系为:12.5 μL 2×PCRTaqmix Buffer,1 μL COE-F,1 μL COE-R,2 μL菌液,8.5 μL ddH2O。反应程序为:95 ℃预变性5 min;95 ℃变性35 s,60 ℃退火35 s,72 ℃延伸1 min,共30个循环;72 ℃延伸15 min。随后将PCR产物利用琼脂凝胶电泳验证。将上述验证正确的阳性菌扩大培养后提取质粒,并利用限制性内切酶PacⅠ和EcoRⅤ进行双酶切鉴定。
1.4 重组质粒转染HEK293细胞
将HEK293细胞按照1×105个/孔加入6孔细胞培养板(含10% FBS的DMEM培养基)进行培养,直到细胞汇合度达到60%~70%。利用Lipo8000TM转染试剂对重组质粒进行转染,在48 h时在显微镜下对转染组进行拍照,观察重组质粒在HEK293细胞中的表达情况,用DAPI试剂对细胞核进行染色,观察绿色荧光蛋白(GFP)在HEK293细胞中的表达位置。
1.5 Western blot验证重组质粒在HEK293细胞中的蛋白表达
将成功转染重组质粒的HEK293细胞培养48 h后,用PBS洗2次,加入裂解液使其充分裂解,加入4×蛋白上样缓冲液,在100 ℃加热15 min,冷却后备用。将上述样品经电泳、转膜、封闭、抗体孵育后,进行显色,在Bio-Rad凝胶成像仪中拍照保存。
1.6 CCK-8法评估重组质粒对细胞的安全性
取浓度为1.0×104个/mL的HEK293细胞进行96孔板铺板,当细胞覆盖率达到60%~70%时,将重组质粒和空载质粒分别按照4个质量浓度50、100、200和400 ng/μL进行转染。分别于24、48、72 h加入CCK-8溶液100 μL,37 ℃避光孵育0.5 h,用酶标仪在450 nm波长检测每孔的OD值,计算细胞活力。
1.7 动物免疫
将18只SD大鼠适应性饲喂后,随机分为3组,第1组为重组质粒GV658-COE组,第2组为空载质粒GV658组,第3组为空白对照PBS组,自由采食和饮水。将重组质粒和空载质粒按照400 μg/只的剂量进行腿部肌肉注射,间隔14 d加强免疫1次,共免疫3次,免疫前进行尾静脉采血。
1.8 T淋巴细胞的分型检测
在无菌条件下取大鼠脾脏,加入PBS对脾脏进行研磨,过200目筛网收集脾细胞悬液,在4 ℃和1 500 r/min条件下离心5 min,弃掉上清液,加5 mL红细胞裂解液重悬细胞,冰上裂解10 min,离心,反复裂解,直到细胞悬液中无红细胞为止。按照抗体说明书对淋巴细胞进行计数染色,样品上机,收集和分析数据。
1.9 抗体水平检测
每次采血后,室温静置2 h,2 500 r/min离心20 min,小心吸取血清并做好标记。参照ELISA试剂盒说明书进行操作。在酶标包被板上按照50 μL/孔量分别加入标准品、稀释血清样品,置于37 ℃温育30 min,使用洗涤液洗涤3次;每孔加入酶标试剂50 μL,再置于37 ℃温育60 min,洗涤3次;每孔先后加入显色剂A和B(各50 μL),轻轻震荡混匀,37 ℃避光显色10 min,每孔加终止液50 μL;混匀后使用分光光度计检测各样品在450 nm波长处的OD值。
1.10 统计分析
数据采用SPSS和GraphPad Prism 7.0进行单因素方差分析并绘图。数据用“平均数±标准差”表示。
2 结果与分析
2.1 抗原表位的筛选及连接
目的基因Omp25和Ag85A进行表位预测结果见表1,将所选取的肽段通过GPGPG/GPLS连接肽进行连接,同时在N端添加Flag和Myc标签,构建出的新肽段分别命名为NewⅠ和NewⅡ。

表1 B细胞及T细胞表位预测结果
NewⅠ序列为:AIQEQPPVPAPVEVAPQYSWGPGPGAIQEQPPVPAPVEVAPQYSWGPGPGGYGWNKA-KTSTVGSIKPDDGPGPGGYGWNKAKTSTVGSIKPDDG-PGPGGYSWAKKSKDGLEVKQGFGPGPGIKLNNGLDD-ESKFRVGPLSQEQPPVPAPGPGPGFQQDQIVYGPGPGV-SAALLPFSATAFAADGPGPGVSAALLPFSATAFAADGPG-PGVSAALLPFSATAFAAD。
NewⅡ序列为:LVGAVGGTATAGAFSRPGLPGPGPGSSFYSDWYQPACGKAGCQTYKGPGPGDAGGYK-ASDMWGPKEDPAWQRNGPGPGKPSDLGGNNLPAKG-PGPGLGATPNTGPAPGPGPGLVGAVGGTATAGAFSRP-GLPGPGPGSSFYSDWYQPACGKAGCQTYKGPGPGPS-QAMGPTGPLSSELPGWLQAGPGPGVEYLQVPSPGPG-PGSALTLAIYHGPGPGGVFDFPDSGTHGPGPGPQQFV-YAGAMSGLLD。
2.2 NewⅠ和NewⅡ序列的二级结构及其抗原性
NewⅠ和NewⅡ序列的预测结果分别是:α螺旋分别为8.89%和3.23%,β转角分别为4.44%和6.85%,延伸链分别为19.56%和16.53%,无规则卷曲分别为67.1%和73.39%。表明该序列中无规则卷曲占比较高,具有良好的免疫原性;通过在线软件VaxiJen预测NewⅠ和NewⅡ序列的抗原性,评分分别为0.945 2和0.904 7,分值均大于0.4,说明该序列可能具有较好的抗原性。
2.3 COE基因的验证与表达
PCR和双酶切结果显示,在3 231 bp处出现明亮的目的条带,与目的基因序列片段大小一致(图1、图2)。经测序和同源性分析,未发现碱基的缺失、增加及突变,说明重组质粒构建成功。
2.4 重组质粒在HEK293细胞中的表达
通过荧光显微镜观察,重组质粒GV658-COE在转染HEK293细胞48 h后,可观察到清晰的绿色荧光,且绿色荧光蛋白基本在细胞质中表达(图3)。

图3 重组质粒转染HEK293细胞结果
2.5 Western blot验证重组质粒在HEK293细胞中的蛋白表达
将重组质粒和空载质粒转染HEK293细胞48 h后,提取细胞总蛋白进行Western blot分析,结果如图4所示。NewⅠ、Omp25、NewⅡ和Ag85A蛋白分别在22.3、17.3、23.9和35.6 kDa处出现特异性条带,空载及未转染的HEK293细胞未出现条带,β-actin内参各组均在42 kDa处出现特异性条带。结果表明,融合Flag、HA、Myc和His标签的NewⅠ、Omp25、NewⅡ和Ag85A蛋白在HEK293细胞中能够成功表达,且特异性蛋白条带与实际蛋白大小相符。

图4 重组质粒在HEK293细胞中的蛋白表达
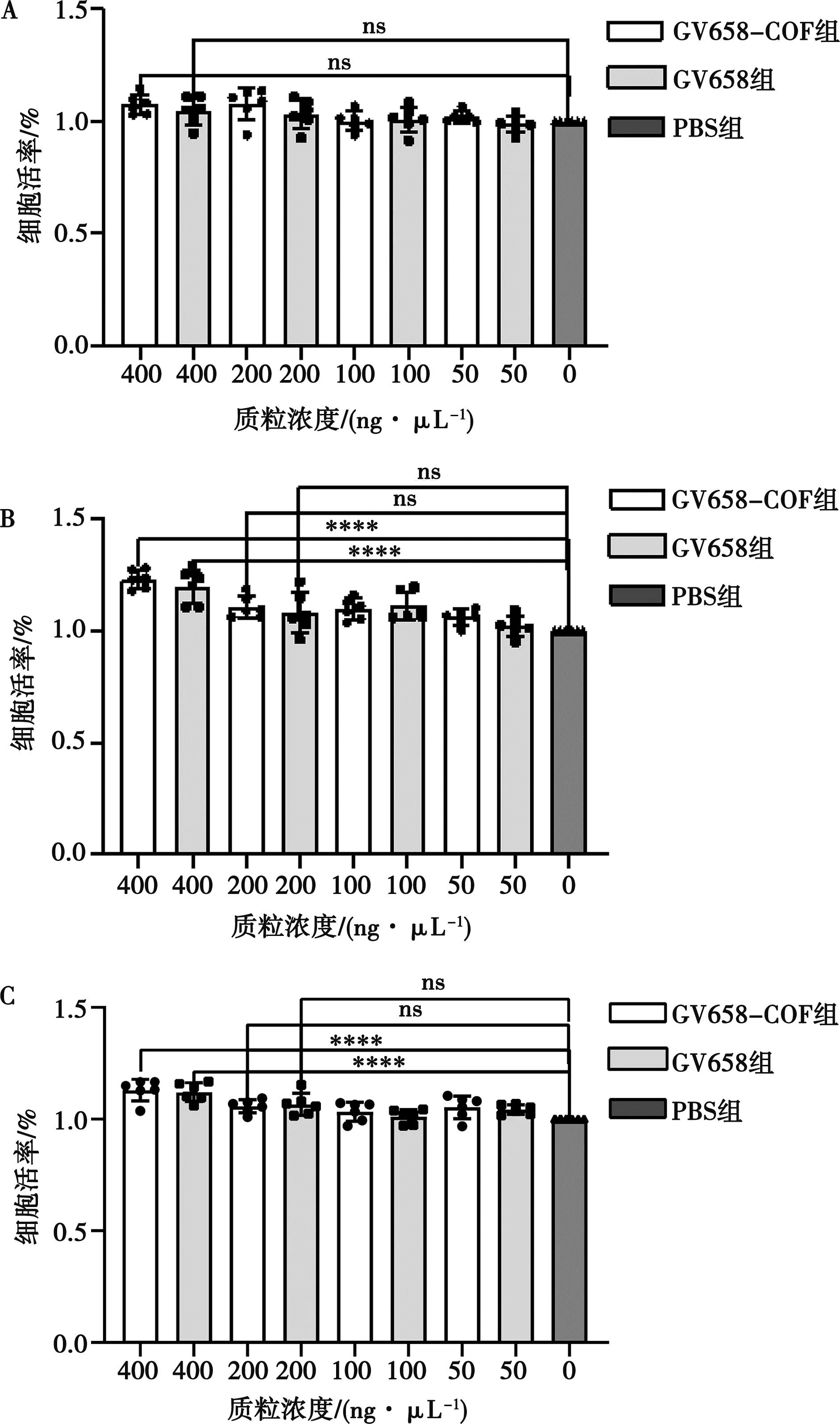
A. 24 h;B. 48 h;C. 72 h;****表示P<0.001,ns表示P>0.05。下同。
2.6 CCK-8法评估重组质粒对细胞活性的影响
将重组质粒GV658-COE、空载质粒GV658和PBS分别和转染试剂进行混合,按照50、100、200、400 ng的剂量转染HEK293细胞。结果如图5所示,在24 h时,细胞存活率分别是101%、100%、107%和107%,最高浓度剂量组与PBS组相比差异不显著(P>0.05),且相同浓度剂量组组间差异不显著(P>0.05)。在48和72 h时,最高浓度剂量组与PBS组差异极显著(P<0.01),但相同浓度剂量组组间差异不显著(P>0.05)。
2.7 T淋巴细胞分型
由表2可见,与PBS组相比,三免后重组质粒组大鼠脾脏中CD4+T淋巴细胞在CD3+T淋巴细胞中的百分比显著升高(P<0.05),而CD8+T淋巴细胞在CD3+T淋巴细胞中的百分比显著降低(P<0.05);在CD3+T淋巴细胞中CD4+与CD8+T淋巴细胞的比值无显著性差异(P=0.27)。而且,重组质粒组与空载质粒组、空载质粒与PBS组之间所有指标均无显著性差异。

表2 CD4+、CD8+与CD3+ T淋巴细胞比值 %
2.8 ELISA检测抗体水平
由图6可见,在免疫第42天时,重组质粒免疫大鼠产生的布氏杆菌IgG抗体水平极显著高于空白对照PBS组(P<0.01),显著高于空载质粒GV658组(P<0.05),且GV658组和PBS组之间大鼠产生的布氏杆菌IgG抗体水平无显著性差异(P>0.05)。

*表示P<0.05,**表示P<0.01。下同。
由图7可见,在免疫第14天时,重组质粒免疫大鼠产生的分枝杆菌IgG抗体水平显著高于空载质粒GV658组(P<0.05),极显著高于空白对照PBS组(P<0.01);在免疫第28和42天时,重组质粒免疫大鼠产生的分枝杆菌IgG抗体水平显著高于空白对照PBS组(P<0.05)。而且,GV658组和PBS组之间大鼠产生的分枝杆菌IgG抗体水平无显著性差异(P>0.05)。
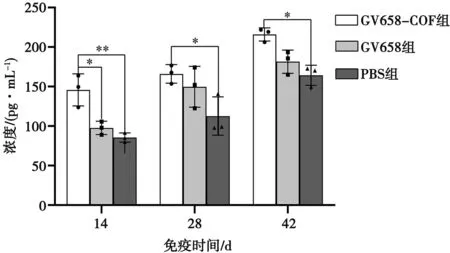
图7 分枝杆菌IgG变化
3 讨论
布氏杆菌可导致妊娠母牛的流产和公牛的睾丸炎[9],牛分枝杆菌常常引起牛的肺结核、淋巴结核和肠结核[10],两种疾病一直影响着养牛业的发展,时刻威胁着动物的生命与健康,接种疫苗是预防这两种疾病最有效的途径。表位疫苗具有免疫力持久、抗原优化、成本低的巨大优势。由于两种细菌都是胞内寄生菌,因此,能够激发有效的细胞免疫就显得格外重要。表位疫苗可以达到这样的效果,研制表位疫苗的关键是找到特异性抗原,其抗原的结构与其功能具有密切的相关性[11]。
随着信息技术和分子生物学技术的发展,为表位疫苗的设计奠定了基础,使用这些免疫信息学工具可以很好的预测特异性抗原表位[12]。抗原的正确选择是设计表位疫苗的关键,选择可以有效刺激机体产生免疫应答的B细胞抗原表位和T细胞抗原表位是决定表位疫苗是否有效的关键所在[13-14]。单独表位构成的表位基因疫苗的效果远低于T、B细胞表位联合后所构建的疫苗[15]。本试验采用在线软件IEBD、BepiPred、ABCPred对序列进行T细胞表位和B细胞表位预测,克服了单一肽表位作为候选表位疫苗的局限性。在相同细胞表位间通过柔性肽GPGPG连接,T细胞表位和B细胞表位间用刚性肽GPLS连接,以此形成多抗原表位来启动抗原特异性T细胞反应,引起高效免疫反应[16]。
2A肽是来源于病毒的短肽,一般为18~25个氨基酸,它们通常被称为“自我剪切”肽,能使一条转录产物产生多种蛋白。2A肽并不是完全的“自我剪切”,而是通过使核糖体跳过2A元件C末端的甘氨酸和脯氨酸肽键的合成而发挥作用,最终导致2A序列末端和下游产物分离。其中,上游蛋白的C端将会添加一些额外的2A残基,而下游蛋白的N端将会有额外的脯氨酸。目前有4种常用的2A肽,分别是P2A、T2A、E2A和F2A,来源于4种不同的病毒。
本研究通过前期的预测,选取的抗原肽段稳定性良好,抗原性较高,不容易发生变形,适合用来进行表位疫苗设计。两种新肽段的β转角和无规则卷曲都占比较高,容易形成抗原表位[17]。布氏杆菌和分枝杆菌的感染都能促进适应性Th1免疫应答,引起干扰素-γ(IFN-γ)释放,增强抗原向T细胞的呈递[18-19]。细胞免疫是清除细胞内寄生微生物的最为有效的防御反应,T细胞功能性亚群主要分为CD4+T细胞和CD8+T细胞,CD8+T细胞能够识别细胞表面的主要组织相容性复合体(MHC)Ⅰ类抗原复合物,CD4+T细胞的受体能识别与MHCⅡ类结合的外来抗原。本研究构建的二联表位疫苗通过细胞计数试验首先证明了重组质粒具有较好的安全性;免疫大鼠后,CD4+T淋巴细胞比例显著升高,表明强烈激发了机体的细胞免疫反应;另外,该疫苗在免疫大鼠14 d后,体液免疫也表现出较好的效果,明显优于牛分枝杆菌cfp10-esat6-cfp7融合基因重组乳酸菌的免疫原性[20]。值得注意的是,随着免疫次数的增加,血清中的抗体效价呈明显上升趋势,而未到达一个峰值,猜测与免疫的质粒浓度有关,有待进一步验证。本研究所构建的重组二联表位基因疫苗弥补了现有疫苗的部分不足之处,具有一定的免疫保护效果,有望成为牛布氏杆菌病和分枝杆菌病预防的候选疫苗。

